Según las guías de muerte súbita, se debe considerar un desfibrilador automático implantable (DAI) para los pacientes con miocardiopatía dilatada debida a variantes en el gen de la lamina (LMNA) con al menos 2 factores: varones, fracción de eyección del ventrículo izquierdo (FEVI) <45%, taquicardia ventricular no sostenida (TVNS) y variantes no missense. Nuestro objetivo es describir las características clínicas de una cohorte española de pacientes con cardiolaminopatías (registro REDLAMINA) y evaluar los criterios de riesgo vigentes.
MétodosSe evaluó la relación entre factores de riesgo y eventos cardiovasculares en una cohorte de 140 portadores de variantes en LMNA (54 probandos, 86 familiares, edad ≥ 16 años). Se consideró: a) evento arrítmico mayor (EAM) si hubo descarga apropiada del DAI o muerte súbita, y b) muerte por insuficiencia cardiaca, incluidos los trasplantes.
ResultadosSe identificaron 11 variantes nuevas y 21 previamente publicadas. La FEVI <45% (p=0,001) y la TVNS (p <0,001) se relacionaron con los EAM, pero no el sexo o el tipo de variante (missense frente a no missense). La FEVI <45% (p <0,001) fue el único factor relacionado con la muerte por insuficiencia cardiaca.
ConclusionesEn el registro REDLAMINA, los únicos 2 predictores asociados con EAM fueron la TVNS y la FEVI <45%. No se debería considerar grupo de bajo riesgo a las portadoras de variantes missense con TVNS o FEVI <45%. Es importante individualizar la estratificación del riesgo de los portadores de variantes missense en LMNA, porque no todas tienen el mismo pronóstico.
Palabras clave
Las variantes genéticas en el gen de la lamina (LMNA) originan del 5 al 10% de los casos de miocardiopatía dilatada (MCD). La MCD por LMNA se asocia con trastornos de la conducción, arritmias auriculares y ventriculares, alta incidencia de muerte súbita (MS) precoz y/o progresión a insuficiencia cardiaca terminal1-5.
Las guías americana y europea de muerte súbita recomiendan el implante de un desfibrilador automático implantable (DAI) a estos pacientes cuando presentan 2 o más de los siguientes factores de riesgo: taquicardia ventricular no sostenida (TVNS), fracción de eyección del ventrículo izquierdo (FEVI) <45% en la evaluación inicial, sexo masculino y mutaciones distintas de las missense (inserciones, deleciones, truncamientos o mutaciones que afectan al splicing)6,7. Recientemente, se ha propuesto una nueva puntuación de riesgo arrítmico basado en los factores de riesgo anteriores, pero que considera la FEVI como una variable continua e incluye un nuevo factor, el bloqueo auriculoventricular (BAV) de primer grado o mayor. Esta puntuación indica el implante de un DAI si el riesgo de MS a los 5 años es ≥ 7%8. Por ambos métodos de estratificación, a una mujer con MCD portadora de una variante missense en LMNA con TVNS o FEVI <45% no se le recomendaría el implante de un DAI.
Los objetivos de este estudio son: a) la caracterización clínica de nuestra población de pacientes con MCD por variantes en LMNA y de sus familiares (portadores sanos o afectados); b) la descripción de nuevas variantes genéticas en LMNA y de posibles correlaciones genotipo-fenotipo, y c) la revaluación de los factores de riesgo arrítmico previamente descritos en nuestra cohorte.
MÉTODOSSe recopilaron restrospectivamente los datos de pacientes con MCD por LMNA seguidos en 18 servicios de cardiología españoles: «Registro español de cardiolaminopatías en adultos» (registro REDLAMINA). Se incluyó a los portadores de edad ≥ 16 años en la primera evaluación cardiaca. Se definió como cardiolaminopatía la presencia de una variante genética patógena o probablemente patógena en el gen LMNA de un paciente con un fenotipo predominantemente cardiaco (MCD o miocardiopatía hipocinética no dilatada), trastornos de la conducción cardiaca, arritmias ventriculares o supraventriculares o MS a una edad temprana. Se incluyó en el análisis a todos los familiares portadores de la variante patogénica en LMNA identificados en el cribado familiar, independientemente de su estado clínico (sanos o no). Se recogieron datos de la primera visita de cardiología y la última visita de seguimiento. Estos datos incluyeron antecedentes médicos personales y familiares, resultados de estudio genético, clase funcional y datos relevantes del ecocardiograma, el electrocardiograma, el Holter electrocardiográfico y las imágenes de resonancia magnética. La información anonimizada se centralizó y analizó en el Complejo Hospitalario Universitario A Coruña, España. El estudio se aprobó por el comité de ética local (código de registro: 2017/300). En el se pueden consultar los métodos completos.
Los estudios genéticos se realizaron en cada centro participante de acuerdo con los protocolos locales, y el periodo de reclutamiento se extendió de 1999 a 2018. Las variantes genéticas se dividieron en no missense (inserción, deleción, truncamiento o que afecta al splicing) y missense.
Para determinar la patogenicidad de las variantes identificadas, se aplicaron las recomendaciones del Colegio Americano de Genética y Genómica Médica y la Asociación de Patología Molecular9. La clasificación final de cada variante se acordó por consenso entre 2 cardiólogos con experiencia en la interpretación de variantes genéticas. Las variantes consideradas no patógenas, las probablemente benignas y las de significado incierto se excluyeron del estudio.
También se excluyeron las variantes genéticas no relacionadas con fenotipos predominantemente cardiacos (lipodistrofia, síndrome metabólico, polineuropatías, etc.) ( y ).
Análisis estadísticoLas variables continuas se expresan como media±desviación estándar y se compararon mediante la prueba de la t de Student o la prueba de la U de Mann-Whitney según la distribución de valores. Las variables no continuas se expresan en frecuencias absolutas y relativas y se compararon mediante la prueba de la χ2 o la prueba exacta de Fisher, según correspondiera. Se consideró significativo un valor de p <0,05. El análisis se realizó utilizando el software R, versión 3.4.3 (The R Foundation for Statistical Computing Platform).
Se consideraron los siguientes eventos combinados: a) evento arrítmico mayor (EAM) si hubo descarga apropiada del DAI o MS, y b) muerte por insuficiencia cardiaca (MIC) si hubo trasplante de corazón (TxC) o muerte por insuficiencia cardiaca.
La probabilidad acumulada de EAM y MIC se calculó utilizando el método de Kaplan-Meier. Los factores se compararon mediante log-rank test (Mantel-Cox). Se consideró inicio de seguimiento la visita en que se diagnosticó al paciente. El análisis de regresión de Cox se utilizó para identificar predictores independientes de eventos; las razones de riesgo y los intervalos de confianza del 95% (IC95%) para los puntos finales se calcularon con los modelos de riesgos proporcionales de Cox, incluido el sexo, el tipo de variante genética (no missense frente a missense), FEVI <45%, BAV de primer grado, BAV completo o cualquier grado de BAV y presencia de TVNS como covariables.
RESULTADOSSe recogieron datos de 222 portadores de variantes en LMNA. Se excluyó a 6 pacientes de una familia por ausencia de seguimiento. Se excluyó a 60 portadores porque sus variantes se consideraron no patógenas o su fenotipo era diferente del definido como cardiolaminopatía y a 16 portadores menores de 16 años en la evaluación inicial. Finalmente, se incluyó en el análisis a 140 portadores (54 probandos y 86 familiares) (). La mediana [intervalo intercuartílico] de seguimiento fue 5,0 [2,0-9,25] años para los probandos y 3,0 [1,0-6,0] años para los familiares.
Variantes genéticas identificadas en el registro REDLAMINAEn la cohorte del registro REDLAMINA, se identificaron 11 variantes patogénicas nuevas (4 missense y 7 no missense) y 21 previamente descritas (16 missense y 5 no missense) (). La variante más frecuente fue la p.Arg190Trp, descrita en 16 portadores de 5 familias diferentes.
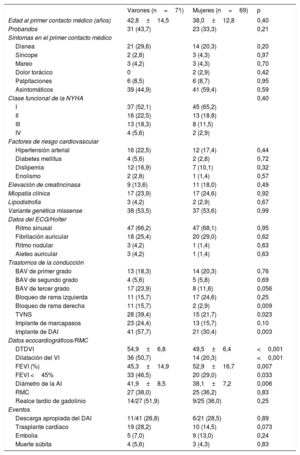
Características clínicasLas características clínicas de la cohorte se resumen en la tabla 1 y, más en detalle, la . No se encontraron diferencias significativas entre mujeres y varones en la edad al primer contacto médico, los síntomas, la clase funcional de la New York Heart Association (NYHA), la miopatía clínica o los factores de riesgo coronario. La dilatación ventricular izquierda y la disfunción sistólica fueron más comunes en los varones. Hubo una alta incidencia de trastornos de la conducción cardiaca, con un 42,9% de los portadores con algún grado de BAV y un 17,9% con BAV de tercer grado, que fue más frecuente en los varones, pero sin significación estadística (p=0,057).
Diferencias en las características y los eventos clínicos entre varones y mujeres portadores de variantes en LMNA en la cohorte del registro REDLAMINA
| Varones (n=71) | Mujeres (n=69) | p | |
|---|---|---|---|
| Edad al primer contacto médico (años) | 42,8±14,5 | 38,0±12,8 | 0,40 |
| Probandos | 31 (43,7) | 23 (33,3) | 0,21 |
| Síntomas en el primer contacto médico | |||
| Disnea | 21 (29,6) | 14 (20,3) | 0,20 |
| Síncope | 2 (2,8) | 3 (4,3) | 0,97 |
| Mareo | 3 (4,2) | 3 (4,3) | 0,70 |
| Dolor torácico | 0 | 2 (2,9) | 0,42 |
| Palpitaciones | 6 (8,5) | 6 (8,7) | 0,95 |
| Asintomáticos | 39 (44,9) | 41 (59,4) | 0,59 |
| Clase funcional de la NYHA | 0,40 | ||
| I | 37 (52,1) | 45 (65,2) | |
| II | 16 (22,5) | 13 (18,8) | |
| III | 13 (18,3) | 8 (11,5) | |
| IV | 4 (5,6) | 2 (2,9) | |
| Factores de riesgo cardiovascular | |||
| Hipertensión arterial | 16 (22,5) | 12 (17,4) | 0,44 |
| Diabetes mellitus | 4 (5,6) | 2 (2,8) | 0,72 |
| Dislipemia | 12 (16,9) | 7 (10,1) | 0,32 |
| Enolismo | 2 (2,8) | 1 (1,4) | 0,57 |
| Elevación de creatincinasa | 9 (13,6) | 11 (18,0) | 0,49 |
| Miopatía clínica | 17 (23,9) | 17 (24,6) | 0,92 |
| Lipodistrofia | 3 (4,2) | 2 (2,9) | 0,67 |
| Variante genética missense | 38 (53,5) | 37 (53,6) | 0,99 |
| Datos del ECG/Holter | |||
| Ritmo sinusal | 47 (66,2) | 47 (68,1) | 0,95 |
| Fibrilación auricular | 18 (25,4) | 20 (29,0) | 0,62 |
| Ritmo nodular | 3 (4,2) | 1 (1,4) | 0,63 |
| Aleteo auricular | 3 (4,2) | 1 (1,4) | 0,63 |
| Trastornos de la conducción | |||
| BAV de primer grado | 13 (18,3) | 14 (20,3) | 0,76 |
| BAV de segundo grado | 4 (5,6) | 5 (5,8) | 0,69 |
| BAV de tercer grado | 17 (23,9) | 8 (11,6) | 0,056 |
| Bloqueo de rama izquierda | 11 (15,7) | 17 (24,6) | 0,25 |
| Bloqueo de rama derecha | 11 (15,7) | 2 (2,9) | 0,009 |
| TVNS | 28 (39,4) | 15 (21,7) | 0,023 |
| Implante de marcapasos | 23 (24,4) | 13 (15,7) | 0,10 |
| Implante de DAI | 41 (57,7) | 21 (30,4) | 0,003 |
| Datos ecocardiográficos/RMC | |||
| DTDVI | 54,9±6,8 | 49,5±6,4 | <0,001 |
| Dilatación del VI | 36 (50,7) | 14 (20,3) | <0,001 |
| FEVI (%) | 45,3±14,9 | 52,9±16,7 | 0,007 |
| FEVI <45% | 33 (46,5) | 20 (29,0) | 0,033 |
| Diámetro de la AI | 41,9±8,5 | 38,1±7,2 | 0,006 |
| RMC | 27 (38,0) | 25 (36,2) | 0,83 |
| Realce tardío de gadolinio | 14/27 (51,9) | 9/25 (36,0) | 0,25 |
| Eventos | |||
| Descarga apropiada del DAI | 11/41 (26,8) | 6/21 (28,5) | 0,89 |
| Trasplante cardiaco | 19 (28,2) | 10 (14,5) | 0,073 |
| Embolia | 5 (7,0) | 9 (13,0) | 0,24 |
| Muerte súbita | 4 (5,6) | 3 (4,3) | 0,83 |
AI: aurícula izquierda; BAV: bloqueo auriculoventricular; DAI: desfibrilador automático implantable; DTDVI: diámetro telediastólico del VI; ECG: electrocardiograma; FEVI: fracción de eyección del VI; NYHA: New York Heart Association; RMC: resonancia magnética cardiaca; TVNS: taquicardia ventricular no sostenida; VI: ventrículo izquierdo.
Los valores expresan n (%) o media±desviación estándar.
Se implantó un DAI a 62 portadores, con mayor frecuencia varones (41/71; 58%) que mujeres (21/69; 30%) (p=0,003). Del total de dispositivos implantados, el 90% (56 portadores: 20 mujeres y 36 varones) fueron en prevención primaria y el 10% (6 portadores: 5 varones y 1 mujer), en prevención secundaria.
EventosAl final del seguimiento, se documentaron 7 MS, 4 en probandos y 3 en familiares detectados durante la evaluación familiar. Hubo 5 MS entre los 78 portadores que no recibieron un dispositivo ().
Solo hubo 1 muerte por insuficiencia cardiaca avanzada (1 probando con contraindicaciones para TxC). Hubo más TxC en los probandos (17/52; 32,7%) que en los familiares (12/88; 13,6%) (p=0,007). En el subgrupo de portadores que recibieron un DAI, el proporción de descargas apropiadas en probandos y familiares fue similar (11/36 [27,9%] frente a 6/26 [22,2%]; p=0,6).
No hubo diferencias significativas en la frecuencia de los eventos (fenómenos embólicos, MS, descarga de DAI o TxC) entre varones y mujeres (tabla 1).
Grupo de portadores con bajo riesgo según las guías y la puntuación de Wahbi et al.Se detectó a 2 portadores con bajo riesgo que sufrieron una MS (ambos portadores de la variante p.Arg190Trp). A los demás portadores que sufrieron una MS o tuvieron una descarga apropiada del DAI, se los detectó por las guías o por la puntuación de Wahbi et al.6-8 ().
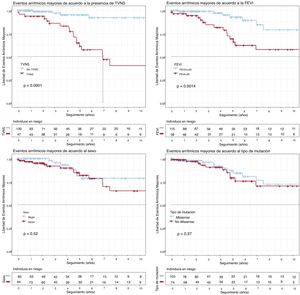
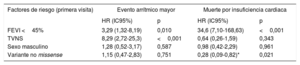
Análisis de supervivenciaEAM (figura 1)Una FEVI <45% al inicio del seguimiento (p=0,001) y la TVNS (p <0,001) se asociaron con una peor supervivencia. Ambos factores se asociaron independientemente con los EAM en el modelo de regresión de Cox, con hazard ratio (HR)=3,29 (IC95%, 1,32-8,19) y HR=8,29 (IC95%, 2,72-25,3) respectivamente (tabla 2). No se encontraron diferencias significativas con el tipo de variante genética (p=0,37), el sexo (p=0,52), el BAV completo (p=0,55) o cualquier grado de BAV (p=0,32).
Análisis de supervivencia de Kaplan-Meier para TVNS, FEVI <45%, sexo y tipo de variante genética (missense frente a no missense). Objetivo compuesto: eventos arrítmicos mayores (descarga apropiada del DAI/muerte súbita) desde el inicio del seguimiento. DAI: desfibrilador automático implantable; FEVI: fracción de eyección del ventrículo izquierdo; TVNS: taquicardia ventricular no sostenida.
Evaluación de los factores de riesgo clásicos de los diferentes eventos combinados en portadores de variantes genéticas en LMNA de la cohorte del registro REDLAMINA (modelo de regresión de Cox)
| Factores de riesgo (primera visita) | Evento arrítmico mayor | Muerte por insuficiencia cardiaca | ||
|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | |
| FEVI <45% | 3,29 (1,32-8,19) | 0,010 | 34,6 (7,10-168,63) | <0,001 |
| TVNS | 8,29 (2,72-25,3) | <0,001 | 0,64 (0,26-1,59) | 0,343 |
| Sexo masculino | 1,28 (0,52-3,17) | 0,587 | 0,98 (0,42-2,29) | 0,961 |
| Variante no missense | 1,15 (0,47-2,83) | 0,751 | 0,28 (0,09-0,82)* | 0,021 |
FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%, intervalo de confianza del 95%; TVNS: taquicardia ventricular no sostenida.
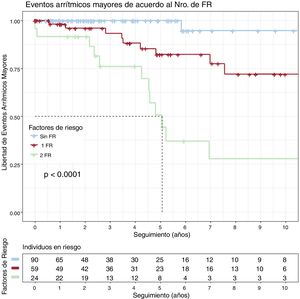
La supervivencia acumulada libre de EAM para portadores con 0, 1 (TVNS o FEVI <45%) o 2 (TVNS y FEVI <45%) factores de riesgo se puede ver en la figura 2. Solo 1 portador sin factores de riesgo sufrió un EAM; la supervivencia libre de MS a los 5 años de seguimiento fue del 82,3% con un solo factor de riesgo y del 50,7% con 2 (p <0,001).
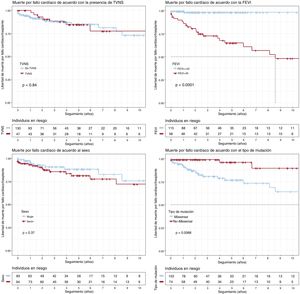
MIC (figura 3)La supervivencia de los pacientes con FEVI <45% en el primer contacto fue significativamente menor (p <0,001), así como la de los portadores de variantes missense (p=0,007). Solo una FEVI <45% se asoció independientemente con la muerte por insuficiencia cardiaca o TxC en el modelo de regresión de Cox (HR=25,1; IC95%, 5,76-109,18). No hubo diferencias significativas en cuanto al sexo (p=0,37) o la presencia de TVNS (p=0,84).
Análisis de supervivencia de Kaplan-Meier para TVNS, FEVI <45%, sexo y tipo de variante genética (missense frente a no missense). Objetivo compuesto: muerte por insuficiencia cardiaca o trasplante cardiaco desde el inicio del seguimiento. FEVI: fracción de eyección del ventrículo izquierdo; TVNS: taquicardia ventricular no sostenida.
Se describió a 16 portadores, con 7 TxC y 2 MS. Un varón asintomático de 28 años con dilatación ligera del ventrículo izquierdo y FEVI normal sufrió una MS durante el sueño. Tenía un Holter y una ergometría normales. Su madre, también portadora de p.Arg190Trp, fue diagnosticada a los 43 años de MCD con FEVI del 40% y fibrilación auricular revertida a ritmo sinusal y sin TVNS en el estudio Holter. Falleció repentinamente estando con tratamiento médico en NYHA II.
DISCUSIÓNNuestra serie, en la que se evaluó una cohorte española de pacientes con cardiolaminopatías y sus familiares portadores, proporciona información novedosa sobre la relevancia clínica y el pronóstico de esta afección. Se describen en detalle las características clínicas de 140 portadores con 32 variantes en LMNA (11 nuevas y 21 previamente descritas) relacionadas con la MCD, lo que contribuye al conocimiento actual sobre las correlaciones genotipo-fenotipo (). Además, se revaluaron los criterios actuales de estratificación de riesgo. En la cohorte del registro REDLAMINA:
- •
Las mujeres mostraron el mismo riesgo de EAM o MIC que los varones.
- •
La FEVI <45% es el único factor relacionado de manera independiente con la MIC, mientras que el sexo y la TVNS no resultan predictores significativos.
- •
No se encontraron diferencias según el tipo de variante (no missense frente a missense) en EAM, pero sí se detectó que algunas variantes missense podrían compartir el mal pronóstico de las no missense.
Las guías americana y europea recomiendan el implante de un DAI si el paciente tiene 2 o más de los siguientes factores de riesgo: FEVI <45%, TVNS, variante no missense o sexo masculino. Wahbi et al.6-8, en una nueva puntuación, agregan el BAV de primer grado o más avanzado y la FEVI como variable lineal. Estas recomendaciones se basan principalmente en un artículo de 2012 de Van Rijsingen et al.10, que publicaron una cohorte europea (6 países) que incluía a 109 familias con un total de 269 portadores. Wahbi et al.8 también utilizaron datos de esta cohorte.
Relación entre el tipo de variante genética en LMNA y pronósticoSegún las recomendaciones actuales, la presencia de una variante no missense en LMNA confiere un peor pronóstico que una missense6-8. Sin embargo, nuestro estudio no confirma esta diferencia.
Una posible explicación es la patogenicidad atribuida a algunas de las variantes incluidas en el estudio original de Van Rijsingen et al.10. Como un criterio de patogenicidad, las variantes recogidas en su cohorte estaban ausentes en al menos 150 controles étnicamente compatibles. Sin embargo, de las 37 variantes genéticas missense incluidas en el artículo original, al menos 6 (p.Lys117Arg, p.Arg397Cys, p.Arg545His, p .Ser573Leu, p.Gly638Arg y p.Arg644Cys) podrían clasificarse actualmente como variantes de significado incierto o probablemente no patógenas (). Todas estas variantes tienen frecuencias bajas pero significativas en las bases de datos públicas, como gnomAD11, y se clasifican como variantes de significado incierto o posibles variantes no patógenas en ClinVar12. Con la información disponible en 2012, era imposible realizar esta comprobación. Estas variantes se encontraron en 12 casos índice y 19 familiares que deberían haber sido excluidos del análisis. La inclusión de variantes de LMNA no patógenas y, por lo tanto, la inclusión de MCD de otras etiologías que podrían haber tenido un curso más benigno podrían explicar el pronóstico diferente observado en los portadores de variantes genéticas missense.
En la puntuación de Wahbi et al., los autores no mencionan qué variantes genéticas se incluyeron en el estudio, por lo que es imposible confirmar su patogenicidad. También incluyeron a pacientes con fenotipos diferentes de la cardiolaminopatía (72 pacientes con lipodistrofia, 65 con Emery-Dreifuss, etc.) de modo que podrían haber influido en sus resultados8,13.
En el registro REDLAMINA se incluyeron solo variantes genéticas patógenas y muy probablemente patógenas (según los criterios actuales)9 y se excluyeron todas las variantes que no están claramente relacionadas con el fenotipo de cardiolaminopatía como se define en la sección «Métodos» ( y ).
La otra posible explicación para la discrepancia de resultados es que no todas las variantes missense patógenas incluidas en estos estudios tienen el mismo pronóstico. Es posible que las variantes genéticas missense incluidas en la cohorte del registro REDLAMINA puedan estar asociadas con un peor pronóstico que las incluidas en la cohorte europea y la cohorte de Wahbi et al.8.
Diferencias entre varones y mujeresEn el presente registro, el riesgo de EAM y MIC fue similar en varones y mujeres. Sin embargo, el número de DAI implantados a varones fue mayor que el de mujeres (tabla 1). Aunque se pudiera pensar que este hecho se debe a la aplicación estricta de las guías (ya que el sexo masculino es un factor de riesgo), en el registro REDLAMINA cada centro ha aplicado criterios propios en cuanto a implante de DAI (). Esta actitud no es infrecuente en casos de enfermedades raras asociadas con eventos de MS.
En nuestra cohorte, los varones tenían una FEVI más baja en el primer contacto y, aunque el número de TxC fue mayor en varones que en mujeres, no hubo diferencias significativas por sexo en la incidencia de este evento durante el seguimiento (figura 3). Tampoco se hallaron diferencias entre varones y mujeres en los eventos finales combinados (EAM y MIC) o los fenómenos embólicos, MS, BAV, implante de marcapasos o descarga del DAI (tabla 1).
La inclusión de variantes missense no patógenas en estudios previos y el diferente pronóstico de algunas variantes missense podrían haber condicionado los resultados de las cohortes previas10,14.
Variantes missense en LMNA de «bajo riesgo»Se han descrito en la literatura variantes missense de «bajo riesgo» con efecto fundador. Así las variantes p.Arg331Gln (58 portadores) y p.Arg216Cys (36 portadores) se han asociado con una presentación tardía y un buen pronóstico comparadas con otras variantes patógenas en LMNA15,16. Captur et al.17,18 realizaron un estudio de todas las variantes genéticas en LMNA publicadas y su relación con el fenotipo descrito, y encontraron que las arritmias ventriculares malignas ocurren con mayor frecuencia en el grupo de portadores de variantes no missense, pero es interesante que observarn que no todas las variantes missense confieren el mismo pronóstico.
Variantes missense en LMNA de «alto riesgo»Por otro lado, hay variantes missense en LMNA asociadas con «mal pronóstico». Un claro ejemplo es la variante descrita con más frecuencia en el registro REDLAMINA: p.Arg190Trp. En el registro REDLAMINA se describe a 2 portadores de esta variante missense que, según los criterios de riesgo establecidos (guías y puntuación de Wahbi et al.8), no precisarían el implante de DAI y sin embargo sufrieron una MS. Estos 2 portadores tenían solo 1 factor de riesgo (el varón por su sexo y la mujer porque su FEVI estaba reducida). Si se hubiéra aplicado la puntuación de Wahbi et al., tampoco se habría indicado el implante de un DAI (< 7%). Pero si se revisa la literatura sobre esta variante, probablemente se debería considerarla de «alto riesgo». Al menos 19 artículos proporcionan información clínica sobre 23 familias afectadas, con alta incidencia de TxC, MS e insuficiencia cardiaca. Mencionaron por primera vez esta variante Arbustini et al.19 en 2002, en una familia italiana con MCD y MS súbita. Posteriormente se ha descrito en varias ocasiones en otras familias europeas, asiáticas y americanas, siempre asociada con pronósticos desfavorables ().
Los criterios de riesgo actuales subestiman el riesgo de las variantes missenseNuestros datos indican que los criterios de riesgo actuales en las cardiolaminopatías no son apropiados para portadores de variantes missense, porque no todas ellas comparten el mismo pronóstico. Las guías americana y europea y la puntuación de Wahbi et al. subestiman el riesgo de estas variantes missense6-8. Los trabajos de Van Rijsingen et al.10,14 y Wahbi et al.8, aparte de las limitaciones ya mencionadas, no proporcionan datos clínicos que permitan saber qué eventos están relacionados con cada variante en particular13. Consideramos que es esencial desarrollar registros internacionales para compartir información clínica sobre variantes missense en LMNA que permitan inferir información pronóstica de ellos y ayuden a la estratificación del riesgo de MS.
Las recomendaciones actuales sobre el implante de DAI en las cardiolaminopatías son una buena estrategia, pero pueden subestimar el riesgo de MS de algunas variantes missense y para las mujeres. Se necesitan más estudios que, venciendo las limitaciones referidas, aborden estos aspectos.
LimitacionesEl registro REDLAMINA tiene las limitaciones de un estudio retrospectivo y multicéntrico. La mayoría de los centros participantes son centros de referencia con programas de TxC, por lo que podría haber un sesgo de selección en cuanto a la gravedad de los pacientes incluidos. La cohorte del registro REDLAMINA recopiló datos de varios centros, lo que podría haber introducido un sesgo imprevisto. Nuestro tamaño muestral es más pequeño que el de los registros previamente publicados, aunque tiene la ventaja de ser de un solo país, a diferencia de los demás, con el sesgo que el distinto tratamiento de los pacientes pudiera conllevar. El hecho de que la variante más frecuente fuera p.Arg190Trp (de la que ya se conocía un pronóstico adverso) puede influir en los resultados obtenidos.
En nuestra cohorte, hubo pocos eventos en los grupos con bajo riesgo, y no se puede sacar conclusiones definitivas, lo que puede ser una limitación de nuestro estudio. De hecho, solo se han registrado 17 EAM, frente a un número más elevado en las otras series mencionadas. Sin embargo, también hay que considerar que en estas series también se incluyeron eventos relacionados con variantes missense de muy dudosa patogenicidad (como en la serie de van Rinjensen et al.10,14) o simplemente no ofrecen datos sobre qué variantes missense se han relacionado con eventos en la serie de Wahbi et al.8. Además, en el registro REDLAMINA, cuando se considera a los pacientes del grupo con «alto riesgo» (al menos 2 factores de riesgo), también se halla que no hay diferencias significativas entre varones y mujeres, como ya se había demostrado.
No a todos los pacientes incluidos en nuestro estudio se les había hecho un panel completo (mediante ultrasecuenciación masiva) de genes relacionados con la MCD, ya que algunos de los estudios más antiguos se realizaron mediante la técnica de Sanger. Esto podría suponer un sesgo, ya que los pacientes de los que solo se estudió el gen LMNA podrían tener una variante patogénica en otro gen que podría haber influido en el pronóstico.
El bajo número de pacientes con resonancia cardiaca realizada (52 pacientes de 140 incluidos) puede ser también una limitación de este estudio.
CONCLUSIONESEn la cohorte del registro REDLAMINA, los únicos 2 predictores independientes asociados con EAM fueron la TVNS y la FEVI <45%, mientras que el sexo y el tipo de variante genética (missense frente a no missense) no lo fueron. Así, no se debe considerar grupo con bajo riesgo a las portadoras de variantes missense con TVNS o FEVI <45%. Para una estratificación de riesgo adecuada, se necesita individualizar el pronóstico de las variantes missense, ya que algunas de estas en LMNA pueden tener un pronóstico tan malo como las variantes no missense.
FINANCIACIÓNEste trabajo recibió una subvención del «Proyecto de investigación de la Sección de Insuficiencia Cardiaca 2017 de la Sociedad Española de Cardiología» y subvenciones del Instituto de Salud Carlos III (ISCIII) [PI14/0967, PI15/01551, AC16/0014] y ERA-CVD Joint Transnational Call 2016 (Genprovic). Las subvenciones de ISCIII y del Ministerio de Economía y Competitividad de España están respaldadas por el Plan Estatal de I+D+i 2013-2016: Fondo Europeo de Desarrollo Regional (FEDER) «Una forma de hacer Europa». El Hospital Universitario Puerta de Hierro Majadahonda y el Hospital Virgen de la Arrixaca son miembros de la Red Europea de Referencia para enfermedades del corazón raras, de baja prevalencia y complejas (ERN GUARD-Heart). Los financiadores no han intervenido en el diseño, la recopilación, el análisis o la interpretación de los datos o en la decisión de enviar el manuscrito para su publicación.
CONFLICTO DE INTERESESL. Monserrat es CEO de Health in Code S.L. Los demás autores no tienen conflictos de intereses que declarar.
- –
Las variantes genéticas en el gen de la lamina (LMNA) causan del 5 al 10% de las MCD y se asocian con trastornos de la conducción, arritmias, MS precoz, MIC o TxC. Según las guías, se debe considerar el DAI cuando hay 2 o más de los siguientes factores de riesgo: sexo masculino, FEVI <45%, TVNS y variantes no missense.
- –
Se describen las características de una cohorte española de 140 portadores (≥ 16 años) de variantes en LMNA y se evalúan los criterios de riesgo vigentes. Los únicos 2 predictores asociados con MS o descarga apropiada del DAI fueron la TVNS y la FEVI <45% y con la MIC, la FEVI <45%, pero no el sexo o el tipo de variante genética.
- –
Nuestros datos indican que los criterios de riesgo actuales subestiman el riesgo de las variantes missense, porque no todas comparten el mismo pronóstico. No se debería considerar grupo de bajo riesgo a las portadoras de variantes missense con TVNS o FEVI <45%, pues es importante individualizar el riesgo.
A Cristina Martinez-Veira, Diana Castro-Dios, Efrén Freije-Botana y David Martos por su inestimable ayuda con el registro REDLAMINA.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2020.03.002
En el