La incidencia de implante de marcapasos permanente (IMP) y nuevas alteraciones de la conducción (AC) con la ACURATE neo (Symetis S.A., Eclubens, Suiza) no se ha estudiado en detalle. Nuestro objetivo fue analizar sus predictores, evaluándose los factores relacionados con el paciente y con el dispositivo, tal como la profundidad del implante y la relación entre el dispositivo y el anillo (RDA).
MétodosDe una población multicéntrica, se realizaron 2 análisis: nuevos IMP (n = 283), e IMP/nuevas AC en pacientes sin AC previas o marcapasos (n = 232).
ResultadosEn el 9,9% de los pacientes se necesitó nuevo IMP, que se asoció con un mayor índice de masa corporal, mayor proporción de bloqueo de rama derecha y bradicardia. Ni el implante de la prótesis ni la RDA difirieron entre pacientes con o sin IMP. En el análisis multivariante ni la RDA (OR = 1,010; IC95%, 0,967-1,055; p = 0,7), ni la profundidad del implante (OR = 0,972; IC95%, 0,743-1,272; p = 0,8) fueron predictores de IMP. Solo el índice de masa corporal, la bradicardia y el bloqueo de rama derecha persistieron como predictores independientes. El IMP/nueva aparición de AC ocurrió en el 22,8% de los pacientes y se asoció con un mayor EuroSCORE logístico. Ni la profundidad del implante ni la RDA eran diferentes en pacientes con o sin IMP/nueva aparición de AC (7,3 ± 1,9 frente a 7,1 ± 1,5mm; p = 0,6 y 41,0 ± 7,9 frente a 42,2 ± 10,1%; p = 0,4). El único predictor de IMP/nuevo inicio de AC fue un mayor EuroSCORE logístico (OR = 1,039; IC95%, 1,008-1,071; p = 0,013).
ConclusionesLa proporción de nuevos IMP y nueva aparición de AC eran inferiores con la ACURATE neo. Estos hechos están principalmente influenciados por las características de los pacientes y no por los factores dependientes del dispositivo.
Palabras clave
Las alteraciones de la conducción cardiaca (AC) que llevan al implante de un marcapasos permanente (IMP) son una complicación tras el implante percutáneo de válvula aórtica (TAVI)1. Aunque en investigaciones anteriores y en los datos recientes del ensayo SURTAVI no se ha observado ningún efecto negativo de los nuevos IMP en los resultados clínicos2,3, los datos del ensayo PARTNER han identificado que el marcapasos crónico es un factor independiente predictivo de la mortalidad a 1 año tras el TAVI4,5. Además, el IMP aumenta los costes totales y es una causa importante de que se prolongue la estancia hospitalaria4,6.
La tasa de nuevos IMP con las válvulas cardiacas percutáneas (VCP) autoexpandibles se ha analizado detalladamente con los dispositivos de la anterior generación, como CoreValve (Medtronic Inc.; Minneapolis, Minnesota, Estados Unidos), con los que la incidencia ha sido de hasta un 40%7. Con la nueva generación de VCP autoexpandible, la tasa de IMP se ha reducido, con tasas del 12 al 15% con la válvula CoreValve Evolut R (Medtronic Inc.) y del 9 al 10% con la válvula Portico (St. Jude Medical; St. Paul, Minnesota, Estados Unidos)8–11.
En 2014 se concedió la autorización de marca de CE a una nueva VCP autoexpandible, la ACURATE neo (Symetis S.A.; Ecublens, Suiza), y los datos del registro poscomercialización con 1.000 pacientes mostraron una tasa de IMP prometedora del 8,2%12. Sin embargo, no se ha realizado un análisis detallado de la tasa de IMP y los posibles mecanismos subyacentes. Aparte de los factores no modificables relacionados con el paciente, como el bloqueo de rama derecha previo, el bloqueo auriculoventricular de primer grado o la fibrilación auricular, que se ha demostrado que influyen en las tasas de IMP, hay mecanismos específicos del dispositivo, como la profundidad del implante y la relación entre dispositivo y anillo (RDA) que pueden tener también un papel1.
Por consiguiente, se analizó la asociación de un conjunto detallado de características clínicas y electrocardiográficas, así como de la profundidad del implante y la RDA determinada mediante tomografía computarizada, con el IMP y la nueva aparición de AC después de un TAVI con la válvula ACURATE neo.
MÉTODOSPoblación de pacientes y definición de los objetivosEntre enero de 2014 y enero de 2016, se trató en 3 centros de Alemania a 311 pacientes consecutivos con estenosis aórtica grave de la válvula nativa con TAVI transfemoral con la válvula ACURATE neo13. Los objetivos de este estudio fueron: a) la necesidad de un IMP antes del alta, y b) el conjunto de eventos de un nuevo IMP o una nueva aparición de AC (IMP/nueva aparición de AC). Para el análisis del nuevo IMP, se excluyó a los pacientes que ya eran portadores de un marcapasos (n = 28), con lo que quedaron 283 pacientes para el análisis.
Para analizar el IMP/nueva aparición de AC, se excluyó a los pacientes que ya llevaban un marcapasos (n = 28), tenían bloqueo completo de rama del haz en situación basal (n = 47) o datos de electrocardiograma incompletos (n = 3) y a los fallecidos en la intervención (n = 1), con lo que quedaron 232 pacientes para el análisis. La nueva aparición de AC se definió como un bloqueo de rama izquierda o derecha de nueva aparición antes del alta.
Se realizó un electrocardiograma de 12 derivaciones al ingreso y antes del alta, examinados por 2 médicos a los que se ocultaron los datos clínicos, siguiendo las recomendaciones actuales14. Los casos dudosos se resolvieron por consenso. En los pacientes con un nuevo IMP, no se evaluó la conducción intraventricular debido a la posible interferencia de la estimulación del marcapasos, y se los designó como «marcapasos». Los datos se obtuvieron de manera prospectiva y se clasificaron según los criterios actualizados del Valve Academic Research Consortium (VARC-2)15.
Análisis de la tomografía computarizada multicorteSe realizó una tomografía computarizada multicorte con sincronización electrocardiográfica en todos los casos, con el SOMATOM Force o el SOMATOM Definition Flash (Siemens Healthcare; Erlangen, Alemania). Se realizaron las mediciones del anillo aórtico en una reconstrucción en múltiples planos, siguiendo lo establecido en las guías actuales como se ha descrito con anterioridad16,17. De forma resumida, se determinaron los diámetros mínimo y máximo, así como el área y el perímetro del anillo en el lugar más bajo de las cúspides coronarias. Se evaluó la excentricidad del anillo mediante el índice de excentricidad: (1 − diámetro mínimo / diámetro máximo). La calcificación de las cúspides aórticas se evaluó visualmente y se dicotomizó clasificándola como ninguna-leve frente a moderada-grave. Se utilizó el programa informático aprobado por la Food and Drug Administration OsiriX MD 3.9.4 (Pixmeo, Suiza) o el 3Mensio (3Mensio; Bilthoven, Países Bajos).
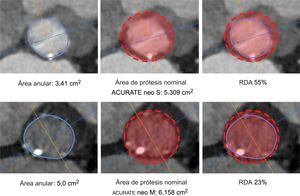
Elección del tamaño de la prótesis e intervenciónLa ACURATE neo está disponible en 3 tamaños (pequeño, medio y grande) que cubren un intervalo de medidas del anillo de 21–27 mm. La decisión final respecto a la elección de la prótesis se dejó al criterio del médico que realizaba la intervención, teniendo en cuenta las recomendaciones del fabricante respecto al tamaño, la calcificación y las características anatómicas. Los aspectos técnicos y las recomendaciones de tamaño se presentan en la . La RDA se calculó como parámetro indirecto indicativo del exceso de tamaño de la prótesis empleando la siguiente fórmula: (tamaño nominal de la prótesis / anatomía del paciente – 1) × 10016. La adherencia a las guías relativas al tamaño según el área se clasificó como «dentro del intervalo de valores», «tamaño insuficiente», y «tamaño excesivo». Se presentan ejemplos en la figura 1. La intervención se realizó según lo descrito con anterioridad18. Todos los pacientes dieron su consentimiento informado por escrito para la intervención.
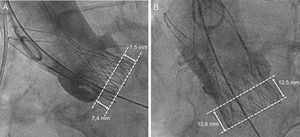
Determinación de la profundidad de implante de la prótesisLa profundidad de implante de la prótesis se determinó en un laboratorio central (ISAResearch Center, Deutsches Herzzentrum München, Múnich, Alemania) mediante la angiografía aórtica final, que mostraba la prótesis en una proyección ortogonal, según lo ya descrito16. Se marcó el anillo aórtico nativo mediante la intersección del punto más bajo de los senos de Valsalva. Se midió la altura del cuerpo del stent de la prótesis y la parte situada por debajo del anillo aórtico en el lado septal (la cúspide no coronaria) y en el no septal (la cúspide coronaria izquierda). La profundidad del implante se definió como la distancia entre el anillo aórtico y la parte distal de la prótesis (figura 2). Para todas las mediciones, se utilizó el QAngio XA versión 7.3 (Medis Medical Imaging Systems; Leiden, Países Bajos) con calibración isocéntrica. Se evaluó la profundidad de la prótesis de los 276/283 (98%) pacientes de los que se dispuso de angiografías aórticas evaluables tras el despliegue del dispositivo. En los casos en que se desplegaron múltiples válvulas (n = 6), se determinó la profundidad máxima de protrusión de la prótesis en el tracto de salida del ventrículo izquierdo.
Ejemplos de implante de prótesis a la altura pretendida (A) y profundo (B) en el tracto de salida del ventrículo izquierdo. La profundidad del implante en la angiografía se determinó mediante la parte de la prótesis que protruía del anillo aórtico virtual en el tracto de salida del ventrículo izquierdo.
Las variables continuas se expresan en forma de media ± desviación estándar o mediana [intervalo intercuartílico] y se compararon con la prueba de la t de Student para datos no emparejados o la prueba de la U de Mann-Whitney, según procediera. Las variables discretas se compararon con la prueba de la χ2 o la prueba exacta de Fisher según procediera. Para identificar los factores independientes predictivos de IMP y nueva aparición de AC, se realizaron análisis multivariables, con un ajuste por las variables que alcanzaban un valor de p < 0,1 en los análisis univariables. Para determinar las repercusiones de la RDA, la profundidad de implante y el bloqueo auriculoventricular de primer grado, que son factores con influencia en las tasas de IMP1, estas variables se incluyeron en los modelos fuera cual fuere su valor de p en los análisis univariables. Dada la multicolinealidad existente entre las puntuaciones de riesgo, el EuroSCORE fue la única puntuación incluida en el análisis multivariable. Se calcularon los valores de odds ratio (OR) junto con los intervalos de confianza del 95% (IC95%). Se consideró estadísticamente significativo un valor de p bilateral < 0,05. Para los análisis se utilizó el programa IBM SPSS Statistics versión 22 (SPSS Inc.; Chicago, Illinois, Estados Unidos).
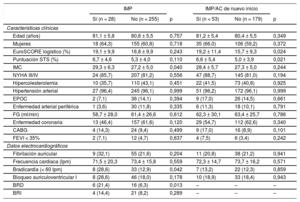
RESULTADOSLa media de edad de la población total del estudio era 80,8 ± 5,5 años, con el 61,1% (173/283) de mujeres, y las medias del EuroSCORE logístico y de la puntuación de la Society of Thoracic Surgeons fueron del 17,0 ± 9,9% y el 5,5 ± 4,1% respectivamente. La media de la profundidad del implante fue 7,1 ± 1,6 mm. La media de la RDA fue un 42,2 ± 9,8% y la elección del tamaño de la prótesis estuvo dentro del intervalo de valores establecidos en el 75,6%, fue de un tamaño insuficiente en el 4,2% y excesivo en el 20,2% de los casos. Se alcanzó el éxito del dispositivo en el 88,7% (251/283) de los casos y la mortalidad hospitalaria fue del 1,4% (4/283).
Nuevo implante de marcapasos permanenteRequirieron un nuevo IMP el 9,9% (28/283) de los pacientes, principalmente por un bloqueo auriculoventricular de tercer grado persistente, el 42,9% (12/28), o una bradicardia sintomática, el 25,0% (7/28). Puede consultarse la indicación detallada del IMP en la . Las tasas de IMP no mostraron diferencias entre los centros participantes (el 10,3, el 8,6 y el 9,9%; p de tendencia = 0,768). Los pacientes con un IMP tenían mayores índice de masa corporal (29,3 ± 6,3 frente a 27,2 ± 5,0kg/m2; p = 0,040), tasa de bradicardia al ingreso (frecuencia cardiaca < 60 lpm) (el 28,6 frente al 12,9%; p = 0,042) y frecuencia de bloqueo completo de rama derecha (el 21,4 frente al 6,3%; p = 0,13) que los pacientes sin IMP (tabla 1). La duración de la intervención (67,4 ± 49,0 frente a 53,5 ± 27,7 min; p = 0,022) y el tiempo de fluoroscopia (13,8 [8,3-17,5] frente a 9,1 [5,8-13,5] min; p = 0,010) de los pacientes con un nuevo IMP fueron significativamente mayores que los de los pacientes sin IMP. No hubo diferencias entre los 2 grupos en el uso de la sedación consciente ni en la estrategia de predilatación y posdilatación. Los resultados clínicos hospitalarios en los pacientes con IMP y sin IMP fueron similares (tabla 2). La necesidad de IMP fue independiente de la elección del tamaño de la prótesis (p de tendencia = 0,555). En términos generales, la estancia hospitalaria de los pacientes que necesitaron un IMP fue mayor (12,5 [8,5-16,0] frente a 8,0 [5,0-10,0] días; p < 0,001).
Características basales y electrocardiográficas
| IMP | IMP/AC de nuevo inicio | |||||
|---|---|---|---|---|---|---|
| Sí (n = 28) | No (n = 255) | p | Sí (n = 53) | No (n = 179) | p | |
| Características clínicas | ||||||
| Edad (años) | 81,1 ± 5,8 | 80,8 ± 5,5 | 0,757 | 81,2 ± 5,4 | 80,4 ± 5,5 | 0,349 |
| Mujeres | 18 (64,3) | 155 (60,8) | 0,718 | 35 (66,0) | 106 (59,2) | 0,372 |
| EuroSCORE logístico (%) | 19,1 ± 9,9 | 16,8 ± 9,9 | 0,243 | 19,2 ± 11,4 | 15,7 ± 9,3 | 0,024 |
| Puntuación STS (%) | 6,7 ± 4,6 | 5,3 ± 4,0 | 0,110 | 6,6 ± 5,4 | 5,0 ± 3,9 | 0,021 |
| IMC | 29,3 ± 6,3 | 27,2 ± 5,0 | 0,040 | 28,4 ± 5,7 | 27,3 ± 5,0 | 0,244 |
| NYHA III/IV | 24 (85,7) | 207 (81,2) | 0,556 | 47 (88,7) | 145 (81,0) | 0,194 |
| Hipercolesterolemia | 10 (35,7) | 110 (43,1) | 0,451 | 22 (41,5) | 73 (40,8) | 0,925 |
| Hipertensión arterial | 27 (96,4) | 245 (96,1) | 0,999 | 51 (96,2) | 172 (96,1) | 0,999 |
| EPOC | 2 (7,1) | 36 (14,1) | 0,394 | 9 (17,0) | 26 (14,5) | 0,661 |
| Enfermedad arterial periférica | 1 (3,6) | 30 (11,8) | 0,335 | 6 (11,3) | 18 (10,1) | 0,791 |
| FG (ml/min) | 58,7 ± 28,0 | 61,4 ± 26,6 | 0,612 | 62,3 ± 30,1 | 63,4 ± 25,7 | 0,786 |
| Enfermedad coronaria | 13 (46,4) | 157 (61,6) | 0,120 | 29 (54,7) | 112 (62,6) | 0,340 |
| CABG | 4 (14,3) | 24 (9,4) | 0,499 | 9 (17,0) | 16 (8,9) | 0,101 |
| FEVI < 35% | 2 (7,1) | 12 (4,7) | 0,637 | 4 (7,5) | 6 (3,4) | 0,242 |
| Datos electrocardiográficos | ||||||
| Fibrilación auricular | 9 (32,1) | 55 (21,6) | 0,204 | 11 (20,8) | 38 (21,2) | 0,941 |
| Frecuencia cardiaca (lpm) | 71,5 ± 20,3 | 73,4 ± 15,8 | 0,559 | 72,3 ± 14,7 | 73,7 ± 16,2 | 0,571 |
| Bradicardia (< 60 lpm) | 8 (28,6) | 33 (12,9) | 0,042 | 7 (13,2) | 22 (12,3) | 0,859 |
| Bloqueo auriculoventricular I | 8 (28,6) | 46 (18,0) | 0,178 | 10 (18,9) | 33 (18,4) | 0,943 |
| BRD | 6 (21,4) | 16 (6,3) | 0,013 | – | – | – |
| BRI | 4 (14,4) | 21 (8,2) | 0,289 | – | – | – |
AC: alteraciones de la conducción; BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; CABG: cirugía de bypass arterial coronario; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; FG: filtrado glomerular; IMC: índice de masa corporal; IMP: implante de marcapasos permanente; NYHA: New York Heart Association; STS: Society of Thoracic Surgeons.
Los valores expresan media ± desviación estándar o n (%).
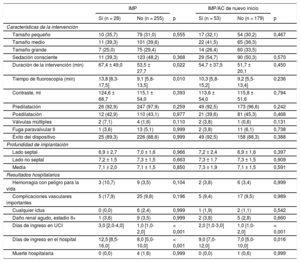
Características de la intervención y resultados
| IMP | IMP/AC de nuevo inicio | |||||
|---|---|---|---|---|---|---|
| Sí (n = 28) | No (n = 255) | p | Sí (n = 53) | No (n = 179) | p | |
| Características de la intervención | ||||||
| Tamaño pequeño | 10 (35,7) | 79 (31,0) | 0,555 | 17 (32,1) | 54 (30,2) | 0,467 |
| Tamaño medio | 11 (39,3) | 101 (39,6) | 22 (41,5) | 65 (36,3) | ||
| Tamaño grande | 7 (25,0) | 75 (29,4) | 14 (26,4) | 60 (33,5) | ||
| Sedación consciente | 11 (39,3) | 123 (48,2) | 0,368 | 29 (54,7) | 90 (50,3) | 0,570 |
| Duración de la intervención (min) | 67,4 ± 49,0 | 53,5 ± 27,7 | 0,022 | 54,7 ± 37,5 | 51,7 ± 20,1 | 0,450 |
| Tiempo de fluoroscopia (min) | 13,8 [8,3-17,5] | 9,1 [5,8-13,5] | 0,010 | 10,3 [5,8-15,2] | 9,2 [5,5-13,4] | 0,236 |
| Contraste, ml | 124,6 ± 68,7 | 115,1 ± 54,0 | 0,393 | 113,6 ± 54,0 | 115,8 ± 51,6 | 0,794 |
| Predilatación | 26 (92,9) | 247 (97,9) | 0,259 | 49 (92,5) | 173 (96,6) | 0,242 |
| Posdilatación | 12 (42,9) | 110 (43,1) | 0,977 | 21 (39,6) | 81 (45,3) | 0,468 |
| Válvulas múltiples | 2 (7,1) | 4 (1,6) | 0,110 | 2 (3,8) | 1 (0,6) | 0,131 |
| Fuga paravalvular II | 1 (3,6) | 13 (5,1) | 0,999 | 2 (3,8) | 11 (6,1) | 0,738 |
| Éxito del dispositivo | 25 (89,3) | 226 (88,6) | 0,999 | 49 (92,5) | 158 (88,3) | 0,388 |
| Profundidad de implantación | ||||||
| Lado septal | 6,9 ± 2,7 | 7,0 ± 1,6 | 0,966 | 7,2 ± 2,4 | 6,9 ± 1,6 | 0,397 |
| Lado no septal | 7,2 ± 1,5 | 7,3 ± 1,5 | 0,663 | 7,3 ± 1,7 | 7,3 ± 1,5 | 0,909 |
| Media | 7,1 ± 2,0 | 7,1 ± 1,5 | 0,850 | 7,3 ± 1,9 | 7,1 ± 1,5 | 0,591 |
| Resultados hospitalarios | ||||||
| Hemorragia con peligro para la vida | 3 (10,7) | 9 (3,5) | 0,104 | 2 (3,8) | 6 (3,4) | 0,999 |
| Complicaciones vasculares importantes | 5 (17,9) | 25 (9,8) | 0,196 | 5 (9,4) | 17 (9,5) | 0,989 |
| Cualquier ictus | 0 (0,0) | 6 (2,4) | 0,999 | 1 (1,9) | 2 (1,1) | 0,542 |
| Daño renal agudo, estadio II+ | 1 (3,6) | 9 (3,5) | 0,999 | 2 (3,8) | 5 (2,8) | 0,660 |
| Días de ingreso en UCI | 3,0 [2,0-4,0] | 1,0 [1,0-2,0] | < 0,001 | 2,0 [1,0-3,0] | 1,0 [1,0-2,0] | < 0,001 |
| Días de ingreso en el hospital | 12,5 [8,5-16,0] | 8,0 [5,0-10,0] | < 0,001 | 9,0 [7,0-12,0] | 7,0 [5,0-10,0] | 0,016 |
| Muerte hospitalaria | 0 (0,0) | 4 (1,6) | 0,999 | 0 (0,0) | 1 (0,6) | 0,999 |
AC: alteraciones de la conducción; IMP: implante de marcapasos permanente; UCI: unidad de cuidados intensivos.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
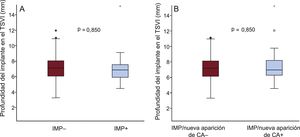
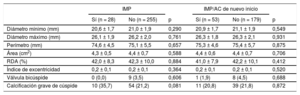
El análisis angiográfico realizado en el laboratorio central puso de manifiesto que la profundidad media del implante no difería entre los pacientes con y sin un IMP (7,1 ± 2,0 frente a 7,1 ± 1,5 mm; p = 0,850) (tabla 2 y figura 3A). En la tabla 3 se presentan los datos de tomografía computarizada multicorte y el grado de RDA en función de la necesidad de IMP. Hubo una tendencia no significativa a unas tasas más altas de calcificación grave de las cúspides en los pacientes que requirieron un IMP en comparación con los que no (el 35,7 frente al 21,2%; p = 0,081), mientras que no se observaron diferencias en la anatomía aórtica por lo que respecta a válvulas bicúspides y excentricidad del anillo.
Mediciones del anillo aórtico y del exceso de tamaño en la tomografía computarizada multicorte
| IMP | IMP/AC de nuevo inicio | |||||
|---|---|---|---|---|---|---|
| Sí (n = 28) | No (n = 255) | p | Sí (n = 53) | No (n = 179) | p | |
| Diámetro mínimo (mm) | 20,6 ± 1,7 | 21,0 ± 1,9 | 0,290 | 20,9 ± 1,7 | 21,1 ± 1,9 | 0,549 |
| Diámetro máximo (mm) | 26,1 ± 1,9 | 26,2 ± 2,0 | 0,761 | 26,3 ± 1,8 | 26,3 ± 2,1 | 0,931 |
| Perímetro (mm) | 74,6 ± 4,5 | 75,1 ± 5,5 | 0,657 | 75,3 ± 4,6 | 75,4 ± 5,7 | 0,875 |
| Área (cm2) | 4,3 ± 0,5 | 4,4 ± 0,7 | 0,588 | 4,4 ± 0,6 | 4,4 ± 0,7 | 0,706 |
| RDA (%) | 42,0 ± 8,3 | 42,3 ± 10,0 | 0,884 | 41,0 ± 7,9 | 42,2 ± 10,1 | 0,412 |
| Índice de excentricidad | 0,2 ± 0,1 | 0,2 ± 0,1 | 0,364 | 0,2 ± 0,1 | 0,2 ± 0,1 | 0,520 |
| Válvula bicúspide | 0 (0,0) | 9 (3,5) | 0,606 | 1 (1,9) | 8 (4,5) | 0,688 |
| Calcificación grave de cúspide | 10 (35,7) | 54 (21,2) | 0,081 | 11 (20,8) | 39 (21,8) | 0,872 |
AC: alteraciones de la conducción; IMP: implante de marcapasos permanente; RDA: relación entre dispositivo y anillo.
Los valores expresan n (%) o media ± desviación estándar.
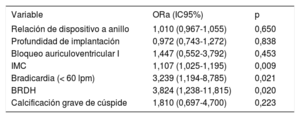
En el análisis multivariable, solo el índice de masa corporal, la bradicardia y el bloqueo completo de rama derecha en la situación inicial siguieron siendo factores independientes predictivos de IMP (tabla 4). La relación entre dispositivo y anillo (OR = 1,010; IC95%, 0,967-1,055; p = 0,650), la profundidad del implante (OR = 0,972; IC95%, 0,743-1,272; p = 0,838) y el bloqueo auriculoventricular I (OR = 1,447; IC95%, 0,552-3,792; p = 0,453) no mostraron asociación con la necesidad de un nuevo IMP. Además, la tasa de IMP se mantuvo constante en todos los terciles de intervenciones consecutivas, lo cual indica que no hubo un efecto de una curva de aprendizaje en las tasas de IMP (p de tendencia = 0,845).
Análisis multivariable del nuevo implante de marcapasos permanente
| Variable | ORa (IC95%) | p |
|---|---|---|
| Relación de dispositivo a anillo | 1,010 (0,967-1,055) | 0,650 |
| Profundidad de implantación | 0,972 (0,743-1,272) | 0,838 |
| Bloqueo auriculoventricular I | 1,447 (0,552-3,792) | 0,453 |
| IMC | 1,107 (1,025-1,195) | 0,009 |
| Bradicardia (< 60 lpm) | 3,239 (1,194-8,785) | 0,021 |
| BRDH | 3,824 (1,238-11,815) | 0,020 |
| Calcificación grave de cúspide | 1,810 (0,697-4,700) | 0,223 |
BRD: bloqueo de rama derecha; IC95%: intervalo de confianza del 95%; IMC: índice de masa corporal; ORa: odds ratio ajustada.
En el seguimiento a los 30 días tras el alta, solo 1 paciente necesitó un IMP, debido a un síndrome del seno enfermo, con lo que la tasa acumulada de IMP fue del 10,2% (29/283) a los 30 días.
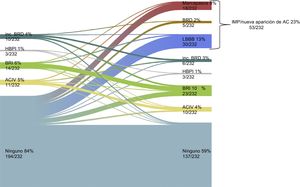
Nuevo implante de marcapasos permanente o nueva aparición de alteraciones de la conducciónEl implante de marcapasos permanente/nueva aparición de AC se dio en el 22,8% (53/232) de los casos. En la figura 4 se muestran los cambios de la conducción cardiaca antes y después del TAVI. El EuroSCORE logístico de los pacientes con un IMP/nueva aparición de AC fue superior que sin ello (el 19,2 ± 11,4 frente al 15,7 ± 9,3%; p = 0,024) (tabla 1). En la tabla 2 se presentan las características de la intervención y los resultados según hubiera o no un IMP/nueva aparición de AC. El tamaño de prótesis elegido (p de tendencia = 0,467) no mostró diferencias en los pacientes con IMP/nueva aparición de AC, mientras que la estancia hospitalaria fue significativamente mayor (9,0 [7,0-12,0] frente a 7,0 [5,0-10,0] días; p = 0,016). El uso de predilatación y posdilatación no mostró diferencias entre los 2 grupos (tabla 2). Tampoco hubo diferencias en la profundidad del implante (media, 7,3 ± 1,9 frente a 7,1 ± 1,5 mm; p = 0,591) (tabla 2 y figura 3B) o la RDA (el 41,0 ± 7,9 frente al 42,2 ± 10,1%; p = 0,412) (tabla 3).
Evolución de la conducción cardiaca en la situación inicial y antes del alta en la población para el análisis de IMP/nueva aparición de AC. AC: alteraciones de la conducción; ACIV: anomalía de conducción intraventricular; BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; HBAI: hemibloqueo anterior izquierdo; HBPI: hemibloqueo posterior izquierdo; IMP: implante de marcapasos permanente.
En un análisis multivariable, solo el EuroSCORE logístico (OR = 1,039; IC95%, 1,008-1,071; p = 0,013) siguió siendo un factor independiente predictivo de IMP/nueva aparición de AC, mientras que la RDA (OR = 0,988; IC95%, 0,954-1,023; p = 0,502), la profundidad del implante (OR = 1,068; IC95%, 0,875-1,303; p = 0,520) y el bloqueo auriculoventricular de primer grado (OR = 1,008; IC95%, 1,008-1,071; p = 0,986) no tuvieron valor predictivo de IMP/nueva aparición de AC (tabla 5). Se produjo una nueva aparición de bloqueo de rama izquierda en un 12,9% (30/232) de los casos. Se calculó un modelo multivariable para evaluar los factores predictivos del riesgo de una nueva aparición de bloqueo de rama izquierda aislado (tabla 2 del material suplementario), y el único factor predictivo fue un valor más alto del EuroSCORE logístico (OR = 1,038; IC95%, 1,002-1,076; p = 0,038). La tasa de IMP/nueva aparición de AC se mantuvo estable en todos los terciles de intervenciones consecutivas, lo cual indica que no había un efecto de curva de aprendizaje (p de tendencia = 0,237).
Análisis multivariable del implante de marcapasos permanente/nueva aparición de alteraciones de la conducción
| Variable | ORa (IC95%) | p |
|---|---|---|
| Relación entre dispositivo y anillo | 0,988 (0,954-1,023) | 0,502 |
| Profundidad de implantación | 1,068 (0,875-1,303) | 0,520 |
| Bloqueo auriculoventricular I | 1,008 (1,008-1,071) | 0,986 |
| EuroSCORE logístico (por cada % de aumento) | 1,039 (1,008-1,071) | 0,013 |
IC95%: intervalo de confianza del 95%; ORa: odds ratio ajustada.
Por primera vez, se han analizado la incidencia y los factores predictivos del IMP y la nueva aparición de AC con la VCP ACURATE neo en un estudio multicéntrico, centrándose en especial en la influencia de la RDA y la profundidad del implante. Nuestros resultados indican bajas tasas de los eventos de valoración de ambos objetivos. El análisis de los datos del laboratorio angiográfico central y de la tomografía computarizada multicorte no mostraron influencia alguna de la profundidad del implante ni de la RDA en el IMP y la nueva aparición de AC, que al parecer se dan por factores relacionados con el paciente, en especial las variables electrocardiográficas iniciales (bloqueo completo de rama derecha del haz y bradicardia basal).
Implantes de marcapasos permanentesAunque algunas investigaciones no han mostrado efecto alguno de los IMP en la mortalidad3, un reciente análisis del ensayo PARTNER ha identificado el marcapasos crónico como un factor independiente predictivo de la mortalidad a 1 año tras el TAVI4,5. Así pues, la reducción de las tasas de IMP es de capital importancia, en especial al ampliar las indicaciones a una población más joven y de menor riesgo. Con la válvula ACURATE neo, se ha observado una tasa de IMP del 9,9%, en línea con los datos de registro, del 8,2%12. Más recientemente, se ha descrito una tasa de IMP muy baja, del 2,3%, con el empleo de la válvula ACURATE neo19. Aunque este análisis se realizó en solo 175 pacientes, los resultados apuntan que puede alcanzarse una tasa de IMP aún más baja. Es preciso tener en cuenta que nuestro análisis corresponde a la experiencia inicial con esta VCP, mientras que la tasa de IMP más baja corresponde a pacientes tratados más recientemente. Las tasas de IMP cambian con el paso del tiempo, a medida que aumenta la experiencia del operador. Por ejemplo, la tasa de IMP inicial con la válvula SAPIEN 3 fue de entre el 13 y el 21%20,21, mientras que la experiencia más reciente ha indicado unas tasas de solo el 9,9 y el 13,2% a 1 año22,23. Futuros estudios evaluarán si la experiencia creciente del operador y una técnica de implante diferente proporcionan unas tasas de IMP más bajas con la válvula ACURATE neo.
En los estudios realizados con otras VCP autoexpandibles de nueva generación, se han descrito tasas de IMP del 12-15% con la válvula Evolut R8,9 y del 9-10% con la válvula Portico10,11. Hasta el momento no se dispone de datos de ensayos aleatorizados en los que se hayan comparado directamente VCP de nueva generación por lo que respecta a las tasas de IMP. Actualmente están en marcha varios ensayos clínicos en los que se aborda esta cuestión, como el SCOPE I (Safety and Efficacy of the Symetis ACURATE Neo/TF Compared to the Edwards SAPIEN 3 Bioprosthesis), registrado en ClinicalTrials.gov (Identificador: NCT03011346); el SCOPE II (Safety and Efficacy Comparison Of Two TAVI Systems in a Prospective Randomized Evaluation II), registrado en ClinicalTrials.gov (Identificador: NCT03192813), y el SOLVE-TAVI (SecOnd-generation seLf-expandable Versus Balloon-expandable Valves and gEneral Versus Local Anesthesia in TAVI), registrado en ClinicalTrials.gov (Identificador: NCT02737150), que aportarán nuevas perspectivas sobre este tema. Además, estas comparaciones aleatorizadas permitirán una comparación amplia de las VCP más allá de la tasa de IMP, evaluando también los resultados clínicos y el éxito de los dispositivos. En este análisis, se observó éxito del dispositivo según los criterios VARC-2 del 89%, que a primera vista puede parecer bajo en comparación con otras tasas descritas en estudios grandes, como los ensayos PARTNER. Sin embargo, muchos estudios no presentan el éxito del dispositivo definido según los criterios VARC-2, lo cual hace difícil la comparación entre distintos estudios. Los estudios que sí presentan los resultados en cuanto a este objetivo han mostrado unas tasas de éxito similares con las válvulas ACURATE neo (89,1%), SAPIEN 3 (75,7-90,4%) y LOTUS (77,1%)13,24. Un importante factor contribuyente al éxito del dispositivo es la fuga paravalvular, que en este análisis fue del 4,9%. Actualmente se está inscribiendo a pacientes para el empleo de una VCP de nueva generación, la ACURATE neo AS, con objeto de obtener la autorización de la marca CE. Este dispositivo dispone de una falda de sellado adicional para reducir la fuga paravalvular. En estudios futuros se esclarecerá si puede alcanzarse una tasa más baja de fuga paravalvular y, por lo tanto, mayor éxito del dispositivo, sin que ello conlleve una mayor tasa de IMP.
En la literatura se han descrito múltiples factores predictivos del IMP tras el TAVI. En un reciente metanálisis del IMP, Siontis et al. clasificaron estos factores en relacionados con el paciente, electrocardiográficos y de la intervención. Aunque las primeras 2 categorías no se ven influidas por las decisiones o la pericia del operador, los factores relacionados con la intervención o con el dispositivo sí pueden verse influidos por el tamaño del dispositivo o la técnica de implante utilizada1.
La influencia de la profundidad del implante en el IMP se ha descrito con diferentes VCP. En el caso de la válvula CoreValve Evolut R, los pacientes que requirieron un IMP tuvieron una media de profundidad del implante de 9 mm en la cúspide no coronaria8, mientras que una profundidad del implante < 7 mm se ha asociado con unas tasas de IMP más bajas con la válvula CoreValve7. Por lo que respecta a las válvulas expandibles con balón, como la SAPIEN 3, se ha observado que un umbral de 8 mm predice la necesidad de un IMP20. En el presente estudio, se observó una protrusión en el tracto de salida del ventrículo izquierdo con una media de profundidad de 7 mm; es de destacar que no hubo asociación alguna de la profundidad del implante con la necesidad de un IMP ni con el IMP/nueva aparición de AC.
La válvula ACURATE neo se despliega en 2 etapas, con una liberación de arriba abajo; primero se abren 3 arcos de estabilización en la aorta ascendente y la corona superior y luego, en una segunda etapa, se libera la parte inferior de la prótesis en el tracto de salida del ventrículo izquierdo. Esta liberación de arriba abajo, que difiere de la mayoría de las VCP autoexpandibles actualmente en uso, puede hacer que el traumatismo mecánico para el sistema de conducción sea menor.
Hasta la fecha, la influencia de la RDA o del tamaño excesivo de la prótesis se ha evaluado principalmente en el contexto de la fuga paravalvular. Al tratarse de un sistema autoexpandible, la válvula ACURATE neo se ancla en el anillo aórtico ejerciendo una fuerza radial continua en el aparato valvular circundante, lo que hace necesario cierto exceso de tamaño para evitar la fuga paravalvular. Sin embargo, su influencia en el nuevo IMP sigue sin estar clara. La experiencia con la prótesis CoreValve no mostró una influencia de la RDA en las tasas de IMP25. En el presente análisis, la RDA fue relativamente alta, de hasta un 40% en área, pero no se observó efecto alguno en las tasas de IMP. Tal vez esta observación no resulte extraña si se tiene en cuenta que las VCP autoexpandibles ejercen una menor fuerza radial y se adaptan a la anatomía del paciente ejerciendo menos presión en el tejido circundante y causando un menor daño al sistema de conducción. Otra posible explicación es que la mayor RDA no afecte negativamente al sistema de conducción, puesto que la prótesis se implanta en el interior del anillo aórtico y ejerce una fuerza radial baja, sobre todo en la parte ventricular de la VCP.
Este estudio pone de manifiesto que el riesgo de IMP se ve influido principalmente por los factores relacionados con el paciente. Entre ellos se encuentran un índice de masa corporal elevado, la bradicardia en la situación inicial y el bloqueo completo de rama derecha preexistente. Concretamente, se ha descrito de manera uniforme que el bloqueo completo de rama derecha es un potente predictor de IMP sea cual fuere el modelo de VCP utilizado1. Presumiblemente, la lesión traumática inducida por el dispositivo en un sistema de conducción generado (que se aprecia en forma de un bloqueo de rama derecha o una bradicardia) da lugar a un bloqueo cardiaco completo que requiere un nuevo IMP. La observación de que un índice de masa corporal alto influye en la tasa de IMP puede ser un hallazgo casual y requerirá confirmación en otros estudios. Sin embargo, una posible explicación es que los pacientes obesos tengan en general más riesgo de enfermedad cardiovascular, así como de AC26.
Las AC después de un TAVI son dinámicas y una parte de los pacientes tienen un riesgo superior de IMP tardío, mientras que en otros la AC puede resolverse sin requerir un IMP27. Nuestra tasa de IMP fue estable, de un 10,2% a los 30 días. Esto puede explicarse por el hecho de que esta VCP ejerce una menor fuerza radial en comparación con otras VCP autoexpandibles y, por consiguiente, no aplica una tensión prolongada en el sistema de conducción subyacente.
Nueva aparición de alteraciones de la conducciónLa nueva aparición o el agravamiento de AC se ha descrito como complicación frecuente después del TAVI. Entre los mecanismos subyacentes, se encuentra la lesión directa del sistema de conducción, pero también la degeneración intrínseca y la calcificación del sistema de conducción, que tienen gran prevalencia en la población anciana tratada con TAVI. Esto puede explicar también la observación de que un EuroSCORE logístico más alto, que refleja una población de más edad y más grave, predice el IMP/nueva aparición de AC.
La mayor parte de los análisis realizados sobre la nueva aparición de AC después de un TAVI se han centrado en el bloqueo completo de rama del haz, en especial la nueva aparición de un bloqueo de rama izquierda. Esto puede deberse a que la presencia de un bloqueo de rama izquierda de nueva aparición después de un TAVI influye negativamente en la supervivencia a largo plazo, con un aumento de la tasa de mortalidad cardiaca, disfunción ventricular izquierda y un aumento de la necesidad de IMP a 1 año5,28. Así pues, tiene importancia reducir al mínimo la AC para prolongar la supervivencia sin episodios.
La incidencia descrita de la nueva aparición de un bloqueo de rama izquierda ha sido de entre el 8 y el 30% con las válvulas expandibles con balón, y es aún más alta con los dispositivos autoexpandibles, como la válvula CoreValve, con valores de entre el 22,2 y hasta un 50,0%16,29-31. En este análisis, se presenta una tasa de IMP/nueva aparición de AC del 22,8%. Concretamente, la nueva aparición de un bloqueo de rama izquierda se produjo en el 12,9% de los pacientes, lo cual es inferior a la incidencia descrita con otras VCP autoexpandibles. Esto podría explicarse por una implantación más alta, así como por una menor fuerza radial de la válvula ACURATE neo y, en consecuencia, un menor traumatismo mecánico en el sistema de conducción. Por lo que respecta a la nueva aparición de un bloqueo de rama izquierda, solo una puntuación más alta del EuroSCORE logístico fue un factor predictivo independiente en el análisis multivariable, mientras que los demás factores predictivos descritos anteriormente, como la cirugía de bypass arterial coronario, no influyeron en las tasas de bloqueo de rama izquierda30.
La incidencia de la nueva aparición de AC después del TAVI, aparte del bloqueo completo de rama izquierda, se ha descrito en varios estudios16,31, pero aún no se ha analizado detalladamente su influencia en los resultados. Al ir avanzando hacia una población de menos edad, serán necesarios nuevos estudios para determinar si estas AC de carácter «menor» afectan a los resultados a largo plazo.
LimitacionesUna limitación de este análisis es el bajo número de casos de IMP y de nueva aparición de AC, que reduce la capacidad estadística de identificar factores predictivos del riesgo para estos objetivos. Sin embargo, este es el primer estudio que aborda específicamente esta cuestión empleando esta nueva VCP. Está justificada la realización de nuevos estudios para abordar esta cuestión. Además, aunque se realizó una evaluación de la profundidad del implante mediante fluoroscopia en un laboratorio central, esta medición no siempre puede predecirse bien y a veces resulta difícil de cuantificar32. La nueva aparición de una AC después del TAVI puede resolverse con el paso del tiempo27; este análisis se centró en el electrocardiograma al alta y, por consiguiente, no se tuvo en cuenta la AC transitoria.
CONCLUSIONESEste es el primer análisis de los factores predictivos de IMP y nueva aparición de AC con la VCP ACURATE neo, y muestra unas tasas bajas de ambos objetivos. En un análisis detallado, se observa que la necesidad de IMP y la nueva aparición de AC parecen verse afectadas principalmente por las características relacionadas con el paciente, y no por los factores relacionados con el operador o con el dispositivo, como el exceso de tamaño de la prótesis y la profundidad del implante.
CONFLICTO DE INTERESESC. Pellegrini declara subvenciones para viajes de carácter menor de Symetis S.A.; O. Husser declara subvenciones para viajes de carácter menor, así como pago de pequeñas cantidades como mentor y por conferencias de Symetis S.A.; W.-K. Kim declara recibir pagos como mentor de Symetis S.A. y St. Jude Medical y pago de pequeñas cantidades por conferencias de Edwards Lifesciences; T. Trenkwalder declara subvenciones para viajes de carácter menor de Symetis S.A.; C. Burgdorf declara pagos como mentor de Symetis S.A.; M. Hilker declara pagos como mentor de Symetis S.A.; H. Möllmann declara pagos como mentor y honorarios por conferencias de Symetis S.A., y C. Hengstenberg declara pagos como mentor y honorarios por conferencias de Symetis S.A.
- –
Las AC cardiacas que conducen a la necesidad de un nuevo IMP son una complicación frecuente e importante tras el TAVI. Con el empleo de la nueva válvula autoexpandible ACURATE neo, los datos de 1.000 pacientes del registro poscomercialización mostraron una prometedora tasa de IMP del 8,2%. Sin embargo, no se ha realizado un análisis detallado de la tasa de IMP y de los posibles mecanismos subyacentes.
- –
Este es el primer análisis de la incidencia y los factores predictivos de IMP y nueva aparición de AC con la VCP ACURATE neo, y muestra unas tasas bajas de ambos objetivos. En un análisis detallado, se observó que la necesidad de IMP y la nueva aparición de AC parecen verse afectados principalmente por las características relacionadas con el paciente, y no por los factores relacionados con el operador o con el dispositivo, como el exceso de tamaño de la prótesis y la profundidad del implante.