La amiloidosis cardiaca por transtirretina (ATTR-AC) es una causa frecuente de insuficiencia cardiaca con fracción de eyección conservada (IC-FEc). El objetivo de este estudio fue determinar la prevalencia de ATTR-AC en pacientes con IC-FEc en un estudio multicéntrico a nivel nacional.
MétodosSe estudiaron pacientes consecutivos ambulatorios u hospitalizados ≥50 años con IC-FEc e hipertrofia ventricular izquierda ≥12mm en 20 hospitales españoles. Se inicio cribado de amiloidosis cardiaca según práctica clínica habitual de cada centro; las gammagrafías positivas se analizaron centralmente.
ResultadosSe incluyeron 422 pacientes, 387 de los cuales evaluados para amiloidosis cardiaca. Un total de 65 pacientes (16,8%) se diagnosticaron de ATTR-AC, ninguno<75 años. Esta prevalencia aumentaba con la edad. De ellos, el 60% eran varones, con 85,3±5,2 años de media, fracción de eyección media del ventrículo izquierdo del 60,3±7,6% y grosor medio máximo de su pared de 17,2 [12-25] mm. La mayoría presentó una clase New York Heart Association II (48,4%) o III (46,8%). Además de ser mayores que los pacientes sin ATTR-AC, presentaban niveles de NT-proBNP más elevados (mediana de 3.801 [2.266-7.132] frente a 2.391 [1.141-4.796] pg/ml; p=0,003). No hubo diferencias significativas en la prevalencia de ATTR-AC en función del sexo (19,7% en varones y 13,8% en mujeres, p=0,085). Un ∼7% (4/56) de los pacientes mostraron una variante patogénica (ATTRv).
ConclusionesEste estudio multicéntrico nacional halló una prevalencia del 16,8%, confirmando que la ATTR-AC contribuye significativamente a la IC-FEc en varones y mujeres con hipertrofia ventricular izquierda y más de 75 años.
Palabras clave
La amiloidosis cardiaca (AC) es una enfermedad mortal causada por el depósito de fibras de amiloide en el corazón que da lugar a una miocardiopatía restrictiva infiltrante1. Más del 98% de los casos de AC se deben a la amiloidosis por depósito de fibrillas de cadenas ligeras de inmunoglobulina (AL) o a amiloidosis por transtirretina (ATTR)2. Los signos y síntomas de estas etiologías son similares, pero las supervivencias difieren: la mediana de supervivencia en la ATTR-AC es de aproximadamente 4 años, mientras que puede ser inferior a los 6 meses en la AL no tratada3.
Uno de los principales problemas de la AC es su diagnóstico tardío, que tiene una relación directa con la supervivencia del paciente4. Esto se debe en gran parte a que esta enfermedad se asemeja a otras formas más frecuentes de hipertrofia del ventrículo izquierdo (HVI), como la miocardiopatía hipertrófica o hipertensiva5. El diagnóstico correcto de estos pacientes es indispensable, puesto que su supervivencia es menos favorable que la de los pacientes con otras miocardiopatías6. Se sabe que la ATTR-AC supone una gran carga para los sistemas de asistencia sanitaria. Los pacientes con esta enfermedad tienen más visitas de asistencia de día y un mayor número de hospitalizaciones por insuficiencia cardiaca (IC) que los pacientes con IC sin ATTR-AC7. Sin embargo, un diagnóstico correcto de la ATTR-AC aumenta la supervivencia y reduce las hospitalizaciones cardiovasculares, a la vez que proporciona ahorros para el sistema nacional de salud en comparación con la falta de diagnóstico8.
En una publicación de varios centros de referencia de Italia se ha puesto de manifiesto que la mitad de los diagnósticos de ATTR-AC de tipo natural o wild-type (ATTRwt-AC) se realizaron en el contexto de una IC9. Uno de los fenotipos clínicos más frecuentes de la ATTR-AC es la IC con fracción de eyección conservada (IC-FEc)1,9. El diagnóstico de esta entidad ha aumentado a lo largo del tiempo10. En 2021, la guía de la Sociedad Europea de Cardiología (ESC) resaltó la importancia de identificar las causas subyacentes de la IC-FEc y recomendó tener en cuenta la posibilidad de la AC en su diagnóstico diferencial11.
Se ha descrito que la prevalencia de la ATTR-AC es de entre el 5 y el 20% de los pacientes con IC-FEc en varios estudios unicéntricos que aplicaron diversidad de edades, definiciones de la fracción de eyección y umbrales de grosor de la pared del ventrículo izquierdo (VI)12-17. El primer estudio prospectivo multicéntrico de la prevalencia de la ATTR-AC en pacientes de edad avanzada con IC y cualquier valor de fracción de eyección se publicó en 202318. No hay estudios multicéntricos en los que se haya evaluado la prevalencia de la ATTR-AC en pacientes con IC-FEc, definida por la fracción de eyección ≥50% y el umbral de sospecha de AC actualmente recomendado para el grosor de la pared del VI (≥12mm).
El objetivo de este estudio es evaluar la prevalencia de la ATTR-AC en pacientes con IC-FEc (≥50%) e HVI ≥12mm por medio de un estudio prospectivo de ámbito nacional en España, que se llevó a cabo principalmente en servicios de cardiología.
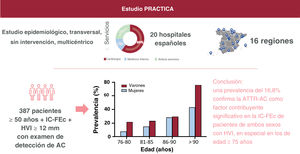
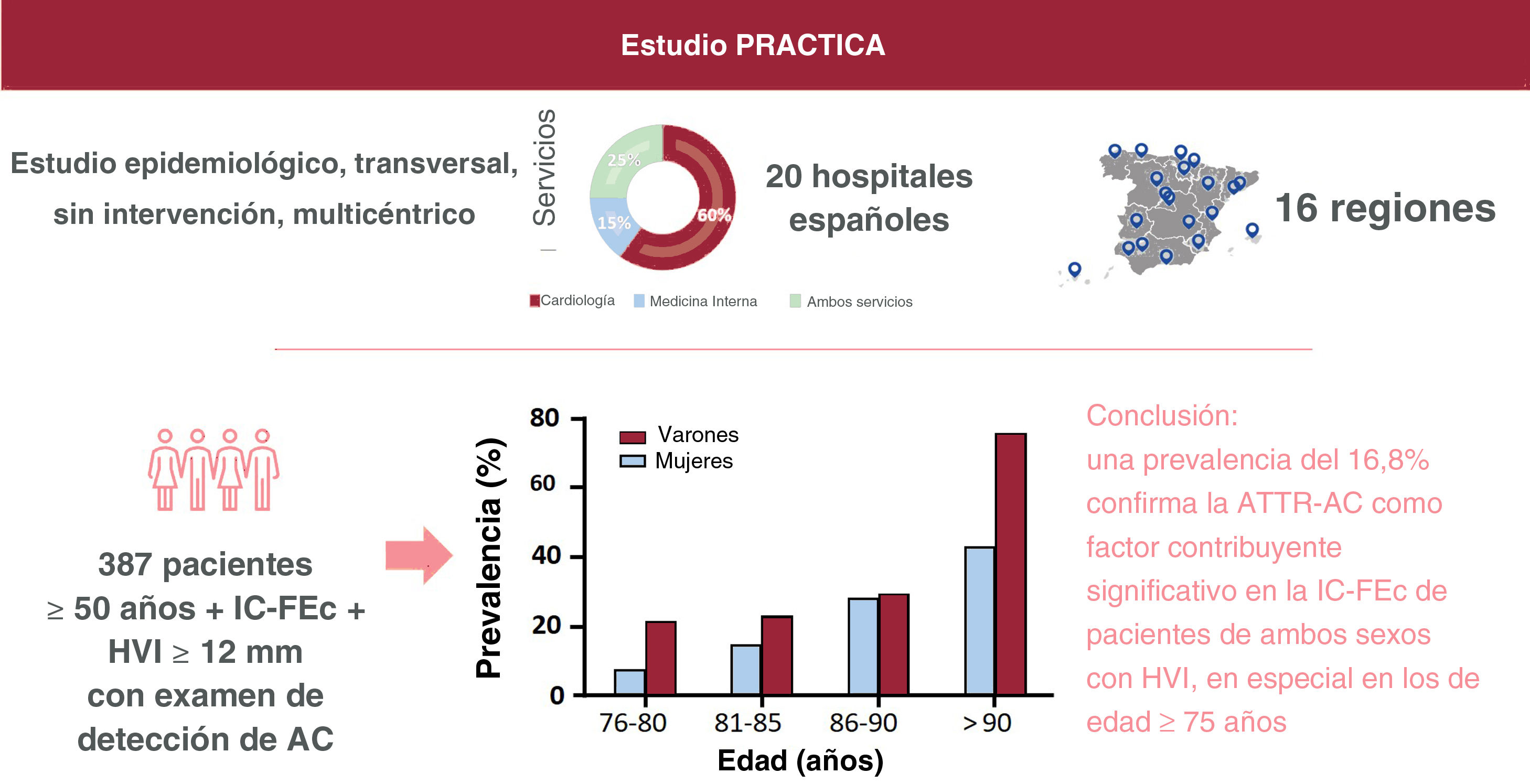
MÉTODOSEl estudio PRACTICA es un estudio epidemiológico, multicéntrico, transversal, sin intervención, llevado a cabo en unidades de IC de 20 hospitales españoles distribuidos en 16 regiones de España, a fin de garantizar una buena representación de ámbito nacional. En estos 20 hospitales, participaron en el estudio 17 servicios de cardiología y 8 de medicina interna (en 5 centros participaron ambos servicios). Se siguieron los principios de la Declaración de Helsinki. El protocolo del estudio, las enmiendas al protocolo y el documento de consentimiento informado fueron examinados y aprobados por comités de ética de investigación clínica independientes en cada uno de los centros participantes. Todos los pacientes dieron su consentimiento informado por escrito antes de la inclusión en el estudio.
Población del estudioEn este estudio se incluyó a pacientes ambulatorios u hospitalizados de edad ≥50 años con IC-FEc e HVI ≥12mm, a quienes se incluyó consecutivamente entre diciembre de 2018 y mayo de 2021. Los centros participantes y los investigadores principales se indican en la .
Los criterios de inclusión fueron: varones y mujeres de edad ≥50 años; diagnóstico de IC-FEc según los criterios de la ESC en el momento de inicio del estudio19, definidos por una fracción de eyección del ventrículo izquierdo (FEVI) ≥50%, altas concentraciones de péptidos natriuréticos (BNP >35 pg/ml o NT-proBNP >125 pg/ml) y una cardiopatía estructural relevante (HVI, agrandamiento de la aurícula izquierda) o disfunción diastólica; al menos 1 ingreso previo por IC en los últimos 24 meses y signos de HVI ≥12mm en la ecocardiografía.
Los criterios de exclusión fueron la presencia o los antecedentes de enfermedad coronaria significativa en al menos 1 arteria coronaria principal, la presencia o los antecedentes de una valvulopatía significativa, un diagnóstico confirmado del origen de la miocardiopatía hipertrófica o una miocardiopatía restrictiva distinta de la AC (miocardiopatía con una variante génica confirmada, mieloma, enfermedad de Fabry, sarcoidosis, cualquier tipo de amiloidosis, etc.) y la retirada del consentimiento informado.
ProtocoloLa información sobre los pacientes se obtuvo a partir de las historias clínicas y de entrevistas con los pacientes en la visita de reclutamiento para el estudio. El examen de selección inicial se llevó a cabo según la práctica clínica de cada centro (por lo que respecta al número y el tipo de pruebas y el orden en que se solicitaron) en el momento de realizarse el estudio. No se recogieron datos sobre el motivo por el que se realizaron o no ciertas pruebas. El examen de selección inicial podía incluir exploraciones de imagen con gammagrafía ósea con 99mTc, utilizando ácido 3,3-difosfono-1,2-propanodicarboxílico (DPD) marcado con 99mTc, pirofosfato (PYP) marcado con 99mTc o hidroximetileno-difosfonato (HMDP) marcado con 99mTc según la práctica clínica. La captación del radiotrazador en el miocardio en comparación con el hueso se evaluó con la escala de grados de Perugini: el grado 0 indica ausencia de captación cardiaca; el grado 1, una captación cardiaca leve inferior a la del hueso; el grado 2, una captación moderada, igual a la del hueso, y el grado 3, una captación alta, superior a la del hueso20. Las gammagrafías que el laboratorio local consideró positivas (grado de Perugini 1-3) se analizaron mediante examen centralizado, cuyos resultados se tomaron como válidos. Los evaluadores tuvieron acceso tan solo a las imágenes gammagráficas de los pacientes, pero no se les ocultó la finalidad del estudio. Las recomendaciones en vigor en el momento de realizarse el estudio incluían también una electroforesis de inmunofijación de suero y orina y un análisis de cadenas ligeras libres en suero20,21.
A los pacientes con una captación cardiaca de grado 1, sin una biopsia confirmatoria, se los consideró con datos no concluyentes. A los pacientes con una captación cardiaca de grado 2-3 y sin anomalías de proteínas monoclonales se los clasificó como con ATTR-AC20,21. A los pacientes con ATTR-AC, con o sin una variante patogénica del gen TTR, se los clasificó como afectados por ATTR-AC hereditaria o wild type respectivamente. A los pacientes con captación cardiaca de grados 2-3 y anomalías de proteínas monoclonales, sin que hubiera una biopsia confirmatoria, se los clasificó como con datos no concluyentes; cuando la biopsia demostró un depósito de TTR, el diagnóstico fue de ATTR-AC.
ObjetivosEl objetivo primario fue evaluar la prevalencia de ATTR-AC en los pacientes con IC-FEc e HVI ≥12mm. Los objetivos secundarios fueron determinar la prevalencia de la ATTR-AC según la región, la edad y el tipo de ATTR-AC, y describir las características de los pacientes con ATTR-AC en la población evaluada.
Análisis estadísticoLos análisis estadísticos se llevaron a cabo en todos los pacientes que cumplían los criterios de elegibilidad. La prevalencia se analizó con los pacientes con una gammagrafía y análisis hematológicos disponibles. A los pacientes sin ninguna de esas exploraciones se los consideró no analizables por lo que respecta a la prevalencia, pero se recogieron sus datos demográficos y sus características basales.
Se utilizó estadística descriptiva para analizar los datos obtenidos. Los datos no disponibles se excluyeron de los análisis. Las variables cualitativas se expresan en forma de frecuencia y se compararon con la prueba exacta de Fisher. Las variables cuantitativas se expresan en forma de media (intervalo de confianza del 95% [IC95%]) o mediana [intervalo intercuartílico], y se comparan mediante ANOVA o prueba de Kruskal-Wallis, según la distribución de la muestra. Se realizó un análisis post-hoc con la prueba de Fisher, la prueba de la t de Student o la prueba de la U de Mann-Whitney, según correspondiera. Los datos se analizaron con el programa SPSS (v18 o posterior). La significación estadística se definió como un valor de p<0,05.
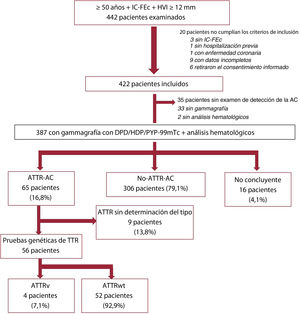
RESULTADOSDurante el periodo de estudio, se incluyó a 442 pacientes con IC-FEc de 20 hospitales (el 64% de los pacientes fueron incluidos en servicios de cardiología y el 27%, en hospitales en los que participaban los servicios tanto de cardiología como de medicina interna). A 20 de estos pacientes se los consideró no aptos para el estudio según los criterios de inclusión (figura 1). La gammagrafía o los análisis hematológicos no se llevaron a cabo en 35 pacientes que cumplían los criterios de inclusión y se consideró que en estos casos no se había realizado el cribado de AC. Así pues, se consideró analizables a 387 pacientes por lo que respecta a la prevalencia de la ATTR-AC. En la figura 1 se presenta un diagrama de flujo de los participantes.
Participantes en el estudio. AC: amiloidosis cardiaca; ATTR: amiloidosis por transtirretina; ATTR-AC: pacientes con diagnóstico confirmado de ATTR-AC; ATTRv: amiloidosis por transtirretina hereditaria; ATTRwt: amiloidosis por transtirretina de tipo natural; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; HVI: hipertrofia del ventrículo izquierdo; No-ATTR-AC: pacientes con IC-FEc en los que se descartó una ATTR-AC; TTR: transtirretina.
De los 422 pacientes incluidos, todos excepto 4 eran caucásicos (99,1%), el 52,5% eran varones y la media de edad era de 79,6 años. La mayor parte de los pacientes (58,3%) fueron evaluados durante una hospitalización por IC. Los centros con una inclusión más frecuente de pacientes fueron los hospitales de Cataluña (15,6%), el País Vasco (14,2%), Madrid (14,0%) y las Islas Canarias (10,7%). Las características de la población total se muestran en la tabla 1. Varios pacientes tenían antecedentes de hipertensión, diabetes e insuficiencia renal. Las concentraciones de NT-proBNP oscilaron entre 1.280 y 5.322 pg/l (mediana, 2.648 pg/l), y la mayoría de los pacientes se encontraban en las clases I-II de la New York Heart Association (NYHA). La media de FEVI era del 60,9±7,2%, y la mediana del grosor máximo de la pared del VI era 14 [13-16] mm.
Características clínicas, analíticas, electrocardiográficas y ecocardiográficas
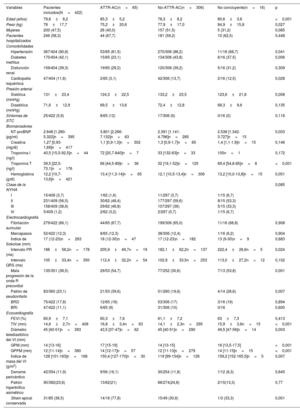
| Variables | Pacientes incluidos(N=422) | ATTR-AC(n=65) | No-ATTR-AC(n=306) | No concluyente(n=16) | p |
|---|---|---|---|---|---|
| Edad (años) | 79,6±8,2 | 85,3±5,2 | 78,3±8,2 | 80,6±3,6 | <0,001 |
| Peso (kg) | 78±17,7 | 75,2±20,6 | 77,9±17,0 | 84,9±15,8 | 0,027 |
| Mujeres | 200 (47,5) | 26 (40,0) | 157 (51,5) | 5 (31,2) | 0,085 |
| Pacientes hospitalizados | 246 (58,3) | 44 (67,7) | 181 (59,2) | 10 (62,5) | 0,448 |
| Comorbilidades | |||||
| Hipertensión | 367/404 (90,8) | 53/65 (81,5) | 270/306 (88,2) | 11/16 (68,7) | 0,041 |
| Diabetes mellitus | 170/404 (42,1) | 15/65 (23,1) | 134/306 (43,8) | 6/16 (37,5) | 0,006 |
| Disfunción renal | 159/404 (39,3) | 19/65 (29,2) | 120/306 (39,2) | 5/16 (31,2) | 0,309 |
| Cardiopatía isquémica | 47/404 (11,6) | 2/65 (3,1) | 42/306 (13,7) | 2/16 (12,5) | 0,028 |
| Presión arterial | |||||
| Sistólica (mmHg) | 131±23,4 | 124,3±22,5 | 133,2±23,5 | 123,6±21,8 | 0,008 |
| Diastólica (mmHg) | 71,6±12,9 | 69,5±13,6 | 72,4±12,8 | 68,3±9,6 | 0,135 |
| Síntomas de STC | 25/422 (5,9) | 8/65 (12) | 17/306 (6) | 0/16 (0) | 0,118 |
| Biomarcadores | |||||
| NT-proBNP (pg/ml) | 2.648 [1.280-5.322]n=395 | 3.801 [2.266-7.132]n=63 | 2.391 [1.141-4.796]n=285 | 2.538 [1.342-3.727]n=15 | 0,003 |
| Creatina (mg/dl) | 1,27 [0,93-1,69]n=417 | 1,1 [0,9-1,5]n=302 | 1,3 [0,9-1,7]n=65 | 1,4 [1,1-1,9]n=15 | 0,146 |
| Troponina I (ng/l) | 40,5 [15,5-92,5]n=44 | 72 [20,7-840]n=7 | 33 [132-63]n=33 | 105n=1 | 0,172 |
| Troponina T (ng/l) | 39,5 [22,5-73,1]n=176 | 66 [44,5-89]n=36 | 32 [19,1-52]n=125 | 69,4 [54,8-85]n=8 | <0,001 |
| Hemoglobina (g/dl) | 12,2 [10,7-13,6]n=421 | 13,4 [11,3-14]n=65 | 12,1 [10,5-13,4]n=306 | 13,2 [10,0-13,8]n=15 | 0,051 |
| Clase de la NYHA | 0,085 | ||||
| I | 15/409 (3,7) | 1/62 (1,6) | 11/297 (3,7) | 1/15 (6,7) | |
| II | 231/409 (56,5) | 30/62 (48,4) | 177/297 (59,6) | 8/15 (53,3) | |
| III | 158/409 (38,6) | 29/62 (46,8) | 107/297 (36) | 5/15 (33,3) | |
| IV | 5/409 (1,2) | 2/62 (3,2) | 2/297 (0,7) | 1/15 (6,7) | |
| Electrocardiografía | |||||
| Fibrilación auricular | 279/422 (66,1) | 44/65 (67,7) | 199/306 (65,0) | 11/16 (68,8) | 0,908 |
| Marcapasos | 52/422 (12,3) | 8/65 (12,3) | 38/306 (12,4) | 1/16 (6,2) | 0,904 |
| Índice de Sokolow (mm) | 17 (12-23)n=263 | 18 (12-30)n=47 | 17 (12-23)n=182 | 13 (9-30)n=9 | 0,683 |
| Intervalo PR (ms) | 186±58,2n=178 | 205,9±49,7n=19 | 182,1±62,2n=137 | 222,4±26,6n=5 | 0,024 |
| Intervalo QRS (ms) | 105±33,4n=350 | 112,4±32,2n=54 | 102,9±33,5n=253 | 113,0±27,2n=12 | 0,102 |
| Mala progresión de la onda R precordial | 135/351 (38,5) | 29/53 (54,7) | 77/252 (30,6) | 7/13 (53,8) | 0,001 |
| Patrón de seudoinfarto | 83/360 (23,1) | 21/53 (39,6) | 51/260 (19,6) | 4/14 (28,6) | 0,007 |
| BRD | 75/422 (17,8) | 12/65 (18) | 53/306 (17) | 3/16 (19) | 0,894 |
| BRI | 47/422 (11,1) | 6/65 (9) | 31/306 (10) | 0/16 | 0,600 |
| Ecocardiografía | |||||
| FEVI (%) | 60,9±7,1 | 60,3±7,6 | 61,1±7,2 | 63±7,3 | 0,413 |
| TIV (mm) | 14,6±2,7n=408 | 16,8±3,4n=63 | 14,1±2,3n=295 | 15,9±3,6n=15 | <0,001 |
| Diámetro telediastólico del VI (mm) | 45 [40-51]n=393 | 43,5 [37-47]n=62 | 45 [40-51]n=290 | 49,5 [47-56]n=14 | 0,003 |
| GPM (mm) | 14 [13-16] | 17 [15-19] | 14 [13-15] | 16 [13,5-17,5] | <0,001 |
| GPPM (mm) | 12 [11-14]n=380 | 14 [12-17]n=57 | 12 [11-13]n=279 | 14 [11-15]n=15 | <0,001 |
| Índice de masa del VI (g/m2) | 128 [101-163]n=168 | 150,4 [127-170]n=30 | 119 [99-154]n=126 | 159,2 [152-165,5]n=5 | 0,007 |
| Derrame pericárdico | 42/354 (11,9) | 9/56 (16,1) | 30/254 (11,8) | 1/12 (8,3) | 0,645 |
| Patrón hipertrófico asimétrico | 90/382(23,6) | 13/62(21) | 68/274(24,8) | 2/15(13,3) | 0,77 |
| Strain apical conservada | 31/85 (36,5) | 14/18 (77,8) | 15/49 (30,6) | 1/3 (33,3) | 0,001 |
ATTR-AC: amiloidosis cardiaca por transtirretina; BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; FEVI: fracción de eyección del ventrículo izquierdo; GPM: grosor máximo de la pared; GPPM: grosor máximo de la pared posterior; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; STC: síndrome del túnel carpiano; TIV: tabique interventricular; VI: ventrículo izquierdo.
Los valores expresan n (%), mediana [intervalo intercuartílico] o media±desviación estándar. Cuando no había datos disponibles para todos los pacientes, se indica el N.
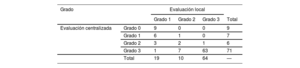
No se realizó una gammagrafía a 33 de los pacientes incluidos. Todas las gammagrafías excepto 4 se realizaron con DPD con 99mTc. Según la interpretación realizada por cada centro local, 93 pacientes mostraban captación miocárdica (tabla 2). En 89 de estos 93 pacientes se realizaron análisis hematológicos. De los pacientes sin captación cardiaca, se realizaron análisis hematológicos en 24 del total de 296. El resultado fue positivo en 18 de 113 (15,9%); solamente se llevaron a cabo 3 biopsias (1 TTR, 1 no concluyente y 1 compatible con un mieloma). La evaluación de la gammagrafía realizada en el laboratorio central reclasificó a 22 pacientes (23,6%), de tal manera que hubo un total de 84 pacientes que presentaban captación miocárdica (tabla 2).
Captación gammagráfica según la evaluación del laboratorio local y del laboratorio central
| Grado | Evaluación local | ||||
|---|---|---|---|---|---|
| Grado 1 | Grado 2 | Grado 3 | Total | ||
| Evaluación centralizada | Grado 0 | 9 | 0 | 0 | 9 |
| Grado 1 | 6 | 1 | 0 | 7 | |
| Grado 2 | 3 | 2 | 1 | 6 | |
| Grado 3 | 1 | 7 | 63 | 71 | |
| Total | 19 | 10 | 64 | — | |
Tan solo se centralizó el análisis de las gammagrafías positivas en la evaluación local.
En un total de 65 pacientes se confirmó una ATTR-AC. La ATTR-AC no pudo confirmarse ni descartarse en 16 pacientes debido a análisis histológico ausente o incompleto. Sobre los pacientes de los que se dispuso tanto de gammagrafía como de análisis hematológicos, en la se muestran las situaciones posibles según los resultados de las pruebas diagnósticas y el diagnóstico final establecido.
La prevalencia de ATTR-AC en los pacientes con gammagrafía y análisis hematológicos fue del 16,8% (tabla 3). Se observan grandes diferencias entre las regiones, con prevalencias >20% en las Islas Canarias, Aragón y el País Vasco (tabla 4). La prevalencia aumenta con la edad, del 14,8% de los pacientes de 76 a 80 años al 28,6% de aquellos de 86 a 90 años (tabla 5). Ninguno de los pacientes a los que se diagnosticó una ATTR-AC tenía menos de 75 años. Se realizaron pruebas genéticas de TTR en un 86% (56/65) de los pacientes con un diagnóstico de ATTR-AC, y los resultados confirmaron una ATTRwt en 52 casos y una ATTRv en 4 (3 pacientes con p.Val122Ile y 1 con p.Val30Met).
Prevalencia de la ATTR-AC en los pacientes con IC-FEc e HVI ≥12mm
| Variable | Pacientes, n | Pacientes incluidos, % | Pacientes analizables, % |
|---|---|---|---|
| ATTR-AC | 65 | 15,4 | 16,8 |
| No-ATTR-AC | 306 | 72,5 | 79,1 |
| No concluyente | 16 | 3,8 | 4,1 |
| No analizable | 35 | 8,3 | — |
| Total | 422 | 100 | 100 |
ATTR-AC: amiloidosis cardiaca por transtirretina; HVI: hipertrofia del ventrículo izquierdo; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada.
Prevalencia de la ATTR-AC por región de residencia
| Comunidad autónoma | Pacientes incluidos | Pacientes con ATTR-AC | Pacientes con ATTR-AC por región, % |
|---|---|---|---|
| País Vasco | 59 | 13 | 22,03 |
| Cataluña | 59 | 7 | 11,86 |
| Comunidad de Madrid | 58 | 9 | 15,52 |
| Islas Canarias | 45 | 17 | 37,78 |
| Aragón | 37 | 9 | 24,32 |
| Andalucía | 24 | 2 | 8,33 |
| Galicia | 22 | 1 | 4,55 |
ATTR-AC: amiloidosis cardiaca por transtirretina.
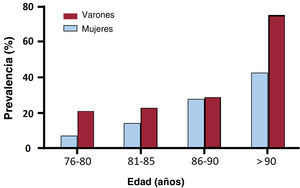
Prevalencia de la ATTR-AC por grupos de edad
| Variable | 50-75 años | 76-80 años | 81-85 años | 86-90 años | ≥91 años |
|---|---|---|---|---|---|
| ATTR-AC | 0 | 12 (14,8) | 21 (18,6) | 20 (28,6) | 12 (63,2) |
| No-ATTR-AC | 102 (97,9) | 64 (79,0) | 84 (74,3) | 49 (70,0) | 7 (36,8) |
| No concluyente | 2 (1,9) | 5 (6,2) | 8 (7,1) | 1 (1,4) | 0 |
| Total | 104 | 81 | 113 | 70 | 19 |
ATTR-AC: amiloidosis cardiaca por transtirretina.
Los valores expresan n (%).
Se halló tendencia a una mayor prevalencia de la ATTR-AC en los varones (el 19,7 frente al 13,8% de los varones y las mujeres respectivamente; p=0,085), sin que hubiera diferencias significativas entre los sexos en ninguna de las franjas de edad (figura 2). La prevalencia de la ATTRv fue del 13% (3/23) en las mujeres y el 3% (1/33) en los varones con ATTR-AC en que se llevaron a cabo pruebas genéticas.
Características clínicas de los pacientes con ATTR-ACLas características clínicas, analíticas, electrocardiográficas y ecocardiográficas de los pacientes con ATTR-AC en comparación con aquellos sin ATTR-AC o con datos no concluyentes se presentan en la tabla 1. No resultó inesperado que los pacientes con ATTR-AC fueran de más edad que los pacientes sin ATTR-AC (p<0,001). En comparación con los pacientes sin ATTR-AC, aquellos con ATTR-AC presentaban superiores medianas de las concentraciones de NT-proBNP y troponina T (p=0,001 y p<0,001). La mitad de los pacientes con ATTR-AC se encontraban en NYHA I-II. Aunque no se observaron diferencias estadísticamente significativas, en los pacientes con ATTR-AC hubo una mayor proporción de casos en NYHA III que en otros grupos (el 46,8 frente al 36,0 frente al 33,3%; p=0,085). Los pacientes con ATTR-AC tenían una presión arterial sistólica inferior que los pacientes sin ATTR-AC (p=0,005). La mayor parte de las características electrocardiográficas fueron similares en los distintos grupos, si bien los pacientes con ATTR-AC mostraron una prevalencia significativamente superior de mala progresión de la onda R precordial (p=0,001) y de patrón de seudoinfarto (p=0,004) en comparación con los pacientes sin ATTR-AC.
En los pacientes con ATTR-AC se observó un aumento moderado del grosor de la pared del VI, que fue significativamente mayor que el observado en los pacientes sin ATTR-AC (p<0,001). Además, el índice de masa del VI mostró un aumento significativo en los pacientes con ATTR-AC respecto a aquellos en los que se descartó una ATTR-AC (p=0,008). En los pacientes con ATTR-AC, el diámetro telediastólico del VI fue significativamente inferior al observado en los demás grupos (p=0,003).
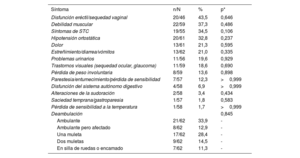
En los pacientes con ATTR-AC se realizó una evaluación adicional para identificar cualquier posible síntoma extracardiaco relacionado con la ATTR (tabla 6). No se observaron diferencias estadísticamente significativas entre los grupos.
Síntomas de ATTR en pacientes con ATTR-AC confirmada
| Síntoma | n/N | % | p* |
|---|---|---|---|
| Disfunción eréctil/sequedad vaginal | 20/46 | 43,5 | 0,646 |
| Debilidad muscular | 22/59 | 37,3 | 0,486 |
| Síntomas de STC | 19/55 | 34,5 | 0,106 |
| Hipotensión ortostática | 20/61 | 32,8 | 0,237 |
| Dolor | 13/61 | 21,3 | 0,595 |
| Estreñimiento/diarrea/vómitos | 13/62 | 21,0 | 0,335 |
| Problemas urinarios | 11/56 | 19,6 | 0,929 |
| Trastornos visuales (sequedad ocular, glaucoma) | 11/59 | 18,6 | 0,690 |
| Pérdida de peso involuntaria | 8/59 | 13,6 | 0,898 |
| Parestesia/entumecimiento/pérdida de sensibilidad | 7/57 | 12,3 | >0,999 |
| Disfunción del sistema autónomo digestivo | 4/58 | 6,9 | >0,999 |
| Alteraciones de la sudoración | 2/58 | 3,4 | 0,434 |
| Saciedad temprana/gastroparesia | 1/57 | 1,8 | 0,583 |
| Pérdida de sensibilidad a la temperatura | 1/58 | 1,7 | >0,999 |
| Deambulación | 0,845 | ||
| Ambulante | 21/62 | 33,9 | - |
| Ambulante pero afectado | 8/62 | 12,9 | - |
| Una muleta | 17/62 | 28,4 | - |
| Dos muletas | 9/62 | 14,5 | - |
| En silla de ruedas o encamado | 7/62 | 11,3 | - |
No-ATTR-AC: pacientes sin amiloidosis cardiaca por transtirretina; STC: síndrome del túnel carpiano.
No hubo diferencias significativas entre los varones y las mujeres con ATTR-AC por lo que respecta a la edad (85,1±5,9 frente a 85,7±3,9 años; p=0,653). La prevalencia de la hipertensión fue significativamente mayor en las mujeres (el 100 frente al 74,4%; p=0,004) y hubo un mayor número de mujeres en NYHA III (el 64,0 frente al 35,1%; p=0,017). Las mujeres tenían también una presión arterial diastólica más alta (75,8±15,8 frente a 65,3±10,1mmHg; p=0,009).
DISCUSIÓNEste estudio determina la prevalencia de la ATTR-AC en los pacientes con IC-FEc en España (figura 3). La alta prevalencia de la ATTR-AC en esta población resalta la importancia de que los especialistas en IC tengan presente esta enfermedad, ya que hay tratamiento para ella. Este es el estudio multicéntrico más amplio realizado hasta la fecha en pacientes con IC-FEc.
Prevalencia de la ATTR-AC en pacientes con IC-FEcLa prevalencia de la ATTR-AC no se conoce aún con precisión, pero diversos estudios han intentado determinar su frecuencia en diferentes poblaciones con IC ()7,12-15,17,18,21-25. Hasta el momento, 7 estudios —de los cuales todos excepto 2 fueron unicéntricos— han investigado la prevalencia de la ATTR-AC en pacientes con IC-FEc13-17,23,25. Los 2 estudios de mayor tamaño indicaron unas tasas de prevalencia que iban del 6,3 al 13,3% (n=286 y n=120)14,16. En nuestro estudio multicéntrico se identificó una prevalencia del 16,8% en una cohorte más grande (n=422; 387 examinados para detectar una posible AC). Recientemente, en un estudio multicéntrico realizado en España en 453 pacientes, todos ellos de edad ≥65 años con cualquier forma de IC e HVI >12mm y evaluados en servicios de medicina interna entre febrero de 2020 y marzo de 202118, se observó una prevalencia del 16,8%. De estos pacientes, un 76,6% con ATTR-AC tenían una FEVI >50%. Sin embargo, en este estudio no se evaluó la prevalencia de pacientes con ATTR-AC en la subpoblación con IC-FEc18.
A pesar de las diferencias publicadas anteriormente entre los pacientes con IC ingresados en servicios de medicina interna en comparación con los de servicios de cardiología26 y de las diferencias entre la población incluida en el estudio de Ruiz-Hueso et al.18 y la población de nuestro estudio, las cifras de prevalencia en estos estudios fueron similares. Es de destacar que la tasa de pruebas genéticas de la ATTR fue del 86% en nuestro estudio frente al 47% en el estudio de Ruiz-Hueso et al.18. Dado que las fechas de inclusión fueron similares, estas diferencias podrían deberse a una mayor concienciación respecto a la enfermedad en este momento o al empleo habitual de más pruebas genéticas para la detección de las miocardiopatías hereditarias por parte de los cardiólogos, que fueron los principales reclutadores de pacientes en nuestro estudio. Se observa una prevalencia del 7,1% de la ATTRv en los pacientes con ATTR-AC de edad más avanzada (>75 años), lo cual subraya la necesidad de realizar pruebas genéticas con independencia de la edad.
Con la cohorte de pacientes más grande presentada hasta la fecha, nuestro estudio aporta evidencia indicativa de que la ATTR-AC es una causa frecuente de IC-FEc en las personas de edad avanzada. Esto respalda la recomendación de la guía de la ESC de 2021 de realizar una detección sistemática de la posible presencia de AC en el diagnóstico diferencial de la IC-FEc11.
ATTR-AC en las mujeresAunque la ATTR-AC se ha descrito clásicamente como una enfermedad que afecta a varones de edad avanzada27,28, un 40% de los pacientes con ATTR-AC identificados en nuestro estudio eran mujeres. En consonancia con nuestras observaciones, en estudios previos (la mayoría de ellos llevados a cabo en España) se ha descrito también un alto porcentaje de mujeres entre los pacientes a los que se diagnostica una ATTR-AC (33-50%)13,16-18. En cambio, en otros estudios se ha observado que del 90 al 100% de los pacientes con ATTR-AC eran varones7,12,15,22. Se ha descrito que la IC-FEc es más frecuente en las mujeres, que tienden a vivir más tiempo, lo cual hace que resulte intrigante que la mayoría de los estudios de la ATTR-AC describan un predominio de varones en la enfermedad7,12,14,15,22,23. Una explicación plausible es que la ATTR-AC se sospeche con más frecuencia en los varones que en las mujeres, posiblemente a causa de las inequidades de género inadvertidas que afectan a algunos sistemas de asistencia sanitaria29. Recientemente se ha señalado que el empleo de mediciones del grosor de la pared sin indexar puede haber contribuido a causar una infrarrepresentación y retrasos en el diagnóstico de la ATTR-AC en las mujeres afectadas30,31. Aunque en nuestro estudio se diagnosticó a mujeres de manera similar que a los varones, la proporción de mujeres con ATTR-AC que se encontraban en NYHA III fue significativamente mayor que la observada en los varones (el 64 frente al 35%), y ello podría indicar un retraso en el diagnóstico.
Tan solo en 2 estudios previos se ha descrito la prevalencia de la ATTR-AC según el sexo14,18 y solamente en el estudio de AbouEzzeddine et al.14 se observaron diferencias significativas. Nosotros observamos una mayor prevalencia de ATTR-AC en los varones que en las mujeres (el 19,7 frente al 13,8%), pero esta diferencia no fue estadísticamente significativa (p=0,085). Aunque no puede descartarse la posibilidad de que falte potencia estadística, el número de pacientes incluidos en nuestro estudio fue mayor que el del estudio de AbouEzzeddine et al.14. Tiene interés señalar que se halló una mayor prevalencia de ATTRv en las mujeres que en los varones (el 13 frente al 3%), lo cual refuerza el valor del sexo como factor predictivo de la ATTRv en los pacientes con ATTR-AC de edad avanzada32.
Nuestro estudio resalta la necesidad de sospechar una ATTR-AC en los pacientes de edad avanzada con IC-FEc e HVI sea cual sea su sexo.
Consecuencias para la detección sistemática y el diagnóstico correctos de la ATTR-ACEs importante señalar que casi un 25% de las gammagrafías cardiacas positivas (grados 1-3 de Perugini) fueron reclasificadas en la evaluación realizada por el laboratorio central con enmascaramiento. A 4 pacientes clasificados inicialmente como de grado 1 se los consideró finalmente de grado 2/3, lo cual llevó al diagnóstico de 3 pacientes con ATTR-AC tras descartar la presencia de proteínas monoclonales. El otro paciente presentaba una proteína monoclonal, y una biopsia cutánea posterior no permitió esclarecer el diagnóstico. Dado que la interpretación correcta de la gammagrafía cardiaca puede tener una repercusión directa en el diagnóstico final y en la necesidad de una evaluación invasiva2, nuestros resultados subrayan el papel central de la medicina nuclear en el diagnóstico de la ATTR-AC, así como la necesidad de integrar los resultados de la gammagrafía con las observaciones de ecocardiografía o resonancia magnética cardiaca que apunten al diagnóstico para llevar a cabo un diagnóstico no invasivo de la ATTR-AC. Aunque se ha documentado una alta reproducibilidad intraobservador e interobservadores para la evaluación visual33, continúa siendo posible una clasificación errónea1,34. A este respecto, las técnicas de imagen de tomografía computarizada por emisión monofotónica (SPECT) son de especial utilidad en los casos positivos o equívocos para diferenciar la señal miocárdica de la sanguínea y describir la heterogeneidad regional35.
Los datos del National Amyloidosis Centre del Reino Unido indicaron que, en los 3 años previos al diagnóstico, los pacientes habían tenido hasta 27 visitas hospitalarias y 5 hospitalizaciones36. Teniendo en cuenta su mediana de concentración de NT-proBNP, la media de grosor del tabique interventricular, los antecedentes de hospitalización por IC y el hecho de que la mitad fueran incluidos durante una hospitalización y la mitad se encontraran ya en NYHA III-IV, parece que con frecuencia el diagnóstico podría ser tardío en el curso de la enfermedad. No sabemos si la ATTR-AC podría haberse sospechado y diagnosticado antes en nuestro estudio, pero los datos indicarían que se pierden oportunidades para el diagnóstico. Como se ha mencionado antes, casi no se observaron diferencias en los síntomas relacionados con la ATTR entre los pacientes con y sin ATTR-AC, lo cual indica un elevado solapamiento clínico. Se sabe que la inespecificidad de los síntomas en la ATTR contribuye a su diagnóstico tardío.
La declaración de posicionamiento de la ESC recomienda el cribado de la AC en todos los pacientes con una HVI ≥12mm y al menos 1 señal de alerta adicional2. Dado que esto requeriría un gran número de pruebas que podrían dar resultados negativos, se están elaborando varios sistemas de puntuación. El objetivo de estas puntuaciones es mejorar el grado de sospecha de la ATTR-AC y ayudar a establecer prioridades en cuanto a los pacientes a quienes deben realizarse pruebas para detectar la enfermedad37,38. En ambas puntuaciones, la edad es una de las variables que contribuyen a establecer un mayor riesgo de amiloidosis. Esto respalda nuestros resultados y los de estudios anteriores al mostrar que la prevalencia de la ATTR-AC aumenta con la edad14,18,25 y que no se diagnostica a ningún paciente menor de 75 años18.
Un diagnóstico de la ATTR-AC correcto y en el momento oportuno tiene importantes consecuencias para los pacientes. Modifica el tratamiento sintomático en comparación con el de los pacientes sin ATTR-AC, ya que es frecuente que fármacos comúnmente utilizados en la IC, como los inhibidores de la enzima de conversión de la angiotensina, los inhibidores de la neprilisina y los receptores de la angiotensina y los bloqueadores beta sean mal tolerados por los pacientes con ATTR-AC, a pesar de la controversia existente respecto al uso de los bloqueadores beta2,39,40. Además, debe iniciarse un tratamiento modificador de la enfermedad lo antes posible para detener el depósito de amiloide. La guía de la ESC de 2021 recomienda el empleo de tafamidis en pacientes con IC y amiloidosis y pacientes con ATTRwt o ATTRv en NYHA I-II con objeto de reducir los síntomas, la hospitalización de causa CV y la mortalidad (recomendación I B)11. La decisión de iniciar un tratamiento modificador de la enfermedad depende de si el paciente va a obtener con ello un beneficio útil41.
Además, el diagnóstico de la ATTR-AC es el primer paso para realizar pruebas genéticas destinadas a identificar a los pacientes con ATTRv, lo cual permite la identificación adecuada de los familiares con riesgo de contraer la enfermedad o que puedan estar ya afectados por ese trastorno. Se dispone de varios tratamientos para los pacientes con ATTRv, dependiendo de su fenotipo42. En nuestro estudio se observa que un 7,1% de los pacientes con ATTR-AC tenían una ATTRv, pero no se evaluó la repercusión del tratamiento, pues se ha descrito hace poco32.
Puntos fuertes y limitacionesEl principal punto fuerte de este estudio es su diseño prospectivo y multicéntrico, con la inclusión de un gran número de pacientes con IC-FEc de casi todas las regiones de España, edad ≥50 años y una HVI ≥12mm, tal como actualmente se recomienda. Además, se incluyó a pacientes tanto ambulatorios como hospitalizados, lo cual refuerza la necesidad de sospechar la enfermedad en ambas situaciones. Las características de los pacientes con ATTR-AC descritos en este estudio son representativas de las de los pacientes de la práctica clínica real. Además, las imágenes de gammagrafía pasaron por un análisis centralizado, con lo que se evitó un sesgo intercentros.
Sin embargo, el estudio tiene limitaciones que deben reconocerse. Este estudio tiene las limitaciones inherentes a su carácter observacional, incluido el posible sesgo de selección. No se obtuvo información sobre el número de pacientes que acudieron a cada centro de estudio o fueron remitidos desde otras consultas, ni sobre los exámenes de detección preliminares realizados en otros lugares. Aunque el protocolo del estudio estipulaba la inclusión de los pacientes consecutivos que cumplieran los criterios de elegibilidad para el estudio, es probable que hubiera alguna variabilidad en las prácticas de inclusión. La inclusión solo de pacientes con antecedentes de hospitalización por IC podría haber influido en la prevalencia observada de la enfermedad.
Aunque es necesaria tanto la cuantificación de cadenas ligeras libres en suero como la inmunofijación en suero y en orina para descartar la amiloidosis AL43, se observa que un 23,4% de los análisis hematológicos eran incompletos. No se tomó biopsia a la mayoría de los pacientes que requerían una confirmación histológica. Por consiguiente, las pruebas incompletas o los resultados no concluyentes en algunos casos pueden haber causado una sobrestimación de la prevalencia descrita de la ATTR-AC en nuestro estudio. Además, dado que tan solo las gammagrafías positivas (grados 1-3) se analizaron de manera centralizada, esto podría haber introducido cierto sesgo. Otra limitación es que no se obtuvieron datos específicos sobre el uso de SPECT, ya que cuando se llevó a cabo el estudio no había recomendaciones sólidas respecto a ello y no se pudo confirmar si se usó o no.
Por otra parte, hubo algunas limitaciones en la inclusión de pacientes y la obtención de datos en el periodo de estudio debido a las repercusiones de la pandemia de COVID-19.
CONCLUSIONESEn este estudio de determinación de la prevalencia, multicéntrico y de ámbito nacional se ha observado que la prevalencia de la ATTR-AC en los pacientes con IC-FEc e HVI ≥12mm era del 16,8%. Se observa una prevalencia de la ATTR-AC creciente con la edad, y no se diagnosticó a ningún menor de 75 años. Además, nuestro estudio no detectó diferencias significativas entre los sexos. Nuestros estudios resaltan la necesidad de un uso más intensivo de las pruebas de detección de la ATTR-AC en los pacientes con IC-FEc en riesgo, con objeto de permitir un acceso más temprano a los tratamientos modificadores de la enfermedad para los pacientes que antes no se diagnosticaban.
- –
La ATTR-AC ha pasado a ser el tipo de amiloidosis cardiaca diagnosticado con más frecuencia, aunque su prevalencia continúa siendo incierta. A pesar de que la ATTR-AC es una causa frecuente de IC-FEc, con una prevalencia de entre el 5 y el 20% en esta población, todavía no se aplica de manera uniforme la detección sistemática en la práctica clínica. Hasta la fecha, no hay ningún estudio multicéntrico nacional que haya explorado la prevalencia de la ATTR-AC en los pacientes con IC-FEc.
- –
Este es el primer estudio multicéntrico de ámbito nacional en el que se ha evaluado la prevalencia de la ATTR-AC en pacientes con IC-FEc e HVI, en su mayoría incluidos en servicios de cardiología, utilizando la definición actual de fracción de eyección conservada (≥ 50%) y el umbral de grosor de la pared del VI recomendado para la sospecha de AC (≥ 12mm). Se observa una prevalencia del 16,8%, lo cual indica que la ATTR-AC es un factor que contribuye de manera significativa a la aparición de la IC-FEc tanto en varones como en mujeres de 75 o más años. Estos resultados resaltan la necesidad de una detección más intensiva de la ATTR-AC en esta población.
El estudio fue patrocinado por Pfizer SLU. El personal de Pfizer participó en el diseño del estudio y en la redacción del artículo.
CONSIDERACIONES ÉTICASEl protocolo del estudio, las enmiendas al protocolo y el documento de consentimiento informado fueron examinados y aprobados por comités de ética de investigación clínica independientes en cada uno de los centros participantes. Todos los pacientes dieron su consentimiento informado por escrito antes de la inclusión en el estudio. En la elaboración de este artículo se han tenido en cuenta los posibles sesgos de sexo y género. Se incluyó en el estudio tanto a varones como a mujeres con IC-FEc: el 52,2% varones y el 47,5% mujeres.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se utilizó ningún programa de inteligencia artificial en la elaboración de este artículo.
CONTRIBUCIÓN DE LOS AUTORESP. García-Pavía, J.M. García-Pinilla y P. Tarilonte participaron en la concepción y el diseño del estudio. P. García-Pavía, J.M. García-Pinilla, A. Lozano-Bahamonde, S. Yun, A. García-Quintana, J.J. Gavira-Gómez, M.A. Aibar-Arregui, G. Barge-Caballero y J. Núñez-Villota llevaron a cabo la investigación. P. García-Pavía, J.M. García-Pinilla y L. Bernal redactaron la primera versión del manuscrito. A. Lozano-Bahamonde, S. Yun, A. García-Quintana, J.J. Gavira-Gómez, M.A. Aibar-Arregui, G. Barge-Caballero, J. Núñez Villota y P. Tarilonte realizaron una revisión crítica de las sucesivas versiones y del manuscrito final. Todos los autores dieron su aprobación final al manuscrito.
CONFLICTO DE INTERESESEl estudio fue patrocinado por Pfizer SLU. L. Bernal y P. Tarilonte son empleados a tiempo completo de Pfizer SLU. P. Tarilonte posee acciones y opciones de compra de acciones de Pfizer. P. García-Pavía declara pagos por conferencias de Pfizer, Bridgebio, Ionis Pharmaceuticals, AstraZeneca, Novo Nordisk, Intellia y Alnylam Pharmaceuticals; pagos por consultoría de Pfizer, Bridgebio, Neuroimmune, Alnylam Pharmaceuticals, AstraZeneca, Novo Nordisk, ATTRalus, Intellia, General Electric y Alexion; y ayudas para investigación/formación a su centro de Pfizer, Bridgebio, Novo Nordisk, AstraZeneca, Intellia y Alnylam Pharmaceuticals. J.M. García-Pinilla declara pagos por conferencias de Pfizer, AstraZeneca, Alnylam Pharmaceuticals, Boehringer Ingelheim, Abbott, Medtronic, Impulse Dynamics, Novartis, Rovi y Orion Pharma; pagos por consultoría de Pfizer, Alnylam Pharmaceuticals y Bristol-Myers Squibb; y apoyo para investigación para su centro de Novartis. P. García-Pavía y J.M. García-Pinilla son coordinadores del estudio y han recibido pagos por este trabajo. A. Lozano-Bahamonde declara no tener ningún conflicto de intereses. S. Yun ha dictado conferencias en congresos científicos para AstraZeneca, Bristol-Myers Squibb, Rovi y Pfizer; ha recibido financiación de Bristol-Myers-Squibb, Rovi y Pfizer para gastos de congresos científicos y su centro ha recibido subvenciones de investigación/formación de AstraZeneca, Novartis, Vifor y Pfizer. A. García-Quintana declara pagos por conferencias de Pfizer, AstraZeneca, Alnylam Pharmaceuticals, Boehringer Ingelheim, Medtronic, Novartis, Rovi, Novo Nordisk y Bayer y pagos por consultoría de Bayer, Novartis y Novo Nordisk. J.J. Gavira-Gómez declara no tener ningún conflicto de intereses. M.A. Aibar-Arregui declara pagos por conferencias de Pfizer y Alnylam y ha recibido subvenciones de investigación/formación de Pfizer, Alnylam y Akcea. G. Barge-Caballero declara haber recibido pagos por consultoría de Pfizer, AstraZeneca y Boehringer Ingelheim, pagos por conferencias de Pfizer, AstraZeneca y Boehringer Ingelheim y subvenciones de investigación/formación de Pfizer. J. Núñez-Villota declara pagos personales y por formar parte de consejos asesores de Alleviant, AstraZeneca, Boehringer Ingelheim, Bayer, Novartis, Novo Nordisk, Pfizer, Rovi y Vifor Pharma (sin relación con el trabajo presentado).
P. García-Pavía es editor asociado de Rev Esp Cardiol. Se ha seguido el procedimiento editorial establecido por la Revista para garantizar un procesamiento imparcial del manuscrito.
Los autores no tienen ninguna otra filiación ni interés económico relevante con ninguna organización o entidad con un interés o conflicto económico respecto al tema o los productos comentados en el manuscrito, aparte de los declarados.
Quisiéramos dar las gracias a todos los investigadores del estudio PRACTICA.