El objetivo del estudio fue determinar la prevalencia de patología colorrectal en los pacientes con endocarditis infecciosa por Enterococcus faecalis (EIEF).
MétodosSe realizó un estudio observacional, retrospectivo y multicéntrico en 4 hospitales de referencia. Se incluyeron todos los episodios consecutivos de EIEF definitivas en adultos desde el momento en que se empezó a realizar una colonoscopia por protocolo en cada centro participante hasta octubre de 2018. Se recogieron los hallazgos endoscópicos de patología colorrectal potencialmente causante de una bacteriemia.
ResultadosSe incluyeron 103 pacientes con EIEF; 83 (81%) eran varones, la edad mediana era 76 [rango intercuartílico, 67-82] años, y la mediana del índice de Charlson ajustado por edad fue 5 [rango intercuartílico, 4-7]. El presunto origen de la infección fue desconocido en 63 (61%), urinario en 20 (19%), digestivo en 13 (13%), bacteriemia de catéter en 5 (5%), y otros en 2 (2%). En 78 (76%) pacientes se realizó una colonoscopia, y en 47 (60%) había hallazgos endoscópicos que indicaban un potencial foco de bacteriemia. Treinta y nueve (83%) tenían una enfermedad colorrectal neoplásica, y 8 (17%) no neoplásica. De los 45 pacientes con puerta de entrada desconocida y colonoscopia, un posible origen gastrointestinal se identificó en 64%. En el subgrupo de 25 con foco de entrada conocido y colonoscopia, excluyendo aquellos con enfermedad colorrectal ya previamente diagnosticada, 44% tenían patología colorrectal.
ConclusionesRealizar una colonoscopia en la EIEF, sin tener en cuenta la puerta de entrada, puede ayudar a diagnosticar la enfermedad colorrectal en estos pacientes y evitar una nueva bacteriemia (y eventualmente endocarditis infecciosa) por el mismo u otro microorganismo.
Palabras clave
Los enterococos son comensales normales del tracto gastrointestinal que pueden causar infección por traslocación a través de las células epiteliales del intestino y consiguen acceder al sistema linfático y al torrente circulatorio mediante mecanismos que aún no se han dilucidado1,2. En consecuencia, las lesiones de la mucosa del colon podrían ser un foco de entrada de bacteriemia, tal como en la endocarditis infecciosa (EI) causada por Streptococcus gallolyticus3,4.
En los países desarrollados, Enterococcus faecalis es la tercera causa de EI5. La endocarditis infecciosa por E. faecalis (EIEF) afecta a pacientes de edad avanzada con comorbilidades6-8, una población con mayor incidencia de enfermedad colorrectal9. Además, el 5% de los pacientes con EI, independientemente de la etiología, sufrirán un episodio adicional de EI con mayor mortalidad10. Así pues, identificar su foco de entrada y tratarlo es especialmente importante para reducir el riesgo de un nuevo episodio de EI11,12.
Un reciente estudio prospectivo, llevado a cabo en una cohorte seleccionada de pacientes, mostró que en los pacientes con EIEF de origen desconocido la prevalencia de lesiones colorrectales (31 de 61, 50,8%) era mayor que en aquellos con EIEF de origen conocido (1 de 6, 16,7%); no obstante, en aquel estudio no se realizó sistemáticamente una colonoscopia a todos los pacientes, en particular a los pacientes con EIEF de origen supuestamente conocido13. Teniendo en cuenta la importancia de controlar los posibles focos de entrada en la EIEF para evitar una nueva bacteriemia por el mismo microorganismo o uno distinto11, la cuestión es si hay que realizar de manera sistemática una colonoscopia a los pacientes con EIEF.
El objetivo de este estudio es evaluar la prevalencia de enfermedad colorrectal en pacientes con EIEF, independientemente de que el origen de la infección sea conocido.
MÉTODOSDiseño, contexto y pacientesEste estudio observacional, retrospectivo y multicéntrico se llevó a cabo en 4 centros de referencia de EI: el Hospital Universitari Vall d’Hebron (HUVH), un hospital universitario de 1.000 camas en Barcelona (España), el Complejo Hospitalario Universitario de Vigo (CHUV), un hospital universitario de 1.200 camas en Vigo, Pontevedra (España), el Presidio Ospedaliero Universitario Santa Maria della Misericordia (POUSMdM), un hospital universitario de 1.000 camas en Udine (Italia) y el Hospital de Barcelona (HdB), un hospital privado de 250 camas en Barcelona (España). Los 4 son centros de referencia para la cirugía cardiaca.
En vista de la importancia de controlar los focos de entrada para evitar recaídas, desde enero de 2014 se ha realizado una colonoscopia sistemática a todos los pacientes con EIEF en el POUSMdM, desde julio de 2014 en el HUVH y desde enero de 2015 en el CHUV y el HdB. Desde que empezaron a realizarse colonoscopias sistemáticas en todos los hospitales participantes hasta octubre de 2018, se han incluido todos los episodios consecutivos de EIEF definitiva en pacientes adultos (edad ≥ 18 años). Solo se registró el primer episodio de EIEF de cada paciente. Se identificó a los pacientes retrospectivamente a partir del registro de enfermedades infecciosas de cada uno de los hospitales participantes, donde se registran prospectivamente todos los episodios consecutivos de EI.
Objetivos del estudioEl objetivo era el hallazgo endoscópico de enfermedad colorrectal que pudiera causar bacteriemia.
Variables relacionadas con endocarditis infecciosaLa definición de las variables relacionadas con EI se detalla en el apartado métodos del 14-20.
Variables relacionadas con la colonoscopiaSe incluyeron todas las colonoscopias realizadas después del inicio de los síntomas de EI o durante los 6 meses anteriores al diagnóstico de EIEF, así como las realizadas durante el tratamiento y los 6 meses de seguimiento. La evaluación de la preparación del colon se realizó según los informes de gastroenterología y se clasificó como buena (sin restos fecales o con muy pocos que permitieron una exploración adecuada de la superficie), normal (presencia de algunas heces semisólidas que pudieron aspirarse y lavarse y permitieron una exploración adecuada de la superficie) o mala (restos fecales abundantes que no pudieron aspirarse ni lavarse y que impidieron la exploración adecuada de la superficie)21, y se registró la posibilidad de intubación cecal.
También se registraron los hallazgos endoscópicos de la colonoscopia y los eventos adversos relacionados con la intervención: perforación de colon, hemorragia digestiva baja y reacciones alérgicas a medicamentos sedantes.
Se registraron todos los hallazgos endoscópicos. La diverticulosis sin complicaciones y las hemorroides sin complicaciones no se incluyeron como causa posible de bacteriemia. Entre los hallazgos endoscópicos que podrían causar bacteriemia, las lesiones de colon se clasificaron en neoplásicas y no neoplásicas según el informe histopatológico. La clasificación se realizó en función de la lesión identificada de mayor gravedad. Cuando no se disponía de informe histopatológico, la lesión se clasificaba como no neoplásica.
Las neoplasias colorrectales incluyeron los adenomas colorrectales y los carcinomas colorrectales. Los adenomas se dividieron en: adenomas colorrectales no avanzados (adenomas tubulares con un diámetro < 10 mm) o en adenomas colorrectales avanzados (adenomas ≥ 10 mm, con arquitectura vellosa, displasia de alto grado o carcinoma intramucoso). El criterio para establecer carcinoma colorrectal fue la presencia de células malignas más allá de la capa muscular de la mucosa22. Las enfermedades no neoplásicas eran: inflamación de la mucosa del colon, angiodisplasias, úlceras y pólipos no neoplásicos. Todos los pacientes con hallazgos endoscópicos fueron remitidos al gastroenterólogo para seguimiento.
Obtención de los datosLos datos sobre la demografía, la clínica, el diagnóstico, el tratamiento, la evolución y el seguimiento se obtuvieron del registro prospectivo de EI de cada centro. Los datos sobre la colonoscopia (fecha de realización, hallazgos patológicos y acontecimientos adversos) se obtuvieron de manera retrospectiva a partir de los expedientes médicos de los pacientes y se introdujeron en una base de datos creada específicamente para este estudio.
Análisis estadísticoLas variables cuantitativas se expresan con la mediana [intervalo intercuartílico] y las variables cualitativas, con el número y el porcentaje. Las diferencias entre pacientes según el origen de la infección o la presencia o ausencia de hallazgos endoscópicos en la colonoscopia se evaluaron mediante la prueba de la χ2 o la prueba exacta de Fisher para variables categóricas, según correspondiera, y con la prueba de suma de rangos de Wilcoxon (Mann-Whitney) para variables continuas. Los análisis estadísticos se realizaron con el software STATA, versión 15. Un valor de p < 0,05 bilateral se consideró estadísticamente significativo.
ÉticaEl estudio fue aprobado por el Comité Ético del Hospital Universitari Vall d’Hebron, Barcelona (España) (aprobación PR(AG)332/2018) y por el resto de los centros participantes. No se requirió el consentimiento informado de los pacientes.
RESULTADOSPacientes incluidos en el estudioEn el estudio se incluyó un total de 103 episodios de EIEF definitiva. De estos casos, 78 pacientes (76%) se sometieron a colonoscopia (figura 1). De los sometidos a colonoscopia, 47 (60%) presentaban hallazgos endoscópicos que indicaban un posible origen de la bacteriemia. Las características epidemiológicas, clínicas y evolutivas se muestran en la .
Diagrama. aLas causas fueron edema agudo pulmonar, broncoaspiración y malignidad hematológica respectivamente. bUno tuvo una infección previa del tracto urinario causada por Enterococcusfaecalis, otro era una mujer de 32 años con infecciones recurrentes del tracto urinario y otro se había sometido a hemicolectomía por un adenocarcinoma de colon 8 meses antes.
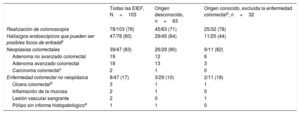
La tabla 1 muestra los hallazgos endoscópicos de todos los pacientes que se sometieron a una colonoscopia y los clasifica por grupos en función de si el origen de la infección era conocido (excluidos los pacientes con diagnóstico previo de enfermedad colorrectal) o desconocido. Para información más detallada véase la .
Hallazgos en la colonoscopia de los pacientes con EIEF y en función de si el origen de la infección era conocido o no
| Todas las EIEF, N=103 | Origen desconocido, n=63 | Origen conocido, excluida la enfermedad colorrectala, n=32 | |
|---|---|---|---|
| Realización de colonoscopia | 78/103 (76) | 45/63 (71) | 25/32 (78) |
| Hallazgos endoscópicos que pueden ser posibles focos de entradab | 47/78 (60) | 29/45 (64) | 11/25 (44) |
| Neoplasias colorrectales | 39/47 (83) | 26/29 (90) | 9/11 (82) |
| Adenoma no avanzado colorrectal | 19 | 12 | 6 |
| Adenoma avanzado colorrectal | 18 | 13 | 3 |
| Carcinoma colorrectalc | 2 | 1 | 0 |
| Enfermedad colorrectal no neoplásica | 8/47 (17) | 3/29 (10) | 2/11 (18) |
| Úlcera colorrectald | 3 | 1 | 1 |
| Inflamación de la mucosa | 2 | 1 | 0 |
| Lesión vascular sangrante | 2 | 0 | 1 |
| Pólipo sin informe histopatológicoe | 1 | 1 | 0 |
EIEF: endocarditis infecciosa causada por Enterococcus faecalis.
Los valores expresan N/n (%).
Con respecto al origen digestivo, se incluyeron 5 casos con un supuesto origen hepatobiliar: 2 colangitis, 2 colangiopancreatografías retrógradas endoscópicas y 1 ablación por radiofrecuencia de un carcinoma hepatocelular. Se excluyeron 8 casos de enfermedad colorrectal diagnosticados durante los 3 meses anteriores al diagnóstico de endocarditis: 3 colitis (una infecciosa con hallazgo de un pólipo en la colonoscopia, una isquémica con inflamación de la mucosa y otra también supuestamente isquémica sin hallazgos patológicos en la colonoscopia), 3 hemorragias digestivas bajas (una debida a lesiones vasculares, una debida a un carcinoma avanzado colorrectal y otra debida a ulcera colorrectal), 1 carcinoma rectal y 1 polipectomía reciente.
De los 78 pacientes que se sometieron a colonoscopia, 47 (60%) presentaban hallazgos endoscópicos que indicaban un posible origen de la bacteriemia. En 39 pacientes (83%) se constataba enfermedad colorrectal neoplásica y en 8 (17%), una enfermedad no neoplásica. De los 39 pacientes con una neoplasia colorrectal, 19 presentaban un adenoma no avanzado colorrectal, 18 un adenoma avanzado colorrectal y 2 un carcinoma colorrectal. De los 8 pacientes con una enfermedad no neoplásica: 3 presentaban úlceras no malignas, 2 inflamación de la mucosa colorrectal (uno debido a colitis isquémica y otro a proctitis rádica), otros 2 presentaban angiodisplasias y el último tenía un pólipo sin informe histopatológico.
Se disponía de colonoscopia de 45 (71%) de los 63 pacientes con un foco de infección desconocido, 25 (78%) de los 32 pacientes con foco de infección conocido (como tracto urinario, hepatobiliar, bacteriemia relacionada con el catéter y otros focos), y en los 8 pacientes con un diagnóstico previo de enfermedad colorrectal como presunto foco de la infección. De los 45 pacientes con un origen desconocido que se sometieron a colonoscopia, se identificó un posible origen gastrointestinal en 29 (64%). De los 25 pacientes con un origen de infección conocido y una colonoscopia, excluidos aquellos con un diagnóstico previo de enfermedad colorrectal, 11 (44%) tenían enfermedad colorrectal ().
Preparación del colon y eventos adversos relacionados con la colonoscopiaLa preparación del colon se consideró buena en 27 colonoscopias, normal en 42, mala en 6 e inadecuada en 2. La intubación cecal fue factible en 74 pacientes (95%) y desconocida en 1 paciente. Se realizó una polipectomía a los 38 pacientes con pólipos y se realizó una biopsia en 3 pacientes (en una de las 3 úlceras y en 2 sospechas de carcinoma colorrectal).
En cuanto a las complicaciones, 4 pacientes (5%) presentaron una hemorragia digestiva baja. Todas las hemorragias tuvieron lugar después de una polipectomía por adenomas avanzados en un promedio de 10 días, incluidos 2 casos de pacientes en tratamiento con acenocumarol (ambos pacientes requirieron transfusión de eritrocitos) y otros 2 pacientes en tratamiento con enoxaparina (1 paciente también requirió transfusión de eritrocitos). Se realizó una segunda colonoscopia a los 4 pacientes con hemorragia, y se colocaron hemoclips endoscópicos a 3 pacientes. No hubo casos de perforación de colon o de reacciones alérgicas a los medicamentos sedantes.
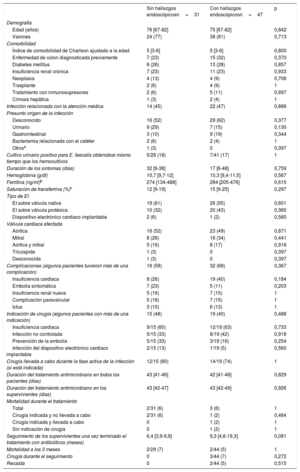
Comparación de las características de los pacientes en función de la presencia o ausencia de hallazgos endoscópicosLa tabla 2 muestra las características de los pacientes con EIEF en función de la presencia o ausencia de hallazgos endoscópicos relevantes. La edad y el grado de comorbilidad fueron parecidos. No se observaron diferencias significativas entre los supuestos focos de infección, aunque eran más los hallazgos endoscópicos cuando el origen era desconocido o gastrointestinal que en el caso de tracto urinario. Las complicaciones, el tratamiento quirúrgico y los resultados eran similares en los 2 grupos, con la excepción de las 2 únicas recaídas, que tuvieron lugar en pacientes con hallazgos endoscópicos relevantes y sin indicación quirúrgica previa. Un paciente recibió un tratamiento antibiótico por vía intravenosa durante 26 días y recayó al cabo de 23 días de haber finalizado el tratamiento. La colonoscopia se realizó durante el tratamiento del primer episodio de EIEF, y se identificaron úlceras pequeñas en el colon sigmoide. El otro paciente recibió tratamiento durante 44 días y recayó al cabo de 48 días de completar el tratamiento antibiótico, con hemocultivos negativos entretanto. La colonoscopia se realizó al cabo de 14 días de la recaída, no durante el tratamiento del primer episodio de EIEF, y se identificaron 3 adenomas no avanzados y un adenoma avanzado.
Características demográficas, comorbilidad, presunto origen de la infección, complicaciones, tratamiento quirúrgico y evolución de los episodios de EI por Enterococcus faecalis en función de la presencia o ausencia de hallazgos endoscópicos relevantes en la colonoscopia
| Sin hallazgos endoscópicosn=31 | Con hallazgos endoscópicosn=47 | p | |
|---|---|---|---|
| Demografía | |||
| Edad (años) | 76 [67-82] | 75 [67-82] | 0,842 |
| Varones | 24 (77) | 38 (81) | 0,713 |
| Comorbilidad | |||
| Índice de comorbilidad de Charlson ajustado a la edad | 5 [3-6] | 5 [3-6] | 0,800 |
| Enfermedad de colon diagnosticada previamente | 7 (23) | 15 (32) | 0,370 |
| Diabetes mellitus | 8 (26) | 13 (28) | 0,857 |
| Insuficiencia renal crónica | 7 (23) | 11 (23) | 0,933 |
| Neoplasia | 4 (13) | 4 (9) | 0,706 |
| Trasplante | 2 (6) | 4 (9) | 1 |
| Tratamiento con inmunosupresores | 2 (6) | 5 (11) | 0,697 |
| Cirrosis hepática | 1 (3) | 2 (4) | 1 |
| Infección relacionada con la atención médica | 14 (45) | 22 (47) | 0,886 |
| Presunto origen de la infección | |||
| Desconocido | 16 (52) | 29 (62) | 0,377 |
| Urinario | 9 (29) | 7 (15) | 0,130 |
| Gastrointestinal | 3 (10) | 9 (19) | 0,344 |
| Bacteriemia relacionada con el catéter | 2 (6) | 2 (4) | 1 |
| Otrosa | 1 (3) | 0 | 0,397 |
| Cultivo urinario positivo para E. faecalis obtenidoal mismo tiempo que los hemocultivos | 5/28 (18) | 7/41 (17) | 1 |
| Duración de los síntomas (días) | 32 [9-38] | 17 [6-48] | 0,759 |
| Hemoglobina (g/dl) | 10,7 [9,7-12] | 10,3 [9,4-11,5] | 0,567 |
| Ferritina (ng/ml)b | 274 [134-488] | 284 [205-476] | 0,615 |
| Saturación de transferrina (%)c | 12 [9-19] | 15 [9-25] | 0,297 |
| Tipo de EI | |||
| EI sobre válvula nativa | 19 (61) | 26 (55) | 0,601 |
| EI sobre válvula protésica | 10 (32) | 20 (43) | 0,360 |
| Dispositivo electrónico cardiaco implantable | 2 (6) | 1 (2) | 0,560 |
| Válvula cardiaca afectada | |||
| Aórtica | 16 (52) | 23 (49) | 0,871 |
| Mitral | 8 (26) | 16 (34) | 0,441 |
| Aórtica y mitral | 5 (16) | 8 (17) | 0,918 |
| Tricúspide | 1 (3) | 0 | 0,397 |
| Desconocida | 1 (3) | 0 | 0,397 |
| Complicaciones (algunos pacientes tuvieron más de una complicación) | 18 (58) | 32 (68) | 0,367 |
| Insuficiencia cardiaca | 8 (26) | 19 (40) | 0,184 |
| Embolia sintomática | 7 (23) | 5 (11) | 0,203 |
| Insuficiencia renal nueva | 5 (16) | 7 (15) | 1 |
| Complicación paravalvular | 5 (16) | 7 (15) | 1 |
| Ictus | 3 (10) | 6 (13) | 1 |
| Indicación de cirugía (algunos pacientes con más de una indicación) | 15 (48) | 19 (40) | 0,488 |
| Insuficiencia cardiaca | 9/15 (60) | 12/19 (63) | 0,733 |
| Infección no controlada | 5/15 (33) | 8/19 (42) | 0,918 |
| Prevención de la embolia | 5/15 (33) | 3/19 (16) | 0,254 |
| Infección del dispositivo electrónico cardiaco implantable | 2/15 (13) | 1/19 (5) | 0,560 |
| Cirugía llevada a cabo durante la fase activa de la infección (si está indicada) | 12/15 (80) | 14/19 (74) | 1 |
| Duración del tratamiento antimicrobiano en todos los pacientes (días) | 43 [41-46] | 42 [41-48] | 0,829 |
| Duración del tratamiento antimicrobiano en los supervivientes (días) | 43 [42-47] | 43 [42-49] | 0,926 |
| Mortalidad durante el tratamiento | |||
| Total | 2/31 (6) | 3 (6) | 1 |
| Cirugía indicada y no llevada a cabo | 2/31 (6) | 1 (2) | 0,464 |
| Cirugía indicada y llevada a cabo | 0 | 1 (2) | 1 |
| Sin indicación de cirugía | 0 | 1 (2) | 1 |
| Seguimiento de los supervivientes una vez terminado el tratamiento con antibióticos (meses) | 6,4 [3,9-9,9] | 9,3 [4,6-19,3] | 0,081 |
| Mortalidad a los 3 meses | 2/29 (7) | 2/44 (5) | 1 |
| Cirugía durante el seguimiento | 0 | 3/44 (7) | 0,272 |
| Recaída | 0 | 2/44 (5) | 0,515 |
EI: endocarditis infecciosa.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
Estos resultados demuestran que un posible foco de bacteriemia en la EIEF se sitúa con frecuencia en el colon, independientemente de si se sospecha otro origen de la infección; así pues, debería considerarse la realización de una colonoscopia en estos pacientes.
En la EI, es fundamental identificar y controlar el supuesto foco de bacteriemia para erradicarlo y reducir el riesgo de un nuevo episodio de EI por el mismo microorganismo o uno distinto12. Estudios previos han propuesto realizar una colonoscopia si es posible que el microorganismo causante de EI proceda del tracto gastrointestinal, sobre todo en pacientes de 50 años o más, así como en aquellos con antecedentes familiares de poliposis colónica11,23,24. Dado que el supuesto origen de infección de la EIEF es a menudo desconocido8,13, la colonoscopia podría ser útil para identificarlo. Por otro lado, puesto que los enterococos se encuentran en el tracto gastrointestinal y la población con riesgo de EIEF son personas de edad avanzada6,7 con una mayor incidencia de enfermedad colorrectal9, aunque esté claro el origen de la infección podría ser útil realizar una colonoscopia para tratar otros posibles focos de entrada de un nuevo episodio de bacteriemia, ya que los pacientes que han sufrido un episodio de EI tienen mayor riesgo de sufrir un nuevo episodio y con una mortalidad mayor10.
En el presente estudio, la colonoscopia sirvió para identificar un supuesto origen en el 64% de los pacientes sin un origen claro, y la mayor parte de los hallazgos colonoscópicos fueron tratables. Además, no solo en los pacientes con un origen de la infección desconocido se constataron hallazgos endoscópicos relevantes. En el 44% de los pacientes con un origen de la infección conocido hubo hallazgos en la endoscopia, incluidos los pacientes en quienes la presunta fuente de infección era el tracto urinario. Lamentablemente, no se identificaron características que diferenciaran a estos pacientes con hallazgos endoscópicos. Aunque sería de esperar que los pacientes sin hallazgos endoscópicos fueran más jóvenes, no se identificaron diferencias de edad entre ambos grupos. Asimismo, la positividad de los cultivos urinarios no se relacionó con la ausencia de hallazgos endoscópicos. Por último, dado que los pacientes con enfermedad colorrectal, en particular enfermedad neoplásica, podrían sufrir hemorragia gastrointestinal microscópica y en consecuencia anemia, se analizó si en los pacientes con hallazgos colorrectales eran inferiores las concentraciones de hemoglobina, ferritina o saturación de transferrina; sin embargo, no se observaron diferencias.
En nuestra serie, el 80% eran varones con una mediana de edad de 76 años, y se sabe que para los varones el riesgo asociado con la edad de sufrir una neoplasia avanzada colorrectal es mayor que para las mujeres25; así pues, podría decirse que se habría hallado el número y el tipo de resultados que se espera en esta población. No obstante, un estudio de cribado previo sobre la enfermedad colorrectal realizado en Austria con 3.098 varones de 70-79 años informó de que la prevalencia de adenomas era del 31,7% y la de adenomas avanzados, del 10,7%9. En nuestra serie, el 23,1% de los pacientes tenían adenomas avanzados (p < 0,001). Aunque el presente estudio no puede demostrar causalidad, la prevalencia de enfermedad colorrectal en la EIEF es alta. Estas observaciones se hallan en consonancia con las de Pericàs et al.13; no obstante, aunque también encontramos que la prevalencia de neoplasias colorrectales supera el 50% de los pacientes con EIEF con un origen de infección desconocido, también se observó que los pacientes con orígenes de la infección no gastrointestinales se benefician de una colonoscopia, ya que en el 44% de ellos los hallazgos endoscópicos eran relevantes.
LimitacionesEste estudio tiene varias limitaciones. Las principales limitaciones son su naturaleza retrospectiva y el tamaño de la muestra, inherente a la EIEF, dado que se trata de una enfermedad grave pero poco frecuente. Habitualmente, el origen de la infección se presume; no obstante, es muy difícil determinar el momento exacto en que la bacteriemia tiene lugar. Aunque se incluyó a los pacientes con EIEF a partir del momento en que la colonoscopia se realizó sistemáticamente en cada uno de los centros participantes, no se realizó colonoscopia en todos los casos de EIEF, básicamente debido al traslado del paciente a otro centro una vez que se rechazó la cirugía, o por la comorbilidad o la mala evolución clínica del paciente. Además, algunas lesiones colorrectales podrían haberse pasado por alto a causa de la mala preparación del colon. Por otro lado, se comparó el porcentaje de adenomas hallados en la cohorte a estudio, caracterizada principalmente por varones de más de 70 años, con una cohorte no contemporánea de pacientes de otro país que se sometían a colonoscopia como sistema de cribado colorrectal9, lo que puede llevar a sesgo, ya que algunos pacientes de nuestra cohorte ya sufrían enfermedad colorrectal y algunos presentaban síntomas atribuibles al tracto gastrointestinal. A este respecto, debido al diseño retrospectivo del estudio, no se dispone de información en relación con los factores de riesgo específicos del cáncer de colon en esta cohorte.
CONCLUSIONESAunque hasta la fecha las últimas guías norteamericana y europea solo recomiendan la colonoscopia para pacientes con bacteriemia causada por S. gallolyticus o EI para determinar la presencia de malignidad o de otras lesiones de la mucosa colorrectal16,26, la enfermedad del colon es muy común en la endocarditis por E. faecalis, incluso en pacientes con un foco de entrada conocido. Por consiguiente, la realización de una colonoscopia a los pacientes con EIEF, independientemente del supuesto origen de la infección, podría ser de utilidad para evitar un nuevo episodio de bacteriemia (y a la larga EI) causada por el mismo microorganismo u otro distinto.
AGRADECIMIENTOSL. Escolà-Vergé tiene un contrato Río Hortega de la convocatoria de 2018 de Acción Estratégica en Salud del Instituto de Salud Carlos III del Ministerio de Sanidad para 2019-2020.
FINANCIACIÓNEsta investigación no recibió ninguna subvención específica de algún organismo de financiación del sector público, comercial o sin fines de lucro.
CONFLICTO DE INTERESESLos autores declaran no tener conflicto de intereses en relación con este estudio.
- –
E. faecalis es la tercera causa de EI, que afecta principalmente a pacientes de edad avanzada con comorbilidad, una población con una mayor incidencia de enfermedad colorrectal.
- –
El 5% de los pacientes con EI sufrirá otro episodio de EI con una mortalidad más alta y, por lo tanto, es importante identificar el foco de entrada y tratar dicho episodio para reducir el riesgo de un nuevo episodio de EI.
- –
Un estudio retrospectivo reciente mostró que en los pacientes con EIEF de origen desconocido era mayor la prevalencia de las lesiones colorrectales (31 de 61; el 50,8%) que en aquellos con EIEF de origen conocido (1 de 6; el 16,7%); no obstante, no se realizaba colonoscopia de manera sistemática a todos los pacientes, en particular no se realizaba a los pacientes en quienes el origen era conocido.
- –
La enfermedad de colon es muy frecuente en la endocarditis causada por E. faecalis, incluso en pacientes con un supuesto foco de entrada conocido.
- –
El 60% de los pacientes con endocarditis causada por E. faecalis que se sometían a colonoscopia presentaban hallazgos en la endoscopia que indicaban un posible foco de bacteriemia. De estos pacientes, el 83% presentaba enfermedad colorrectal neoplásica.
- –
En el subgrupo de pacientes con un foco de infección supuestamente conocido, la colonoscopia indicaba enfermedad colorrectal en el 44%.
- –
Realizar una colonoscopia a todos los pacientes con EIEF, independientemente del presunto origen de la infección, podría ayudar a evitar un nuevo episodio de bacteriemia causado por el mismo microorganismo u otro distinto.