Hay evidencia discordante sobre el pronóstico del infarto sin lesiones coronarias obstructivas (MINOCA). Además, existen pocos datos del impacto de sus subtipos angiográficos. Los objetivos del estudio son evaluar el impacto pronóstico del MINOCA y sus subtipos angiográficos en el seguimiento a largo plazo.
MétodosSe incluyó a 591 pacientes consecutivos con IAMSEST a los que se realizó una coronariografía. Los pacientes con MINOCA se clasificaron según la angiografía en: coronarias lisas, irregularidades leves (estenosis<30%) y ateroesclerosis moderada (estenosis del 30-49%). El objetivo primario fue un combinado de mortalidad, infarto de miocardio y revascularización (MACE) en una mediana de seguimiento de 5 años.
ResultadosEn total, 121 pacientes (20,5%) no tenían lesiones obstructivas. El MINOCA se asoció con una menor ocurrencia de MACE (p=0,014; HR=0,63; IC95%, 0,44-0,91) y fue un factor independiente en el análisis multivariado (p=0,018; HR=0,63; IC95%, 0,43-0,92). Al analizar los componentes individuales, el MINOCA se asoció significativamente con menores tasas de infarto de miocardio y revascularización, pero no con la mortalidad. El análisis de los subtipos angiográficos mostró que las arterias coronarias lisas eran un factor protector significativo tanto en el análisis univariante como en el multivariado, mientras que las irregularidades leves y las estenosis del 30-49% se asociaron con mayor riesgo de MACE.
ConclusionesEl diagnóstico de MINOCA se asocia con una tasa de MACE más baja debida a un menor número de reinfartos y revascularizaciones. De los subtipos angiográficos, las arterias lisas se asociaron de manera independiente con un menor número de MACE.
Palabras clave
Entre un 5 y un 25% de los pacientes que sufren un infarto agudo de miocardio (IAM) no muestran una estenosis coronaria significativa en la coronariografía (infarto agudo de miocardio sin lesiones coronarias obstructivas, MINOCA)1–11. Los datos obtenidos respecto al pronóstico de los pacientes con MINOCA han sido discordantes, y se ha descrito una evolución mejor1,4,9,10,12, similar2,7,8 o incluso peor2,13 que la de los pacientes en los que se encuentran lesiones coronarias obstructivas. La mayor parte de los estudios aportan datos a 1 año, algunos se centran en los eventos aparecidos durante la hospitalización, pero el seguimiento a largo plazo es excepcional. No puede considerarse una entidad «benigna», dado que los estudios en los que se ha comparado a estos pacientes con la población general de iguales edad y sexo han confirmado un peor pronóstico del MINOCA y la literatura médica ha mostrado de manera uniforme una tasa de mortalidad anual total del 4-5%2,4.
Los criterios diagnósticos actuales para el MINOCA incluyen un diagnóstico de IAM según lo establecido en la definición universal, ausencia de lesiones coronarias obstructivas (es decir, ausencia de lesiones que afecten al 50% o más de un vaso epicárdico principal) y ausencia de otras causas alternativas14,15. Sin embargo, recientemente la American Heart Association (AHA) ha recomendado clasificar el MINOCA en los subgrupos de arterias coronarias angiográficamente normales, irregularidades leves (estenosis < 30%) y ateroesclerosis coronaria moderada (estenosis del 30-49%)15. Hay pocos datos sobre las diferentes repercusiones de estos subtipos angiográficos en el pronóstico de los pacientes con un MINOCA16,17.
En este estudio se analiza una cohorte de pacientes con diagnóstico de MINOCA clasificados según los subtipos angiográficos. Se siguió a los pacientes durante 5 años. Los objetivos son evaluar la repercusión pronóstica del diagnóstico de MINOCA y sus subtipos angiográficos en el seguimiento a largo plazo.
MÉTODOSSe realizó un estudio de cohorte unicéntrico observacional de pacientes consecutivos (entre el 1 de noviembre de 2010 y el 28 de febrero de 2014) hospitalizados por un infarto agudo de miocardio sin elevación del segmento ST (IAMSEST) de quienes se obtuvo una coronariografía. Los criterios de exclusión fueron: diagnóstico de miocardiopatía, lesión miocárdica no isquémica (miocarditis, síndrome de tako-tsubo) u origen no cardiaco del cuadro clínico y cirugía de revascularización coronaria previa. Este proyecto se enmarca en el «registro de pacientes ingresados en la sala de cardiología por dolor torácico», que ha sido aprobado por el comité de ética de investigación clínica local. Se trató a los pacientes según el criterio del médico encargado, siguiendo las guías de práctica clínica18.
Se recogieron sistemáticamente los datos de presentación y del ingreso mediante una base de datos específica (tabla 1, tabla 2 y tabla 3). Por lo que respecta a la determinación de troponina (Tn), se utilizó el análisis de Tn cardiaca T de alta sensibilidad Elecsys (Roche Diagnostics, Suiza); 14 ng/l corresponden al valor de corte del percentil 99 para una población de referencia sana. Se llevó a cabo una primera determinación de la Tn al ingreso y se programó una segunda determinación en las primeras 6h, según lo recomendado por la guía clínica en vigor al inicio del periodo de estudio19. Se analizó también la concentración máxima de Tn durante el ingreso y el incremento de Tn (calculado como cambio absoluto o relativo entre la primera y la segunda determinación de Tn).
Características basales: antecedentes patológicos
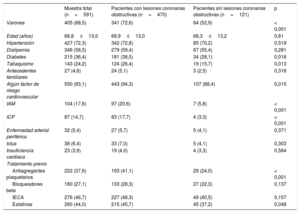
| Muestra total (n=591) | Pacientes con lesiones coronarias obstructivas (n=470) | Pacientes sin lesiones coronarias obstructivas (n=121) | p | |
|---|---|---|---|---|
| Varones | 405 (68,5) | 341 (72,6) | 64 (52,9) | < 0,001 |
| Edad (años) | 68,8±13,0 | 68,9±13,0 | 68,3±13,2 | 0,61 |
| Hipertensión | 427 (72,3) | 342 (72,8) | 85 (70,2) | 0,519 |
| Dislipemia | 346 (58,5) | 279 (59,4) | 67 (55,4) | 0,281 |
| Diabetes | 215 (36,4) | 181 (38,5) | 34 (28,1) | 0,016 |
| Tabaquismo | 143 (24,2) | 124 (26,4) | 19 (15,7) | 0,013 |
| Antecedentes familiares | 27 (4,6) | 24 (5,1) | 3 (2,5) | 0,316 |
| Algún factor de riesgo cardiovascular | 550 (93,1) | 443 (94,3) | 107 (88,4) | 0,015 |
| IAM | 104 (17,6) | 97 (20,6) | 7 (5,8) | < 0,001 |
| ICP | 87 (14,7) | 83 (17,7) | 4 (3,3) | < 0,001 |
| Enfermedad arterial periférica | 32 (5,4) | 27 (5,7) | 5 (4,1) | 0,371 |
| Ictus | 38 (6,4) | 33 (7,0) | 5 (4,1) | 0,303 |
| Insuficiencia cardiaca | 23 (3,9) | 19 (4,0) | 4 (3,3) | 0,584 |
| Tratamiento previo | ||||
| Antiagregantes plaquetarios | 222 (37,6) | 193 (41,1) | 29 (24,0) | < 0,001 |
| Bloqueadores beta | 160 (27,1) | 133 (28,3) | 27 (22,3) | 0,137 |
| IECA | 276 (46,7) | 227 (48,3) | 49 (40,5) | 0,157 |
| Estatinas | 260 (44,0) | 215 (45,7) | 45 (37,2) | 0,048 |
IAM: infarto agudo de miocardio; ICP: intervención coronaria percutánea; IECA: inhibidores de la enzima de conversión de la angiotensina.
Los valores expresan n (%) o media ± desviación estándar.
Características basales en la presentación clínica y durante el ingreso
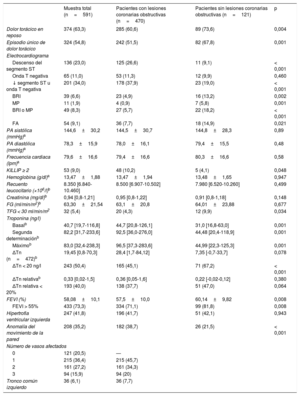
| Muestra total (n=591) | Pacientes con lesiones coronarias obstructivas (n=470) | Pacientes sin lesiones coronarias obstructivas (n=121) | p | |
|---|---|---|---|---|
| Dolor torácico en reposo | 374 (63,3) | 285 (60,6) | 89 (73,6) | 0,004 |
| Episodio único de dolor torácico | 324 (54,8) | 242 (51,5) | 82 (67,8) | 0,001 |
| Electrocardiograma | ||||
| Descenso del segmento ST | 136 (23,0) | 125 (26,6) | 11 (9,1) | < 0,001 |
| Onda T negativa | 65 (11,0) | 53 (11,3) | 12 (9,9) | 0,460 |
| ↓ segmento ST u onda T negativa | 201 (34,0) | 178 (37,9) | 23 (19,0) | < 0,001 |
| BRI | 39 (6,6) | 23 (4,9) | 16 (13,2) | 0,002 |
| MP | 11 (1,9) | 4 (0,9) | 7 (5,8) | 0,001 |
| BRI o MP | 49 (8,3) | 27 (5,7) | 22 (18,2) | < 0,001 |
| FA | 54 (9,1) | 36 (7,7) | 18 (14,9) | 0,021 |
| PA sistólica (mmHg)a | 144,6±30,2 | 144,5±30,7 | 144,8±28,3 | 0,89 |
| PA diastólica (mmHg)a | 78,3±15,9 | 78,0±16,1 | 79,4±15,5 | 0,48 |
| Frecuencia cardiaca (lpm)a | 79,6±16,6 | 79,4±16,6 | 80,3±16,6 | 0,58 |
| KILLIP ≥ 2 | 53 (9,0) | 48 (10,2) | 5 (4,1) | 0,048 |
| Hemoglobina (g/dl)a | 13,47±1,88 | 13,47±1,94 | 13,48±1,65 | 0,947 |
| Recuento leucocitario (×106/l)b | 8.350 [6.840-10.460] | 8.500 [6.907-10.502] | 7.980 [6.520-10.260] | 0,499 |
| Creatinina (mg/dl)b | 0,94 [0,8-1,21] | 0,95 [0,8-1,22] | 0,91 [0,8-1,18] | 0,148 |
| FG (ml/min/m2)b | 63,30±21,54 | 63,1±20,8 | 64,01±23,88 | 0,677 |
| TFG < 30 ml/min/m2 | 32 (5,4) | 20 (4,3) | 12 (9,9) | 0,034 |
| Troponina (ng/l) | ||||
| Basalb | 40,7 [19,7-116,8] | 44,7 [20,8-126,1] | 31,0 [16,8-63,0] | 0,001 |
| Segunda determinaciónb | 82,2 [31,7-233,6] | 92,5 [36,0-276,0] | 44,48 [20,4-118,9] | 0,001 |
| Máximob | 83,0 [32,4-238,3] | 96,5 [37,3-283,6] | 44,99 [22,3-125,3] | 0,001 |
| ΔTn (n=472)b | 19,45 [0,8-70,3] | 28,4 [1,7-84,12] | 7,35 [-0,7-33,7] | 0,078 |
| ΔTn < 20 ng/l | 243 (50,4) | 165 (45,1) | 71 (67,2) | < 0,001 |
| ΔTn relativab | 0,33 [0,02-1,5] | 0,36 [0,05-1,6] | 0,22 [-0,02-0,12] | 0,380 |
| ΔTn relativa < 20% | 193 (40,0) | 138 (37,7) | 51 (47,0) | 0,064 |
| FEVI (%) | 58,08±10,1 | 57,5±10,0 | 60,14±9,82 | 0,008 |
| FEVI > 55% | 433 (73,3) | 334 (71,1) | 99 (81,8) | 0,008 |
| Hipertrofia ventricular izquierda | 247 (41,8) | 196 (41,7) | 51 (42,1) | 0,943 |
| Anomalía del movimiento de la pared | 208 (35,2) | 182 (38,7) | 26 (21,5) | < 0,001 |
| Número de vasos afectados | ||||
| 0 | 121 (20,5) | — | ||
| 1 | 215 (36,4) | 215 (45,7) | ||
| 2 | 161 (27,2) | 161 (34,3) | ||
| 3 | 94 (15,9) | 94 (20) | ||
| Tronco común izquierdo | 36 (6,1) | 36 (7,7) | ||
BRI: bloqueo de rama izquierda; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; FG: filtrado glomerular; MP: marcapasos; PA: presión arterial; TFG: tasa de filtrado glomerular; Tn: troponina.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Revascularización y tratamiento al alta
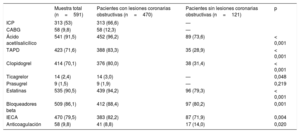
| Muestra total (n=591) | Pacientes con lesiones coronarias obstructivas (n=470) | Pacientes sin lesiones coronarias obstructivas (n=121) | p | |
|---|---|---|---|---|
| ICP | 313 (53) | 313 (66,6) | — | |
| CABG | 58 (9,8) | 58 (12,3) | — | |
| Ácido acetilsalicílico | 541 (91,5) | 452 (96,2) | 89 (73,6) | < 0,001 |
| TAPD | 423 (71,6) | 388 (83,3) | 35 (28,9) | < 0,001 |
| Clopidogrel | 414 (70,1) | 376 (80,0) | 38 (31,4) | < 0,001 |
| Ticagrelor | 14 (2,4) | 14 (3,0) | — | 0,048 |
| Prasugrel | 9 (1,5) | 9 (1,9) | — | 0,219 |
| Estatinas | 535 (90,5) | 439 (94,2) | 96 (79,3) | < 0,001 |
| Bloqueadores beta | 509 (86,1) | 412 (88,4) | 97 (80,2) | 0,001 |
| IECA | 470 (79,5) | 383 (82,2) | 87 (71,9) | 0,004 |
| Anticoagulación | 58 (9,8) | 41 (8,8) | 17 (14,0) | 0,020 |
CABG: cirugía de revascularización coronaria; ICP: intervención coronaria percutánea; IECA: inhibidores de la enzima de conversión de la angiotensina; TAPD: tratamiento antiagregante plaquetario doble.
Los valores expresan n (%).
El MINOCA se subdividió según los resultados de la coronariografía en los siguientes grupos: arterias coronarias (AC) normales (lisas), irregularidades leves (estenosis < 30%) y ateroesclerosis coronaria moderada (estenosis del 30-49%)15.
El objetivo principal fue la combinación de los eventos de muerte, infarto de miocardio no mortal y revascularización (MACE) con una mediana de seguimiento de 5,1 años. Los objetivos secundarios fueron cada uno de los componentes individuales del objetivo principal. La información de seguimiento se obtuvo en la consulta ambulatoria o mediante la revisión de la historia clínica electrónica.
Análisis estadísticoLas variables continuas se presentan en forma de media±desviación estándar o mediana [intervalo intercuartílico], mientras que las variables cualitativas se expresan en forma de valores absolutos y porcentajes.
Para el objetivo principal, se llevó a cabo un análisis univariante, en el que se consideraron las variables clínicas presentadas en las tabla 1, tabla 2 y tabla 3. A continuación, todas las variables con una asociación significativa (p<0,05) se incluyeron en un análisis de regresión de Cox multivariante con el método de regresión escalonada retrógrada. Después, el modelo resultante se verificó con un método escalonado anterógrado (Wald). Los resultados se expresan mediante la hazard ratio (HR) de cada variable con su intervalo de confianza del 95% (IC95%) y la significación estadística (p) y el estadístico c de los modelos. Tras ello, se aplicó el mismo método para los objetivos secundarios. En el caso de los eventos de reinfarto y revascularización, se realizó también un análisis tomando la muerte como evento competitivo, utilizando el método de Fine y Gray para modificar el modelo de riesgos proporcionales de Cox.
Se llevó a cabo un análisis de sensibilidad en el subgrupo de pacientes con MINOCA. Siguiendo la misma metodología indicada en el párrafo anterior, se realizaron análisis univariante y multivariantes utilizando la regresión de Cox para identificar las variables asociadas con el evento, y se expresó su significación estadística y la magnitud del efecto. Se clasificó a los pacientes según los resultados angiográficos en los grupos de AC lisas, irregularidades de la pared vascular y estenosis coronaria no significativa.
Para el cálculo del tamaño muestral, se estimó una prevalencia del MINOCA del 20%20. El objetivo propuesto fue alcanzar un mínimo de 100 MINOCA, por lo que se planificó reclutar a un mínimo de 500 pacientes. La duración del seguimiento fue de un mínimo de 5 años para evaluar el pronóstico a largo plazo de estos pacientes y alcanzar un número de eventos significativo que permitiera realizar un ajuste multivariante.
RESULTADOSDurante el periodo de estudio, hubo un total de 603 pacientes ingresados por un IAMSEST a los que se realizó una coronariografía, y 133 de ellos presentaron AC sin lesiones obstructivas. Se tomaron imágenes intracoronarias de 3 pacientes y se evaluó la reserva fraccional de flujo de 2 pacientes del grupo con AC sin lesiones obstructivas, y los resultados descartaron la rotura de placas coronarias o una estenosis coronaria funcional significativa. Tras un estudio diagnóstico completo, que incluyó cardiorresonancia magnética en un 40,6% de los casos de AC sin lesiones obstructivas, se excluyó a 12 pacientes debido a un diagnóstico alternativo: 5 miocarditis, 1 síndrome de tako-tsubo, 4 miocardiopatías hipertróficas y 2 casos de causas extracardiacas de daño miocárdico. En se muestra el diagrama de flujo del estudio.
Se incluyó en el análisis a 591 pacientes (el 68% varones; media de edad, 69 años); 121 pacientes (20,5%) no mostraron lesiones obstructivas en la coronariografía; de ellos, el 61,9% estaba angiográficamente normal, el 22,3% tenía irregularidades leves (estenosis < 30%) y el 15,7%, una ateroesclerosis coronaria moderada (estenosis del 30-49%). En las tabla 1, tabla 2 y tabla 3 se muestran las características basales al ingreso y el tratamiento utilizado en el conjunto de la muestra y en los subgrupos con AC con lesiones obstructivas y sin ellas. De manera resumida, los pacientes con AC sin lesiones obstructivas eran con más frecuencia mujeres y mostraron una menor prevalencia de diabetes, tabaquismo, IAM previo e intervención coronaria percutánea, así como menos tratamientos con antiagregantes plaquetarios y estatinas. Por lo que respecta a las características del evento, los pacientes con un MINOCA presentaron con más frecuencia dolor torácico en reposo y un único episodio y una menor frecuencia de descenso del segmento ST, pero con una mayor prevalencia de bloqueo de rama izquierda, ritmo de marcapasos y fibrilación auricular (FA). Todas las concentraciones de Tn fueron inferiores en el grupo de MINOCA, y hubo un mayor porcentaje de pacientes con un incremento de Tn <20 ng/l, sin diferencias significativas en los cambios relativos. Todos los tratamientos registrados se utilizaron con menos frecuencia en el grupo de MINOCA, excepto por un mayor empleo del tratamiento anticoagulante.
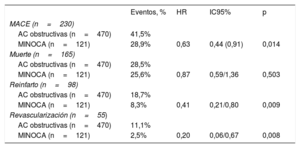
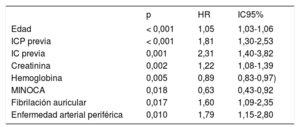
Repercusión pronóstica del MINOCATras una mediana de seguimiento de 5,1 años (máximo de 91 meses), se produjeron MACE en el 38,9% (230) de los pacientes; las tasas de los diversos objetivos fueron: mortalidad del 27,9% (n=165); reinfartos, el 16,6% (n=98), y revascularizaciones, el 9,3% (n=55). El MINOCA mostró una asociación significativa con una menor frecuencia de MACE (p=0,014; HR = 0,63; IC95%, 0,44-0,91) (tabla 4, figura 1A). En consecuencia, se elaboró un modelo multivariante para los MACE, en el que se incluyó el diagnóstico de MINOCA junto con todas las variables que mostraron una asociación significativa en el análisis univariante. El MINOCA se mantuvo en el modelo como predictor independiente de MACE (p=0,018; HR = 0,63; IC95%, 0,43-0,92) junto con la edad, la intervención coronaria percutánea previa, los antecedentes de insuficiencia cardiaca, las concentraciones de creatinina y hemoglobina, la FA y la enfermedad arterial periférica (tabla 5). El área bajo la curva (AUC) del modelo fue 0,783.
Regresión de Cox univariante. Repercusión del MINOCA y los subtipos angiográficos en la ocurrencia de MACE y cada uno de sus componentes (muerte, reinfarto y revascularización) durante el seguimiento (n=591)
| Eventos, % | HR | IC95% | p | |
|---|---|---|---|---|
| MACE (n=230) | ||||
| AC obstructivas (n=470) | 41,5% | |||
| MINOCA (n=121) | 28,9% | 0,63 | 0,44 (0,91) | 0,014 |
| Muerte (n=165) | ||||
| AC obstructivas (n=470) | 28,5% | |||
| MINOCA (n=121) | 25,6% | 0,87 | 0,59/1,36 | 0,503 |
| Reinfarto (n=98) | ||||
| AC obstructivas (n=470) | 18,7% | |||
| MINOCA (n=121) | 8,3% | 0,41 | 0,21/0,80 | 0,009 |
| Revascularización (n=55) | ||||
| AC obstructivas (n=470) | 11,1% | |||
| MINOCA (n=121) | 2,5% | 0,20 | 0,06/0,67 | 0,008 |
AC: arterias coronarias; HR: hazard ratio; IC95%: intervalo de confianza del 95%; MACE: eventos adversos cardiovasculares mayores (muerte, reinfarto y revascularización); MINOCA: infarto agudo de miocardio sin lesiones coronarias obstructivas.
Curvas de Kaplan-Meier. A: MACE en el seguimiento según el diagnóstico de MINOCA o AC con lesiones obstructivas. B: MACE en el grupo de MINOCA según los subtipos angiográficos del MINOCA. AC: arterias coronarias; MACE: eventos cardiovasculares adversos mayores (muerte, reinfarto y revascularización); MINOCA: infarto agudo de miocardio sin lesiones coronarias obstructivas.
Regresión de Cox. Modelo predictivo de MACE en el seguimiento (n=591)
| p | HR | IC95% | |
|---|---|---|---|
| Edad | < 0,001 | 1,05 | 1,03-1,06 |
| ICP previa | < 0,001 | 1,81 | 1,30-2,53 |
| IC previa | 0,001 | 2,31 | 1,40-3,82 |
| Creatinina | 0,002 | 1,22 | 1,08-1,39 |
| Hemoglobina | 0,005 | 0,89 | 0,83-0,97) |
| MINOCA | 0,018 | 0,63 | 0,43-0,92 |
| Fibrilación auricular | 0,017 | 1,60 | 1,09-2,35 |
| Enfermedad arterial periférica | 0,010 | 1,79 | 1,15-2,80 |
HR: hazard ratio; IC: insuficiencia cardiaca; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; MACE: eventos adversos cardiovasculares mayores (muerte, reinfarto y revascularización); MINOCA: infarto agudo de miocardio sin lesiones coronarias obstructivas.
El análisis univariante de cada uno de los componentes del objetivo principal mostró que el MINOCA se asociaba de manera significativa con menores tasas de IAM (p=0,009; HR = 0,41; IC95%, 0,21-0,80) y revascularización (p=0,008; HR = 0,20; IC95%, 0,06-0,67) en el seguimiento (tabla 4). Esta asociación se mantuvo en el análisis multivariante. Sin embargo, la asociación estadística entre el MINOCA y la mortalidad no fue significativa.
Por último, se realizó un análisis en los pacientes con MINOCA (n=121). Se observaron MACE en el 28,1% de ellos. Las curvas de Kaplan-Meier mostraron que, de entre los diferentes subtipos angiográficos, la presencia de AC lisas se asociaba significativamente con una menor frecuencia de MACE (log-rank test, p = 0,003) (figura 1B). De hecho, en el análisis de regresión de Cox univariante, tanto las irregularidades de la pared vascular (p=0,03; HR = 2,45; IC95%, 1,09-5,53) como la estenosis no significativa (p=0,002; HR = 3,64; IC95%, 1,61-8,23) mostraron un riesgo de MACE significativamente superior en comparación con las AC lisas (tabla 6). El análisis multivariante mostró que las AC lisas (p=0,015; HR = 0,40; IC95%, 0,19-0,84), el tratamiento con ácido acetilsalicílico al alta (p=0,019; HR =0,42; IC95%, 0,21-0,87) y la edad (p=0,046; HR = 1,04; IC95%, 1,01-1,09) eran las únicas variables asociadas de manera independiente con los MACE.
Regresión de Cox univariante. Repercusión de los subtipos angiográficos de MINOCA en la ocurrencia de MACE en el grupo de MINOCA durante el seguimiento (n=121)
| MACE (n=34), % | HR | IC95% | p | |
|---|---|---|---|---|
| AC lisas (n=75) | 18,7 | ref. | ||
| Irregularidades leves < 30% (n=27) | 37,0 | 2,45 | 1,09-5,53 | 0,03 |
| Placas de un 30-50% (n=19) | 52,6 | 3,64 | 1,61-8,23 | 0,002 |
AC: arterias coronarias; HR: hazard ratio; IC95%: intervalo de confianza del 95%; MACE: eventos adversos cardiovasculares mayores (muerte, reinfarto y revascularización); MINOCA: infarto agudo de miocardio sin lesiones coronarias obstructivas.
Los resultados de nuestro estudio indican una prevalencia de AC sin lesiones obstructivas del 20% en una serie no seleccionada de pacientes con IAMSEST. A diferencia de otros estudios en este campo, este se centra en el seguimiento a largo plazo, así como en el valor pronóstico de los subtipos angiográficos. El diagnóstico de MINOCA se asoció con una menor frecuencia de MACE (combinación de muerte, reinfarto y revascularización) en un seguimiento de 5 años, debido principalmente a un menor número de reinfartos y revascularizaciones. Además, el subgrupo de AC lisas fue el que tuvo el mejor pronóstico dentro de los pacientes con MINOCA, mientras que los que tenían placas con obstrucción de un 30-49% mostraron una mayor frecuencia de MACE.
Epidemiología del MINOCALa prevalencia de las AC sin lesiones obstructivas en nuestra serie de pacientes con IAMSEST fue del 20,5%. Este valor es elevado en comparación con otros datos publicados. Pasupathy et al. observaron una prevalencia de MINOCA del 6% en un metanálisis10. Sin embargo, hay una variabilidad significativa (de entre el 5 y el 25%) en las series publicadas1–11. Esta variabilidad puede atribuirse a diversos factores: diferencias en los criterios de inclusión (todo el espectro de los IAM frente a solo los IAMCEST o los IAMSEST), falta de homogeneidad en el diagnóstico de MINOCA, reciente uso generalizado de la Tn de alta sensibilidad, variabilidad intraobservador e interobservadores en la interpretación visual de la coronariografía, porcentaje variable de indicación de coronariografía en el contexto del IAM de tipo 2 y realización de exploraciones complementarias para establecer un diagnóstico específico (cardiorresonancia magnética, exploraciones de imagen o técnicas de fisiología intracoronaria)3,14,15,21–26. En resumen, la heterogeneidad de los datos refleja el conocimiento incompleto sobre esta entidad. En la práctica clínica tiene especial importancia disponer de una definición estricta del MINOCA (siguiendo la definición estandarizada que se da en las recomendaciones de la ESC y la AHA) y realizar un estudio exhaustivo para identificar la causa subyacente en el mayor número de pacientes posible14,15. Nuestra serie puede verse influida también por estas limitaciones, especialmente la escasa realización de exploraciones complementarias. Sin embargo, la práctica clínica actual en nuestro contexto se refleja en las determinaciones de Tn de alta sensibilidad, el seguimiento de las guías clínicas vigentes y servirse de los criterios recomendados para el diagnóstico de MINOCA en los consenso recientes.
Pronóstico del MINOCAEn términos generales, la literatura médica que aborda esta cuestión se basa en estudios observacionales que son heterogéneos en cuanto a los criterios de inclusión y exclusión, las variables de valoración (generalmente la mortalidad total) y el seguimiento (la mayoría de las publicaciones presentan datos a 1 año). Decidimos atenernos a las recomendaciones más recientes para el diagnóstico del MINOCA, evaluar la aparición de MACE y planificar un seguimiento a largo plazo, dado que los datos de la literatura son escasos a este respecto. Concretamente, se excluyó a los pacientes con un diagnóstico no isquémico al alta (es decir, miocardiopatía, lesión miocárdica no isquémica o enfermedad no cardiaca), ya que se trata de entidades independientes con tratamiento y pronóstico diferentes.
En general, nuestros resultados indican que, en un seguimiento a largo plazo, el MINOCA en los pacientes con un IAMSEST se asocia de manera independiente con un número significativamente inferior de MACE (muerte, reinfarto y nueva revascularización) respecto a los pacientes con AC y lesiones obstructivas. Los datos publicados sobre esta cuestión son contradictorios. La mayor parte de los estudios muestran un mejor pronóstico de mortalidad del MINOCA1,4,9,10,12. En un metanálisis, Pasupathy et al. observaron una mortalidad del 4,7% a los 12 meses (similar al 4,5% de nuestro estudio); 6 de los estudios incluidos compararon los eventos con los pacientes con AC sin lesiones obstructivas y hallaron una mortalidad significativamente inferior en el grupo de MINOCA (el 3,5 frente al 6,7%; odds ratio = 0,59; intervalo de confianza del 95%, 0,41-0,83; p=0,003)10. En el estudio con un seguimiento más largo, se observaron menores tasas de mortalidad y reinfarto a los 2 años en esos pacientes4. En cambio, en algunos estudios no se observó un mejor pronóstico del MINOCA. Un análisis mediante emparejamiento por propensión del ensayo clínico ACUITY observó más mortalidad a los 12 meses en los pacientes con IAMSEST y MINOCA que en aquellos con AC y lesiones obstructivas (el 5,2 frente al 1,6%), debido principalmente a la mortalidad no cardiovascular; sin embargo, en este último grupo se observaron tasas superiores de reinfartos y revascularizaciones13. Andersson et al.2 no observaron diferencias de mortalidad total en el IAMCEST, aunque los pacientes con MINOCA presentaron una menor mortalidad cardiovascular. La mortalidad a 1 año descrita también fue similar en los pacientes jóvenes de ambos grupos y en la comparación del MINOCA con la enfermedad coronaria de 1 o 2 vasos8,27.
Subtipos angiográficos de MINOCALa definición angiográfica recomendada de los AC sin lesiones obstructivas (estenosis < 50%) incluye un grado variable de enfermedad coronaria. Por esta razón, los documentos de consenso sobre el MINOCA recomiendan una clasificación angiográfica que distinga las arterias coronarias con ausencia total de ateroesclerosis de las que presentan una ateroesclerosis no obstructiva, ya que pueden traducirse en entidades diferentes y tener consecuencias para el diagnóstico y el pronóstico14,15. Sin embargo, la evidencia existente hasta la fecha sobre la repercusión que tienen estos subtipos angiográficos del MINOCA en el pronóstico es muy escasa.
Se ha observado que las AC lisas (sin signos de ateroesclerosis en la angiografía) se asocian de manera significativa con un número de MACE inferior al observado con los demás subtipos angiográficos (es decir, el de irregularidades leves <30% y el de placas con obstrucción de un 30-50%). Estas observaciones respaldan la hipótesis de que los subgrupos angiográficos son entidades independientes dentro del MINOCA, posiblemente con mecanismos fisiopatológicos diferentes y con consecuencias diagnósticas y terapéuticas. Serán necesarios más estudios sobre este tema para confirmar esta hipótesis. En una revisión no sistemática, Di Fiore et al.28 examinaron una serie de estudios del MINOCA que presentaron datos diferentes para la enfermedad con AC lisas y la enfermedad con AC sin lesiones significativas; se señaló que hay menos mortalidad total entre los pacientes con AC lisas, aunque no se presentó un análisis que proporcionara significación estadística. Bugiardini et al.16 realizaron un metanálisis de pacientes con IAMSEST de 3 ensayos clínicos de grupo TIMI, y observaron que los pacientes con AC lisas tenían menos eventos durante el seguimiento en comparación con los pacientes con una ateroesclerosis no significativa, pero solo la revascularización fue significativa al analizarla por separado. En cambio, Bainey et al.17 no observaron diferencias significativas en las tasas de mortalidad o reinfarto a 1 año en función del tipo angiográfico, y Andersson et al.2 observaron una mortalidad superior (principalmente por las muertes de causa no cardiovascular) en el grupo con AC lisas en comparación con el de AC con lesiones obstructivas en pacientes con IAMCEST.
El peor pronóstico del MINOCA con ateroesclerosis no significativa podría explicarse por haberse subestimado la estenosis coronaria o su repercusión fisiológica en la coronariografía, porque el tratamiento médico para la prevención secundaria se aplica en menor medida a este tipo de pacientes o porque estas observaciones sean un indicador del riesgo y traduzcan una enfermedad ateroesclerótica subclínica pero relacionada con los eventos aparecidos en el seguimiento. En cualquiera de estos casos, esta situación podría implicar un riesgo de eventos aterotrombóticos durante el seguimiento. Hay varias observaciones que respaldan estas hipótesis. En primer lugar, la coronariografía muestra una elevada variabilidad interobservadores en la estimación de la gravedad de la lesión23. En segundo lugar, la evidencia de placas inestables no visibles en la coronariografía: en series de casos pequeñas se ha observado que alrededor de una tercera parte de los pacientes con MINOCA presentan rotura o erosión de placas ateroescleróticas en la ecografía intracoronaria, y es posible que esto sea aún mayor si se explora con tomografía de coherencia óptica (OCT)29–31. En tercer lugar, la correlación inexacta entre el grado de estenosis y la repercusión funcional de una lesión coronaria: un documento de consenso apunta el posible papel de la evaluación funcional intracoronaria en casos seleccionados, aunque ello no está respaldado por la evidencia15. En cuarto lugar, la evidencia de progresión de la ateroesclerosis en los pacientes con MINOCA: en un análisis de 9.092 pacientes con MINOCA del registro sueco SWEDEHEART, se observaron AC con lesiones obstructivas en casi la mitad de los pacientes con IAM recurrente en los que se realizó una coronariografía de seguimiento32. Por último, el beneficio del tratamiento médico para los pacientes con MINOCA: aunque son escasos, algunos datos observacionales indican un beneficio de las medicaciones que tienen un papel bien establecido en la enfermedad coronaria con MINOCA, como son los inhibidores de la enzima de conversión de la angiotensina y los bloqueadores beta33. Todos estos resultados resaltan tanto la necesidad de nuevas investigaciones sobre el diagnóstico y el tratamiento del MINOCA como la importancia de un diagnóstico etiológico completo en cada uno de estos pacientes.
En el análisis multivariante realizado en nuestro estudio, se confirmó la asociación independiente con una menor frecuencia de MACE de las AC lisas, junto con el tratamiento antiagregante plaquetario con ácido acetilsalicílico y la edad. El bajo número de pacientes incluidos para este fin limita las conclusiones. Sin embargo, estos resultados refuerzan el posible papel del subtipo angiográfico de AC lisas en el pronóstico de estos pacientes. Nordenskjöld et al.34 evaluaron los factores independientes predictivos de MACE en los pacientes con MINOCA en el registro SWEDEHEART, y observaron un perfil de riesgo clínico alto (edad, hipertensión, tabaquismo, ictus, enfermedad arterial periférica y FEVI baja, entre otros factores) relacionado con los eventos, pero no se incluyeron las características del episodio de MINOCA.
LimitacionesEn este trabajo hay que reconocer diversas limitaciones. En primer lugar, se trata de un estudio unicéntrico y los resultados pueden verse influidos por peculiaridades locales en el tratamiento de los pacientes. El número de pacientes puede limitar las conclusiones, en especial por lo que respecta al análisis de subgrupos, que debe considerarse solo generador de hipótesis. La clasificación angiográfica de las AC sin lesiones obstructivas se realizó mediante estimación visual subjetiva, lo cual puede limitar su reproducibilidad. Por último, no se llevó a cabo un estudio etiológico sistemático (es decir, exploraciones por imagen intracoronaria, evaluación de la función microvascular, cardiorresonancia magnética, etc.) y, por consiguiente, no pueden extraerse conclusiones respecto a la influencia de los procesos fisiopatológicos subyacentes en el pronóstico y su posible relación con los subtipos angiográficos, y la falta de un estudio etiológico sistemático puede producir una sobrestimación de la tasa de MINOCA en la cohorte.
CONCLUSIONESEn una cohorte no seleccionada de pacientes con IAMSEST sometidos a coronariografía, el diagnóstico de MINOCA se asoció con una mayor tasa de MACE (muerte, reinfarto y revascularización) durante el seguimiento a largo plazo inferior a la observada en las AC con lesiones obstructivas. Ello se debió principalmente a la menor frecuencia de reinfartos y revascularizaciones. De entre los diversos subtipos angiográficos de MINOCA, solo la presencia de AC lisas se asoció de manera significativa e independiente con un menor número de MACE y de sus componentes.
FINANCIACIÓNMinisterio de Economía y Competitividad de España a través del Instituto de Salud Carlos III: CIBER-CV 16/11/00420, Madrid, España.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
El MINOCA es una entidad frecuente, que supone un 5-25% del total de infartos de miocardio.
- –
Los datos obtenidos respecto al pronóstico de los pacientes con MINOCA han sido discordantes. Aunque en la mayoría de los estudios se ha observado un mejor pronóstico que con lesiones coronarias obstructivas, otros estudios han descrito un pronóstico similar o incluso peor. Además, el pronóstico a largo plazo no está tan bien documentado.
- –
Recientemente se ha recomendado subdividir los MINOCA en diversos subtipos angiográficos.
- –
El MINOCA se asoció con menor frecuencia de MACE en el seguimiento a largo plazo (mediana, 61,6 meses) en comparación con las AC con lesiones obstructivas, principalmente por un menor número de reinfartos y revascularizaciones, sin diferencias significativas en cuanto a la mortalidad.
- –
Las AC lisas (sin signos angiográficos de ateroesclerosis) se asociaron de manera independiente con una menor frecuencia de MACE.
- –
De los pacientes con MINOCA, los que presentaban irregularidades leves (estenosis < 30%) o una ateroesclerosis coronaria moderada (30-49%) presentaron una mayor tasa de MACE.
- –
Los únicos factores pronósticos independientes en la población con MINOCA fueron las AC lisas, el tratamiento con ácido acetilsalicílico y la edad.