La resonancia magnética cardiovascular está adquiriendo un papel cada vez más relevante en la práctica clínica habitual en cardiología. Se trata de una modalidad de diagnóstico por imagen versátil que permite una evaluación exacta, amplia y profunda de la función y la estructura cardiacas y que aporta información sobre cuestiones clínicas relevantes, en enfermedades como la cardiopatía isquémica, las miocardiopatías no isquémicas y la insuficiencia cardiaca, a la vez que permite indicaciones especiales, como la evaluación y/o cuantificación de la sobrecarga de hierro o la infiltración miocárdica. La creciente evidencia que respalda el papel de la resonancia magnética cardiovascular, junto con la difusión del conocimiento y la pericia en su uso fuera de los centros expertos, ha permitido un mayor acceso de los pacientes a esta técnica y la obtención de una experiencia clínica más amplia. En esta revisión se refleja la situación de la resonancia magnética cardiovascular en la práctica clínica moderna relacionando la adquisición y el posprocesado de las imágenes con una descripción efectiva de su significado clínico.
Palabras clave
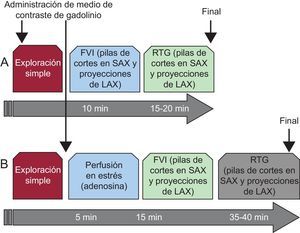
Los protocolos estandarizados de adquisición mediante resonancia magnética cardiovascular (RMC) se diseñan para abordar específicamente cuestiones clínicas. El uso actual de la RMC en la práctica clínica habitual se ha modelado con los esfuerzos realizados para estandarizar la adquisición y el posprocesado de las imágenes1,2 para obtener una amplia información clínica que afecta al tratamiento y la evolución del paciente, lo cual facilita el reembolso de los costes3. Se han examinado detalladamente las adquisiciones de imagen amplias y prolongadas y los informes de RMC manifiestamente descriptivos para identificar resultados clínicamente relevantes, con mediciones e informaciones esenciales que sean útiles para responder a la cuestión clínica. Dos protocolos de obtención de imágenes permitirán esclarecer cuestiones de gran relevancia en la labor de la cardiología clínica moderna:
- 1.
«Protocolo de función del ventrículo izquierdo (VI) y cicatriz/fibrosis». Este protocolo evalúa los volúmenes y la función del corazón mediante imágenes de cine, así como la presencia, el grado y el tipo de cicatriz/fibrosis mediante realce tardío de gadolinio (RTG) (figura 1A).
Figura 1.Protocolos básicos de resonancia magnética cardiovascular en la práctica clínica habitual, basados en la robustez y la maximización del aporte de información de las aplicaciones de diagnóstico por la imagen. A: la función ventricular izquierda y el realce tardío de gadolinio permiten una evaluación estándar de la función y la estructura cardiacas y aportan la identificación de la miocardiopatía subyacente basándose en la presencia y el patrón del realce tardío de gadolinio. B: la adición de la perfusión con estrés miocárdico (adenosina) al esquema básico facilita la evaluación de la isquemia miocárdica cuando ello es necesario ante ciertos síntomas anginosos característicos. La omisión de estudiar la perfusión en reposo se basa en que la información adicional que aporta es desdeñable en presencia de realce tardío de gadolinio, lo cual reduce el tiempo necesario para la exploración y la dosis de contraste utilizada. FVI: función ventricular izquierda; LAX: eje largo; RTG: realce tardío de gadolinio; SAX: eje corto.
(0.16MB). - 2.
«Protocolo de perfusión miocárdica de estrés». Este protocolo se añade al anterior cuando así lo exigen los síntomas que indican isquemia miocárdica o, si es pertinente, cuando es necesario guiar una intervención coronaria (figura 1B).
Dadas su facilidad y solidez, estos dos protocolos de RMC pueden llevarse a cabo en la mayoría de los departamentos clínicos en 20 y 45 min, respectivamente, y aportan imágenes diagnósticas de casi todos los pacientes, excepto un pequeño número de ellos que no pueden aprovechar la resonancia magnética (RM) debido a contraindicaciones (como dispositivos médicos) o gran tamaño corporal. Estos tiempos de obtención de imagen más cortos facilitan mayor comodidad para el paciente, que el proceso clínico sea eficiente y que aumente la experiencia en la adquisición e interpretación de las imágenes. En la segunda parte de esta revisión se presentan algunas variaciones sobre este esquema básico, que también tienen interés, junto con su finalidad clínica.
VOLÚMENES Y FUNCIÓN DEL CORAZÓNAl no verse limitada por la calidad de las ventanas de adquisición, la RMC puede proporcionar una visión general de la morfología cardiaca, así como de las relaciones de las cámaras del corazón con los grandes vasos y otras estructuras torácicas. El pilar de la práctica radiológica, las secuencias de sangre negra, en las que la señal de la sangre se suprime con objeto de resaltar las estructuras vasculares y miocárdicas, se ha sustituido por las secuencias, más rápidas, de gradiente-eco y finalmente por las secuencias equilibradas de precesión libre en estado estacionario. Estas secuencias modernas permiten una adquisición rápida de múltiples imágenes consecutivas que pueden presentarse en modo «estático» o de «cine» para mostrar el movimiento cardiaco.
Las secuencias de cine equilibradas constituyen el patrón de referencia para la cuantificación de los volúmenes y la función de ambos ventrículos, así como de la masa del VI, y superan las limitaciones que tiene la ecocardiografía, como la mala ventana acústica o las presunciones geométricas que comportan inexactitudes y menor reproducibilidad de las mediciones. Una definición excelente de los límites del endocardio y el epicardio se traduce en una mayor fiabilidad de los valores obtenidos, con resultados excelentes en cuanto a la variabilidad interobservadores e intraobservador (variabilidad interobservadores del 4,4% para la fracción de eyección, el 6,3% para el volumen diastólico y el 8,6% para el volumen sistólico; variabilidad intraobservador del 4,0, el 3,6 y el 6,5% respectivamente)4. Además de la cuantificación del tamaño de las cámaras, las imágenes de cine permiten inspeccionar la estructura cardiaca y el movimiento regional de la pared de manera exacta y reproducible5. Dado que estos parámetros son la base para la toma de decisiones de manejo clínico, para el diagnóstico (p. ej., miocardiopatía dilatada6) o como guía para el tratamiento (p. ej., empleo de un dispositivo7), la exactitud de las mediciones es un aspecto clave. Otra ventaja es la evaluación del ventrículo derecho, que resulta difícil en la ecocardiografía debido a su forma compleja, que no se corresponde con ningún modelo geométrico.
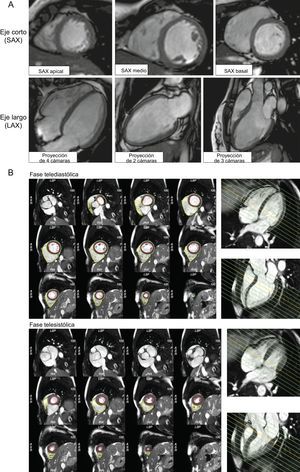
En la figura 2 se muestran imágenes de cine obtenidas en un paciente adulto estándar:
- 1.
Una pila de cortes en eje corto, desde el ápex a la base, siguiendo el eje largo central del VI.
- 2.
Proyecciones perpendiculares en el eje largo (proyecciones de 2, 3 y 4 cámaras).
Evaluación de la función y la estructura del ventrículo izquierdo. A: las geometrías básicas en la evaluación de la función y la estructura del corazón siguen las recomendaciones estándares del diagnóstico por la imagen cardiovascular basadas en el modelo de 17 segmentos, y los planos de imagen en las proyecciones de eje corto (eje corto, apical, ventricular medio, basal) y de eje largo (eje largo, proyecciones de 2, 3 y 4 cámaras); estas mismas geometrías se utilizan también para los módulos de perfusión y de realce tardío de gadolinio, lo que permite una comparación en paralelo de las imágenes de cine y las anomalías del movimiento de la pared con las imágenes de la cicatriz. B: se necesita una pila de cortes en el eje corto completa, que cubra la totalidad desde la base de ambos ventrículos hasta el ápex, para la delimitación manual o automática del borde ventricular del endocardio y el epicardio. Posprocesado ventricular izquierdo y ventricular derecho basado en la recomendación de la Sociedad de Resonancia Magnética Cardiovascular en la diástole y la sístole, mediante un ejemplo que usó CVI42®. El empleo en paralelo de la proyección de eje largo permite delimitar las estructuras en los cortes basales, lo que reduce una frecuente causa de error en la cuantificación del volumen cardiaco.
La pila de cortes en el eje corto incluye ambos ventrículos en su totalidad. Este esquema o geometría de adquisición se sigue en la posterior adquisición de imágenes de RTG, lo cual permite la evaluación de los hallazgos en paralelo. Existen recomendaciones sobre los protocolos de posprocesado de las imágenes ya adquiridas con programas informáticos validados clínicamente2, que permiten la cuantificación y las comparaciones longitudinales entre distintos observadores y centros de diagnóstico, así como comparaciones con los valores normales publicados8–11. Una pila de cortes en el eje corto sirve de base para la cuantificación de los volúmenes y la función de ambos ventrículos, así como de la masa del VI, con la inclusión de los músculos papilares en el volumen de sangre, siguiendo las convenciones aceptadas. La delimitación de los contornos de los cortes transversales basales puede resultar difícil debido a los cortes parciales a través de las estructuras. En esto, la referencia lateral que ofrecen las proyecciones de eje largo proporciona una guía que resulta muy útil.
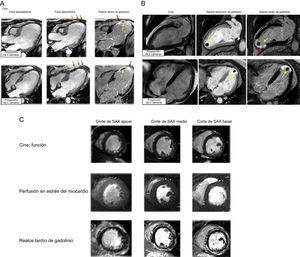
CICATRIZ O FIBROSIS MIOCÁRDICAS MEDIANTE REALCE TARDÍO DE GADOLINIOLas imágenes de RTG tienen como característica única la capacidad de visualizar directamente el sustrato fisiopatológico extracelular que es clave en el desarrollo de las cardiopatías: la cicatriz/fibrosis del miocardio12. El uso del RTG pone de manifiesto las diferencias existentes en la distribución regional y temporal del gadolinio entre distintos tipos de tejidos, como el miocardio sano en comparación con el miocardio necrótico o con el tejido cicatrizal. El gadolinio no se visualiza directamente; la imagen de contraste se basa en la modificación de las propiedades magnéticas del tejido en presencia de gadolinio, el «acortamiento» (aceleración) de la relajación longitudinal del tejido en que se acumula el gadolinio. El RTG está especialmente indicado para delimitar mejor los cambios regionales, como la cicatriz del miocardio después de un infarto13 (figura 3). Este fenómeno puede observarse de modo característico entre 10 y 20 min después de la administración del medio de contraste usando secuencias de gradiente-eco con adquisición de imágenes de inversión-recuperación potenciadas en T1. El contraste de imagen entre negro y blanco, es decir, el miocardio sano (remoto) y la cicatriz posterior al infarto, respectivamente, se obtiene mediante la «anulación» del miocardio sano, ajustando el tiempo de inversión en cada paciente hasta suprimir la señal del miocardio normal (que entonces aparece en negro) para mostrar la hipercaptación de contraste brillante en la cicatriz. Además de la cicatrización posterior a un infarto, el RTG puede mostrar también patrones de lesión del miocardio no isquémico, como la fibrosis difusa en parches o las estrías intramiocárdicas, cuando hay un grado suficiente de confluencia y delimitación respecto al resto del miocardio enfermo (figura 4). La observación histológica correlacionada con este fenómeno, con independencia de cuál sea la enfermedad, es la sustitución del miocardio sano por fibrosis densa12,14,15, que corresponde clínicamente a una lesión irreversible y fija. Su presencia y su extensión constituyen un marcador pronóstico de interés. En comparación con otras modalidades de imagen, como la SPECT (tomografía computarizada por emisión monofotónica), la RMC con RTG, debido a su mayor resolución espacial, es considerablemente más exacta en la detección de cicatrices, cuya presencia, transmuralidad y extensión aportan información respecto al pronóstico y la viabilidad residual13.
Evaluación en paralelo de las imágenes de cine y de realce tardío de gadolinio. A: ejemplo de miocardiopatía isquémica; las imágenes de cine en las fases telediastólica y telesistólica revelan un miocardio adelgazado y acinético en los segmentos apical medio anterior-anteroseptal-inferoseptal (flechas naranjas), que corresponden a la cicatriz isquémica transmural del 100% (flechas rojas); el vacío de señal dentro del realce tardío de gadolinio corresponde a las áreas de obstrucción microvascular (flechas amarillas). B: ejemplo de miocardiopatía isquémica con un trombo apical adyacente a una cicatriz del miocardio que afecta al grosor completo; los métodos de imagen incluyen las técnicas de cine y de realce temprano y tardío de gadolinio. C: ejemplo de un paciente con síntomas de tipo anginoso; la ausencia de anomalías en el movimiento de la pared y de hipoperfusión del miocardio descarta una cardiopatía isquémica; la observación de realce tardío de gadolinio de tipo no isquémico en las capas epicárdicas-intramiocárdicas concuerda con la presencia de miocarditis. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
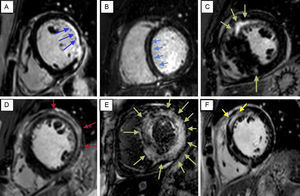
Patrones característicos del realce tardío de gadolinio que facilitan la diferenciación de diversas miocardiopatías. A: miocardiopatía isquémica. B: miocardiopatía no isquémica. C: miocardiopatía hipertrófica. D: miocarditis. E: amiloidosis. F: sarcoidosis. El realce tardío de gadolinio permite simplificar esta evaluación para abordar primero si se trata de una miocardiopatía isquémica o no isquémica; el patrón característico dell realce tardío de gadolinio isquémica afecta al subendocardio siempre (A muestra hiperrealce isquémico subendocárdico que afecta a los segmentos lateral medio y posterolateral del ventrículo izquierdo), con extensión variable desde las cicatrices que afectan a menos del 25% del grosor del miocardio hasta los infartos transmurales; una vez identificada como no isquémica un realce tardío de gadolinio concreta, hay algunas morfologías que apuntan a diferentes enfermedades. La presencia de una fibrosis intramiocárdica, que con frecuencia afecta a la parte media de la pared del tabique interventricular con una morfología longitudinal (estrías miocárdicas), indica miocardiopatía dilatada (B), aunque se observan también patrones epicárdicos, difusos y focales. La miocardiopatía hipertrófica (C) se manifiesta con frecuencia en un patrón moteado o confluente, por lo general limitado a los segmentos con mayor engrosamiento de la pared y los puntos de inserción del ventrículo derecho-ventrículo izquierdo. El realce tardío de gadolinio en la miocarditis (D) tiene una distribución regional no isquémica, con áreas de cicatrización focales subepicárdicas e intramiocárdicas. Los depósitos de amiloide en el interior del miocardio alteran significativamente la cinética del gadolinio, con lo que dan lugar a imágenes de un aspecto diferente que el realce tardío de gadolinio habitual. La incapacidad de anular el miocardio pese a emplear distintos tiempos de retraso de inversión o intensificación con contraste focal subendocárdica respalda claramente el diagnóstico de amiloidosis. Las áreas de cicatrización focales se observan a menudo en la sarcoidosis (F), en la que es característica una afección moteada de la parte media de la pared y subepicárdica, que a menudo afecta a la pared anteroseptal y anterolateral del ventrículo izquierdo y el ventrículo derecho.
Todas las secuencias de RTG que se utilizan en el ámbito clínico se basan en un principio común de adquisición de secuencias de gradiente-eco con potenciacion en T1, y difieren entre ellas en utilizar un único latido cardiaco («latido único») o dos para la adquisición de las imágenes. La ventaja de emplear el latido único es la rapidez, que permite la adquisición de una parte o incluso la totalidad de las pilas de cortes del eje corto en una única apnea, lo que agradecerán mucho los pacientes a los que resulte difícil tolerar la permanencia dentro de la cámara cilíndrica del escáner. Su inconveniente es la recuperación, frecuentemente incompleta, de la magnetización longitudinal (después del prepulso de inversión que es necesario para anular el miocardio), con la adición de un nuevo ángulo en cada inversión siguiente. Como consecuencia de ello, existe la posibilidad de que en el miocardio remoto la supresión sea insuficiente, de modo que aparezca en gris y con un contraste menos intenso con el tejido cicatrizal brillante, sobre todo en los pacientes con taquicardia. Mientras que parece improbable que esto pudiera afectar a la identificación de la cicatriz isquémica (con una captación alta de gadolinio y bien regionalizada), la observación de otras formas de RTG no isquémico sí puede verse comprometida. La adquisición durante dos latidos cardiacos a menudo proporciona un contraste impecable entre negro y blanco, pero a costa de aguantar la respiración durante más tiempo para cada corte y una adquisición más larga de las pilas de cortes únicos. Se puede preseleccionar estos dos tipos de obtención de imágenes o usarlos consecutivamente, en función de la probabilidad pretest de que haya una miocardiopatía isquémica o no isquémica; siempre se puede considerar la adición del RTG con dos latidos cardiacos para los casos en que parece probable o no se puede descartar con certeza la presencia de una cicatrización no isquémica después de las adquisiciones realizadas con un solo latido.
El RTG en la RMC aporta importante valor añadido respecto a otras modalidades de diagnóstico por imagen en el estudio de las enfermedades cardiovasculares. Aunque inicialmente se concibió para utilizarlo en la miocardiopatía isquémica, también permite diferenciar entre el miocardio disfuncionante pero viable (que tiene un potencial de recuperación funcional) y la cicatriz miocárdica (en la que no hay viabilidad alguna) con una exactitud casi equivalente a la de la histología14. La transmuralidad de la cicatriz isquémica puede usarse como guía para orientar la toma de decisiones respecto a una posible revascularización13,16, ya que aporta información sobre la viabilidad residual y la probabilidad de obtener un efecto beneficioso con la revascularización13,17,18. El empleo del RTG aporta también una visualización excelente de las complicaciones del infarto agudo de miocardio, incluidos los trombos del VI o la obstrucción microvascular (fenómeno de no reflujo) (figura 3). Ambas observaciones tienen repercusiones en la asistencia que se presta a los pacientes, por el tratamiento anticoagulante en el primer caso y por la intensificación del tratamiento antirremodelado en el segundo. La adquisición del mismo tipo de secuencias pero inmediatamente después de la administración del gadolinio (primer paso) con un retraso largo y fijo (> 400 ms) puede ser útil para delimitar mejor estos fenómenos.
El RTG proporciona también información sobre la etiología que subyace a la disfunción del miocardio. Los patrones del RTG sirven de base para diferenciar de manera fiable las miocardiopatías isquémicas de las no isquémicas19,20, así como los tipos específicos de las miocardiopatías no isquémicas21. De hecho, se han utilizado de manera ordinaria en el diagnóstico de diversas entidades, como miocarditis, miocardiopatía hipertrófica y dilatada, y enfermedades inflamatorias o de almacenamiento, basándose en los diferentes patrones de captación de contraste que pueden apuntar a la etiología de la cardiopatía existente (figura 4). La presencia de RTG no isquémico y su extensión están relacionadas también con la carga de lesión miocárdica irreversible existente y predicen el mal pronóstico de esas miocardiopatías15,22–25.
PERFUSIÓNLa perfusión en presencia de estrés farmacológico con vasodilatadores (adenosina o regadenosón) es el método diagnóstico no invasivo de elección ante la sospecha de isquemia miocárdica en pacientes con una probabilidad pretest intermedia o con una enfermedad conocida en los que la evidencia de isquemia respalda la conveniencia de una mayor intervención26. Se adquiere una serie dinámica de imágenes de gradiente-eco, potenciadas en T1, ultrarrápidas y adquiridas precozmente en el momento de la administración de gadolinio. Ello permite la visualización del primer paso del contraste en el miocardio (periodo de entrada o wash-in), que pone de manifiesto las áreas de perfusión miocárdica afectada por una estenosis arterial coronaria significativa. La perfusión en estrés farmacológico se realiza cada vez más de manera aislada, es decir, sin más análisis de la perfusión en reposo, puesto que la evidencia existente indica que la aportación diagnóstica de esta (junto con las imágenes de RTG, que proporcionan información completa de la fibrosis miocárdica27) resulta desdeñable. La perfusión en reposo, si se hace, debe realizarse después de la perfusión en estrés, y no en el orden inverso, ya que el gadolinio se acumula en las áreas de cicatriz, con la consiguiente intensificación (brillo), y ello dificulta la lectura de la hipoperfusión debida a la isquemia en esa zona. Se puede adquirir varios cortes en diferentes planos simultáneamente, incluidos al menos tres cortes en el eje corto y, opcionalmente, planos del eje largo en cada latido cardiaco para evaluar los 17 segmentos del VI1. La mayoría de las exploraciones de perfusión realizadas en la práctica clínica se evalúan visualmente y describen la hipoperfusión según la localización (correspondiente a un territorio de irrigación de una arteria coronaria), el número de segmentos afectados y la transmuralidad. Los métodos semicuantitativos y la cuantificación absoluta del flujo miocárdico continúan en estudio28.
La perfusión del miocardio en estrés es un método no invasivo muy bien validado y exacto para confirmar la presencia de isquemia miocárdica significativa29. Dicha técnica puede utilizarse para evaluar la reserva de perfusión del miocardio y permite detectar de manera fiable la enfermedad arterial coronaria angiográficamente significativa30 (sensibilidad, 88%; especificidad, 90%; exactitud diagnóstica, 89%) incluso en presencia de enfermedad de un solo vaso. El rendimiento diagnóstico de la RMC de perfusión comparada con la SPECT se ha evaluado en la práctica clínica real en varios ensayos prospectivos de alta calidad29,31,32, en los que se han utilizado tecnologías de múltiples proveedores y poblaciones con diferentes perfiles de riesgo y de enfermedad coronaria. A pesar de esta variabilidad, se obtuvieron resultados similares, que coincidieron con los de estudios previos; de tal manera que la RMC proporcionó un rendimiento diagnóstico superior al de la SPECT, principalmente gracias a su mayor sensibilidad, con una especificidad similar o inferior. Estos resultados fueron homogéneos en toda la población estudiada —incluida la que presentaba enfermedad de 1, 2 o 3 vasos— e independientes del valor de corte utilizado para definir la estenosis angiográficamente significativa. Lamentablemente, en estos ensayos no se incluyó una evaluación funcional de la estenosis coronaria, y la evaluación anatómica con la angiografía es un patrón de referencia imperfecto, lo cual podría conllevar resultados falsos positivos o falsos negativos de las pruebas funcionales. La RMC admite también comparación con la tomografía por emisión de positrones en lo que respecta al cálculo de la reserva de perfusión miocardica33, si bien ambas técnicas tienen una débil correlación y requieren nuevos perfeccionamientos.
Como alternativa a la perfusión de estrés con adenosina, la RM de estrés con dobutamina es una opción viable para la evaluación de la isquemia miocárdica, ya que detecta las anomalías del movimiento de la pared inducidas por el estrés. De hecho, el rendimiento diagnóstico de la RM de estrés con dobutamina es superior al de la exploración de estrés con adenosina34, y esta tiene potencia insuficiente para detectar anomalías del movimiento de la pared (tan solo en presencia de defectos de perfusión > 75%). La perfusión con adenosina tiene una sensibilidad excelente, que se alcanza a costa de una menor especificidad. No obstante, la RM de estrés con dobutamina conlleva mayor riesgo de efectos adversos, como arritmias ventriculares e hipotensión, y requiere la presencia física de un equipo muy experimentado y medios de apoyo vital avanzado.
Tiene gran importancia que ambas modalidades de exploración en estrés hayan mostrado un importante valor pronóstico, puesto que permiten diferenciar entre pacientes con riesgo bajo y riesgo alto de presentar eventos cardiacos, de tal manera que la supervivencia sin eventos a los 3 años de un resultado negativo de la RM de estrés con adenosina y dobutamina es > 99%35. Además, un resultado negativo en alguna de estas exploraciones en estrés aporta una importante información pronóstica respecto a los factores de riesgo clínicos clásicos. Sin embargo, la cuestión importante no es solo si hay isquemia o no, sino la cantidad de miocardio isquémico; además, la «carga isquémica»36 tiene un papel clave en la evolución clínica. Para evaluar el pronóstico se han utilizado diferentes umbrales de corte basados en las distintas técnicas de diagnóstico por la imagen, pero una revisión reciente indica que 4 o más de 32 defectos de perfusión en estrés o 3 o más de 16 segmentos disfuncionales inducidos por la dobutamina implican un riesgo anual de muerte cardiaca o infarto de miocardio de aproximadamente un 5%37.
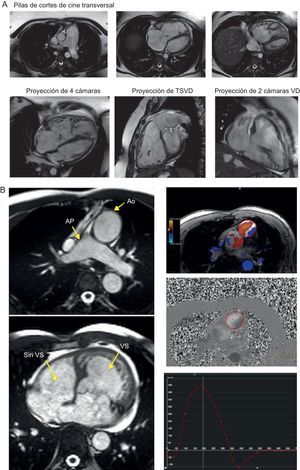
SECUENCIAS PARA PROTOCOLOS ESPECIALESEvaluación del corazón derechoSe utilizan otras imágenes adicionales para visualizar estructuras del corazón derecho en indicaciones especiales, como las de los adultos con una cardiopatía congénita o hipertensión pulmonar, y ello incluye las pilas adicionales de cortes transversales, el tracto de salida del ventrículo derecho y la proyección de dos cámaras del ventrículo derecho (figura 5). Aunque las pilas de cortes transversales son el modo principal de obtención de imágenes de pacientes adultos con cardiopatías congénitas, la adquisicion de volúmenes tridimensionales de imágenes estáticas obtenidas de secuencias equilibradas en telediástole (sin necesidad de medios de contraste) son útiles también para facilitar la visualización exacta de la morfología y las relaciones anatómicas existentes entre los grandes vasos y el corazón. Con frecuencia se prefieren estas técnicas a las angiografías de RM convencionales con contraste, sobre todo en la población pediátrica, ya que permiten inspeccionar las relaciones existentes entre los vasos y las estructuras torácicas frente a la simple delimitación de los vasos que se obtienen mediante la opacificación con medio de contraste en fase arterial (figura 6). Aunque la magnitud de los cortocircuitos cardiacos puede evaluarse mediante la comparación de los volúmenes latido de cada ventrículo, el cociente Qp:Qs puede determinarse con exactitud mediante mediciones del flujo en el plano transversal de los grandes vasos empleando secuencias de mapas de velocidad de contraste de fase. Esta secuencia utiliza la diferencia de la fase de los spins estacionarios y no estacionarios para determinar el perfil de flujo a lo largo de todo un ciclo cardiaco, así como la diferencia de fase de los spins que se mueven con diferentes velocidades. Esta técnica permite también medir la estenosis y la insuficiencia valvulares, y su uso en la valvulopatía aórtica y pulmonar es más uniforme y está mejor validado que su empleo en la valvulopatía mitral y tricuspídea.
Evaluación del corazón derecho. A partir de las proyecciones cardiacas básicas, se puede planificar proyecciones específicas para una evaluación más detallada de las cámaras cardiacas derechas, de capital importancia en los trastornos que afectan al ventrículo derecho como las cardiopatías congénitas o la hipertensión pulmonar. A: ejemplo de hipertensión pulmonar; un juego de imágenes de cine transversales (un plano axial que incluye la totalidad del ventrículo derecho y la arteria pulmonar) permite visualizar con facilidad las estructuras apicales derechas en la transición del tracto de salida del ventrículo derecho a la arteria pulmonar; las proyecciones de cuatro cámaras, del tracto de salida del ventrículo derecho y dos cámaras del ventrículo derecho resultan de especial utilidad para la evaluación de las anomalías del movimiento de la pared regional en la pared libre del ventrículo derecho en la miocardiopatía arritmogénica ventricular derecha y la cardiopatía congénita. B: ejemplo de transposición de grandes vasos congénita corregida; es posible obtener rápidamente imágenes de contraste de fase del flujo aórtico y pulmonar, lo cual permite calcular los volúmenes sistólicos, la regurgitación aórtica/pulmonar y el Qp:Qs para determinar la presencia de un cortocircuito. Ao: aorta; AP arteria pulmonar; TSVD: tracto de salida del ventrículo derecho; VD: ventrículo derecho; VS: volumen sistólico.
Angiografía por resonancia magnética con contraste de la aorta descendente de un paciente adulto con coartación aórtica (flechas amarillas) y flujo colateral eyectado a través de las arterias mamarias internas (flechas rojas). Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Una pila de cortes transversales contiguos obtenidos de secuencias equilibradas es el primer paso para una visualización detallada. Una vez se ha identificado la estructura de interés y se han esclarecido sus relaciones regionales, la caracterización del tejido puede aportar información adicional. Convencionalmente se puede usar secuencias de spin eco en T1 y T2 con supresión de la grasa, así como perfusión de primer paso y RTG (vascularidad y fibrosis). Las secuencias de sangre negra en T1 y T2 tienen múltiples inconvenientes, como los artefactos producidos por flujo sanguíneo lento, flujo oblicuo o supresión insuficiente de la señal de la sangre, así como los artefactos de movimiento debidos a los tiempos de adquisición largos. Por lo que respecta a la información adicional, el aporte de las secuencias de T1 y T2 a la caracterización del tejido (en comparación con las imágenes de cine, perfusión y RTG) en las masas cardiacas tiende a ser mínima, y ello limita el empleo de estas secuencias basadas en abordajes tradicionales.
Técnicas cuantitativas tisulares modernas (mapas tisulares)En los pacientes a los que se administran transfusiones de sangre, una adquisición en apnea potenciada en T2* permite obtener información sobre la sobrecarga de hierro en el miocardio y relacionarla con el riesgo de eventos adversos, y es el primer método que ha realizado con éxito la cuantificación no invasiva de esta sobrecarga mediante técnicas de imagen. La evidencia que está surgiendo respecto a la cuantificación de la relajación del tejido miocárdico mediante mapeo de T1 y T238–40 es prometedora en lo que respecta al estudio de la afección difusa del miocardio, como la fibrosis y la inflamación, lo que tiene trascendencia ante la escasez de opciones de tratamiento en las miocardiopatías no isquémicas41. En un considerable número de estas enfermedades, el músculo cardiaco está afectado de manera difusa y con afección miocárdica en progresión continua. Estas técnicas de imagen permiten la cuantificación de, respectivamente, la recuperación o la pérdida de magnetización en el tejido miocárdico, que está alterada en la enfermedad. Las mediciones de las masas en T1 pueden proporcionar índices clínicamente útiles, como el T1 nativo, el T1 poscontraste y un coeficiente de partición corregido con el hematocrito, la fracción de volumen extracelular. Para calcularla, es preciso obtener una muestra de sangre para determinar el hematocrito en el momento de la exploración42. Para estas mediciones se ha descrito el empleo de diversos tipos de secuencias, que tienen fortalezas y limitaciones, dadas por la adquisición y el posprocesado, en cuanto a exactitud y precisión de las mediciones en T1 y la exactitud diagnóstica de diversos trastornos cardiacos. Hasta el momento, la evidencia existente revela que los índices de mapeo de T1 reflejan el miocardio anormal en diversas enfermedades cardiacas42 y están relacionados con índices de la función sistólica y diastólica del miocardio43,44. La evidencia acumulada indica que los índices de mapeo de T1 podrían ser útiles para detectar enfermedad miocárdica difusa y complementar el RTG como instrumento para el estudio de la enfermedad miocárdica regional.
CONCLUSIONESLa RMC aporta una exhaustiva evaluación morfológica y funcional del corazón. En la mayoría de los casos, se puede alcanzar un abordaje básico orientado a responder preguntas clínicas clave con un estudio de la función ventricular izquierda y RTG, a lo que puede añadirse un protocolo de perfusión. Esta aproximación permite una evaluación rápida y facilitará la generalización de esta técnica fuera de los centros especializados, que generalmente están centrados en la investigación. La capacidad de la técnica para la caracterización de los tejidos proporciona información adicional e importante en las miocardiopatías, con un futuro prometedor de las nuevas técnicas de mapeo.
CONFLICTO DE INTERESESV.O. Puntmann tiene un acuerdo de consultoría con Circle Cardiovascular Imaging Ltd. para la elaboración de material de formación.
Los autores desean agradecer al Prof. Eike Nagel (Department of Cardiovascular Imaging, Goethe University, Frankfurt) por ofrecer su punto de vista y las recomendaciones proporcionadas y al Dr. Eltjo Haselhof (Philips Healthcare) por sus esfuerzos para facilitar esquemas de diagnóstico por imagen concisos para la práctica clínica contemporánea de la RMC.