La evidencia sobre los resultados de la intervención y la evolución clínica de los pacientes tratados con armazones bioabsorbibles solapados en comparación con los tratados con stents liberadores de everolimus solapados es escasa. Se evalúan los resultados de pacientes tratados con armazones solapados frente a los tratados con stents liberadores de everolimus emparejados por puntuación de propensión.
MétodosTras aparearlos por puntuación de propensión, se incluyó en este estudio a 70 pacientes consecutivos con angina estable tratados con armazones bioabsorbibles solapados y 70 pacientes tratados con stents liberadores de everolimus de nueva generación. El objetivo principal fue la tasa a 1 año de eventos adversos cardiovasculares mayores, definidos como el conjunto de muerte por cualquier causa, infarto de miocardio no asociado a la intervención y revascularización del vaso diana.
ResultadosLos pacientes de los 2 grupos tenían características similares en cuanto a edad (grupo de armazones bioabsorbibles frente a grupo de stents, 64,5 ± 10,3 frente a 66 ± 9,7 años; p = 0,381), sexo, diabetes mellitus, antecedentes cardiovasculares y puntuación SYNTAX (armazón frente a stent, 18,6 ± 9,2 frente a 19,4 ± 10,4; p = 0,635). La ganancia aguda tras la intervención fue significativamente menor en los pacientes tratados con armazones bioabsorbibles (1,82 ± 0,66 frente a 2,03 ± 0,68 mm; p = 0,033). En el seguimiento a 1 año, la tasa de eventos adversos cardiovasculares mayores estimada no mostró diferencias significativas entre los 2 grupos (el 14,5 y el 14,6%; plog-rank = 0,661). De manera análoga, no se observaron diferencias significativas en las tasas a 1 año de revascularización del vaso diana (el 14,5 y el 10%; plog-rank = 0,816) o de revascularización de lesión diana (el 9,7 y el 8,3%; plog-rank = 0,815).
ConclusionesEl tratamiento de lesiones largas con el uso de armazones bioabsorbibles solapados es viable y proporciona unos resultados a 1 año aceptables.
Palabras clave
La experiencia inicial con el implante de un armazón bioabsorbible (ABA) en lesiones de novo simples ha sido prometedora, con unos resultados a largo plazo aceptables en la cohorte A del estudio ABSORB1. El estudio ABSORB2, en el que se utilizaron múltiples técnicas de imagen, puso de manifiesto una pérdida luminal tardía inalterada tras el primer año siguiente al implante del Absorb v1.1, mientras que en la ecografía intravascular (IVUS), la media de la luz, el armazón y el área vascular mostraron un agrandamiento hasta los 2 años.
A pesar de que los datos aleatorizados que están apareciendo3–8 indican resultados angiográficos y clínicos a medio plazo similares entre los pacientes tratados con ABA y los tratados con stents liberadores de everolimus (SLE) de nueva generación, los estudios realizados en la práctica clínica real han mostrado algunos indicios preocupantes de aumento de la tasa de trombosis en el armazón de los pacientes tratados con ABA. Las tasas de trombosis en el armazón a los 6 meses del 3,0, el 2,2 y el 2,1% indicadas por los registros AMC, BVS EXPAND y GHOST-EU9, respectivamente, no pueden considerarse desdeñables y se han propuesto varios posibles mecanismos para explicar la trombosis en el armazón bioabsorbible, uno de los cuales hace referencia a los segmentos solapados. En estudios previos en modelos porcinos10 se observó una reducción de la cobertura endotelial en los struts de ABA apilados 28 días después del implante, lo cual indicaba un posible sustrato para la trombosis en el stent y la futura revascularización de la lesión diana (RLD).
El objetivo del presente estudio es evaluar los resultados de la intervención (ganancia aguda, éxito angiográfico y éxito de la intervención) y clínicos a medio plazo en pacientes con angina estable tratados con intervención coronaria percutánea utilizando solapamiento de ABA o SLE de nueva generación.
MÉTODOSSe trató a un total de 590 pacientes con angina estable en el EMO GVM Centro Cuore Columbus de Milán (Italia) con ABA (Absorb v1.1, Abbott Vascular; Santa Clara, California, Estados Unidos), entre mayo de 2012 y julio de 2014, o con SLE de polímero duradero de nueva generación (XIENCE Prime de Abbott Vascular o Promus Element de Boston Scientific; Natick, Massachusetts, Estados Unidos) entre mayo de 2011 y julio de 2014. De ellos, se trató a 219 con ABA y a 371 con SLE de nueva generación. Aparte de la preferencia de los pacientes de nuestra población, no se utilizó ningún criterio de selección especial para implantar ABA o SLE. Se consideró que un diámetro del vaso de referencia > 4,2 o < 2,5 mm impedía el implante de un ABA. Se identificaron como lesiones con solapamiento (figuras 1 y 2) las que requerían el implante de al menos 2 stents/ABA solapados, con la exclusión de las lesiones de bifurcación tratadas con una estrategia de uso de 2 stents/ABA. Otros criterios de exclusión fueron los antecedentes de síndrome coronario agudo (SCA) y la insuficiencia renal terminal (con hemodiálisis).
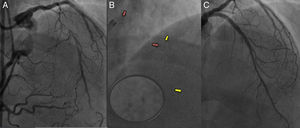
Armazones bioabsorbibles (ABA) con solapamiento en el segmento proximal y medio, en un paciente joven con una oclusión total distal de la descendente anterior izquierda. A: descendente anterior izquierda con llenado retrógrado a partir de colaterales procedentes de la coronaria derecha distal; segmento largo de oclusión total crónica observada en el segmento ostial-proximal. B: después de una preparación agresiva de la lesión, se implantaron dos ABA (Absorb 3,5 × 18 mm) en los segmentos ostial-proximal y medio, con un solapamiento mínimo; los marcadores de platino del ABA proximal se indican con las flechas rojas, mientras que los del segmento medio se señalan con flechas amarillas; en el segmento con solapamiento, se puede ver el marcador de platino distal del ABA proximal y el marcador de platino proximal del ABA distal lado a lado (círculo agrandado). C: resultado final tras la posdilatación del ABA del segmento proximal-medio y balón de liberación de medicación en el segmento distal. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
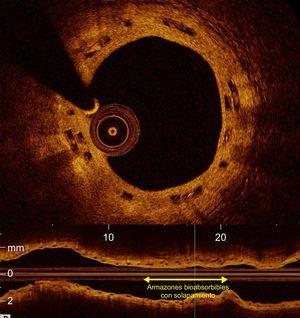
Tomografía de coherencia óptica (imágenes transversal y longitudinal) de un paciente tratado con armazones bioabsorbibles con solapamiento (solapamiento de ∼15 mm) en el seguimiento a 2 años. Se puede observar los struts de los armazones apilados uno sobre otro (recuadros negros) y totalmente cubiertos por neoíntima. En el corte longitudinal, se muestra la longitud del solapamiento con la flecha amarilla. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Se incluyó en el análisis a un total de 109 pacientes con angina estable tratados con ABA solapados y a 149 pacientes tratados con SLE de nueva generación solapados. Todos los pacientes dieron su consentimiento informado por escrito, según lo establecido en la Declaración de Helsinki. Todos los datos clínicos del seguimiento de todos los pacientes se obtuvieron en visitas hospitalarias o consultas telefónicas.
Todos los pacientes recibieron tratamiento previo con ácido acetilsalicílico y clopidogrel, ticagrelor o prasugrel, y se les indicó que continuaran con el tratamiento antiagregante plaquetario combinado doble como mínimo durante 1 año. Un operador experto realizó mediciones offline mediante angiografía coronaria cuantitativa, con un sistema de detección de bordes validado (CMS, versión 5.2, Medis Medical Imaging Systems BV; Leiden, Países Bajos), y determinó el diámetro luminal mínimo previo y posterior a la intervención y el porcentaje de estenosis del diámetro en situación basal. La ganancia aguda con stent/ABA se definió como la diferencia de diámetro luminal mínimo entre antes y después de la intervención. El solapamiento del stent se definió por la presencia de al menos 2 stents en una única lesión tratada, según lo determinado mediante la angiografía coronaria cuantitativa11. En los pacientes que presentaron una RLD, se identificaron las zonas de solapamiento de stents mediante la posición de los marcadores de balón del segundo stent respecto al primero. Específicamente, los segmentos solapados se consideraron armazones/stents adyacentes (solapamiento < 1 mm), de solapamiento mínimo (1-2 mm) o de solapamiento completo (solapamiento > 2 mm). Se utilizó IVUS en la mayoría de los casos de ABA, con objeto de verificar la expansión y la aposición del ABA. El uso considerablemente alto de IVUS en los pacientes con SLE refleja la complejidad de las lesiones tratadas (lesiones calcificadas, reestenosis en el stent, bifurcaciones, etc.).
Además, las lesiones con RLD se clasificaron según la clasificación de Mehran12. La calcificación angiográficamente moderada/intensa se definió por las radioopacidades observadas con o sin el movimiento cardiaco antes de la inyección del contraste, que comprometían generalmente ambos lados de la luz arterial13,14. Se calculó prospectivamente la puntuación SYNTAX en todos los pacientes13. El éxito angiográfico se definió por una estenosis mínima < 20% del diámetro, con un flujo TIMI 3 sin oclusión de una rama lateral significativa, disección limitante del flujo, embolización distal ni signos angiográficos de presencia de trombo. El éxito de la intervención se definió por la combinación de éxito angiográfico y ausencia de complicaciones clínicas mayores durante la hospitalización (es decir, muerte, infarto de miocardio [IM], ictus o cirugía de revascularización aortocoronaria [CABG] de urgencia)15. La definición de IM periintervención (IMP) fue similar a la utilizada en el estudio de Vranckx et al16.
El objetivo principal fue la tasa a 1 año de eventos cardiovasculares adversos mayores (MACE), definidos como la combinación de mortalidad por cualquier causa, IM no asociado a la intervención y revascularización del vaso diana (RVD). Los objetivos secundarios fueron los resultados de la intervención (ganancia aguda, éxito angiográfico y éxito de la intervención), la RLD y la RVD. La RVD se definió como una nueva revascularización del vaso diana y la RLD, como una nueva revascularización del segmento en el que se había implantado un stent o a una distancia máxima de 5 mm del borde del stent. El IM agudo en el seguimiento, no asociado a la intervención, se definió según lo indicado en las guías actuales17. La trombosis del stent se clasificó según la definición del Academic Research Consortium18.
Análisis estadísticoSe evaluó la normalidad de todas las variables continuas mediante la prueba de Kolmogorov-Smirnov. Las variables continuas se presentan en forma de media ± desviación estándar o mediana [intervalo intercuartílico] según las variables sean de distribución normal o no normal respectivamente. Las diferencias entre las cohortes totales en cuanto a las variables continuas se analizaron con la prueba de la t de Student o la U de Mann-Whitney.
Con objeto de reducir el sesgo de selección y otros factores de confusión basales en este estudio retrospectivo, se utilizó un emparejamiento mediante la puntuación de propensión (ABA:SLE, 1:1). Las puntuaciones de propensión se estimaron con un modelo de regresión logística multivariable no limitado, con la intervención percutánea mediante ABA o SLE como variable dependiente y las siguientes características angiográficas y del paciente como covariables (consideradas predictores de MACE clínicamente importantes): edad, sexo, diabetes mellitus, IM previo, intervención coronaria percutánea previa, CABG previa, puntuación SYNTAX y longitud total del stent. El apareamiento se realizó usando un protocolo de igualación 1:1 sin sustitución (algoritmo de igualación voraz [greedy]), con una amplitud de 0,2 para la desviación estándar de la puntuación logit de la puntuación de propensión. Tras igualar mediante la puntuación de propensión, todas las diferencias estandarizadas para cada una de las variables basales fueron < 0,10 (10%). Después de la igualación por propensión, se analizaron las diferencias de las variables continuas utilizando la prueba de la t para datos emparejados. Las variables discretas se expresan en forma de valores numéricos y porcentajes. Los datos de este tipo de variables se compararon con la prueba de la χ2 o la exacta de Fisher (cohorte total) o con la prueba de McNemar (cohorte igualada según la puntuación de propensión). Se determinaron los valores de incidencia acumulada empleando un análisis de Kaplan-Meier y se evaluó la significación de las diferencias observadas aplicando el test de log rank (cohorte total) o empleando un modelo de regresión de riesgos proporcionales de Cox, que se estratificó según los pares igualados con objeto de preservar el beneficio aportado por la igualación (cohorte igualada según la puntuación de propensión).
Todos los valores de p presentados fueron bilaterales, y se consideraron estadísticamente significativos los valores de p < 0,05. El análisis se llevó a cabo con el programa SPSS (versión 21.0, IBM Corp.; Armonk, Nueva York, Estados Unidos).
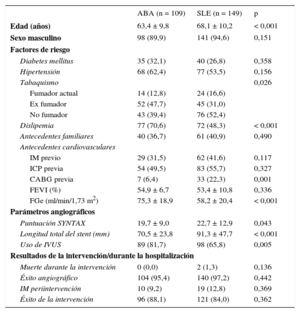
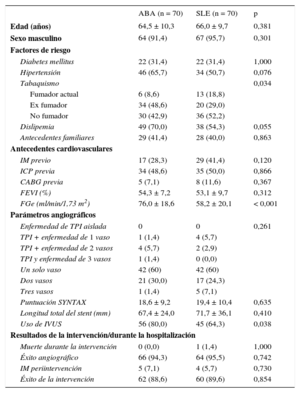
RESULTADOSCaracterísticas basalesCaracterísticas demográficas de los pacientesLas características basales de la cohorte global tratada con dispositivos solapados se presentan en la tabla 1. De esta cohorte, se emparejó mediante igualación 1:1 a 70 pacientes tratados con ABA y 70 pacientes tratados con SLE. Las características basales de la cohorte igualada según la puntuación de propensión se presentan en la tabla 2. Ninguna de las variables igualadas según la puntuación de propensión mostró diferencia significativa alguna entre los 2 grupos. Los pacientes tratados con ABA eran con mayor frecuencia ex fumadores, mientras que los tratados con SLE tenían un filtrado glomerular estimado significativamente inferior (tabla 2). Tenía enfermedad de un solo vaso el 60% de los pacientes de ambos grupos. Se utilizó IVUS con más frecuencia en los pacientes tratados con ABA.
Características basales de la cohorte total
| ABA (n = 109) | SLE (n = 149) | p | |
|---|---|---|---|
| Edad (años) | 63,4 ± 9,8 | 68,1 ± 10,2 | < 0,001 |
| Sexo masculino | 98 (89,9) | 141 (94,6) | 0,151 |
| Factores de riesgo | |||
| Diabetes mellitus | 35 (32,1) | 40 (26,8) | 0,358 |
| Hipertensión | 68 (62,4) | 77 (53,5) | 0,156 |
| Tabaquismo | 0,026 | ||
| Fumador actual | 14 (12,8) | 24 (16,6) | |
| Ex fumador | 52 (47,7) | 45 (31,0) | |
| No fumador | 43 (39,4) | 76 (52,4) | |
| Dislipemia | 77 (70,6) | 72 (48,3) | < 0,001 |
| Antecedentes familiares | 40 (36,7) | 61 (40,9) | 0,490 |
| Antecedentes cardiovasculares | |||
| IM previo | 29 (31,5) | 62 (41,6) | 0,117 |
| ICP previa | 54 (49,5) | 83 (55,7) | 0,327 |
| CABG previa | 7 (6,4) | 33 (22,3) | 0,001 |
| FEVI (%) | 54,9 ± 6,7 | 53,4 ± 10,8 | 0,336 |
| FGe (ml/min/1,73 m2) | 75,3 ± 18,9 | 58,2 ± 20,4 | < 0,001 |
| Parámetros angiográficos | |||
| Puntuación SYNTAX | 19,7 ± 9,0 | 22,7 ± 12,9 | 0,043 |
| Longitud total del stent (mm) | 70,5 ± 23,8 | 91,3 ± 47,7 | < 0,001 |
| Uso de IVUS | 89 (81,7) | 98 (65,8) | 0,005 |
| Resultados de la intervención/durante la hospitalización | |||
| Muerte durante la intervención | 0 (0,0) | 2 (1,3) | 0,136 |
| Éxito angiográfico | 104 (95,4) | 140 (97,2) | 0,442 |
| IM periintervención | 10 (9,2) | 19 (12,8) | 0,369 |
| Éxito de la intervención | 96 (88,1) | 121 (84,0) | 0,362 |
ABA: armazón bioabsorbible; CABG: cirugía de revascularización aortocoronaria; FEVI: fracción de eyección del ventrículo izquierdo; FGe: filtrado glomerular estimado; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IVUS: ecografía intravascular; SLE: stent liberador de everolimus.
Los valores expresan n (%) o media ± desviación estándar.
Características basales de los grupos igualados por puntuación de propensión
| ABA (n = 70) | SLE (n = 70) | p | |
|---|---|---|---|
| Edad (años) | 64,5 ± 10,3 | 66,0 ± 9,7 | 0,381 |
| Sexo masculino | 64 (91,4) | 67 (95,7) | 0,301 |
| Factores de riesgo | |||
| Diabetes mellitus | 22 (31,4) | 22 (31,4) | 1,000 |
| Hipertensión | 46 (65,7) | 34 (50,7) | 0,076 |
| Tabaquismo | 0,034 | ||
| Fumador actual | 6 (8,6) | 13 (18,8) | |
| Ex fumador | 34 (48,6) | 20 (29,0) | |
| No fumador | 30 (42,9) | 36 (52,2) | |
| Dislipemia | 49 (70,0) | 38 (54,3) | 0,055 |
| Antecedentes familiares | 29 (41,4) | 28 (40,0) | 0,863 |
| Antecedentes cardiovasculares | |||
| IM previo | 17 (28,3) | 29 (41,4) | 0,120 |
| ICP previa | 34 (48,6) | 35 (50,0) | 0,866 |
| CABG previa | 5 (7,1) | 8 (11,6) | 0,367 |
| FEVI (%) | 54,3 ± 7,2 | 53,1 ± 9,7 | 0,312 |
| FGe (ml/min/1,73 m2) | 76,0 ± 18,6 | 58,2 ± 20,1 | < 0,001 |
| Parámetros angiográficos | |||
| Enfermedad de TPI aislada | 0 | 0 | 0,261 |
| TPI + enfermedad de 1 vaso | 1 (1,4) | 4 (5,7) | |
| TPI + enfermedad de 2 vasos | 4 (5,7) | 2 (2,9) | |
| TPI y enfermedad de 3 vasos | 1 (1,4) | 0 (0,0) | |
| Un solo vaso | 42 (60) | 42 (60) | |
| Dos vasos | 21 (30,0) | 17 (24,3) | |
| Tres vasos | 1 (1,4) | 5 (7,1) | |
| Puntuación SYNTAX | 18,6 ± 9,2 | 19,4 ± 10,4 | 0,635 |
| Longitud total del stent (mm) | 67,4 ± 24,0 | 71,7 ± 36,1 | 0,410 |
| Uso de IVUS | 56 (80,0) | 45 (64,3) | 0,038 |
| Resultados de la intervención/durante la hospitalización | |||
| Muerte durante la intervención | 0 (0,0) | 1 (1,4) | 1,000 |
| Éxito angiográfico | 66 (94,3) | 64 (95,5) | 0,742 |
| IM periintervención | 5 (7,1) | 4 (5,7) | 0,730 |
| Éxito de la intervención | 62 (88,6) | 60 (89,6) | 0,854 |
ABA: armazón bioabsorbible; CABG: cirugía de revascularización aortocoronaria; FEVI: fracción de eyección del ventrículo izquierdo; FGe: filtrado glomerular estimado; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IVUS: ecografía intravascular; SLE: stent liberador de everolimus; TPI: tronco principal de la coronaria izquierda.
Los valores expresan n (%) o media ± desviación estándar.
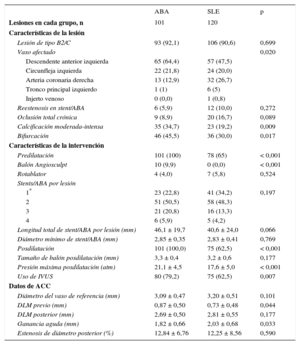
Las tasas de lesiones de tipo B2/C fueron similares en ambos grupos (tabla 3). La arteria descendente anterior izquierda se trató con más frecuencia en el grupo de ABA que en el de SLE, mientras que la arteria coronaria derecha se trató con más frecuencia en el grupo de SLE. Hubo una tasa significativamente superior de lesiones calcificadas y lesiones de bifurcación en los pacientes tratados con ABA, mientras que se observó una tendencia a tasas de oclusiones totales crónicas y reestenosis en el stent más altas en el grupo de SLE (tabla 3). Las puntuaciones SYNTAX fueron similares en ambos grupos (tabla 2). Se aplicó con mayor frecuencia predilatación (con balones convencionales y balones scoring) y posdilatación a los pacientes tratados con ABA (tabla 3). De las 101 lesiones tratadas del grupo de ABA, 78 correspondieron a segmentos con solapamiento, mientras que de las 120 lesiones del grupo de SLE, 79 fueron en segmentos con solapamiento (tabla 3).
Características de la lesión y de la intervención en los grupos igualados por puntuación de propensión
| ABA | SLE | p | |
|---|---|---|---|
| Lesiones en cada grupo, n | 101 | 120 | |
| Características de la lesión | |||
| Lesión de tipo B2/C | 93 (92,1) | 106 (90,6) | 0,699 |
| Vaso afectado | 0,020 | ||
| Descendente anterior izquierda | 65 (64,4) | 57 (47,5) | |
| Circunfleja izquierda | 22 (21,8) | 24 (20,0) | |
| Arteria coronaria derecha | 13 (12,9) | 32 (26,7) | |
| Tronco principal izquierdo | 1 (1) | 6 (5) | |
| Injerto venoso | 0 (0,0) | 1 (0,8) | |
| Reestenosis en stent/ABA | 6 (5,9) | 12 (10,0) | 0,272 |
| Oclusión total crónica | 9 (8,9) | 20 (16,7) | 0,089 |
| Calcificación moderada-intensa | 35 (34,7) | 23 (19,2) | 0,009 |
| Bifurcación | 46 (45,5) | 36 (30,0) | 0,017 |
| Características de la intervención | |||
| Predilatación | 101 (100) | 78 (65) | < 0,001 |
| Balón Angiosculpt | 10 (9,9) | 0 (0,0) | < 0,001 |
| Rotablator | 4 (4,0) | 7 (5,8) | 0,524 |
| Stents/ABA por lesión | |||
| 1* | 23 (22,8) | 41 (34,2) | 0,197 |
| 2 | 51 (50,5) | 58 (48,3) | |
| 3 | 21 (20,8) | 16 (13,3) | |
| 4 | 6 (5,9) | 5 (4,2) | |
| Longitud total de stent/ABA por lesión (mm) | 46,1 ± 19,7 | 40,6 ± 24,0 | 0,066 |
| Diámetro mínimo de stent/ABA (mm) | 2,85 ± 0,35 | 2,83 ± 0,41 | 0,769 |
| Posdilatación | 101 (100,0) | 75 (62,5) | < 0,001 |
| Tamaño de balón posdilatación (mm) | 3,3 ± 0,4 | 3,2 ± 0,6 | 0,177 |
| Presión máxima posdilatación (atm) | 21,1 ± 4,5 | 17,6 ± 5,0 | < 0,001 |
| Uso de IVUS | 80 (79,2) | 75 (62,5) | 0,007 |
| Datos de ACC | |||
| Diámetro del vaso de referencia (mm) | 3,09 ± 0,47 | 3,20 ± 0,51 | 0,101 |
| DLM previo (mm) | 0,87 ± 0,50 | 0,73 ± 0,48 | 0,044 |
| DLM posterior (mm) | 2,69 ± 0,50 | 2,81 ± 0,55 | 0,177 |
| Ganancia aguda (mm) | 1,82 ± 0,66 | 2,03 ± 0,68 | 0,033 |
| Estenosis de diámetro posterior (%) | 12,84 ± 6,76 | 12,25 ± 8,56 | 0,590 |
ABA: armazón bioabsorbible; ACC: angiografía coronaria cuantitativa; DLM: diámetro luminal mínimo; IVUS: ecografía intravascular; SLE: stent liberador de everolimus.
La ganancia aguda tras la intervención fue significativamente menor para los pacientes tratados con ABA (1,82 ± 0,66 frente a 2,03 ± 0,68; p = 0,033). Las tasas de éxito angiográfico fueron similares en los 2 grupos (ABA frente a SLE, el 94,3 frente al 95,5%; p = 0,742). La prevalencia de IMP también fue similar (el 7,1 frente al 5,7%; p = 0,73), al igual que ocurrió con las tasas de éxito de la intervención (el 88,6 frente al 89,9%; p = 0,854).
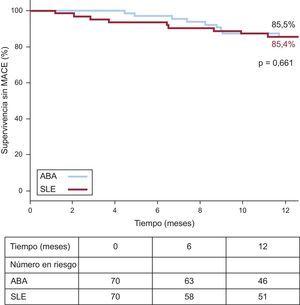
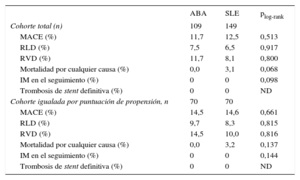
Resultados clínicos en la cohorte igualada según la puntuación de propensiónLos resultados clínicos obtenidos en la cohorte total de pacientes tratados con solapamiento se presentan en la tabla 4. La media de tiempo de seguimiento de los pacientes a los que se implantó ABA fue 14,6 ± 6,3 meses, mientras que el de los pacientes tratados con SLE fue 25,3 ± 18 meses (p < 0,001). En la cohorte igualada por puntuación de propensión, en el seguimiento a 1 año la tasa estimada de MACE (figura 3) no mostró diferencias significativas entre los 2 grupos (ABA frente a SLE, el 14,5 y el 14,6%; plog-rank = 0,661). De manera análoga, no se apreciaron diferencias significativas en las tasas a 1 año de RVD (el 14,5 frente al 10%; plog-rank = 0,816), RLD (el 9,7 frente al 8,3%; plog-rank = 0,815), IM en el seguimiento (0 frente a 0; plog-rank = 0,144) o mortalidad por cualquier causa (0 frente al 3,2%; plog-rank = 0,137). No se observó ningún caso de trombosis definitiva del stent, mientras que hubo 1 caso de probable trombosis del stent en el grupo de SLE 40 días después de implantarse el stent (muerte súbita). El análisis de la RLD a 1 año para las lesiones con solapamiento en la cohorte igualada por puntuación de propensión no mostró diferencias significativas (ABA, el 7,4 frente al 7,6%; plog-rank = 0,935).
Estimación de Kaplan-Meier de los resultados clínicos a 1 año en la cohorte total y la igualada por puntuación de propensión
| ABA | SLE | plog-rank | |
|---|---|---|---|
| Cohorte total (n) | 109 | 149 | |
| MACE (%) | 11,7 | 12,5 | 0,513 |
| RLD (%) | 7,5 | 6,5 | 0,917 |
| RVD (%) | 11,7 | 8,1 | 0,800 |
| Mortalidad por cualquier causa (%) | 0,0 | 3,1 | 0,068 |
| IM en el seguimiento (%) | 0 | 0 | 0,098 |
| Trombosis de stent definitiva (%) | 0 | 0 | ND |
| Cohorte igualada por puntuación de propensión, n | 70 | 70 | |
| MACE (%) | 14,5 | 14,6 | 0,661 |
| RLD (%) | 9,7 | 8,3 | 0,815 |
| RVD (%) | 14,5 | 10,0 | 0,816 |
| Mortalidad por cualquier causa (%) | 0,0 | 3,2 | 0,137 |
| IM en el seguimiento (%) | 0 | 0 | 0,144 |
| Trombosis de stent definitiva (%) | 0 | 0 | ND |
ABA: armazón bioabsorbible; IM: infarto de miocardio; MACE: eventos cardiovasculares adversos mayores (muerte, IM y RVD); ND: no disponible; RLD: revascularización de lesión diana; RVD: revascularización de vaso diana; SLE: stent liberador de everolimus.
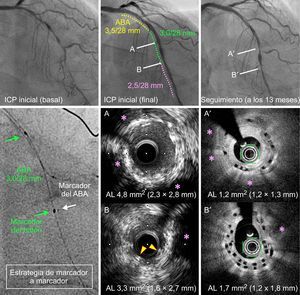
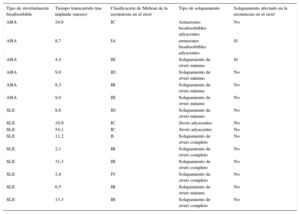
En la tabla 5 se presenta la clasificación de Mehran12 de cada una de las lesiones de reestenosis de los 2 grupos. Entre los pacientes con un seguimiento angiográfico (grupo de ABA, 6 de 70; grupo de SLE, 9 de 70), hubo afección del solapamiento en 2 pacientes con reestenosis en el stent de ABA (figura 4) y en ninguno de los pacientes tratados con SLE (el 33,3% frente a 0; p = 0,063), a pesar de la prevalencia muy superior del solapamiento completo entre los pacientes con RLD del grupo de SLE (el 55,5% frente a 0; p = 0,025).
Características de la reestenosis en el stent/armazón bioabsorbible en la revascularización de lesión diana y tipo de solapamiento
| Tipo de stent/armazón bioabsorbible | Tiempo transcurrido tras implante (meses) | Clasificación de Mehran de la reestenosis en el stent | Tipo de solapamiento | Solapamiento afectado en la reestenosis en el stent |
|---|---|---|---|---|
| ABA | 24,6 | IC | Armazones bioabsorbibles adyacentes | No |
| ABA | 8,7 | IA | armazones bioabsorbibles adyacentes | Sí |
| ABA | 4,4 | III | Solapamiento de struts mínimo | Sí |
| ABA | 9,0 | ID | Solapamiento de struts mínimo | No |
| ABA | 8,3 | IB | Solapamiento de struts mínimo | No |
| ABA | 9,0 | III | Solapamiento de struts mínimo | No |
| SLE | 8,6 | ID | Solapamiento de struts mínimo | No |
| SLE | 18,9 | IC | Stents adyacentes | No |
| SLE | 54,1 | IC | Stents adyacentes | No |
| SLE | 11,2 | II | Solapamiento de struts completo | No |
| SLE | 2,1 | IB | Solapamiento de struts completo | No |
| SLE | 31,3 | IB | Solapamiento de struts completo | No |
| SLE | 2,8 | IV | Solapamiento de struts completo | No |
| SLE | 6,5 | IB | Solapamiento de struts mínimo | No |
| SLE | 13,3 | IB | Solapamiento de struts completo | No |
ABA: armazón bioabsorbible; SLE: stent liberador de everolimus.
Reestenosis en la zona de solapamiento con tomografía de coherencia óptica en la angiografía de seguimiento a los 13 meses de un paciente tratado con 3 ABA solapados, que mostró una proliferación de neoíntima en la zona del solapamiento, que causaba un área luminal mínima de 1,7 mm2 (B’). A y B: imágenes de ecografía intravascular (IVUS) al final de la intervención inicial. A’ y B’: imágenes de tomografía de coherencia óptica al mismo nivel en el seguimiento realizado a los 13 meses. A y A’: área de expansión incompleta del armazón bioabsorbible en la intervención inicial (A), que se caracterizaba por una hiperplasia de neoíntima excesiva en el seguimiento (A’). B y B’: área de solapamiento de los armazones bioabsorbibles, que tuvieron también una expansión incompleta en la intervención inicial (B). Como resultado de ello, en el seguimiento a los 13 meses, la hiperplasia de neoíntima dio lugar a reestenosis en el armazón. Asterisco rosa: lesiones calcificadas. Las flechas amarillas indican los struts de los armazones solapados en la IVUS inicial (B). ABA: armazón bioabsorbible; AL: área de la luz; ICP: intervención coronaria percutánea. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
El presente estudio con igualación por puntuación de propensión demostró que los pacientes con angina estable tratados con ABA con solapamiento presentan unos resultados comparables a los de los tratados con SLE con solapamiento. Es interesante señalar que una tercera parte del total de RLD se produjeron en zonas de solapamiento en lesiones tratadas con ABA, frente a ninguna de las lesiones en el caso de los SLE, a pesar de que los segmentos solapados eran de mayor longitud en los segundos. Serán necesarios nuevos estudios controlados y aleatorizados con la potencia estadística precisa para confirmar estos resultados.
Nuestros resultados indican que, a pesar de una menor ganancia aguda, el tratamiento de las lesiones coronarias con ABA con solapamiento es viable, con un éxito angiográfico y de la intervención aceptable. Un estudio pequeño de 2 centros australianos19 en el que se incluyó a 23 pacientes también indicó que el implante de ABA con solapamiento era «viable y seguro», a pesar de la presencia de 2 IMP en el grupo de solapamiento (8,7%). El número muy bajo de pacientes y la ausencia de un grupo control no permitieron a los autores de ese estudio extraer conclusión alguna respecto a la seguridad y la eficacia de los ABA con solapamiento, en comparación con los SLE de nueva generación. En un estudio más amplio (1.627 pacientes) del registro multicéntrico europeo GHOST-EU20, un total de 287 pacientes (17,6%) presentaban lesiones tratadas con ABA con solapamiento. El objetivo clínico orientado al paciente, a 1 año, mostró unos resultados muy similares a los descritos en el presente estudio (13,6%). Tiene interés señalar que, en el mismo estudio, las tasas de trombosis del armazón bioabsorbible a 1 año fueron similares, aunque no desdeñables, en los grupos con y sin solapamiento (el 2,1 frente al 2,2%; p = 1,000). En el seguimiento de 1 año del estudio ABSORB-EXTEND21 (n = 812) se registró una tasa significativamente de IM más alta entre los pacientes con solapamiento que entre los que no lo tenían (el 8,7 frente al 2,4%; p = 0,002), lo cual probablemente refleje que se trataba de un subgrupo de pacientes más complejo. En nuestra cohorte, a pesar de que no se observó ningún IM durante el seguimiento, hubo una tasa igualmente alta de IMP (∼7,1%), lo cual constituye una complicación notable. Es importante señalar que en el estudio ABSORB-EXTEND se registró también una tasa de trombosis de los armazones bioabsorbibles en el grupo de ABA con solapamiento a 1 año del 1,8%, lo cual es similar a la cifra indicada por el GHOST-EU. Sin embargo, ni en el GHOST-EU ni en el ABSORB-EXTEND se realizó una comparación con una cohorte tratada con SLE de nueva generación para disponer de una perspectiva de la seguridad/eficacia comparadas.
A pesar de que se han implantado más de 180.000 ABA Absorb en todo el mundo, hasta el momento solo se han publicado 6 estudios aleatorizados relativamente pequeños, que apuntan unos resultados comparables con el ABSORB y con los SLE de nueva generación en los pacientes con lesiones simples3–8. El ensayo controlado y aleatorizado ABSORB II3, a pesar de la menor ganancia luminal aguda tras el implante en el grupo de ABA, mostró unas tasas de fallo en la lesión diana a 1 año similares en los 2 grupos (ABA frente a SLE, el 5 y el 3%; p = 0,35). Sin embargo, puesto que ese estudio no tuvo la potencia estadística necesaria para los resultados clínicos, se siguió del ensayo más amplio ABSORB III4, en el que se incluyó a 1.322 pacientes tratados con ABA y 686 tratados con SLE. La frecuencia de fallo en la lesión diana en el grupo de ABA (7,8%) fue no inferior a la observada en el grupo de SLE (el 6,1%; pno-inferioridad = 0,007; psuperioridad = 0,16). En los ensayos aleatorizados más pequeños ABSORB China7 y ABSORB Japan8, se observó también na ausencia de diferencias significativas en los resultados a 1 año. El ensayo aleatorizado con inclusión de pacientes sin selección (all-comers) EVERBIO II5 (ABA frente a SLE frente a stents liberadores de biolimus) y el ensayo ABSORB China7 (480 pacientes aleatorizados 1:1 a ABA o SLE) no mostraron diferencias en cuanto a la pérdida tardía de luz angiográfica, a los 9 y a los 12 meses, respectivamente, tras el implante de stents/armazones. Además, en el contexto del infarto agudo de miocardio con elevación del segmento ST (IAMCEST), el ensayo TROFI II6 demostró unas tasas de respuesta de cicatrización similares con los ABA y los SLE a los 6 meses del implante.
Los registros de ABA en la práctica clínica real22 han mostrado unos resultados generales a medio plazo aceptables, aunque con algunos signos preocupantes de aumento de trombosis en el stent. Ishibashi et al9 han resumido la experiencia en cuanto a trombosis de los stents con el empleo de ABA en diversos contextos (angina estable, síndromes coronarios agudos, infarto agudo de miocardio con elevación del segmento ST [IAMCEST]). En una población total de 4.309 pacientes a los que se implantó ABA (Absorb v1.1) y se dio seguimiento durante 10,3 meses, se observó trombosis del stent definitiva/probable en el 1,22% de los pacientes, que fue aguda en el 0,16% y subaguda en el 0,76%. Se produjo trombosis del stent en el 0,94% de los pacientes que sufrían angina estable, el 2,16% de los que tenían SCA y el 1,22% de los pacientes con IAMCEST. Como ya se ha mencionado, las tasas de trombosis probable/definitiva en el armazón bioabsorbible a 1 año en los pacientes tratados con ABA con solapamiento se sitúan alrededor del 2%20,21. Estas cifras han generado cierta preocupación en comparación con las tasas anuales de trombosis de stent definitiva/probable muy bajas, del 0,89%, descritas en los estudios realizados con SLE de nueva generación23,24. Esta preocupación se ha confirmado recientemente en un metanálisis25 de los 6 ensayos aleatorizados existentes hasta la fecha (n = 3.738 pacientes), que ha puesto de manifiesto un riesgo significativamente superior de trombosis de stent subaguda definitiva/probable en los pacientes tratados con ABA.
El principal inconveniente actual de los ABA con everolimus (Absorb v1.1) es el grosor y la anchura de los struts (157 × 190,5 μm en los armazones bioabsorbibles de 2,5 mm y 3,0 mm y 157 × 216 μm en el de 3,5 mm), que puede hacer que estos dispositivos sean más trombogénicos, en especial cuando la aposición no es adecuada o la expansión no es completa. En las áreas de solapamiento, los struts apilados podrían alcanzar un grosor de ∼300 μm. En un modelo porcino de implante de ABA, en los segmentos arteriales coronarios con solapamiento completo (es decir, con múltiples struts apilados) se observó endotelización tardía (ABA frente a SLE, el 80,1 frente al 98,2%; p < 0,001) a los 28 días10 en comparación con el grupo de SLE, mientras que hubo un aumento del grosor de la neoíntima en el grupo de ABA a los 90 días. En una intervención en la práctica clínica real, la colocación adyacente de los struts de ABA (mediante la colocación cuidadosa de los marcadores de platino con objeto de que estén lado a lado) (figura 1) sin solapamiento puede ser una tarea muy difícil. El fallo geográfico (espacio entre los ABA) o el solapamiento completo (sea con un número reducido o múltiples struts apilados) se dan con frecuencia (figura 2), y pueden predisponer a una futura RLD. En el presente estudio, una tercera parte de las reestenosis en el stent se produjeron en la zona de solapamiento en los pacientes tratados con ABA (el 33,3% frente a 0; p = 0,063), lo cual concuerda con los resultados ya mencionados con el modelo porcino. Tiene interés señalar que no se observó reestenosis en el stent en el solapamiento en los pacientes tratados con SLE a pesar de que los segmentos tenían un solapamiento de mayor longitud (tabla 5).
LimitacionesLas limitaciones del presente estudio incluyen el pequeño tamaño muestral, el diseño no aleatorizado y la falta de: a) exploraciones de imagen angiográficas e intracoronarias sistemáticas (IVUS, tomografía de coherencia óptica) de seguimiento, y b) la falta de un análisis independiente de los resultados angiográficos en un laboratorio central. Además, a pesar de la igualación en cuanto a las características de los pacientes mediante las puntuaciones de propensión, continuó habiendo diferencias significativas en las características basales de las lesiones (como las lesiones calcificadas, el uso de IVUS, las lesiones en bifurcaciones), que podrían haber introducido un sesgo en los resultados.
CONCLUSIONESEste pequeño estudio con igualación por puntuación de propensión demostró que el tratamiento de lesiones largas empleando ABA solapados es viable, con unos resultados de la intervención y clínicos aceptables. Serán necesarios nuevos ensayos aleatorizados amplios para evaluar el resultado clínico de los ABA en comparación con los SLE de nueva generación en los pacientes a los que se ha implantado ABA con solapamiento.
CONFLICTO DE INTERESESNinguno.
- -
En ensayos aleatorizados se han observado resultados clínicos no inferiores en los pacientes con lesiones simples tratadas con armazones bioabsorbibles farmacoactivos en comparación con los tratados con stents farmacoactivos.
- -
Sin embargo, ha generado cierta preocupación en metanálisis recientes y registros de la práctica clínica real que se hayan observado tasas de trombosis más altas con los armazones bioabsorbibles.
- -
Hasta la fecha no se ha realizado ningún estudio en el que se haya investigado la repercusión en los resultados clínicos de usar armazones bioabsorbibles con solapamiento.
- -
El presente estudio pone de relieve que el implante de armazones bioabsorbibles con solapamiento es viable y seguro siempre que se utilicen técnicas de implante y de imagen intracoronaria óptimas.
- -
Serán necesarios estudios aleatorizados amplios para evaluar de manera detallada el rendimiento y los resultados clínicos de los armazones bioabsorbibles con solapamiento en comparación con las plataformas metálicas liberadoras de everolimus de nueva generación.