El tratamiento óptimo de los pacientes con enfermedad coronaria multivaso e infarto de miocardio con elevación del segmento ST (IAMCEST) tras una intervención coronaria percutánea (ICP) primaria es motivo de controversia. Con este trabajo se pretende analizar el impacto pronóstico de la ICP multivaso frente a ICP solo de la arteria origen del infarto en pacientes con IAMCEST y enfermedad multivaso en la práctica clínica real.
MétodosEstudio de cohortes retrospectivo que incluyó a 1.499 pacientes consecutivos con diagnóstico de IAMCEST sometidos a ICP primaria entre enero de 2008 y diciembre de 2015. El 40,8% (n=611) tenía enfermedad coronaria multivaso. Se realizó un análisis mediante puntuación de propensión emparejada, con lo que se obtuvieron 2 grupos de 215 pacientes emparejados según se sometieran a ICP multivaso o solamente de la arteria culpable del infarto.
ResultadosDurante el seguimiento (mediana, 2,36 años), tras emparejar por puntuación de propensión, los pacientes sometidos a ICP multivaso tuvieron menos mortalidad (el 5,1 frente al 11,6%; Peto-Peto p=0,014), revascularización no planeada (el 7,0 frente al 12,6%; Peto-Peto p=0,043) y eventos cardiovasculares adversos mayores (el 22,0 frente al 30,8%; Peto-Peto p=0,049). Pese a que no resultó significativa, la tasa de reinfarto fue menor (el 4,2 frente al 6,1%; Peto-Peto p=0,360).
ConclusionesLa estrategia de realizar ICP multivaso en los pacientes con IAMCEST y enfermedad multivaso se asoció a una disminución de la mortalidad, la revascularización no planeada y los eventos cardiovasculares adversos mayores durante el seguimiento de una población de la práctica clínica real.
Palabras clave
La enfermedad coronaria multivaso (ECMV) es un hallazgo angiográfico frecuente en el infarto agudo de miocardio con elevación del segmento ST (IAMCEST), que se observa en más del 40% de los pacientes a los que se practica una intervención coronaria (ICP) primaria1,2. En comparación con los pacientes con enfermedad de un solo vaso, los que presentan ECMV tienen peor pronóstico tanto durante la hospitalización como a largo plazo, con ingresos repetidos por infarto de miocardio y nuevas revascularizaciones2–4. Para hacer frente a esta situación, ha surgido el concepto de la ICP preventiva de las lesiones no culpables como alternativa a la estrategia tradicional de revascularizar solo la arteria origen del infarto. Sin embargo, realizar una ICP en lesiones no culpables puede tener complicaciones. La actual guía de la Sociedad Europea de Cardiología recomienda limitar la ICP primaria al vaso culpable (con la excepción de los casos de shock cardiogénico e isquemia persistente) y plantear una posible revascularización en etapas de las lesiones no culpables si hay síntomas o isquemia en un plazo de días o semanas tras la ICP primaria5,6. Algunos ensayos recientemente publicados, como los estudios PRAMI7, CvLPRIT8 y DANAMI-3 PRIMULTI9, han puesto en duda la necesidad, el momento adecuado de realización y los criterios para llevar a cabo una revascularización multivaso de los pacientes con IAMCEST y han observado mejores resultados con la revascularización completa inmediata o en etapas.
Con objeto de definir las consecuencias de usar una ICP multivaso frente a la ICP solo de la lesión culpable en pacientes de la práctica clínica real, se ha analizado nuestro registro retrospectivo de 8 años con 1.499 pacientes con IAMCEST a los que se practicó una ICP primaria.
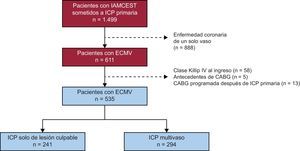
MÉTODOSPoblación del estudioSe realizó un estudio de cohortes observacional, retrospectivo y unicéntrico, en el que se incluyó consecutivamente a todos los pacientes hospitalizados con diagnóstico de IAMCEST a los que se practicó ICP primaria en el Hospital Clínico Universitario de Santiago de Compostela entre enero de 2008 y diciembre de 2015 (n=1.499). El 40,8% (n=611) del total tenía ECMV. Para analizar las consecuencias de realizar la ICP multivaso o solo de la lesión culpable, se excluyó del estudio a los pacientes con ECMV y las siguientes características: a) clase Killip IV al ingreso (n=58); b) antecedentes de cirugía de revascularización aortocoronaria (n=5), y c) previsión de una intervención de revascularización aortocoronaria después de la ICP primaria (n=13), tal como se indica en la figura 1. Formaron la población en estudio 535 pacientes con ECMV, de los que el 55,0% (n=294) se sometió a ICP multivaso y el 45,0% (n=241), a ICP solo de la lesión culpable. La decisión de realizar una revascularización percutánea de una arteria coronaria no culpable y el momento de llevarla a cabo se dejaron al criterio del cardiólogo intervencionista y el cardiólogo clínico o del equipo multidisciplinario (heart team), según procediera. Se registraron los factores que influyeron en esta decisión.
La ICP primaria se realizó según lo establecido en la guía de la Sociedad Europea de Cardiología10,11 y según la práctica habitual de los operadores, y se dejó a su criterio el empleo de trombectomía por aspiración, heparina o administración de un inhibidor de la glucoproteína IIb/IIIa. El tratamiento antiagregante plaquetario consistió en ácido acetilsalicílico y un inhibidor de la P2Y12 (clopidogrel en los primeros años y ticagrelor y prasugrel más recientemente).
Se registraron los datos demográficos, clínicos, ecocardiográficos, de angiografía coronaria y de laboratorio, y se introdujeron en una base de datos informatizada, usando el protocolo de nuestro departamento para los pacientes con IAMCEST tratados con una ICP primaria. El filtrado glomerular se calculó al ingreso con la fórmula de Cockgrauft-Gault.
DefinicionesEl diagnóstico del IAMCEST se estableció según la guía vigente11,12. El tiempo de isquemia se definió como el tiempo transcurrido entre el inicio de los síntomas y la reperfusión (paso de la guía a través de la lesión culpable durante la ICP primaria). La ECMV se definió por la presencia de al menos una lesión en una arteria no culpable del infarto y que se considerara angiográficamente significativa (más de un 50% de reducción del diámetro luminal). La ICP solo del vaso culpable se definió como la revascularización únicamente de la arteria origen del infarto y la ICP multivaso, como la revascularización de al menos una lesión más en un vaso diferente, bien durante el procedimiento índice, bien de manera programada en los 30 días siguientes. Los eventos adversos cardiovasculares mayores (MACE) durante el seguimiento incluyeron la mortalidad por cualquier causa, el infarto de miocardio, la insuficiencia cardiaca con necesidad de hospitalización y una nueva revascularización no programada.
Objetivo del estudio y seguimientoEl objetivo principal de este estudio es comparar los resultados clínicos durante el seguimiento (es decir, la mortalidad por cualquier causa y los MACE) de la ICP multivaso frente la ICP de tan solo el vaso culpable, en pacientes con IAMCEST a los que se practicó una ICP primaria y que presentaban una ECMV, después de ajustar emparejando por propensity score.
El seguimiento se realizó mediante la consulta de los registros electrónicos disponibles en la Comunidad Autónoma de Galicia (programa IANUS); se revisaron todas las evaluaciones médicas y registros hospitalarios. La mediana de seguimiento fue de 2,36 [intervalo intercuartílico, 0,68-4,67] años.
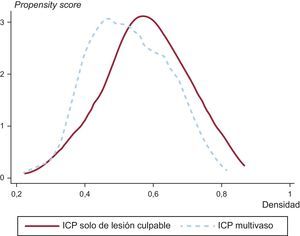
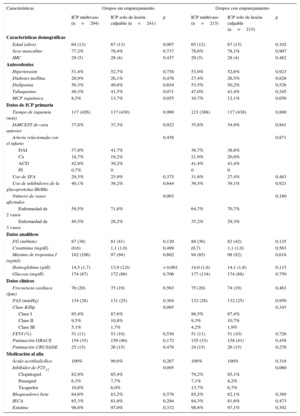
Análisis estadísticoSe realizó un análisis univariable de las variables discretas con la prueba de la χ2, expresando los resultados en forma de porcentajes, y de las variables continuas con la prueba de la t de Student, expresando los resultados en forma de media±desviación estándar. Dado que se trataba de un estudio observacional no aleatorizado, se aplicó análisis emparejando por propensity score con objeto de igualar las poblaciones de estudio (pacientes sometidos a ICP multivaso frente a tratamiento solo de la arteria culpable) y para reducir el sesgo debido a las variables de confusión que podían influir en las decisiones de tratamiento y en los resultados clínicos13. El emparejamiento se llevó a cabo con las siguientes variables: edad, sexo, índice de masa corporal, hipertensión, diabetes, dislipemia, tabaquismo, miocardiopatía isquémica, tiempo de isquemia, localización del IAMCEST (anterior frente a otras localizaciones), arteria culpable del infarto, uso de stents farmacoactivos, uso de inhibidores de la glucoproteína IIb/IIIa, número de vasos enfermos (enfermedad coronaria de 2 vasos frente a 3 vasos), filtrado glomerular, creatinina, valor máximo de troponina I, hemoglobina, glucosa, frecuencia cardiaca, presión arterial sistólica, clase Killip, fracción de eyección del ventrículo izquierdo, puntuación GRACE, puntuación CRUSADE y año de inclusión del paciente. Para estimar el propensity score de cada paciente, el emparejamiento se basó en la técnica del vecino más próximo sin sustitución por medio de un modelo probit utilizando todas las variables antes mencionadas. Este método se basa en la identificación de pacientes dentro del área de apoyo común de los 2 grupos. El grado de solapamiento en el área de apoyo común para el emparejamiento por propensity score fue muy alto (figura 2) y ello permitió la inclusión de 215 pacientes en cada grupo. No hubo diferencias estadísticamente significativas en cuanto a las características basales entre los pacientes sometidos a ICP multivaso o ICP del vaso culpable. La bondad de ajuste de la puntuación de emparejamiento según la propensión fue suficiente (Hosmer-Lemeshow, χ2=476,44) y las variables utilizadas no mostraron problemas de multicolinealidad (media del factor de inflación de la varianza, 2,01).
Se utilizó un análisis de Kaplan-Meier con una prueba de orden logarítmico (log-rank test) modificada para mostrar la mortalidad por cualquier causa acumulada a los 4 años que presentaban los pacientes según la estrategia de revascularización utilizada (ICP del vaso culpable o ICP multivaso). Las curvas de mortalidad de Kaplan-Meier mostraron cierta superposición durante los primeros meses de seguimiento, de modo que se utilizó la prueba de Peto-Peto-Prentice, que asigna una mayor ponderación a los eventos más tempranos, para confirmar los resultados. Se utilizó también un análisis de Kaplan-Meier con pruebas de Peto-Peto-Prentice para evaluar las diferencias existentes en los MACE durante el seguimiento. Para evitar la violación de las asunciones de proporcionalidad, tanto en el análisis de la mortalidad por cualquier causa como en el de los MACE, en estudios previos se ha propuesto un análisis de la supervivencia media restringida14,15. Por consiguiente, se utilizó el modelo propuesto por Royston y Parmar16, que muestra el número de días ganados hasta la aparición de cada evento durante el seguimiento y su significación estadística.
Dado que los componentes no mortales de los MACE (infarto de miocardio, insuficiencia cardiaca y nueva revascularización) y el criterio de valoración de trombosis de stent pueden competir con la mortalidad por cualquier causa17,18, se utilizó un modelo de riesgos en competencia19 que muestra las curvas de la función de incidencia acumulada de estos objetivos y sus diferencias de sub-hazard ratio.
Todos los análisis fueron bilaterales y las diferencias se consideraron significativas si p<0,05. El análisis estadístico se llevó a cabo con el progrma SPSS versión 22.0.
RESULTADOSCaracterísticas basalesFormaron la cohorte inicial 535 pacientes con ECMV; la media de edad fue 65,8±13,0 años, el 77,8% eran varones, el 27,7% tenía diabetes y el 37,6% de los IAMCEST eran de localización anterior. Se compararon las características basales de los pacientes sometidos a ICP multivaso (55,0%; n=294) con las de los pacientes en los que se realizó revascularización solo de la arteria culpable (45,0%; n=241). La ICP multivaso se realizó la mayor parte de las veces en etapas (85,4%; n=251); se llevó a cabo una revascularización multivaso durante la intervención de ICP primaria en 43 pacientes (14,6%). Se alcanzó la revascularización completa del 67,3% de los pacientes (n=198) tratados con ICP multivaso. Múltiples factores influyen en la decisión de no realizar una ICP de las arterias coronarias no culpables (tabla 1). Los pacientes sometidos a ICP multivaso eran más jóvenes, tenían cifras de hemoglobina al ingreso más altas y más frecuecia de enfermedad de 3 vasos en la angiografía coronaria (tabla 2). Los pacientes a los que se practicó una ICP multivaso tenían menor probabilidad de antecedentes de miocardiopata isquémica (el 8,5 frente al 13,7%; p=0,055) y más probabilidad de filtrado glomerular más alto al ingreso (87 frente a 81 ml/min; p=0,120), aunque estas diferencias no alcanzaron la significación estadística. No hubo diferencias significativas en cuanto al sexo, los factores de riesgo cardiovascular, el tiempo de isquemia, la arteria culpable del infarto, el uso de stents farmacoactivos en la ICP primaria, el valor máximo de troponina, las variables hemodinámicas, la clase Killip, la fracción de eyección y las puntuaciones de riesgo (GRACE y CRUSADE) (tabla 2). El tratamiento farmacológico al alta hospitalaria fue similar en los 2 grupos.
Factores que influyen en la decisión de no realizar intervención coronaria percutánea multivaso
| Factores | n (%) |
|---|---|
| Lesión residual moderada (estenosis ≤ 70%) | 97 (40,2) |
| Lesión residual compleja/dificultades anatómicas | 65 (27,0) |
| Oclusión total crónica | 44 (18,3) |
| Prueba de estrés de isquemia negativa | 35 (14,5) |
Características basales de los grupos de estudio
| Características | Grupos sin emparejamiento | Grupos con emparejamiento | ||||
|---|---|---|---|---|---|---|
| ICP multivaso (n=294) | ICP solo de lesión culpable (n=241) | p | ICP multivaso (n=215) | ICP solo de lesión culpable (n=215) | p | |
| Características demográficas | ||||||
| Edad (años) | 64 (13) | 67 (13) | 0,007 | 65 (12) | 67 (13) | 0,102 |
| Sexo masculino | 77,2% | 78,4% | 0,737 | 78,6% | 78,1% | 0,907 |
| IMC | 29 (5) | 28 (4) | 0,437 | 29 (5) | 28 (4) | 0,482 |
| Antecedentes | ||||||
| Hipertensión | 51,4% | 52,7% | 0,758 | 53,0% | 52,6% | 0,923 |
| Diabetes mellitus | 28,9% | 26,1% | 0,476 | 27,4% | 26,5% | 0,828 |
| Dislipemia | 50,3% | 49,8% | 0,654 | 53,5% | 50,2% | 0,526 |
| Tabaquismo | 49,3% | 41,5% | 0,071 | 47,0% | 41,4% | 0,245 |
| MCP isquémica | 8,5% | 13,7% | 0,055 | 10,7% | 12,1% | 0,650 |
| Datos de ICP primaria | ||||||
| Tiempo de isquemia (min) | 117 (426) | 117 (430) | 0,990 | 123 (388) | 117 (438) | 0,880 |
| IAMCEST de cara anterior | 37,8% | 37,3% | 0,922 | 35,8% | 34,9% | 0,841 |
| Arteria relacionada con el infarto | 0,458 | 0,871 | ||||
| DAI | 37,8% | 41,7% | 36,7% | 38,6% | ||
| Cx | 18,7% | 19,2% | 21,9% | 20,0% | ||
| ACD | 42,9% | 39,2% | 41,4% | 41,4% | ||
| PI | 0,7% | 0 | 0 | 0 | ||
| Uso de SFA | 29,3% | 25,9% | 0,375 | 31,6% | 27,4% | 0,483 |
| Uso de inhibidores de la glucoproteína IIb/IIIa | 40,1% | 38,2% | 0,644 | 39,5% | 39,1% | 0,921 |
| Número de vasos afectados | 0,003 | 0,180 | ||||
| Enfermedad de 2 vasos | 59,5% | 71,8% | 64,7% | 70,7% | ||
| Enfermedad de 3 vasos | 40,5% | 28,2% | 35,2% | 29,3% | ||
| Datos analíticos | ||||||
| FG (ml/min) | 87 (38) | 81 (41) | 0,120 | 88 (36) | 82 (42) | 0,125 |
| Creatinina (mg/dl) | (0,6) | 1,1 (1,0) | 0,499 | (0,7) | 1,1 (1,0) | 0,563 |
| Máximo de troponina I (ng/ml) | 102 (106) | 97 (94) | 0,602 | 94 (85) | 98 (92) | 0,618 |
| Hemoglobina (g/dl) | 14,5 (1,7) | 13,9 (2,0) | < 0,001 | 14,0 (1,6) | 14,1 (1,8) | 0,115 |
| Glucosa (mg/dl) | 174 (87) | 172 (86) | 0,706 | 177 (134) | 174 (88) | 0,750 |
| Datos clínicos | ||||||
| Frecuencia cardiaca (lpm) | 76 (20) | 75 (19) | 0,563 | 75 (20) | 74 (19) | 0,463 |
| PAS (mmHg) | 134 (28) | 131 (25) | 0,304 | 132 (28) | 132 (25) | 0,950 |
| Clase Killip | 0,095 | 0,343 | ||||
| Clase I | 85,4% | 87,6% | 86,5% | 87,4% | ||
| Clase II | 9,5% | 10,8% | 9,3% | 10,7% | ||
| Clase III | 5,1% | 1,7% | 4,2% | 1,9% | ||
| FEVI (%) | 51 (11) | 51 (10) | 0,530 | 51 (11) | 51 (10) | 0,726 |
| Puntuación GRACE | 154 (35) | 159 (40) | 0,172 | 155 (33) | 158 (41) | 0,458 |
| Puntuación CRUSADE | 25 (15) | 26 (15) | 0,478 | 24 (15) | 26 (15) | 0,276 |
| Medicación al alta | ||||||
| Ácido acetilsalicílico | 100% | 99,6% | 0,267 | 100% | 100% | 0,318 |
| Inhibidor de P2Y12 | 0,095 | 0,060 | ||||
| Clopidogrel | 82,9% | 85,4% | 79,2% | 85,1% | ||
| Prasugrel | 6,3% | 7,7% | 7,1% | 8,2% | ||
| Ticagrelor | 10,8% | 6,0% | 13,7% | 6,7% | ||
| Bloqueadores beta | 84,6% | 83,2% | 0,578 | 85,2% | 82,1% | 0,389 |
| IECA | 85,3% | 81,9% | 0,294 | 84,3% | 81,6% | 0,473 |
| Estatina | 98,6% | 97,0% | 0,332 | 98,6% | 97,1% | 0,302 |
ACD: arteria coronaria derecha; Cx: arteria circunfleja; DAI: arteria coronaria descendente anterior izquierda; FEVI: fracción de eyección del ventrículo izquierdo; FG: filtrado glomerular; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; MCP: miocardiopatía; PAS: presión arterial sistólica; PI: arteria coronaria principal izquierda; SFA: stent farmacoactivo.
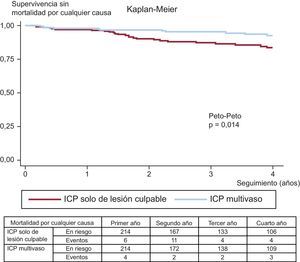
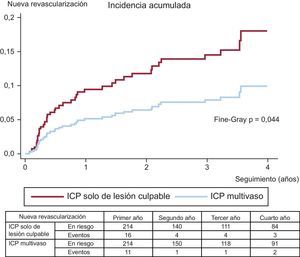
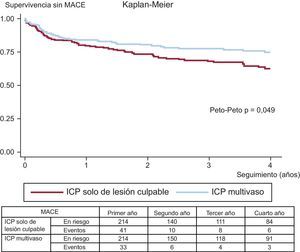
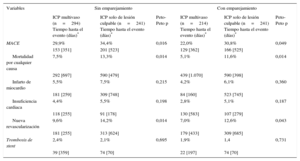
Los eventos adversos clínicos durante el seguimiento se muestran en la tabla 3. Tras el ajuste por propensity score, la mortalidad por cualquier causa (el 11,6 frente al 5,1%; Peto-Peto p=0,014) (figura 3), la nueva revascularización no programada (el 12,6 frente al 7,0%; Peto-Peto p=0,043) (figura 4) y los MACE (el 30,8 frente al 22,0%; Peto-Peto p=0,049) (figura 5) continuaron siendo significativamente superiores en los pacientes sometidos a ICP solo del vaso culpable. Estos pacientes presentaron también una tendencia a mayor incidencia de infarto de miocardio (el 6,1 frente al 4,2%; Peto-Peto p=0,360) e insuficiencia cardiaca (el 5,1 frente al 2,8%; Peto-Peto p=0,187). Los análisis realizados para evaluar la robustez de los datos confirmaron los resultados previos (tabla 4). El análisis de supervivencia media restringida demostró una ganancia significativa en el número de días transcurridos hasta la aparición de un MACE, la mortalidad por cualquier causa y la nueva revascularización. El modelo en competencia mostró que las nuevas revascularizaciones se redujeron a casi la mitad (sub-hazard ratio=0,52; p=0,044) (figura 4).
Eventos adversos durante el seguimiento
| Variables | Sin emparejamiento | Con emparejamiento | ||||
|---|---|---|---|---|---|---|
| ICP multivaso (n=294) Tiempo hasta el evento (días)* | ICP solo de lesión culpable (n=241) Tiempo hasta el evento (días)* | Peto-Peto p | ICP multivaso (n=214) Tiempo hasta el evento (días)* | ICP solo de lesión culpable (n=241) Tiempo hasta el evento (días)* | Peto-Peto p | |
| MACE | 29,9% | 34,4% | 0,016 | 22,0% | 30,8% | 0,049 |
| 153 [351] | 201 [523] | 129 [362] | 166 [525] | |||
| Mortalidad por cualquier causa | 7,5% | 13,3% | 0,014 | 5,1% | 11,6% | 0,014 |
| 292 [697] | 590 [479] | 439 [1.070] | 590 [398] | |||
| Infarto de miocardio | 5,5% | 7,5% | 0,215 | 4,2% | 6,1% | 0,360 |
| 181 [259] | 309 [748] | 84 [160] | 523 [745] | |||
| Insuficiencia cardiaca | 4,4% | 5,5% | 0,198 | 2,8% | 5,1% | 0,187 |
| 118 [255] | 91 [178] | 130 [583] | 107 [279] | |||
| Nueva revascularización | 9,6% | 14,2% | 0,014 | 7,0% | 12,6% | 0,043 |
| 181 [255] | 313 [624] | 179 [433] | 309 [685] | |||
| Trombosis de stent | 2,4% | 2,1% | 0,695 | 1,9% | 1,4 | 0,731 |
| 39 [359] | 74 [70] | 22 [197] | 74 [70] | |||
ICP: intervención coronaria percutánea; MACE: eventos adversos cardiovasculares mayores.
Verificación de la robustez empleando un análisis de supervivencia media restringida y un modelo de riesgos en competencia
| Variables | χ2 de proporcionalidad (p) | Días de supervivencia media restringida16 (p) | Modelo de riesgos en competencia19, sub-hazard ratio (p) |
|---|---|---|---|
| MACE | 1,27 (0,260) | +108 (0,041) | - |
| Mortalidad por cualquier causa | 0,01 (0,941) | +73 (0,015) | - |
| Infarto de miocardio | 4,68 (0,030) | –28 (0,336) | 0,66 (0,340) |
| Insuficiencia cardiaca | 0,59 (0,441) | +35 (0,199) | 0,52 (0,195) |
| Nueva revascularización | 0,39 (0,533) | +79 (0,046) | 0,52 (0,044) |
| Trombosis de stent | 0,29 (0,590) | +6 (0,731) | 1,29 (0,734) |
MACE: eventos adversos cardiovasculares mayores.
El presente estudio confirma el beneficio de la ICP multivaso para los pacientes con IAMCEST y ECMV, en comparación con la estrategia de ICP solo del vaso culpable, tras aplicar un ajuste por las características basales emparejado por propensity score. En este estudio, realizado en la práctica clínica real y en pacientes no seleccionados, se presenta una reducción significativa de la mortalidad por cualquier causa, las nuevas revascularizaciones no programadas y los MACE durante el seguimiento empleando datos respaldados por un análisis estadístico sólido.
En este estudio, la decisión de practicar una ICP multivaso se dejó al criterio de los cardiólogos clínicos e intervencionistas o del equipo multidisciplinario, según procediera. Esto refleja lo que sucede en la práctica clínica real, en la que la decisión de cómo, cuándo y qué arterias coronarias revascularizar o no se toma de manera individualizada en función de las características anatómicas de las lesiones restantes, los síntomas, los resultados de los tests de isquemia, el territorio miocárdico en riesgo, la función sistólica ventricular izquierda, el riesgo de complicaciones, la experiencia del centro y el operador y la edad, las comorbilidades y las preferencias del paciente. La integración de todos estos factores es un proceso complejo que puede ser difícil de evaluar en un solo ensayo controlado aleatorizado y permite decantarse por una u otra estrategia (tratamiento médico frente a revascularización parcial o completa).
El aumento del riesgo de morbilidad y mortalidad de los pacientes con IAMCEST y ECMV, en comparación con los que presentan enfermedad de 1 solo vaso, puede explicarse por varios mecanismos, como la inestabilidad de múltiples placas, el deterioro de la perfusión miocárdica y la contractilidad, los eventos arrítmicos y la muerte1,20. Las posibles ventajas de la ICP multivaso en este contexto incluyen la prevención de la isquemia recurrente o el infarto de miocardio y las complicaciones asociadas, la reducción del territorio miocárdico en riesgo y la mejora de la función miocárdica gracias a un mejor flujo en las áreas periinfarto21. Sin embargo, la ICP multivaso podría tener también ciertas desventajas: un tiempo de intervención más largo, un mayor uso de contraste, la exposición a una dosis de radiación más alta y un aumento de las complicaciones relacionadas con el stent (trombosis del stent y reestenosis) debido al implante de stents adicionales. Los nuevos fármacos antiagregantes plaquetarios22,23, la vía de acceso radial24,25 y los stents farmacoactivos de nueva generación26,27 pueden contribuir a que la intervención sea más segura en manos de operadores expertos. En este estudio, los pacientes sometidos a ICP multivaso presentaron una tasa de trombosis de stent similar a la de los pacientes con ICP solo del vaso culpable. La aparentemente elevada tasa de trombosis de stent (> 2,0% en cada grupo antes del emparejamiento) podría estar relacionada con el seguimiento a largo plazo (con la consiguiente inclusión de casos de trombosis de stent muy tardía), el uso de stents más antiguos en los primeros años y la inclusión de pacientes ancianos con muchas comorbilidades.
En el presente estudio, la ICP multivaso se realizó sobre todo mediante una intervención en etapas y rara vez en el momento de la ICP primaria, lo cual concuerda con las recomendaciones actuales5,11. La intervención sobre una lesión no culpable en el procedimiento de la ICP primaria puede llevar a un deterioro hemodinámico innecesario, en un momento en el que el paciente tiene una afección miocárdica regional importante debido al infarto y al aturdimiento; además, es posible que se sobrestimen las lesiones no culpables (lo cual conducirá a ICP innecesarias)28, y su trascendencia fisiológica a menudo resulta difícil de evaluar. Las ICP en etapas permiten evaluar la trascendencia fisiológica de las lesiones no culpables (de manera no invasiva o a través de la reserva de flujo fraccional), proporcionan tiempo para comentar las estrategias de revascularización y probablemente sean más seguras29.
Recientemente se han publicado 3 ensayos aleatorizados sobre el tratamiento de la ECMV después de la ICP primaria. El ensayo PRAMI7 indicó que la ICP preventiva de arterias coronarias que no eran el origen del infarto y presentaban lesiones angiográficamente significativas en la intervención inicial redujo significativamente el riesgo de infarto de miocardio no mortal y de angina refractaria, en comparación con la ICP limitada a la arteria culpable del infarto. Además, el estudio CvLPRIT8 demostró que la revascularización completa durante el ingreso inicial se asociaba a una tasa de MACE a los 12 meses significativamente inferior (al evaluar sus componentes por separado, hubo solo tendencia a una menor frecuencia de mortalidad, reinfarto, insuficiencia cardiaca y nueva revascularización) en comparación con lo observado al tratar solo la arteria que era origen del infarto. Por último, el ensayo DANAMI-3 PRIMULTI9 puso de manifiesto que la revascularización completa guiada por las determinaciones de la reserva fraccional de flujo redujo significativamente el riesgo de eventos adversos respecto a lo observado cuando no había ninguna otra intervención invasiva tras la ICP primaria; este efecto se debe sobre todo a un número significativamente inferior de nuevas revascularizaciones. Además, la revascularización completa parece segura, puesto que en un análisis combinado de este estudio no se observó un aumento de accidentes cerebrovasculares, hemorragias y nefropatías inducidas por contraste8,30. En consecuencia, los metanálisis recientemente publicados de ensayos clínicos y estudios observacionales muestran un resultado favorable a la revascularización multivaso en los pacientes con IAMCEST31–34. Sin embargo, solo hay evidencia sólida respecto a la reducción de los MACE (debido en gran parte a la reducción de las nuevas revascularizaciones), y no en lo que respecta a la reducción de las muertes o los infartos de miocardio. En el presente estudio, se observó también una reducción de los MACE y las nuevas revascularizaciones; no obstante, la mortalidad también fue menos en los pacientes sometidos a ICP multivaso. Los pacientes de la práctica clínica real son de más edad y tienen más comorbilidades y peor pronóstico, lo cual, junto con el seguimiento más largo, podría haber contribuido a nuestros resultados en cuanto a la mortalidad. Actualmente está en marcha un amplio ensayo clínico aleatorizado (COMPLETE) con la potencia estadística suficiente para analizar las variables de valoración objetivas de muerte e infarto de miocardio, en el que se incluye a pacientes con IAMCEST tratados con revascularización solo de la arteria culpable o revascularización completa en etapas, realizada preferiblemente durante la hospitalización inicial; este ensayo recomienda el uso de stents farmacoactivos de segunda generación y un tratamiento antiagregante plaquetario combinado doble, con ticaglelor, como reflejo de la práctica clínica actual.
LimitacionesEste estudio tiene varias limitaciones que es preciso tener en cuenta para su interpretación. En primer lugar, se trata de un estudio retrospectivo, observacional y no aleatorizado, llevado a cabo en un solo hospital; por consiguiente, tiene las limitaciones y el sesgo inherentes a los estudios retrospectivos de un solo centro. Aunque el emparejamiento de los grupos mediante propensity score aumenta la solidez de los análisis estadísticos, es imposible introducir una corrección respecto a factores de confusión no medidos y todos los sesgos de selección relativos a la decisión terapéutica, lo cual impide extraer conclusiones definitivas. En segundo lugar, no fue posible determinar los factores que llevaron a la realización de una ICP multivaso en cada caso, por lo que no puede definirse un enfoque estandarizado para abordar el tratamiento de los pacientes con ECMV e IAMCEST. En tercer lugar, no se obtuvieron datos sobre la evaluación funcional de la estenosis coronaria de los pacientes tratados con ICP multivaso; es probable que, en la mayoría de los casos, la evaluación de la importancia de las lesiones no culpables del infarto se realizara solo mediante angiografía.
CONCLUSIONESEste estudio respalda las observaciones recientes de ensayos clínicos aleatorizados y metanálisis en una población de la práctica clínica real que muestra que la ICP multivaso de lesiones no culpables en pacientes con diagnóstico de IAMCEST puede reducir los eventos adversos clínicos durante el seguimiento, incluidos MACE, nuevas revascularizaciones no programadas y mortalidad por cualquier causa.
CONFLICTO DE INTERESESNinguno.
- –
No hay consenso sobre el tratamiento de la enfermedad multivaso detectada en el momento de realizar una ICP primaria, a menos que el paciente esté en shock cardiogénico o tenga una isquemia persistente.
- –
La guía vigente recomienda una revascularización por etapas de las lesiones no culpables tan solo si el paciente presenta síntomas o se detecta isquemia tras la ICP primaria.
- –
En ensayos clínicos aleatorizados recientes, se han observado mejores resultados clínicos asociados a la revascularización completa inmediata o por etapas que con la ICP de solo la lesión culpable.
- –
Este estudio respalda las observaciones recientes de ensayos clínicos que muestran que la ICP multivaso de lesiones no culpables en pacientes de la práctica clínica real con diagnóstico de IAMCEST puede reducir los eventos clínicos adversos durante el seguimiento.