Varios estudios han investigado la eficacia de guiarse por la reserva fraccional de flujo (RFF) para mejorar los resultados clínicos tras la revascularización miocárdica, con resultados contradictorios. El objetivo es comparar los resultados clínicos en pacientes con enfermedad coronaria tras una revascularización guiada por RFF o por angiografía.
MétodosSe incluyeron estudios de intervención, tanto ensayos clínicos aleatorizados (ECA) como estudios no aleatorizados. Los objetivos coprimarios fueron la muerte por cualquier causa, el infarto de miocardio y los eventos adversos cardiovasculares mayores (MACE). El estudio está registrado en PROSPERO (CRD42022344765).
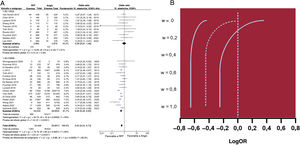
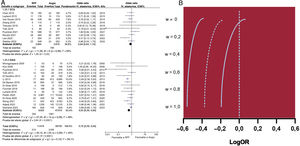
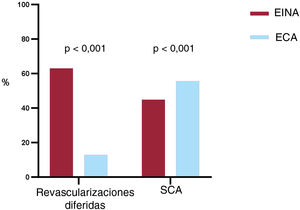
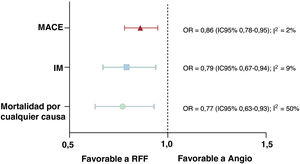
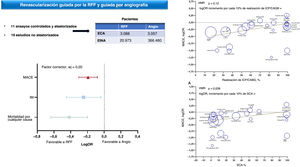
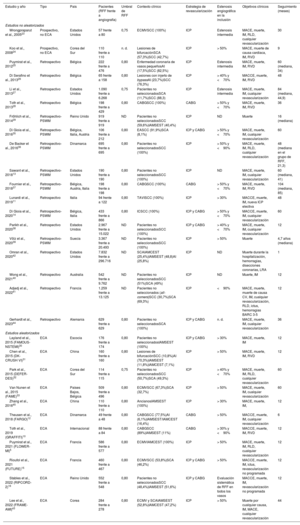
ResultadosSe incluyeron en total 30 estudios con 393.588 pacientes. La revascularización guiada por RFF se asoció con tasas significativamente inferiores de muerte por cualquier causa (OR=0,63; IC95%, 0,53-0,73), infarto de miocardio (OR=0,70; IC95%, 0,59-0,84) y MACE (OR=0,77; IC95%, 0,70-0,85). Cuando solo se tuvieron en cuenta los ECA, no se observaron diferencias significativas entre las 2 estrategias en ningún criterio de valoración. Sin embargo, el uso de la RFF se asoció con tasas reducidas de revascularización y de lesiones tratadas. El análisis de metarregresión indicó que, cuanto mayor es la tasa de pacientes revascularizados, menor es el beneficio de utilizar la RFF en la reducción de los MACE, en comparación con la revascularización guiada por angiografía (p=0,012). Asimismo altas tasas de pacientes con síndrome coronario agudo se asociaron con menor beneficio de la revascularización guiada por RFF (p=0,039).
ConclusionesLa revascularización guiada por RFF se asoció con menores tasas de muerte por todas las causas, infarto de miocardio y MACE en comparación con la revascularización guiada por angiografía, con datos contradictorios procedentes de ECA y estudios no aleatorizados. Los beneficios de la revascularización guiada por RFF parecen ser menos evidentes en los estudios con altas tasas de revascularización y con alta prevalencia de pacientes con síndrome coronario agudo.
Palabras clave
Identifíquese
¿Aún no es suscriptor de la revista?
Comprar el acceso al artículo
Comprando el artículo el pdf del mismo podrá ser descargado
Precio: 19,34 €
Teléfono para incidencias
De lunes a viernes de 9h a 18h (GMT+1) excepto los meses de julio y agosto que será de 9 a 15h