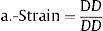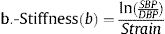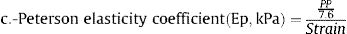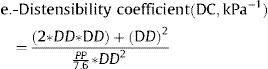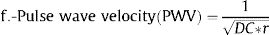Los objetivos son analizar la relación dosis-respuesta de la rigidez de la arteria carótida y la mortalidad y evaluar su capacidad predictiva.
MétodosEstudio de cohorte poblacional que incluyó a 6.468 participantes, con una mediana de seguimiento de 6,5 años. Se evaluaron 6 índices de rigidez. Se identificaron los eventos coronarios y cerebrovasculares y la mortalidad.
ResultadosLa rigidez carotídea, el coeficiente de Peterson y la velocidad de la onda de pulso (VOP) se asociaron de manera lineal y directa con los eventos cerebrovasculares: aumento del 8% (IC95%, 1-16%) por unidad de rigidez, del 7% (IC95%, 2-13%) cada 10 unidades del coeficiente de Peterson y del 26% (IC95%, 8-48%) por unidad de la VOP. La tensión carotídea se asoció de modo no lineal con el riesgo de enfermedad coronaria: en valores <0,09 unidades, cada aumento de 0,01 unidades se asoció con una disminución de un 16% del riesgo (IC95%, –33 a +6%); por encima de 0,09 unidades, cada incremento de 0,01 unidades se asoció con un aumento de un 16% del riesgo (IC95%, 6-27%). La inclusión de estos índices no mejoró la capacidad predictiva de las funciones de riesgo.
ConclusionesLa rigidez carotídea, el coeficiente de elasticidad de Peterson y la VOP tienen una relación lineal y directa con el riesgo de enfermedad cerebrovascular. La tensión (strain) carotídea tiene una relación en U con el riesgo de enfermedad coronaria. Estos índices no contribuyen a mejorar la capacidad predictiva de las funciones de riesgo.
Palabras clave
La enfermedad coronaria o cardiopatía isquémica (CPI) y el ictus continúan siendo las principales causas de la carga mundial de enfermedad en la población de más de 49 años1. Se ha propuesto el empleo de la rigidez arterial como método de diagnóstico por imagen no invasivo para evaluar el daño de la pared arterial y el envejecimiento vascular, así como para su uso como biomarcador predictivo del riesgo vascular. Aunque las guías de práctica clínica actuales no recomiendan su empleo debido a las dificultades de medición2,3, un metanálisis con la inclusión de 10 estudios (n=22.472 individuos) puso de manifiesto que la rigidez de la arteria carótida predice la mortalidad de causa cardiovascular y la mortalidad global, así como los eventos cerebrovasculares futuros, y mejora la capacidad predictiva de las funciones de riesgo clásicas4.
La rigidez arterial puede estimarse midiendo la rigidez regional o local, y se dispone de varios índices para ello3. El índice más popular para el cálculo de la rigidez arterial regional es la velocidad de la onda del pulso (VOP), generalmente la VOP carotídea-femoral para estimar la rigidez de la aorta. La rigidez arterial local puede cuantificarse mediante índices basados en los cambios de los diámetros arteriales y su relación con los cambios de la presión arterial5. Hasta la fecha, no se ha analizado adecuadamente el patrón lineal y no lineal de la asociación de estos índices con los resultados vasculares y la mortalidad.
El objetivo de este análisis fue determinar la asociación entre dosis y respuesta de varias medidas de la rigidez de la arteria carótida local con los resultados vasculares y con la mortalidad global en una cohorte de población de una región con una incidencia baja de enfermedad cardiovascular (figura 1). También evaluamos el valor de la capacidad predictiva de los índices de rigidez de la arteria carótida respecto a estos resultados.
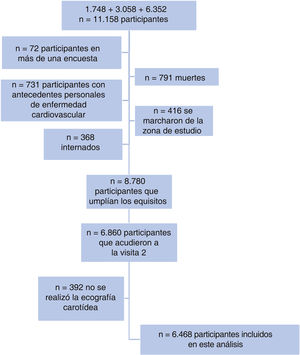
MÉTODOSDiseño y poblaciónEl Registre Gironí del Cor (REGICOR) se realiza en una cohorte de base poblacional prospectiva en Girona6. Se seleccionó aleatoriamente, a partir del censo, a personas residentes en la ciudad de Girona y otras ciudades y pueblos de la provincia de Girona, y se les invitó a participar en 3 encuestas diferentes (porcentaje de participación >70,0%): 1.748 personas de entre 25 y 74 años desde 1994 hasta 1996; 3.058 personas de entre 25 y 74 años desde 1999 hasta 2001, y 6.352 personas de entre 35 y 79 años desde 2003 hasta 2006. A estos participantes se les invitó a acudir a una segunda visita entre 2007 y 2013, en la que se realizó una ecografía carotídea y luego se llevó a cabo un seguimiento hasta el 31 de diciembre de 2016. En el presente análisis se incluyó a todos los participantes de las 3 encuestas que no tuvieran antecedentes personales de enfermedad coronaria o enfermedad cerebrovascular, no internados, residentes en el área de estudio y que acudieron a la segunda visita y se determinaron en ella los parámetros de rigidez carotídea.
Se informó debidamente sobre el estudio a todos los participantes seleccionados y otorgaron el consentimiento informado por escrito. El estudio fue aprobado por el comité de ética en investigación local.
Mediciones de la rigidez de la arteria carótidaComo se ha descrito con anterioridad7, las exploraciones de ecografía carotídea se evaluaron por 3 ecografistas titulados, con el empleo de un protocolo estandarizado y de un aparato de ecografía Acuson XP128 (Acuson-Siemens, Alemania) equipado con un transductor de haz lineal de L7 de 5-12MHz. Las ecografías se llevaron a cabo en un centro específico de cada ciudad o pueblo, generalmente un centro de atención primaria. Se evaluó la variabilidad interecografistas e intraecografista en 42 participantes, mediante la repetición de las mediciones del grosor de la íntima-media (GIM) realizadas en 2 visitas con 2 semanas de diferencia entre ellas. Los coeficientes de correlación intraclase para la media del GIM de la arteria carótida común (ACC) fueron> 0,82 tanto para la variabilidad interecografistas como para la variabilidad intraecografista; la correlación y la diferencia media entre el diámetro medio de la ACC derecha e izquierda en modo M fueron 0,73 y 0,10, respectivamente.
Durante la ecografía carotídea se visualizaron en modo B las paredes anterior y posterior de las ACC derecha e izquierda en la parte distal. Para obtener el registro en modo M de la íntima-luz de la pared anterior y de la luz-íntima de la pared posterior, el ecografista pasó del modo B a una imagen de 1/3 en modo B y 2/3 en modo M de la ACC en la parte distal. La imagen de 1/3 en modo B guía la de modo M. Los movimientos de las paredes arteriales en la imagen de 2/3 en modo M muestran las formas de onda con los patrones de doble línea de las paredes arteriales a lo largo del tiempo. Se registraron bilateralmente las imágenes como imágenes estáticas DICOM (digital information and communication in medicine). Estas imágenes estáticas se analizaron posteriormente, fuera de línea, con el programa informático validado «eTrack» en 2 laboratorios de diagnóstico por imagen, Imagelabonline & Cardiovascular, Países Bajos, n=3.182 imágenes e Instituto de Ciencias del Corazón (ICICOR/ICICORELAB), España, n=3.286 imágenes), utilizando el mismo programa informático y protocolo de procesado8. El programa eTrack establece un trazado de las formas de onda de los bordes de avance de las interfases de la íntima-luz de la pared anterior y de la luz-íntima de la pared posterior. Si se identifican los contornos de ambas paredes durante, al menos, 2 latidos cardiacos, el programa permite calcular los cambios del diámetro de la luz y calcular los parámetros y las frecuencias cardiacas según las recomendaciones internacionales9. Se determinaron dos veces la presión arterial sistólica y la presión arterial diastólica después de un periodo de reposo de 5minutos; el valor medio se calculó antes de realizar el estudio y se tuvo en cuenta en los cálculos posteriores.
Se calcularon varios índices de rigidez de la arteria carótida local en la ACC derecha e izquierda:
Donde: ΔD es el incremento del diámetro de la ACC en sístole (diámetro en sístole – diámetro en diástole), DD es el diámetro diastólico de la ACC, PAS es la presión arterial sistólica, PAD es la presión arterial diastólica, PP es la presión del pulso (PAS-PAD) y ρ es la densidad de la sangre, para la que se supuso un valor de 1,050kg/m3.
Algunos de estos índices (β, Ep, VOP) están directamente relacionados con la rigidez, mientras que otros (tensión [strain], CC, CD) están inversamente relacionados con ella. De cada participante se promediaron los valores de la carótida derecha e izquierda en modo M para cada uno de los índices de rigidez5. Si no se disponía de datos en modo M para un lugar determinado, se usaban los datos del lugar disponible solamente.
Seguimiento y objetivosSe utilizaron varias fuentes de datos para identificar los objetivos clínicos de interés en el seguimiento de los participantes: nuevas exploraciones físicas, contacto telefónico, examen de historias clínicas y vinculación con el programa de datos analíticos para investigación e innovación en salud (PADRIS) del Gobierno de Cataluña, que incluye todos los ingresos hospitalarios, los diagnósticos de atención primaria y el registro oficial de mortalidad. En la fecha de obtención de los datos, el seguimiento estaba actualizado hasta el 31 de diciembre de 2016. En los participantes que se trasladaron fuera de Cataluña, la fecha de seguimiento se censuró estadísticamente para el análisis en el momento del cambio de residencia.
Se definieron cuatro objetivos principales: a) eventos de CPI, incluido el infarto de miocardio mortal o no mortal o la angina de pecho (códigos de la CIE-9 410-414 o códigos de la CIE-10 I2-I25 en las historias clínicas o los registros de mortalidad); b) eventos cerebrovasculares, incluido el ictus mortal o no mortal (códigos de la CIE-9 431-437 o códigos de la CIE-10 I69.1-I69.9, en las historias clínicas o los registros de mortalidad); c) eventos totales de enfermedad vascular, incluida la CPI mortal o no mortal, y los eventos cerebrovasculares, así como otros trastornos vasculares mortales (códigos de la CIE-9 390-459 y 798 o códigos de la CIE-10 I00-I99 en el registro de mortalidad), y d) mortalidad por cualquier causa. Todos los eventos se clasificaron por un comité de eventos con unos criterios estandarizados. Este comité lo formaban 3 investigadores del estudio a quienes se ocultó cualquier exposición de interés relevante. En el caso de que hubiera numerosos eventos en un mismo participante, se tuvo en cuenta el que se hubiera producido en primer lugar para definir el resultado vascular global combinado.
Otras covariablesUn grupo de enfermeras y entrevistadores con una formación específica para ello utilizaron cuestionarios y métodos de medición estandarizados y validados para obtener otras variables de interés10. El consumo de tabaco y el nivel de estudios se determinaron según lo indicado por los propios participantes en cuestionarios estándares. Se consideró que había hipertensión si la había diagnosticado anteriormente un médico, si el paciente recibía tratamiento o si presentaba valores de PAS ≥ 140mmHg o de PAD ≥ 90mmHg. Se obtuvieron muestras de sangre en ayunas y se determinaron las concentraciones de colesterol total, colesterol de lipoproteínas de alta densidad, triglicéridos y glucosa. Las concentraciones de colesterol de lipoproteínas de baja densidad se calcularon con el empleo de la fórmula de Friedewald si los triglicéridos eran <300mg/dl. La presencia de diabetes se definió por la existencia de un diagnóstico previo, el uso de tratamiento para ella o unos valores de glucosa en ayunas ≥ 126mg/dl. Los eventos vasculares previos los notificaba el propio participante y se validaban mediante las historias clínicas hospitalarias y de ambulatorios.
Análisis estadísticoLos datos de variables cualitativas se expresan en número y porcentaje. Las variables continuas se expresan en forma de media (desviación estándar) o mediana [rango intercuartílico]. Se utilizó la prueba de la t de Student o la prueba no paramétrica de Mann-Whitney para identificar las diferencias entre los grupos en cuanto a rasgos continuos. Se utilizó la prueba de la χ2 para evaluar las diferencias entre los grupos en cuanto a las variables cualitativas. La asociación bivariante entre variables continuas se evaluó con el coeficiente de correlación de Spearman.
Con objeto de explorar el patrón de dosis-respuesta lineal y no lineal de la relación entre los índices de rigidez carotídea y los resultados vasculares o la mortalidad por cualquier causa, se utilizaron modelos de regresión de Cox o de Fine-Gray (para tener en cuenta el riesgo competidor para los eventos), con homogeneización de splines penalizada para cada variable de interés de la rigidez. La mortalidad no cardiovascular se consideró un evento competidor para los eventos cardiovasculares, la mortalidad no coronaria un evento competidor para los eventos coronarios, y la mortalidad no cerebrovascular un evento competidor para los eventos cerebrovasculares. Cuando la relación incluía un componente no lineal significativo (p <0,05), se utilizó un análisis morfológico de la curva para definir el mejor nudo en el que se observaba un cambio en la relación dosis-respuesta lineal. A continuación, se segmentaban los análisis según este nudo y se aplicaba un modelo de regresión de Cox o de Fine-Gray en el que se tenía en cuenta el índice de rigidez de interés como variable continua en cada uno de los segmentos definidos, partiendo del supuesto de un riesgo lineal en cada uno de los segmentos. Todos los modelos se ajustaron por completo a priori respecto a edad, sexo, factores de riesgo cardiovascular clásicos (índice de masa corporal, tabaquismo, diabetes, PAS, presión arterial diastólica, colesterol de lipoproteínas de baja densidad, colesterol de lipoproteínas de alta densidad y triglicéridos), y respecto a la diabetes, la hipertensión, la dislipidemia y sus respectivos tratamientos.
El valor predictivo añadido de los índices de rigidez carotídea se evaluó mediante el análisis de la mejora de la discriminación (área bajo la curva ROC [AUC]) y en el índice de reclasificación neta (IRN) por categorías, tomando como valores de corte el 5 y el 10% cuando se incluía cada uno en las funciones de riesgo validadas y específicas de la CPI (REGICOR)11 y de los eventos cerebrovasculares (FRESCO)12.
Todas las pruebas estadísticas se basaron en la verificación de hipótesis bilateral y se consideraron estadísticamente significativos los valores de p inferiores a 0,05. El análisis estadístico se llevó a cabo con el programa R, versión 4.1.2, y se utilizaron también los paquetes de R para la función pspline, supervivencia, cmprsk y mstate.
Para el análisis de sensibilidad se examinó el posible papel del laboratorio en que se habían analizado las imágenes, de 3 formas: a) incluyendo la interacción entre el laboratorio y la variable de rigidez en el modelo multivariante; b) estratificando el análisis según el laboratorio, y c) incluyendo el laboratorio como covariable en el modelo multivariante.
RESULTADOSEn la figura 2 se muestra el diagrama de flujo de los participantes que se incluyeron finalmente en el análisis (n=6.468; 73,67% de los participantes que cumplieron inicialmente los requisitos). No se observaron diferencias clínicamente significativas entre los participantes incluidos (n=6.468) y los no incluidos (n=2.312) (tabla 1 del material adicional).
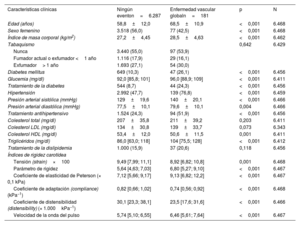
La mediana de seguimiento fue 6,5 años, y se observaron 97, 85, 181 y 311 eventos de CPI, eventos cerebrovasculares, eventos vasculares globales y eventos mortales, respectivamente. Estos eventos suponen una tasa de incidencia acumulada del 1,50, el 1,31, el 2,80 y el 4,81%, respectivamente, durante el seguimiento. En la tabla 1 se presentan las características de los participantes incluidos en el estudio, estratificados según la incidencia de la enfermedad vascular global. Los participantes con enfermedad vascular global eran de mayor edad, incluían una mayor proporción de hombres y tenían una mayor prevalencia de factores de riesgo vascular. También presentaban valores superiores de rigidez, coeficiente de elasticidad de Peterson y VOP, y valores inferiores de la tensión y los coeficientes de adaptación y distensibilidad. En las tablas 2 a 4 del material adicional se muestran las características de los participantes estratificados según la presencia de CPI, enfermedad cerebrovascular y la mortalidad global. La correlación entre los índices de rigidez carotídea y los factores de riesgo vascular se muestra en la tabla 2.
Características clínicas y valores de rigidez carotídea en los participantes con y sin un evento vascular durante el seguimiento
| Características clínicas | Ningún eventon=6.287 | Enfermedad vascular globaln=181 | p | N |
|---|---|---|---|---|
| Edad (años) | 58,8±12,0 | 68,5±10,9 | <0,001 | 6.468 |
| Sexo femenino | 3.518 (56,0) | 77 (42,5) | <0,001 | 6.468 |
| Índice de masa corporal (kg/m2) | 27,2±4,45 | 28,5±4,63 | <0,001 | 6.462 |
| Tabaquismo | 0,642 | 6.429 | ||
| Nunca | 3.440 (55,0) | 97 (53,9) | ||
| Fumador actual o exfumador <1 año | 1.116 (17,9) | 29 (16,1) | ||
| Exfumador> 1 año | 1.693 (27,1) | 54 (30,0) | ||
| Diabetes mellitus | 649 (10,3) | 47 (26,1) | <0,001 | 6.456 |
| Glucemia (mg/dl) | 92,0 [85,8; 101] | 96,0 [88,9; 109] | <0,001 | 6.411 |
| Tratamiento de la diabetes | 544 (8,7) | 44 (24,3) | <0,001 | 6.456 |
| Hipertensión | 2.992 (47,7) | 139 (76,8) | <0,001 | 6.459 |
| Presión arterial sistólica (mmHg) | 129±19,6 | 140±20,1 | <0,001 | 6.466 |
| Presión arterial diastólica (mmHg) | 77,5±10,1 | 79,6±10,1 | 0,004 | 6.466 |
| Tratamiento antihipertensivo | 1.524 (24,3) | 94 (51,9) | <0,001 | 6.456 |
| Colesterol total (mg/dl) | 207±35,8 | 211±39,2 | 0,203 | 6.411 |
| Colesterol LDL (mg/dl) | 134±30,8 | 139±33,7 | 0,073 | 6.343 |
| Colesterol HDL (mg/dl) | 53,4±12,0 | 50,6±11,5 | 0,001 | 6.411 |
| Triglicéridos (mg/dl) | 86,0 [63,0; 118] | 104 [75,5; 128] | <0,001 | 6.412 |
| Tratamiento de la dislipidemia | 1.000 (15,9) | 37 (20,6) | 0,118 | 6.456 |
| Índices de rigidez carotídea | ||||
| Tensión (strain)×100 | 9,49 [7,99; 11,1] | 8,92 [6,82; 10,8] | 0,001 | 6.468 |
| Parámetro de rigidez | 5,64 [4,63; 7,03] | 6,80 [5,27; 9,10] | <0,001 | 6.467 |
| Coeficiente de elasticidad de Peterson (× 0,1 kPa) | 7,12 [5,66; 9,17] | 9,13 [6,82; 12,2] | <0,001 | 6.467 |
| Coeficiente de adaptación (compliance) (kPa−1) | 0,82 [0,66; 1,02] | 0,74 [0,56; 0,92] | <0,001 | 6.468 |
| Coeficiente de distensibilidad (distensibility) (× 1.000kPa−1) | 30,1 [23,3; 38,1] | 23,5 [17,6; 31,6] | <0,001 | 6.466 |
| Velocidad de la onda del pulso | 5,74 [5,10; 6,55] | 6,46 [5,61; 7,64] | <0,001 | 6.467 |
HDL: colesterol ligado a lipoproteínas de alta densidad; LDL: colesterol ligado a lipoproteínas de baja densidad.
La distribución de los rasgos continuos se muestra en forma de media±desviación estándar o mediana [rango intercuartílico: cuartil 1; cuartil 3]. Los rasgos cualitativos se muestran mediante número (%).
Correlación de Spearman entre las variables clínicas y los índices de rigidez
| Edad | IMC | Gluc | PAS | PAD | Col-T | LDL | HDL | TG | CD | VOP | Tensión (strain) | Rig | Adap | EP | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Edad | 1 | 0,190 | 0,240 | 0,467 | 0,002 | 0,075 | 0,043 | 0,015 | 0,180 | -0,621 | 0,634 | -0,290 | 0,618 | -0,446 | 0,633 |
| IMC | <0,001 | 1 | 0,371 | 0,361 | 0,321 | 0,027 | 0,042 | -0,282 | 0,361 | -0,258 | 0,269 | -0,097 | 0,186 | -0,085 | 0,265 |
| Gluc | <0,001 | <0,001 | 1 | 0,344 | 0,222 | 0,043 | 0,030 | -0,197 | 0,330 | -0,274 | 0,281 | -0,098 | 0,212 | -0,125 | 0,280 |
| PAS | <0,001 | <0,001 | <0,001 | 1 | 0,598 | 0,061 | 0,041 | -0,116 | 0,280 | -0,588 | 0,590 | -0,115 | 0,406 | -0,361 | 0,599 |
| PAD | 0,872 | <0,001 | <0,001 | <0,001 | 1 | 0,113 | 0,108 | -0,099 | 0,227 | -0,271 | 0,272 | -0,189 | 0,068 | -0,159 | 0,271 |
| Col-T | <0,001 | 0,034 | 0,001 | <0,001 | <0,001 | 1 | 0,940 | 0,324 | 0,281 | -0,056 | 0,056 | -0,023 | 0,026 | -0,100 | 0,057 |
| C-LDL | 0,001 | 0,001 | 0,018 | 0,001 | <0,001 | <0,001 | 1 | 0,132 | 0,206 | -0,036 | 0,035 | -0,018 | 0,010 | -0,064 | 0,036 |
| C-HDL | 0,220 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | 1 | -0,412 | 0,077 | -0,082 | 0,043 | -0,062 | -0,066 | -0,080 |
| TG | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | 1 | -0,224 | 0,233 | -0,102 | 0,170 | -0,108 | 0,230 |
| CD | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | 0,005 | <0,001 | <0,001 | 1 | -0,990 | 0,703 | -0,931 | 0,773 | -0,992 |
| VOP | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | 0,005 | <0,001 | <0,001 | <0,001 | 1 | -0,696 | 0,948 | -0,767 | 0,995 |
| Tensión (strain) | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | 0,060 | 0,147 | 0,001 | <0,001 | <0,001 | <0,001 | 1 | -0,743 | 0,615 | -0,682 |
| Rig | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | 0,035 | 0,427 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | 1 | -0,753 | 0,936 |
| Adap | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | 1 | -0,766 |
| EP | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | 0,004 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | <0,001 | 1 |
Adap: coeficiente de adaptación (compliance); CD: coeficiente de distensibilidad (distensibility); C-HDL: colesterol ligado a lipoproteínas de alta densidad; C-LDL: colesterol ligado a lipoproteínas de baja densidad; Col-T: colesterol total; EP: coeficiente de elasticidad de Peterson; Gluc: glucosa; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; Rig: rigidez; TG: triglicéridos; VOP: velocidad de la onda del pulso.
Correlación de Spearman (coeficiente ρ, encima de la diagonal; valor de p, debajo de la diagonal) entre las variables clínicas y los índices de rigidez de interés.
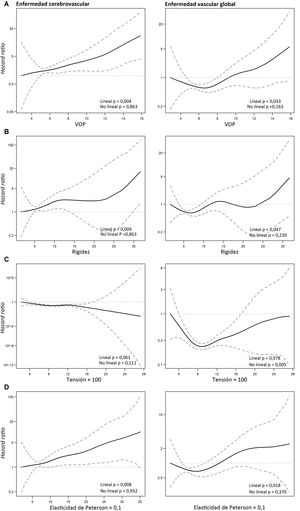
La asociación entre dosis y respuesta entre los índices de rigidez de la arteria carótida y los resultados de interés puso de manifiesto 3 patrones (figura 3; figura 1 del material adicional): a) los coeficientes de adaptación y distensibilidad no se relacionaban con ninguno de los resultados interés; b) la VOP, la rigidez y el coeficiente de elasticidad de Peterson tenían una relación lineal y directa con la enfermedad cerebrovascular y la enfermedad vascular global (figura 3A,B,D), y c) la tensión mostró una relación no lineal, en forma de U con la enfermedad vascular global y con la CPI (figura 2C; figura 1C del material adicional), con una disminución inicial del riesgo hasta valores de 0,09 y un aumento posterior del riesgo a partir de valores de tensión de> 0,09.
Riesgo relativo predicho (con intervalos de confianza del 95%: líneas de puntos) de enfermedad cerebrovascular y de enfermedad vascular global en relación con varios índices de rigidez (A-D). El gráfico se generó con el empleo de un modelo de regresión de Cox con funciones de homogeneización (smoothing) de splines y 2 grados de libertad.
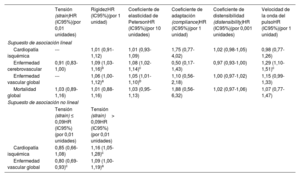
En el modelo de regresión de Cox multivariable, el riesgo de enfermedad cerebrovascular aumentó el 9% (IC95%, del 3 al 16%) por cada unidad de aumento de la rigidez, el 8% (IC95%, 2-14) por cada aumento de 10 unidades en el coeficiente de elasticidad de Peterson y el 29% (IC95%, 10-51) por cada unidad de aumento de la VOP (tabla 3). En el análisis de la enfermedad vascular global, el aumento de riesgo por unidad de rigidez y de elasticidad de Peterson fue del 6% (IC95%, 0-12) y del 5% (IC95%, 1-10%), respectivamente (tabla 3).
Asociación ajustada multivariante entre cada uno de los índices de rigidez carotídea y los resultados de interés, teniendo en cuenta los riesgos competidores
| Tensión (strain)HR (IC95%)(por 0,01 unidades) | RigidezHR (IC95%)(por 1 unidad) | Coeficiente de elasticidad de PetersonHR (IC95%)(por 10 unidades) | Coeficiente de adaptación (compliance)HR (IC95%)(por 1 unidad) | Coeficiente de distensibilidad (distensibility)HR (IC95%)(por 0,001 unidades) | Velocidad de la onda del pulsoHR (IC95%)(por 1 unidad) | |
|---|---|---|---|---|---|---|
| Supuesto de asociación lineal | ||||||
| Cardiopatía isquémica | --- | 1,01 (0,91-1,12) | 1,01 (0,93-1,09) | 1,75 (0,77-4,02) | 1,02 (0,98-1,05) | 0,98 (0,77-1,26) |
| Enfermedad cerebrovascular | 0,91 (0,83-1,00) | 1,09 (1,03-1,16)b | 1,08 (1,02-1,14)c | 0,50 (0,17-1,43) | 0,97 (0,93-1,00) | 1,29 (1,10-1,51)c |
| Enfermedad vascular global | --- | 1,06 (1,00-1,12)a | 1,05 (1,01-1,10)b | 1,10 (0,56-2,18) | 1,00 (0,97-1,02) | 1,15 (0,99-1,33) |
| Mortalidad global | 1,03 (0,89-1,16) | 1,01 (0,88-1,16) | 1,03 (0,95-1,13) | 1,88 (0,56-6,32) | 1,02 (0,97-1,06) | 1,07 (0,77-1,47) |
| Supuesto de asociación no lineal | ||||||
| Tensión (strain) ≤ 0,09HR (IC95%)(por 0,01 unidades) | Tensión (strain)> 0,09HR (IC95%)(por 0,01 unidades) | |||||
| Cardiopatía isquémica | 0,85 (0,66-1,08) | 1,16 (1,05-1,28)c | ||||
| Enfermedad vascular global | 0,80 (0,69-0,93)c | 1,09 (1,00-1,19)a | ||||
HR: hazard ratio; IC95%: intervalo de confianza del 95%.
Ajustado respecto a edad, sexo, índice de masa corporal, tabaquismo, diabetes, presión arterial sistólica, presión arterial diastólica, colesterol ligado a lipoproteínas de baja densidad, colesterol ligado a lipoproteínas de alta densidad, triglicéridos. Riesgos competidores: mortalidad no cardiovascular como evento competidor para la cardiopatía isquémica y enfermedad cerebrovascular, mortalidad por cardiopatía isquémica como evento competidor para las enfermedades cerebrovasculares, y mortalidad por enfermedad cerebrovascular como evento competidor para la cardiopatía isquémica. Supuesto de asociación lineal: se contempla un supuesto de asociación lineal para todos los índices. Supuesto de asociación no lineal: el análisis de la asociación entre la tensión (strain) y la enfermedad vascular global/cardiopatía isquémica se segmentó según el nudo en el que se observa un cambio de la relación entre dosis y respuesta lineal (0,09), y la tensión se considera una variable continua en cada uno de los segmentos definidos, partiendo del supuesto de un riesgo lineal en cada uno de los segmentos.
Dado que la asociación entre la tensión y la enfermedad vascular global no era lineal, se estratificó el análisis según el punto que diferenciaba mejor los 2 patrones de la asociación: ≤ 0,09 y> 0,09 (figura 2C, tabla 3). Cuando la tensión era ≤ 0,09 unidades, cada 0,01 de aumento se asociaba a un riesgo inferior de eventos vasculares (HR, 0,80; IC95%, 0,69-0,93), mientras que, cuando la tensión era> 0,09, cada 0,01 de aumento de la tensión se asociaba a un riesgo superior de eventos vasculares (HR, 1,09; IC95%, 1,00-1,19). Este patrón no lineal dependía principalmente del riesgo de CPI: cuando la tensión era ≤ 0,09 unidades, cada 0,01 de aumento se asociaba a un riesgo inferior de eventos coronarios (HR, 0,85; IC95%, 0,66-1,08), mientras que, por encima de ese valor, cada 0,01 de aumento de la tensión se asociaba a un riesgo superior de eventos coronarios (HR, 1,16; IC95%, 1,05-1,28). Los índices de rigidez de la arteria carótida no se asociaban a la mortalidad por cualquier causa.
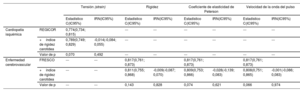
La adición de la tensión, la rigidez, el coeficiente de elasticidad de Peterson o la VOP a los modelos predictivos validados para la CPI o los eventos cerebrovasculares no mejoró la capacidad de discriminación ni la reclasificación de los modelos del riesgo clínico (tabla 4).
Análisis de la capacidad predictiva añadida de los índices de rigidez carotídea para la cardiopatía isquémica y los eventos cardiovasculares
| Tensión (strain) | Rigidez | Coeficiente de elasticidad de Peterson | Velocidad de la onda del pulso | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Estadístico C(IC95%) | IRN(IC95%) | Estadístico C(IC95%) | IRN(IC95%) | Estadístico C(IC95%) | IRN(IC95%) | Estadístico C(IC95%) | IRN(IC95%) | ||
| Cardiopatía isquémica | REGICOR | 0,774(0,734; 0,815) | --- | --- | --- | --- | --- | --- | |
| +índice de rigidez carotídea | 0,789(0,749; 0,829) | -0,014(-0,084; 0,055) | --- | --- | --- | --- | --- | --- | |
| Valor de p | 0,070 | 0,492 | --- | --- | --- | --- | --- | --- | |
| Enfermedad cerebrovascular | FRESCO | --- | --- | 0,817(0,761; 0,873) | 0,817(0,761; 0,873) | 0,817(0,761; 0,873) | |||
| +índice de rigidez carotídea | --- | --- | 0,811(0,755; 0,868) | -0,009(-0,087; 0,070) | 0,809(0,753; 0,866) | -0,028(-0,139; 0,083) | 0,808(0,751; 0,865) | -0,001(-0,086; 0,083) | |
| Valor de p | --- | --- | 0,143 | 0,828 | 0,074 | 0,621 | 0,066 | 0,974 | |
IC95%: intervalo de confianza del 95%; se utilizó el IRN, índice de reclasificación neta por categorías (usando 0-4,99%; 5-9,99%; ≥ 10% para definir las categorías de riesgo bajo, intermedio y alto, respectivamente).
Los resultados estratificados según el sexo (tablas 5 y 6 del material adicional) y el análisis de sensibilidad fueron coherentes con lo observado en el análisis principal.
DISCUSIÓNEn este estudio se analizó la asociación entre dosis y respuesta lineal y no lineal de varios índices de la rigidez de la arteria carótida local con los resultados vasculares clínicos y con la mortalidad global. Se describió una asociación lineal, directa e independiente entre la enfermedad cerebrovascular y la rigidez carotídea, el coeficiente de elasticidad de Peterson y la VOP. También se describió una asociación no lineal independiente entre la tensión carotídea y la enfermedad vascular global y la CPI, con un cambio claro en el sentido de la asociación a un valor de tensión de 0,09: una asociación inversa por debajo de este valor y una asociación directa por encima de este umbral. La adición de estos índices a las funciones de riesgo coronario o cerebrovascular específicas no mejoró la capacidad predictiva.
La asociación entre los índices de la rigidez carotídea local y los resultados vasculares se ha analizado en estudios previos. Tres revisiones sistemáticas publicadas entre 2015 y 2016 resumen la evidencia existente4,13,14 que respalda la asociación entre arterias carótidas más rígidas y riesgo de enfermedad cerebrovascular en la mayor parte de los estudios15–19, aunque no en todos ellos20–21. Estos estudios también señalan una falta de asociación entre la mayor parte de los índices de rigidez carotídea y el riesgo de CPI4,13,22.
En nuestro estudio se incorporó uno de los tamaños muestrales más grandes y uno de los seguimientos más prolongados para evaluar la correlación entre la rigidez carotídea y la enfermedad vascular. Además, se examinaron patrones de dosis-respuesta tanto lineales como no lineales en esa relación. Este análisis es crucial para identificar patrones no lineales que puedan definir valores específicos de rigidez en los cuales la magnitud del efecto de la asociación muestre un aumento o una disminución exponenciales, alcance una estabilización o incluso se invierta el sentido de la asociación. Se reprodujo una asociación lineal entre algunos índices de la rigidez carotídea y la enfermedad cerebrovascular. Los mecanismos que explican esta asociación se han relacionado con un aumento de la presión pulsátil y de la carga de flujo, que se caracteriza por un incremento de la presión del pulso4.
Resulta difícil discernir si la rigidez carotídea es una causa o una consecuencia de la disfunción vascular. Por un lado, los fármacos antihipertensivos reducen la presión del pulso, con lo que mejoran la función vascular; por otro lado, el aumento de la presión del pulso induce una disfunción vascular y endotelial23,24, y un remodelado hipertrófico arterial y una rarefacción de las pequeñas arterias cerebrales, con lo que se reduce la capacidad de relajación vascular25. Se han propuesto también otros factores proinflamatorios, proliferativos, prooxidantes y hemostáticos26, así como la hemorragia intraplaca carotídea a través de placas ateroescleróticas propensas a la rotura27, como posibles factores que intervengan en esta relación compleja entre rigidez arterial, disfunción vascular y eventos clínicos.
Tiene interés señalar que se ha observado también una asociación no lineal entre la tensión carotídea y la enfermedad vascular global, que depende principalmente del riesgo de CPI. La tensión carotídea no se ha relacionado anteriormente con el riesgo de CPI4,14, aunque generalmente la relación entre dosis y respuesta no lineal no se ha explorado adecuadamente y se ha supuesto la existencia de una relación lineal. Esta observación fue inesperada (principalmente por lo que respecta a la asociación directa observada en valores superiores a 0,09 unidades de tensión con el riesgo de CPI) y no se puede descartar que se trate de una asociación espuria, ya que los índices de rigidez carotídea locales podrían no reflejar la disfunción vascular coronaria local. No obstante, este patrón no lineal de asociación merece una evaluación y una posible replicación de los resultados en otros estudios.
Por último, la inclusión de los índices de rigidez carotídea en funciones específicas del riesgo coronario o cerebrovascular no mejoró la capacidad predictiva de esas funciones. Un metanálisis previo con datos individuales señaló una mejora de la reclasificación (IRN continuo, índice de discriminación integrada), pero no de la capacidad de discriminación de modelo original4. Así pues, el valor predictivo añadido limitado, junto con la falta de técnicas estandarizadas y de valores de referencia, podrían limitar la utilidad de estos índices en la práctica clínica.
El principal punto fuerte de este estudio es el muestreo de base poblacional, la metodología estandarizada y el seguimiento completo de los participantes. Sin embargo, tiene algunas limitaciones. En primer lugar, a pesar de las recomendaciones de consensos de expertos de determinar la presión del pulso en el lugar de la distensión3, se determinó la presión del pulso a partir de mediciones de la arteria humeral y es posible que ello no refleje las condiciones de presión locales existentes en las arterias carótidas. Los índices de rigidez carotídea se midieron en 2 laboratorios, lo cual podría haber introducido algunos errores de clasificación de las variables principales de exposición, a pesar de utilizar la misma metodología. Sin embargo, no se observaron diferencias entre los laboratorios y los resultados fueron uniformes en los análisis de sensibilidad. La variabilidad interecografistas e intraecografista se evaluó con el empleo de mediciones repetidas del grosor de la íntima-media (GIM), pero no de los índices de rigidez. Los eventos cerebrovasculares incluyeron los ictus mortales y los no mortales, pero no se dispuso de información respecto al tipo de ictus.
CONCLUSIONESLa rigidez carotídea, el coeficiente de elasticidad de Peterson y la VOP tienen una asociación lineal y directa con el riesgo de enfermedad cerebrovascular. La tensión de la carótida muestra una relación no lineal, en forma de U, con el riesgo de CPI; se observa una asociación inicial inversa hasta valores de 0,09 y una asociación directa por encima de ese valor. Sin embargo, la inclusión de estos índices de rigidez no mejoró la capacidad predictiva de las funciones de riesgo.
- –
La asociación entre la rigidez carotídea y la enfermedad cerebrovascular se ha documentado ya con anterioridad.
- –
Sin embargo, el patrón de la relación entre dosis y respuesta de estas asociaciones no se ha evaluado adecuadamente.
- –
Varios parámetros de la rigidez carotídea (rigidez, coeficiente de elasticidad de Peterson y VOP) muestran una relación positiva lineal con el riesgo cerebrovascular, pero no con el riesgo de CPI.
- –
La asociación no lineal entre la tensión carotídea y la CPI debería replicarse en otros estudios.
- –
La adición de los índices de rigidez no mejoró la capacidad predictiva de los modelos de riesgo cerebrovascular y de riesgo de CPI validados.
Este trabajo fue financiado por el Instituto de Salud Carlos III-Fondo de Desarrollo Regional Europeo [CIBERCV]; PERIS de la Agència de Gestió d’Ajuts Universitaris i de Recerca [SLT002/16/00088], y el Gobierno de Cataluña a través de la Agencia de Gestión de Ayudas Universitarias y de Investigación [2017SGR946].
CONSIDERACIONES ÉTICASSe informó debidamente a todos los participantes, que otorgaron el consentimiento por escrito. El estudio fue aprobado por el comité de ética del Parc de Salut Mar (2016/7075/I). Se han tenido en cuenta los aspectos de género en la selección, la obtención de los datos y los análisis.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALDurante la preparación de este trabajo, los autores no utilizaron ninguna herramienta de inteligencia artificial.
CONTRIBUCIÓN DE LOS AUTORESContribución sustancial en la idea y diseño del trabajo: R. Elosua, R. Arnold, E. de Groot, I.R. Degano, J. Marrugat, R. Ramos. Contribución sustancial en la obtención de los datos del trabajo: R. Elosua, R. Arnold, E. de Groot, R. Martí-Lluch, I.R. Degano, J. Marrugat, R. Ramos. Contribución sustancial en el análisis y la interpretación del trabajo: R. Elosua, A. Toloba, R. Ramos. Redacción de la versión inicial del trabajo: R. Elosua, R. Ramos. Revisión crítica del trabajo en cuanto a contenido intelectual importante: A. Toloba, R. Arnold, E. de Groot, R. Martí-Lluch, I.R. Degano, J. Marrugat. Aprobación final de la versión para publicar: R. Elosua, A. Toloba, R. Arnold, E. de Groot, R. Martí-Lluch, I.R. Degano, J. Marrugat, R. Ramos. Aceptación de la responsabilidad respecto a todos los aspectos del trabajo por lo que respecta a garantizar que las cuestiones relativas a la exactitud o integridad de cualquier parte de este se hayan investigado y resuelto adecuadamente: R. Elosua, A. Toloba, R. Arnold, E. de Groot, R. Martí-Lluch, I.R. Degano, J. Marrugat, R. Ramos.
CONFLICTO DE INTERESESNinguno.
Damos las gracias a Elaine M. Lilly, PhD, por su lectura crítica y corrección del texto inglés.