Comparar la incidencia en 3 años de eventos mayores en pacientes con lesiones de bifurcación tratados con implante condicional de stents liberadores de sirolimus frente a stents liberadores de everolimus.
MétodosSe llevó a cabo un análisis combinado de dos ensayos prospectivos y aleatorizados de metodología similar (SEAside y CORpal). En dichos ensayos, se asignó aleatoriamente a 443 pacientes con lesiones de bifurcación a tratamiento con stents liberadores de sirolimus o everolimus. El seguimiento clínico se amplió a 3 años para evaluar los eventos adversos cardiovasculares mayores (muerte o infarto agudo de miocardio o revascularización de vaso diana).
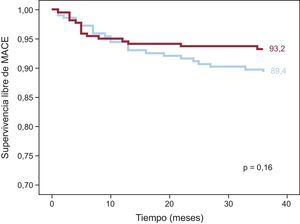
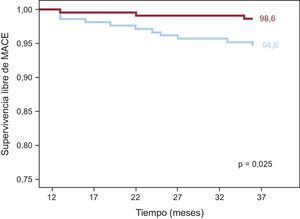
ResultadosA los 3 años, la supervivencia libre de eventos adversos cardiovasculares mayores fue del 93,2 y el 91,3% en los grupos de stents liberadores de everolimus y sirolimus respectivamente (p = 0,16). El análisis exploratorio de referencia para los eventos tardíos (aparecidos después de los primeros 12 meses) mostró una frecuencia de eventos adversos cardiovasculares mayores significativamente inferior en el grupo de stents liberadores de everolimus: el 1,4 frente al 5,4% en el grupo de stents liberadores de sirolimus (p = 0,02).
ConclusionesEl implante de stents liberadores de sirolimus o everolimus en lesiones de bifurcación se asocia a unas tasas bajas de eventos adversos mayores a los 3 años de seguimiento. Los resultados de un subanálisis de los eventos que se produjeron después del primer año indican una tasa de eventos con los stents liberadores de everolimus inferior que con los liberadores de sirolimus, lo cual indica que está justificado realizar estudios exploratorios del beneficio clínico a largo plazo obtenido con los stents liberadores de fármacos de última generación.
Palabras clave
La tecnica de stent condicional en la rama lateral (RL) es el método percutáneo actualmente recomendado para el tratamiento de los pacientes con lesiones de bifurcación coronaria1. Sin embargo, su resultado puede verse influido por el tipo de stent liberador de fármacos (SLF) implantado en el vaso principal (VP). De hecho, durante el tratamiento de una bifurcación, la plataforma metálica del stent puede sufrir una deformación y puede dañarse también el polímero2. Además, las turbulencias del flujo sanguíneo que se producen en los stents implantados en bifurcaciones pueden facilitar tanto la reestenosis como los eventos trombóticos. En consecuencia, es necesario diseñar ensayos clínicos específicos en pacientes con lesiones de la bifurcación para establecer las posibles diferencias existentes entre los SLF actualmente existentes.
Este artículo es el resultado de un estudio de colaboración destinado a comparar la eficacia y la seguridad de dos de los SLF más ampliamente utilizados. Se ha realizado un análisis combinado de los dos ensayos prospectivos y aleatorizados disponibles, que utilizaron una metodología similar (SEAside y CORpal)3,4, con un seguimiento clínico ampliado hasta los 3 años. El objetivo principal de este estudio es analizar las diferencias en eventos adversos cardiovasculares mayores (MACE) durante este periodo entre el grupo de pacientes tratados con stent liberador de sirolimus (SLS) y el de pacientes tratados con stent liberador de everolimus (SLE).
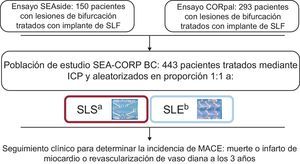
MÉTODOSEstudiosEste análisis combinado, el estudio SEAside, incluyó a 150 pacientes con lesiones de la bifurcación a los que se implantó un SLF con una estrategia de implante condicional en RL. Se asignó aleatoriamente a los pacientes al tratamiento con un SLS (n = 75) o un SLE (n = 75) antes de la intervención. El diámetro del VP debía ser ≥ 2,5 mm y el de la RL, ≥ 2,0 mm respectivamente, según la estimación visual; anteriormente se han presentado los datos obtenidos en el seguimiento realizado a los 18 meses3. Los investigadores del estudio CORpal incluyeron a 293 pacientes con lesiones de bifurcación en la asignación aleatoria a tratamiento con SLS (n = 145) o SLE (n = 148). El diámetro del VP debía ser ≥ 2,50 mm y el de la RL, ≥ 2,25 mm respectivamente, según la estimación visual. Anteriormente ya se había descrito también el seguimiento a 1 año4.
PacientesDurante los años 2007 y 2008, se incluyó a 443 pacientes con lesiones de bifurcación tratados con la técnica de stent condicional en RL provenientes de tres centros (dos de España y uno de Italia) y se los asignó aleatoriamente a tratamiento con SLS (Cypher Select, Cordis; Warren, New Jersey, Estados Unidos) o SLE (Xience V, Abbott Vascular) Santa Clara, California, Estados Unidos) en el VP. En la figura 1 se resume el diagrama de flujo del estudio conjunto. Los pacientes cumplían los siguientes criterios de inclusión: a) la lesión era > 50% y estaba situada en un punto de bifurcación importante, con independencia de longitud, morfología o angulación; b) el VP tenía un diámetro ≥ 2,50mm; c) la RL tenía un diámetro ≥ 2,00 mm en el estudio SEAside y > 2,25 mm en el estudio CORpal, y d) la longitud de la estenosis en la RL era < 10 mm en el estudio CORpal, mientras que no se aplicó ninguna limitación en cuanto a la longitud de la lesión de la RL en el estudio SEAside. Los criterios de exclusión fueron: a) contraindicaciones para tratamiento antiagregante plaquetario combinado doble a largo plazo, y b) fase aguda de infarto de miocardio (angioplastia directa o de rescate); en el ensayo SEAside, los pacientes no debían presentar un infarto agudo de miorcardio con elevación aguda del segmento ST (en un plazo de 48 h), mientras que los investigadores del ensayo CORpal incluyeron a pacientes con un infarto agudo de miorcardio después de 24 h de trombolisis intravenosa, y c) shock cardiogénico. Se obtuvo el consentimiento informado escrito de todos los pacientes.
IntervenciónLas intervenciones coronarias percutáneas se realizaron por abordaje radial o femoral, según la preferencia del médico. Se trató a todos los pacientes con stents utilizando una estrategia simple o implante condicional en RL. Así pues, se implantó un primer stent en el VP, dejando una guía en la RL que quedaba enjaulada entre la estructura metálica del stent y la pared vascular. Llegados a este punto, se evaluaba el ostium de la RL. Si había afección de la RL, se realizaba una posdilatación simultánea o secuencial de la RL. Tras esta maniobra, se evaluaba de nuevo el ostium de la RL y se implantaba un segundo stent en la RL si el operador lo consideraba necesario en el estudio SEAside y si había una estenosis residual > 50% o flujo coronario TIMI (Thrombolysis in Myocardial infarction) < 3 en el estudio CORpal. Se implantó el stent en RL según la técnica de stent en T5. El éxito de la intervención se definió como flujo TIMI 3 tanto en VP como en RL y una estenosis residual visual ≤ 20% en el VP. En el momento de la intervención coronaria percutánea, todos los pacientes estaban recibiendo tratamiento antiagregante plaquetario combinado doble con ácido acetilsalicílico y tienopiridinas. La anticoagulación para la intervención se realizó con heparina no fraccionada (70-100 U/kg en bolo intravenoso, con un posterior ajuste para mantener un tiempo de coagulación activado de aproximadamente 300 s). En ambos estudios, el uso de inhibidores de la glucoproteína IIb/IIIa se dejó al criterio del operador. Después de la intervención, todos los pacientes recibieron tratamiento antiagregante plaquetario combinado doble durante al menos 12 meses, con instrucciones de continuar indefinidamente con el ácido acetilsalicílico. Después de la intervención coronaria percutánea, se realizó a todos los pacientes un electrocardiograma tras la intervención coronaria percutánea, así como determinaciones de creatincinasa tras 6 y 24 h. Posteriormente se efectuaron otros electrocardiogramas y evaluaciones enzimáticas si estaba indicado clínicamente. El infarto de miocardio sin onda Q se definió como un aumento de creatincinasa de hasta 3 veces el límite superior del intervalo de normalidad.
Estudio angiográficoLa anatomía de la bifurcación en la situación basal se evaluó con la clasificación de Medina et al6. Se realizaron angiografías antes y después de la intervención coronaria utilizando el sistema CAAS II versión 4.1.1 (Pie Medical Imaging; Maastricht, Países Bajos) o el sistema CardiOp-B7 para angiografía coronaria cuantitativa. Se empleó el catéter lleno de contraste como referencia. Se determinaron los siguientes parámetros en la angiografía previa y posterior a la intervención coronaria: diámetro de referencia, diámetro mínimo de la luz y porcentaje de estenosis del VP, así como diámetro de referencia, diámetro mínimo de la luz y porcentaje de estenosis de la RL. Se realizó una ecografía intravascular a criterio del operador.
Estudio de seguimientoDespués del alta, los pacientes fueron objeto de un seguimiento mediante visitas en el hospital o telefónicamente al cabo de 1 año, 18 meses (pacientes del ensayo SEAside) y 3 años. Para los pacientes con recurrencias, síntomas o isquemia inducible, se recomendó la evaluación angiográfica. Los eventos clínicos se definieron como sigue: a) muerte: la causa de la muerte se determinó revisando los datos de la historia clínica, y se consideró muerte cardiaca a toda muerte sin una causa no cardiaca clara; b) infarto agudo de miocardio: aumento y disminución característicos de los marcadores bioquímicos de la necrosis miocárdica con síntomas isquémicos o alteraciones del electrocardiograma 24 h después de la intervención inicial; c) revascularización de vaso diana: nueva intervención coronaria percutánea o cirugía coronaria sobre el vaso diana a causa de isquemia recurrente; d) MACE: muerte o infarto agudo de miocardio o revascularización de vaso diana, y e) trombosis de stent: según los criterios del Academic Research Consortium8, «definitiva» (trombosis de stent confirmada mediante angiografía o autopsia) o «probable» (cualquier muerte inexplicada en los primeros 30 días o cualquier infarto de miocardio en el territorio del stent y en ausencia de otra causa obvia).
Objetivos del estudioEl objetivo principal del estudio es analizar las diferencias de MACE durante el seguimiento de 3 años entre los grupos de pacientes tratados con SLS o SLE. Los objetivos secundarios fueron cada uno de los componentes del objetivo principal (muerte o infarto agudo de miocardio o revascularización de vaso diana). Se excluyó de los MACE el infarto de miocardio periintervención.
Análisis estadísticoLas variables dicotómicas se presentan en forma de recuentos y porcentajes del total. Las variables cuantitativas se expresan como media ± desviación estándar. Las diferencias entre las proporciones se analizaron con la prueba de la χ2 o la exacta de Fisher según fuera apropiado. Se utilizó la prueba de la t de Student-Fisher para datos no apareados para comparar las variables continuas de los dos grupos de pacientes. Se generaron curvas de supervivencia libre de eventos mediante método de Kaplan-Meier. Se utilizó el log rank test para determinar la significación estadística de las diferencias entre los grupos en la tasa acumulativa de eventos a 3 años. Para comparar los eventos adversos tardíos, se realizó un subanálisis de los episodios aparecidos después de 1 año.
Un valor de p < 0,05 se consideró estadísticamente significativo. Todos los análisis se realizaron con el programa informático SPSS 20.0.0.
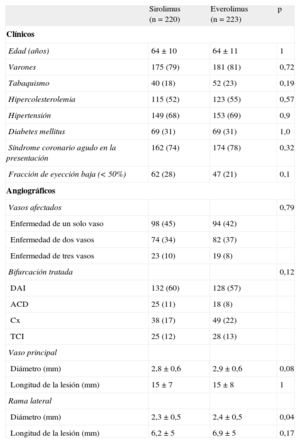
RESULTADOSDatos basalesLos datos clínicos y angiográficos basales se muestra en la tabla 1. La mayoría de los pacientes ingresaron en el hospital a causa de un síndrome coronario agudo. Las distribuciones de edad, sexo, factores de riesgo y características clínicas eran similares en ambos grupos. Un porcentaje significativo de los pacientes eran diabéticos (31%), con similar prevalencia en los dos grupos. La zona de bifurcación fue la localización más frecuente en la arteria descendente anterior izquierda/rama diagonal. Ambos grupos eran similares por lo que respecta a la localización de la bifurcación, el tamaño del VP, la gravedad de las estenosis y el tipo de lesión de bifurcación según la clasificación de Medina et al6 (tabla 2). La media de diámetro de RL era mayor en el grupo de SLE que en el de SLS (2,3 ± 0,5 frente a 2,4 ± 0,5mm; p = 0,04) (tabla 1).
Datos basales
| Sirolimus (n = 220) | Everolimus (n = 223) | p | |
| Clínicos | |||
| Edad (años) | 64 ± 10 | 64 ± 11 | 1 |
| Varones | 175 (79) | 181 (81) | 0,72 |
| Tabaquismo | 40 (18) | 52 (23) | 0,19 |
| Hipercolesterolemia | 115 (52) | 123 (55) | 0,57 |
| Hipertensión | 149 (68) | 153 (69) | 0,9 |
| Diabetes mellitus | 69 (31) | 69 (31) | 1,0 |
| Síndrome coronario agudo en la presentación | 162 (74) | 174 (78) | 0,32 |
| Fracción de eyección baja (< 50%) | 62 (28) | 47 (21) | 0,1 |
| Angiográficos | |||
| Vasos afectados | 0,79 | ||
| Enfermedad de un solo vaso | 98 (45) | 94 (42) | |
| Enfermedad de dos vasos | 74 (34) | 82 (37) | |
| Enfermedad de tres vasos | 23 (10) | 19 (8) | |
| Bifurcación tratada | 0,12 | ||
| DAI | 132 (60) | 128 (57) | |
| ACD | 25 (11) | 18 (8) | |
| Cx | 38 (17) | 49 (22) | |
| TCI | 25 (12) | 28 (13) | |
| Vaso principal | |||
| Diámetro (mm) | 2,8 ± 0,6 | 2,9 ± 0,6 | 0,08 |
| Longitud de la lesión (mm) | 15 ± 7 | 15 ± 8 | 1 |
| Rama lateral | |||
| Diámetro (mm) | 2,3 ± 0,5 | 2,4 ± 0,5 | 0,04 |
| Longitud de la lesión (mm) | 6,2 ± 5 | 6,9 ± 5 | 0,17 |
ACD: arteria coronaria derecha; Cx: arteria circunfleja; DAI: descendente anterior izquierda; TCI: tronco común izquierdo.
Los datos expresan n (%) o media ± desviación estándar.
Tipo de bifurcación según la clasificación de Medina et al6
| Sirolimus (n = 220) | Everolimus (n = 223) | p | |
| 1,1,1 | 69 (31) | 96 (43) | 0,12 |
| 1,1,0 | 66 (30) | 54 (24) | |
| 1,0,1 | 8 (4) | 4 (2) | |
| 0,1,1 | 20 (9) | 16 (7) | |
| 1,0,0 | 24 (11) | 19 (8,5) | |
| 0,1,0 | 29 (13) | 33 (15) | |
| 0,0,1 | 4 (2) | 1 (0,5) |
Los datos expresan n (%).
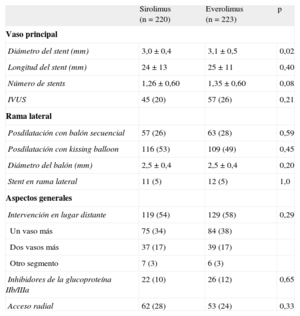
Las características de la intervención se resumen en la tabla 3. Las lesiones de ambos grupos se trataron de manera similar. Se aplicó posdilatación en la RL a la mayoría de los pacientes. El uso de un segundo stent en la RL fue bajo y casi idéntico en ambos grupos (5%). No hubo diferencias significativas entre los grupos en cuanto a los demás aspectos técnicos o el uso de inhibidores plaquetarios de la glucoproteína IIb/IIIa.
Datos de la intervención
| Sirolimus (n = 220) | Everolimus (n = 223) | p | |
| Vaso principal | |||
| Diámetro del stent (mm) | 3,0 ± 0,4 | 3,1 ± 0,5 | 0,02 |
| Longitud del stent (mm) | 24 ± 13 | 25 ± 11 | 0,40 |
| Número de stents | 1,26 ± 0,60 | 1,35 ± 0,60 | 0,08 |
| IVUS | 45 (20) | 57 (26) | 0,21 |
| Rama lateral | |||
| Posdilatación con balón secuencial | 57 (26) | 63 (28) | 0,59 |
| Posdilatación con kissing balloon | 116 (53) | 109 (49) | 0,45 |
| Diámetro del balón (mm) | 2,5 ± 0,4 | 2,5 ± 0,4 | 0,20 |
| Stent en rama lateral | 11 (5) | 12 (5) | 1,0 |
| Aspectos generales | |||
| Intervención en lugar distante | 119 (54) | 129 (58) | 0,29 |
| Un vaso más | 75 (34) | 84 (38) | |
| Dos vasos más | 37 (17) | 39 (17) | |
| Otro segmento | 7 (3) | 6 (3) | |
| Inhibidores de la glucoproteína IIb/IIIa | 22 (10) | 26 (12) | 0,65 |
| Acceso radial | 62 (28) | 53 (24) | 0,33 |
IVUS: ecocardiografía intravascular.
Los datos expresan n (%).
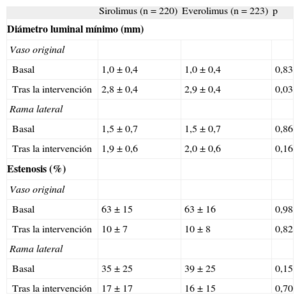
Los datos angiográficos cuantitativos se resumen en la tabla 4. La media de diámetro luminal mínimo de los segmentos tratados y la reducción de la estenosis inmediatamente después de la intervención fueron similares para el VP y para la RL en ambos grupos. Ya se describió con anterioridad3,4 los resultados durante la hospitalización y en el seguimiento a 1 año. La tasa de eventos mayores durante el primer año de seguimiento fue baja en ambos grupos, sin diferencias significativas. En la tabla 5 se resumen estos resultados.
Estudio angiográfico cuantitativo
| Sirolimus (n = 220) | Everolimus (n = 223) | p | |
| Diámetro luminal mínimo (mm) | |||
| Vaso original | |||
| Basal | 1,0 ± 0,4 | 1,0 ± 0,4 | 0,83 |
| Tras la intervención | 2,8 ± 0,4 | 2,9 ± 0,4 | 0,03 |
| Rama lateral | |||
| Basal | 1,5 ± 0,7 | 1,5 ± 0,7 | 0,86 |
| Tras la intervención | 1,9 ± 0,6 | 2,0 ± 0,6 | 0,16 |
| Estenosis (%) | |||
| Vaso original | |||
| Basal | 63 ± 15 | 63 ± 16 | 0,98 |
| Tras la intervención | 10 ± 7 | 10 ± 8 | 0,82 |
| Rama lateral | |||
| Basal | 35 ± 25 | 39 ± 25 | 0,15 |
| Tras la intervención | 17 ± 17 | 16 ± 15 | 0,70 |
Los datos expresan media ± desviación estándar.
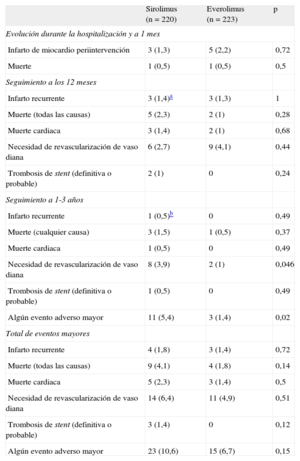
Eventos adversos cardiovasculares mayores y resultados del seguimiento
| Sirolimus (n = 220) | Everolimus (n = 223) | p | |
| Evolución durante la hospitalización y a 1 mes | |||
| Infarto de miocardio periintervención | 3 (1,3) | 5 (2,2) | 0,72 |
| Muerte | 1 (0,5) | 1 (0,5) | 0,5 |
| Seguimiento a los 12 meses | |||
| Infarto recurrente | 3 (1,4)a | 3 (1,3) | 1 |
| Muerte (todas las causas) | 5 (2,3) | 2 (1) | 0,28 |
| Muerte cardiaca | 3 (1,4) | 2 (1) | 0,68 |
| Necesidad de revascularización de vaso diana | 6 (2,7) | 9 (4,1) | 0,44 |
| Trombosis de stent (definitiva o probable) | 2 (1) | 0 | 0,24 |
| Seguimiento a 1-3 años | |||
| Infarto recurrente | 1 (0,5)b | 0 | 0,49 |
| Muerte (cualquier causa) | 3 (1,5) | 1 (0,5) | 0,37 |
| Muerte cardiaca | 1 (0,5) | 0 | 0,49 |
| Necesidad de revascularización de vaso diana | 8 (3,9) | 2 (1) | 0,046 |
| Trombosis de stent (definitiva o probable) | 1 (0,5) | 0 | 0,49 |
| Algún evento adverso mayor | 11 (5,4) | 3 (1,4) | 0,02 |
| Total de eventos mayores | |||
| Infarto recurrente | 4 (1,8) | 3 (1,4) | 0,72 |
| Muerte (todas las causas) | 9 (4,1) | 4 (1,8) | 0,14 |
| Muerte cardiaca | 5 (2,3) | 3 (1,4) | 0,5 |
| Necesidad de revascularización de vaso diana | 14 (6,4) | 11 (4,9) | 0,51 |
| Trombosis de stent (definitiva o probable) | 3 (1,4) | 0 | 0,12 |
| Algún evento adverso mayor | 23 (10,6) | 15 (6,7) | 0,15 |
Los datos expresan n (%).
Se dispuso de un seguimiento clínico a 3 años en 439 de los 443 pacientes (99,1%). Las tasas de eventos de ambos grupos se indican en la tabla 5. Se produjeron MACE a 3 años en 23 pacientes (10,6%) del grupo de SLS frente a 15 (6,7%) del grupo de SLE (p = 0,15). La incidencia de casos de muerte, revascularización de vaso diana e infarto de miocardio también fue similar en los dos grupos. Se produjo trombosis de stent definitiva o probable en 3 pacientes (1,4%) del grupo de SLS y ninguno del grupo de SLE. En la figura 2 se muestra la probabilidad de supervivencia sin MACE a los 3 años en ambos grupos de pacientes. Aunque la tasa general de MACE no mostró diferencias estadísticamente significativas entre los dos grupos, se apreció una separación de las curvas a partir del año. Así, un subanálisis de los eventos aparecidos después del primer año evidenció diferencias significativas en cuanto a la revascularización de vaso diana y el total de MACE, favorable al grupo de SLE (figura 3). Durante este periodo, hubo 4 muertes adicionales: 1 infarto de miocardio mortal en el grupo de SLS y 3 muertes no cardiacas, 2 neoplasias pulmonares y 1 aneurisma aórtico (tabla 5). En la figura 3 se presentan las curvas de Kaplan-Meier de supervivencia total después del primer año sin MACE en ambos grupos de pacientes.
Curvas de Kaplan-Meier de supervivencia libre de eventos en los dos grupos de pacientes a los 3 años de seguimiento. Los eventos mayores fueron el conjunto de episodios de muerte por todas las causas, infarto de miocardio y revascularización de vaso diana. MACE: eventos adversos cardiovasculares mayores.
Curvas de Kaplan-Meier de supervivencia sin eventos en los dos grupos de pacientes tras 1 año de seguimiento. Los eventos mayores fueron el conjunto de episodios de muerte por cualquier causa, infarto de miocardio y revascularización de vaso diana. MACE: eventos adversos cardiovasculares mayores.
Las lesiones de bifurcación constituyen un subgrupo de lesiones coronarias que plantea un verdadero reto. Se puede implantar los SLF en las lesiones bifurcadas utilizando diferentes técnicas, de entre las que el implante de stent condicional en RL es la estrategia preferida actualmente. Aunque se ha observado que los SLS han sido los más eficaces para el tratamiento percutáneo de las lesiones de bifurcación durante la última década9–13, teóricamente la segunda generación de SLF podría mejorar aún más los resultados clínicos en estos pacientes14.
Stents liberadores de everolimus frente a stents liberadores de sirolimus en las lesiones de bifurcación: el presente estudioEn este estudio se realizó un análisis combinado de los dos estudios aleatorizados existentes en los que se ha comparado un SLF de primera generación (es decir, un SLS) con un SLF de última generación (es decir, un SLE) en el contexto específico y especialmente difícil de las lesiones de bifurcación. La población en estudio presentaba unas características clínicas y angiográficas de alto riesgo, según indican la tasa del 75% de síndromes coronarios agudos y el 70% de ubicación en la bifurcación del tronco coronario izquierdo distal o la arteria descendente anterior izquierda. La intervención coronaria percutánea se llevó a cabo con la técnica de implante condicional en RL que, hasta la fecha, es el patrón de referencia para las lesiones de bifurcación no seleccionadas. En un seguimiento de 3 años, la incidencia total de MACE fue baja, y estos episodios se produjeron en el 6,7% de los pacientes del grupo de SLE frente al 10,6% de los del grupo de SLS (p = 0,15). Dado que los eventos tardíos pueden diferir entre los SLF y que las curvas de supervivencia mostraron una separación a partir de 1 año, en este estudio se investigaron específicamente estos eventos tardíos. Los resultados de este subanálisis indican que la aparición de nuevos eventos se estabilizaba después de 1 año en el grupo de SLE, con una frecuencia de revascularización del vaso diana y MACE significativamente inferior que los SLS en el intervalo comprendido entre 1 y 3 años. De entre los posibles mecanismos que podrían explicar la menor frecuencia de eventos tardíos con los SLE en comparación con los SLS, pueden desempeñar un papel tanto la idoneidad de la plataforma para el implante de stents en una bifurcación como la cicatrización a largo plazo. De hecho, se ha documentado que la abertura lateral hacia la RL es mejor con los SLE que con los SLS15 y da lugar a mejor resultado angiográfico tridimensional en el ostium de la RL3. Estos factores pueden determinar un patrón de flujo diferente a la altura de una bifurcación, lo cual podría influir en las fuerzas tangenciales locales y, por consiguiente, la respuesta de la pared vascular al stent16. Por lo que respecta al proceso de cicatrización a largo plazo, un estudio reciente de tomografía de coherencia óptica ha puesto de manifiesto que, a partir del primer año de seguimiento, los SLE tienen una tasa de struts descubiertos y sin aposición inferior que los SLS17.
Estudios previos de comparación de stents liberadores de everolimus y stents liberadores de sirolimus en lesiones no situadas en una bifurcaciónRecientemente se han publicado seis metanálisis de comparación de la eficacia y la seguridad de los SLE frente a otros SLF (incluidos los SLS)18–23. En todos ellos se combinaron los resultados de ensayos aleatorizados sin un seguimiento clínico muy largo, y se alcanzaron conclusiones similares: en comparación con otros SLF, los SLE parecen asociados a una reducción significativa de las trombosis de stent, efecto que aparece precozmente y aumenta de magnitud a todo lo largo del seguimiento. La mortalidad, la revascularización de vaso diana y los MACE no mostraron mejora significativa con los SLE.
Un reciente metanálisis de ensayos que evaluaron cuatro SLF (incluidos SLS y SLE) comparándolos entre sí o con stents metálicos, ha indicado que los SLE pueden ser muy eficaces y seguros en pacientes diabéticos22. Estas observaciones concuerdan bien con las tasas inferiores de revascularización de lesión diana y MACE observadas en nuestro estudio e indican que puede ser necesario un seguimiento más largo para detectar diferencias de rendimiento clínico entre los SLF de primera y de última generación.
LimitacionesNo se dispuso de información sobre el tratamiento médico después del primer año de seguimiento. Las diferencias en las pautas de tratamiento antitrombótico podrían determinar la evolución de los pacientes tras un seguimiento a largo plazo.
CONCLUSIONESLa estrategia de stent condicional en RL empleando SLS o SLE en lesiones de bifurcación se asocia a unas tasas bajas de MACE a los 3 años de seguimiento. Los resultados de un subanálisis de eventos después del primer año, que muestran una tasa de eventos inferior con los SLE que con los SLS, indican que se necesitan estudios que exploren el beneficio clínico a largo plazo que se obtiene con los SLF de última generación.
CONFLICTO DE INTERESESManuel Pan: pagos menores por conferencias de Abbott. Francesco Burzotta: pagos menores por conferencias de Medtronic.