El implante percutáneo de válvula aórtica se utiliza como alternativa a la sustitución valvular quirúrgica para pacientes con estenosis aórtica grave de alto riesgo quirúrgico o inoperables. Dos de las principales áreas de incertidumbre son la durabilidad de la válvula y la supervivencia a largo plazo.
MétodosRegistro unicéntrico prospectivo de un hospital terciario que incluyó consecutivamente todos los implantes percutáneos de válvula aórtica entre 2008 y 2012. Se realizó seguimiento clínico durante un mínimo de 2,5 años y un máximo de 6,5 años. Se utilizaron definiciones Valve Academic Research Consortium-2.
ResultadosSe incluyó a 79 pacientes, con un éxito inmediato del 94,9%. La mediana de supervivencia fue de 47,6 (intervalo de confianza del 95%, 37,4-57,9) meses, es decir, 4 años. Un cuarto de las muertes sucedieron en el primer mes, la mayoría de causa cardiovascular. Después del primer mes, la causa más frecuente fue no cardiovascular. Los valores medios de gradientes valvulares no se incrementaron en el seguimiento. La tasa acumulada de disfunción protésica fue del 15,3%, sin ningún caso de resustitución valvular.
ConclusionesLa mitad de los pacientes con estenosis aórtica intervenidos mediante implante percutáneo de válvula aórtica sobreviven 4 años después del procedimiento. Se detectó un 15,3% de disfunción protésica en el seguimiento acumulado, sin casos de resustitución valvular.
Palabras clave
Vídeo del artículo

La estenosis aórtica (EAo) es la valvulopatía adquirida más frecuente, con una prevalencia de hasta el 4,6% en mayores de 75 años, y la primera causa de cirugía valvular en el adulto1. En los países desarrollados, la etiología más frecuente es la EAo degenerativa2. La historia natural de la enfermedad se inicia con un largo periodo subclínico, que ningún tratamiento médico es capaz de modificar3. Los síntomas aparecen cuando la EAo es hemodinámicamente grave, y a partir de ese momento la supervivencia cae rápidamente si no se reemplaza la válvula. La sustitución valvular quirúrgica consiguió por primera vez mejorar la supervivencia en EAo grave4. Sin embargo, y a pesar de 60 años de experiencia, se estima que más de un tercio de los candidatos a sustitución valvular quirúrgica no se operaban2,5. La razón principal era su elevado riesgo quirúrgico, evaluado con escalas como EuroSCORE o la de la STS, aunque existen otros factores limitantes: edad avanzada, hepatopatía, aorta en porcelana, injertos coronarios, hipertensión pulmonar, disfunción ventricular derecha o el denominado «tórax hostil»6.
En este contexto se desarrolló el implante percutáneo de válvula aórtica (TAVI), procedimiento que ha crecido exponencialmente en poco más de una década de existencia. La indicación actual de TAVI es para pacientes con EAo grave sintomática que un equipo multidisciplinario considera inoperables por alto riesgo quirúrgico (indicación I-B). En pacientes operables con alto riesgo, la decisión debe individualizarse (indicación IIa-B)7. Estas indicaciones se basan principalmente en dos ensayos clínicos aleatorizados en que el TAVI demostró no inferioridad respecto a la sustitución valvular quirúrgica en pacientes de alto riesgo quirúrgico (PARTNER A)8 y mejora de la supervivencia y la clase funcional respecto al tratamiento médico (incluida la valvuloplastia) de pacientes inoperables (PARTNER B)9.
El procedimiento de TAVI se lleva a cabo con éxito aproximadamente en un 90-98%10–13. Varios registros han publicado una mortalidad a 30 días en torno al 5-15%8,13,14; a 1 año, un 15-30,7%9,14,15, y a 2 años en torno al 26,3-43%12,16,17. Sin embargo, más allá de los 2 años tras el procedimiento los datos son escasos, especialmente en España. Entre las áreas de incertidumbre en los TAVI están la supervivencia de los pacientes y la durabilidad de las válvulas a largo plazo.
MÉTODOSObjetivosEl objetivo principal del estudio es analizar a largo plazo la supervivencia libre de muerte por cualquier causa en una cohorte de pacientes consecutivos con EAo grave, indicación de sustitución valvular y alto riesgo quirúrgico intervenidos mediante TAVI. Los objetivos secundarios son describir la causa y la secuencia temporal de las muertes, los acontecimientos adversos y la función valvular en el seguimiento.
Diseño y selección de la muestraSe trata de un estudio observacional, prospectivo y con seguimiento de todos los pacientes consecutivos (n=79) a los que se realizó un procedimiento de TAVI en el centro entre junio de 2008 y junio de 2012.
Todos los pacientes tenían diagnóstico de EAo grave e indicación de sustitución valvular según las recomendaciones de la guía de valvulopatías de la Sociedad Europea de Cardiología7. El alto riesgo quirúrgico se definió como mortalidad esperada en EuroSCORE ≥ 15% o Society of Thoracic Surgeons (STS) ≥ 10%; se consideró inoperables a los pacientes por otros factores o comorbilidades tras la valoración del Heart Team6.
ProcedimientoLa evaluación clínica y las pruebas diagnósticas de los pacientes con EAo grave y alto riesgo quirúrgico son similares a las de las recomendaciones publicadas y se han reportado previamente6,18–20. Los procedimientos se realizaron tras la firma de su correspondiente consentimiento informado en una sala de hemodinámica en ambiente estéril, según los protocolos establecidos por el fabricante, con anestesia general y monitorización continua mediante ecocardiograma transesofágico19,20. En caso de encontrar enfermedad coronaria significativa, se revascularizaba a los pacientes y el procedimiento de TAVI se difería 1 mes. Los accesos vasculares se realizaron por disección quirúrgica femoral, excepto los primeros 10 (cierre percutáneo). El tratamiento médico post-TAVI fue ácido acetilsalicílico 100mg (indefinidamente) y clopidogrel 75mg (6 meses). La prótesis implantada fue la Edwards SAPIEN o la posterior Edwards SAPIEN XT (a partir de 2010), ambas de Edwards Lifesciencies. Para los pacientes con acceso vascular apropiado (diámetro iliofemoral <7mm o <6mm en modelo XT) se utilizó el acceso transfemoral y en los demás, el acceso transapical.
Parámetros estudiadosLas variables fueron incluidas en una base de datos especialmente dedicada. En octubre de 2011 se publicó el primer documento de consenso europeo de TAVI llamado Valve Academic Research Consortium (VARC), revisado después en las recomendaciones del VARC-26. Para este estudio, se adaptaron todas las variables a las definiciones del VARC-2, excepto la insuficiencia renal tras el procedimiento (diuresis de 24h no registrada), y el objetivo combinado de seguridad precoz por incluir la insuficiencia renal.
A continuación se definen las variables más relevantes (en el anexo del se muestran las definiciones de todas las variables):
- •
Mortalidad: mortalidad por cualquier causa (objetivo principal), subclasificada en cardiovascular y no cardiovascular (objetivo secundario); las muertes de naturaleza desconocida se atribuyeron a causa cardiovascular.
- •
Evento adverso mayor: mortalidad por cualquier causa, ictus, rehospitalización por síntomas relacionados con la válvula o por empeoramiento de la insuficiencia cardiaca, deterioro de la clase funcional a III-IV o disfunción protésica; equivalente al objetivo compuesto de VARC-2 de eficacia clínica después de 30 días.
- •
Insuficiencia renal aguda tras el procedimiento sin necesidad de hemodiálisis: incremento de la creatinina>0,5mg/dl o>50% de la cifra basal.
- •
Éxito del dispositivo (VARC-2): supervivencia tras el procedimiento, implante de una sola prótesis en su posición anatómica correcta y normofunción de la prótesis (ausencia de mismatch, gradiente medio<20mmHg o velocidad pico<3 m/s y ausencia de insuficiencia aórtica [IAo] moderada o grave).
- •
Seguridad precoz a 30 días (modificada de VARC-2): mortalidad por cualquier causa, ictus, hemorragia que amenaza la vida, insuficiencia renal aguda tras el procedimiento, obstrucción coronaria que requiere intervención, complicación vascular mayor o disfunción protésica que requiere intervención (sustitución valvular quirúrgica, nuevo TAVI o valvuloplastia).
- •
Disfunción protésica (VARC-2): gradiente protésico medio>20mmHg, área valvular efectiva<0,9-1,1cm2, índice de velocidad Doppler<0,35 y/o IAo moderada o grave.
Se realizó seguimiento prospectivo de los eventos adversos en visitas clínicas o telefónicas: a 1 mes, a los 6 meses y anualmente. El periodo de inclusión fue de junio de 2008 hasta junio de 2012. El seguimiento clínico finalizó en enero de 2015, con lo que se obtuvo un seguimiento mínimo de 2,5 años y máximo de hasta 6,5 años. No hubo pérdidas en el seguimiento clínico y hubo contacto con todos los pacientes hasta su muerte o el fin del seguimiento. En el seguimiento ecocardiográfico se perdió a 4 pacientes por traslado a otra comunidad autónoma (se obtuvo seguimiento clínico, pero no datos ecocardiográficos).
Análisis estadísticoEn la estadística descriptiva se utilizaron recuento y porcentaje (variables categóricas) y media±desviación estándar o mediana [intervalo intercuartílico] (variables cuantitativas). La comparación de datos ecocardiográficos se realizó mediante la prueba de la t de Student para datos apareados. Para el análisis de datos de supervivencia, se empleó el método de Kaplan-Meier. En el análisis de eventos adversos solo se tuvo en cuenta el primero registrado. Se consideró significativo un valor de p bilateral<0,05. Se utilizaron los programas SPSS 20 (SPSS Inc.) y STATA 11.1 (StataCorp LP).
RESULTADOSCaracterísticas de la poblaciónSe realizaron en total 79 procedimientos, todos en indicaciones aprobadas, excepto 7 casos en indicaciones off label: 2 casos con anillo aórtico<1,8cm, 2 portadores de prótesis mitral, 2 valve in valve sobre bioprótesis degeneradas y 1 sobre válvula aórtica bicúspide.
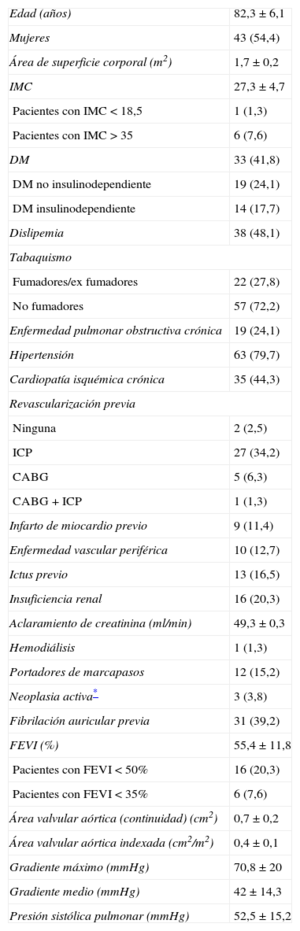
Las características clínicas y los datos ecocardiográficos basales se muestran en la tabla 1. Todos los pacientes tenían EAo grave sintomática con indicación de sustitución valvular y alto riesgo quirúrgico o inoperable. Se realizaron 64 procedimientos transfemorales (81%) y 15 transapicales (19%). Se implantó la válvula Edwards SAPIEN en 14 pacientes (17,7%) y la Edwards SAPIEN XT, en 65 (82,3%). La puntuación media en escalas de riesgo quirúrgico fue: EuroSCORE logístico, 16,9±9,1% (1,8-46,9%); EuroSCORE-2, 5,7±3,8% (0,7-18,1%); STS, 5,9±2,9% (1,1-13,4%).
Características clínicas y parámetros ecocardiográficos basales de la población (n=79)
| Edad (años) | 82,3±6,1 |
| Mujeres | 43 (54,4) |
| Área de superficie corporal (m2) | 1,7±0,2 |
| IMC | 27,3±4,7 |
| Pacientes con IMC<18,5 | 1 (1,3) |
| Pacientes con IMC>35 | 6 (7,6) |
| DM | 33 (41,8) |
| DM no insulinodependiente | 19 (24,1) |
| DM insulinodependiente | 14 (17,7) |
| Dislipemia | 38 (48,1) |
| Tabaquismo | |
| Fumadores/ex fumadores | 22 (27,8) |
| No fumadores | 57 (72,2) |
| Enfermedad pulmonar obstructiva crónica | 19 (24,1) |
| Hipertensión | 63 (79,7) |
| Cardiopatía isquémica crónica | 35 (44,3) |
| Revascularización previa | |
| Ninguna | 2 (2,5) |
| ICP | 27 (34,2) |
| CABG | 5 (6,3) |
| CABG+ICP | 1 (1,3) |
| Infarto de miocardio previo | 9 (11,4) |
| Enfermedad vascular periférica | 10 (12,7) |
| Ictus previo | 13 (16,5) |
| Insuficiencia renal | 16 (20,3) |
| Aclaramiento de creatinina (ml/min) | 49,3±0,3 |
| Hemodiálisis | 1 (1,3) |
| Portadores de marcapasos | 12 (15,2) |
| Neoplasia activa* | 3 (3,8) |
| Fibrilación auricular previa | 31 (39,2) |
| FEVI (%) | 55,4±11,8 |
| Pacientes con FEVI<50% | 16 (20,3) |
| Pacientes con FEVI<35% | 6 (7,6) |
| Área valvular aórtica (continuidad) (cm2) | 0,7±0,2 |
| Área valvular aórtica indexada (cm2/m2) | 0,4±0,1 |
| Gradiente máximo (mmHg) | 70,8±20 |
| Gradiente medio (mmHg) | 42±14,3 |
| Presión sistólica pulmonar (mmHg) | 52,5±15,2 |
CABG: revascularización coronaria quirúrgica; DM: diabetes mellitus; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IMC: índice de masa corporal.
Los valores expresan n (%) o media±desviación estándar.
Se implantó la prótesis con éxito en 75 pacientes (94,9%). Hubo 4 fallos de implante: 2 casos suspendidos por complicaciones vasculares mayores en acceso percutáneo y 2 embolizaciones. El objetivo combinado del VARC-2 de éxito del dispositivo se consiguió en 69 pacientes (87,3%). Los pacientes sin éxito del dispositivo fueron los 4 fallos de implante, 5 pacientes con gradiente medio tras el procedimiento>20mmHg y/o IAo moderada, y 1 muerte durante el procedimiento; 6 de 7 procedimientos off label tuvieron éxito del dispositivo según el VARC-2.
Solo 1 paciente falleció durante el procedimiento (oclusión coronaria y shock refractario). La mortalidad hospitalaria fue del 11,4% (9 pacientes, 2 de ellos con fallo del implante) y a 30 días, del 12,7%. Las complicaciones intrahospitalarias se muestran en la tabla 2. De los 79 procedimientos, 55 pacientes (69,6%) alcanzaron los 30 días libres de eventos del objetivo combinado de seguridad precoz modificado.
Complicaciones durante el ingreso hospitalario
| Cualquier complicación | 39 (49,4) |
| Muerte hospitalaria | 9 (11,4) |
| Complicaciones inmediatas | |
| Taponamiento que requiere drenaje | 5 (6,4) |
| Fallo de implante primario | 4 (5,0) |
| Embolización protésica | 2 (2,6) |
| Infarto agudo de miocardio | 2 (2,6) |
| Cirugía cardiaca urgentea | 1 (1,3) |
| Complicaciones respiratorias | |
| Intubación>24 h | 5 (6,4) |
| Insuficiencia respiratoriab | 3 (3,8) |
| Complicaciones renales | |
| Insuficiencia renal sin hemodiálisis | 12 (15,2) |
| Insuficiencia renal con hemodiálisis | 2 (2,6) |
| Hemorragias y complicaciones vasculares | |
| Transfusión | 17 (21,0) |
| Cualquier hemorragia (BARC) | 9 (11,4) |
| Complicación vascular menor (VARC-2)c | 9 (11,4) |
| Complicación vascular mayor (VARC-2)c | 3 (3,8) |
| Otras complicaciones | |
| Fibrilación auricular de nueva aparición | 7 (9,0) |
| Infección | 6 (7,7) |
| Implante de marcapasos definitivo | 3 (3,8) |
| Ictus | 2 (2,6) |
| Endocarditis | 0 (0,0) |
BARC: Bleeding Academic Research Consortium; VARC: Valve Academic Research Consortium.
Los valores expresan n (%).
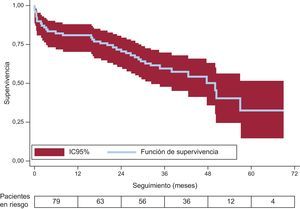
El objetivo principal del estudio es la supervivencia libre de muerte por cualquier causa durante el seguimiento. Se analizó en los 79 pacientes sometidos al TAVI, independientemente del éxito del procedimiento. La mediana de seguimiento fue de 34 [18,3-42,4] meses, es decir 2,8 años, con un seguimiento acumulado de 2.416,7 pacientes-mes. La mediana de supervivencia fue de 47,6 meses (casi 4 años) (intervalo de confianza del 95%, 37,4- 57,9 meses). En la figura se muestra la curva de supervivencia de Kaplan-Meier.
Las supervivencias acumuladas al final de los años 1 a 5 fueron del 79,7, el 70,9, el 58,9, el 49,5 y el 32% respectivamente. Si se selecciona solo a los pacientes vivos al alta hospitalaria (n=70), la mediana de supervivencia fue de 50,3 (intervalo de confianza del 95%, 41,8-58,8) meses, y las supervivencias a 1, 2, 3, 4 y 5 años, del 90,0, el 80,0, el 66,5, el 55,9 y el 36,1%.
Se realizó un análisis estratificado por el 50% y por cuartiles de inclusión de pacientes, además de por acceso transfemoral y transapical, sin encontrar diferencias significativas.
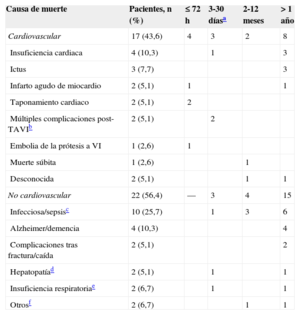
Causas de muerteDe los 79 procedimientos, 39 pacientes fallecieron durante el seguimiento (49,4%) (tabla 3). Algo menos de la mitad de todos los pacientes (43,6%) fallecieron por causas cardiovasculares; las causas más frecuentes fueron la insuficiencia cardiaca y el ictus. La infecciosa fue la causa no cardiovascular y absoluta más frecuente. Una cuarta parte de las muertes (10 de 39) sucedieron antes de 1 mes, periodo en que la causa cardiovascular fue la más frecuente (70%). A partir del primer mes las muertes se reparten más homogéneamente en el tiempo y predomina la causa no cardiovascular (65,5%).
Causas y secuencia temporal de todas las muertes de la serie (n=39)
| Causa de muerte | Pacientes, n (%) | ≤ 72 h | 3-30 díasa | 2-12 meses | >1 año |
|---|---|---|---|---|---|
| Cardiovascular | 17 (43,6) | 4 | 3 | 2 | 8 |
| Insuficiencia cardiaca | 4 (10,3) | 1 | 3 | ||
| Ictus | 3 (7,7) | 3 | |||
| Infarto agudo de miocardio | 2 (5,1) | 1 | 1 | ||
| Taponamiento cardiaco | 2 (5,1) | 2 | |||
| Múltiples complicaciones post-TAVIb | 2 (5,1) | 2 | |||
| Embolia de la prótesis a VI | 1 (2,6) | 1 | |||
| Muerte súbita | 1 (2,6) | 1 | |||
| Desconocida | 2 (5,1) | 1 | 1 | ||
| No cardiovascular | 22 (56,4) | — | 3 | 4 | 15 |
| Infecciosa/sepsisc | 10 (25,7) | 1 | 3 | 6 | |
| Alzheimer/demencia | 4 (10,3) | 4 | |||
| Complicaciones tras fractura/caída | 2 (5,1) | 2 | |||
| Hepatopatíad | 2 (5,1) | 1 | 1 | ||
| Insuficiencia respiratoriae | 2 (6,7) | 1 | 1 | ||
| Otrosf | 2 (6,7) | 1 | 1 |
TAVI: implante percutáneo de válvula aórtica; VARC: Valve Academic Research Consortium; VI: ventrículo izquierdo.
Hasta 30 días o alta hospitalaria; equivale a la definición procedural mortality del Valve Academic Research Consortium-2.
Un paciente tuvo una disección de la arteria femoral que requirió cirugía vascular urgente y después presentó múltiples complicaciones; el otro paciente tuvo múltiples complicaciones peri-implante percutáneo de válvula aórtica y tras el implante percutáneo de válvula aórtica (oclusión coronaria que precisó angioplastia urgente, taponamiento cardiaco que requirió pericardiocentesis e insuficiencia renal con necesidad de hemodiálisis). Ambos tuvieron larga estancia tras el implante percutáneo de válvula aórtica y fallecieron antes del alta.
El origen de la infección/sepsis fue: en 7 casos, respiratorio; en 1, urinario; en 1, digestivo, y 1, de origen desconocido tras descartar endocarditis (hemocultivos y pruebas de imagen negativas).
En la población estudiada hubo 52 pacientes (65,8%) con algún evento adverso mayor durante el seguimiento (objetivo combinado de eficacia clínica del VARC-2), una cuarta parte (25%) en el primer mes y aproximadamente la mitad (51,9%) en el primer año. La mediana de supervivencia libre de eventos adversos mayores fue de 25,4 (intervalo de confianza del 95%, 13,9-36,9) meses (2,1 años).
De los 52 los eventos adversos, 30 (57,7%) fueron mortales y 22 (42,3%), no mortales. La causa mayoritaria del evento adverso no mortal fue empeoramiento de la clase funcional o de la insuficiencia cardiaca (16 pacientes). Todos ellos tenían codiagnóstico de infección respiratoria y/o reagudización de enfermedad pulmonar obstructiva crónica. Se realizó ecocardiograma a todos ellos, y en ninguno se evidenció nueva disfunción protésica o deterioro de la fracción de eyección. Los otros 6 pacientes presentaron 4 ictus (2 ictus, 2 accidentes isquémicos transitorios), un implante de marcapasos y un ingreso por causa desconocida en otro centro (se atribuyó como evento adverso mayor). La tasa acumulada de ictus en el seguimiento fue del 11,4% (el 6,3% de ictus y el 5,1% de accidentes isquémicos transitorios). La mediana de tiempo desde el procedimiento hasta el ictus fue de 489 días.
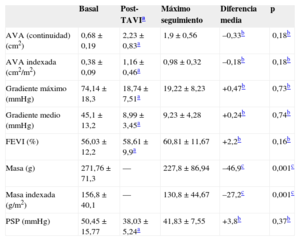
Función protésica durante el seguimientoSe excluyó del seguimiento ecocardiográfico a los pacientes que fallecieron antes del alta hospitalaria (n=9) o antes de alcanzar 12 meses de seguimiento (n=7), con fallo de implante dados de alta (n=2) y 2 pérdidas de seguimiento ecocardiográfico. En la tabla 4 se muestran los parámetros basales y tras el procedimiento y el máximo seguimiento disponible (n=59). Todos los parámetros mejoraron significativamente tras el procedimiento. Los valores medios obtenidos en el máximo seguimiento ecocardiográfico no ofrecen diferencias significativas respecto a los valores medios tras el procedimiento. Es de destacar la estabilidad en los gradientes y la fracción de eyección en el seguimiento. La masa y la masa indexada ventricular se redujeron significativamente en el seguimiento respecto a los valores basales.
Datos ecocardiográficos medios basales, tras el procedimiento y al máximo seguimiento disponible
| Basal | Post-TAVIa | Máximo seguimiento | Diferencia media | p | |
|---|---|---|---|---|---|
| AVA (continuidad) (cm2) | 0,68±0,19 | 2,23±0,83a | 1,9±0,56 | –0,33b | 0,18b |
| AVA indexada (cm2/m2) | 0,38±0,09 | 1,16±0,46a | 0,98±0,32 | –0,18b | 0,18b |
| Gradiente máximo (mmHg) | 74,14±18,3 | 18,74±7,51a | 19,22±8,23 | +0,47b | 0,73b |
| Gradiente medio (mmHg) | 45,1±13,2 | 8,99±3,45a | 9,23±4,28 | +0,24b | 0,74b |
| FEVI (%) | 56,03±12,2 | 58,61±9,9a | 60,81±11,67 | +2,2b | 0,16b |
| Masa (g) | 271,76±71,3 | — | 227,8±86,94 | –46,9c | 0,001c |
| Masa indexada (g/m2) | 156,8±40,1 | — | 130,8±44,67 | –27,2c | 0,001c |
| PSP (mmHg) | 50,45±15,77 | 38,03±5,24a | 41,83±7,55 | +3,8b | 0,37b |
AVA: área valvular aórtica; FEVI: fracción de eyección del ventrículo izquierdo; PSP: presión sistólica pulmonar; TAVI: implante percutáneo de válvula aórtica.
Se comparan los valores al máximo seguimiento y al alta, excepto para la masa ventricular, que se compara con los valores basales. Los valores expresan media±desviación estándar.
Los ecocardiogramas tras el implante percutáneo de válvula aórtica se realizaron en el periodo comprendido entre 24h después del procedimiento y el alta hospitalaria. La comparación estadística de los parámetros al alta respecto de los valores basales resultó estadísticamente significativa (p<0,05) en todas las variables.
En el ecocardiograma post-TAVI, el 94,9% tenía IAo indetectable o leve; y solo 3 pacientes (5,1%) tenían IAo moderada. En el seguimiento 3 pacientes más (tasa acumulada, 10,2%) presentaron IAo moderada. No se detectó ningún caso de IAo grave. En cuanto a la estenosis protésica, ningún paciente tuvo un gradiente post-TAVI>25mmHg; 3 (5,1%) tuvieron gradientes de 20-25mmHg, definido en el VARC-2 como «posible estenosis». Este porcentaje no se incrementó en el seguimiento. No hubo casos de «estenosis significativa» (gradiente medio>35mmHg).
La variable combinada del VARC-2 de disfunción valvular se incrementó de un 10,2% tras el procedimiento al 15,3% en el seguimiento (el 10,2% por IAo moderada y el 5,1% por gradiente medio>20mmHg). Ninguno de estos casos precisó resustitución valvular. No hubo ningún caso documentado de complicación aórtica, lesión de válvula mitral, endocarditis o trombosis protésica.
DISCUSIÓNPoblación del estudio y resultados del procedimientoEn este trabajo se describen los resultados a largo plazo de un registro prospectivo monocéntrico que incluye pacientes consecutivos sometidos a TAVI y su seguimiento a largo plazo. La población incluida en el estudio es de avanzada edad (media, 82,3 años), con significativas comorbilidades y escalas de riesgo quirúrgico moderadamente elevadas (EuroSCORE, 16,9%; STS, 5,9%). El perfil de riesgo es similar al de otras series publicadas en España, pero ligeramente menor que en otras series internacionales12,14,21,22.
A corto plazo, el presente estudio se sitúa dentro de las cifras publicadas de series nacionales e internacionales contemporáneas del estudio, con tasas de éxito entre el 90 y el 98%10–13,21 y mortalidad a 30 días entre el 7,4 y el 14,5%12–14,22,23. Los estudios más recientes tienen tasas de supervivencia a 30 días>95%24,25, lo que puede explicarse por el aumento de experiencia en los centros y las evoluciones técnicas de los dispositivos.
El objetivo combinado del VARC-2 de éxito del dispositivo no se alcanzó en 10 de 79 pacientes (12,7%), dato similar o mejor que los de series contemporáneas del estudio con datos del VARC-1 (12,9-20,0%)23,26. Sin embargo, el reciente estudio CHOICE obtuvo una excelente tasa de solo el 4,1% (fallo de dispositivo según el VARC-1) en el brazo Edwards SAPIEN25.
Supervivencia a largo plazoExisten pocas series de válvula Edwards SAPIEN con seguimiento ≥ 3 años, ninguna de ellas nacional. Sus resultados se resumen en la tabla 5. La serie monocéntrica de Toggweiler et al27 describe 5 años completos del seguimiento de 88 pacientes seleccionados (excluyeron fallos de implante y fallecidos antes de 30 días), utilizando las primeras generaciones de válvula y sistemas de liberación y obteniendo resultados similares a los de nuestra serie no seleccionada. En un trabajo muy exhaustivo, Rodés-Cabau et al28 publicaron el seguimiento de hasta 4 años de un estudio multicéntrico canadiense con 339 pacientes consecutivos (probablemente incluidos los de Toggweiler et al27); obtuvieron resultados también comparables a los obtenidos en el presente estudio.
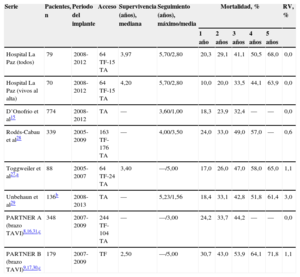
Datos de mortalidad a largo plazo empleando la válvula Edwards SAPIEN, en este estudio, otros estudios internacionales y dos ensayos clínicos
| Serie | Pacientes, n | Periodo del implante | Acceso | Supervivencia (años), mediana | Seguimiento (años), máximo/media | Mortalidad, % | RV, % | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 año | 2 años | 3 años | 4 años | 5 años | |||||||
| Hospital La Paz (todos) | 79 | 2008-2012 | 64 TF-15 TA | 3,97 | 5,70/2,80 | 20,3 | 29,1 | 41,1 | 50,5 | 68,0 | 0,0 |
| Hospital La Paz (vivos al alta) | 70 | 2008-2012 | 64 TF-15 TA | 4,20 | 5,70/2,80 | 10,0 | 20,0 | 33,5 | 44,1 | 63,9 | 0,0 |
| D’Onofrio et al15 | 774 | 2008-2012 | TA | — | 3,60/1,00 | 18,3 | 23,9 | 32,4 | — | — | 0,0 |
| Rodés-Cabau et al28 | 339 | 2005-2009 | 163 TF-176 TA | — | 4,00/3,50 | 24,0 | 33,0 | 49,0 | 57,0 | — | 0,6 |
| Toggweiler et al27,a | 88 | 2005-2007 | 64 TF-24 TA | 3,40 | —/5,00 | 17,0 | 26,0 | 47,0 | 58,0 | 65,0 | 1,1 |
| Unbehaun et al29 | 136b | 2008-2013 | TA | — | 5,23/1,56 | 18,4 | 33,1 | 42,8 | 51,8 | 61,4 | 3,0 |
| PARTNER A (brazo TAVI)8,16,31,c | 348 | 2007-2009 | 244 TF-104 TA | — | —/3,00 | 24,2 | 33,7 | 44,2 | — | — | 0,0 |
| PARTNER B (brazo TAVI)9,17,30,c | 179 | 2007-2009 | TF | 2,50 | —/5,00 | 30,7 | 43,0 | 53,9 | 64,1 | 71,8 | 1,1 |
TA: transapical; TAVI: implante percutáneo de válvula aórtica; TF: transfemoral; RV: resustitución valvular.
Los pacientes de esta serie monocéntrica probablemente estén incluidos en la serie de Rodés-Cabau et al28; sin embargo, se aportan los datos por ser el único estudio con datos completos a 5 años. El estudio de Toggweiler et al27 reporta una población seleccionada de la que se excluyeron los fallos del implante o los fallecidos antes de 30 días. Seguimiento a 5 años obtenido en 84 de 88 pacientes.
Otras dos series ofrecen datos de mortalidad a 5 años: Unbehaun et al29 describen mortalidad del 61,4% de 136 pacientes seleccionados (vivos a los 30 días) con datos de origen administrativo; el brazo TAVI del PARTNER B ha comunicado recientemente una mortalidad del 71,8% a los 5 años30. A los 3 años, D’Onofrio et al15 observaron una mortalidad del 32,4%; en el brazo TAVI del PARTNER A fue del 44,2%31.
En general, puede decirse que la mortalidad a 5 años después de un procedimiento de TAVI con válvula Edwards SAPIEN se sitúa en torno al 60-70%, limitada por una población tratada muy anciana y con importantes comorbilidades (como referencia, la mortalidad estimada a 5 años de controles americanos sin comorbilidades sería del 40,5%30). Actualmente la reducción de la mortalidad peri-TAVI (supervivencia a 30 días>95%24,25) y el desplazamiento hacia características de menor riesgo de los candidatos permiten teorizar que la mortalidad a largo plazo de los pacientes que hoy reciben un TAVI probablemente sea menor.
Causas de muerte y eventos adversos mayoresEn cuanto a las causas de muerte, los hallazgos concuerdan con los de un procedimiento de alto riesgo, con alta mortalidad el primer mes (un tercio de los fallecidos), de predominio cardiovascular, y predominio de mortalidad no cardiovascular en el medio y largo plazo. Entre las causas específicas destaca la infecciosa, sobre todo asociada a enfermedades respiratorias, que es, independientemente del TAVI, una causa frecuente de muerte en los ancianos32. La siguen en frecuencia las muertes por demencia avanzada, lo que obliga a considerar la relevancia de la función cognitiva en el pronóstico de estos pacientes. Es de destacar una mortalidad cardiovascular residual tras el primer año del 34,5%, similar a la de otras series28,30.
Los eventos adversos mayores se concentran en el primer año post-TAVI y ocurrieron en 2 tercios de los pacientes en el largo plazo (65,8%). Este dato es difícil de comparar con los de otras series, por discordancia de definiciones y distintos periodos de seguimiento. En la serie de Gurvitch et al33, el objetivo combinado de muerte, infarto, ictus o resustitución valvular aórtica se alcanzó en el 48,6% a los 3 años. La insuficiencia cardiaca no asociada a disfunción protésica es la primera causa de eventos adversos no mortales, lo que, unido al dato de la relevante mortalidad cardiovascular residual, indica la necesidad de más investigación en este campo.
Función protésica durante el seguimientoEs de destacar la durabilidad de la prótesis utilizada en este estudio durante el seguimiento obtenido, con el 15,3% de disfunción protésica según el VARC-2 (IAo moderada y/o gradiente medio de 20-25mmHg) y sin necesidad de resustitución valvular. La disfunción protésica a largo plazo se ha reportado de manera muy heterogénea centrándose en la IAo moderada o grave, que a largo plazo es muy reducida (el 2,3, el 0,0 y el 0,0% en la series de Toggweiler et al27, Rodés-Cabau et al28 y PARTNER B30 a 4-5 años), si bien podría haber un sesgo, dado que estos pacientes tienen mayor mortalidad. La necesidad de resustitución valvular publicada es marginal (tabla 5).
LimitacionesEl número de pacientes es pequeño en comparación con los registros multicéntricos, pero refleja la práctica habitual de un centro terciario español, y la inclusión de pacientes consecutivos acerca los resultados a la práctica clínica. En el centro se ha realizado una media de 19,8 procedimientos anuales durante el periodo del estudio, mientras que en España el promedio fue 15,8 por centro en 201234. El número de pacientes ha podido limitar la capacidad de encontrar diferencias en relación con la experiencia del centro o entre diferentes accesos. El tiempo de seguimiento no es homogéneo para todos los pacientes, pero es la metodología empleada en muchos trabajos similares15,28, se diseñó un mínimo de 2,5 años de seguimiento para pacientes vivos y no ha habido pérdidas en el seguimiento clínico.
CONCLUSIONESEn una población no seleccionada de 79 pacientes consecutivos con EAo grave, indicación de sustitución valvular y alto riesgo quirúrgico intervenidos mediante TAVI, la mediana de supervivencia libre de muerte por cualquier causa fue de 47,6 meses (4 años). Si se selecciona a los 70 pacientes vivos al alta hospitalaria, la mediana de supervivencia fue de 50,3 meses (4,2 años).
Un tercio de las muertes ocurren en los primeros 30 días, de causa mayoritariamente cardiovascular (70%). Las demás muertes se distribuyen homogéneamente en el tiempo y es más frecuente la causa no cardiovascular (65,5%), especialmente la infecciosa asociada a enfermedades respiratorias. Sin embargo, persiste una no despreciable morbimortalidad cardiovascular residual no asociada a disfunción valvular.
La mejora de parámetros hemodinámicos post-TAVI perduró en el seguimiento y, si bien durante el seguimiento el 15,3% de los pacientes alcanzaron criterios del VARC-2 de disfunción valvular, ningún paciente precisó resustitución valvular.
FINANCIACIÓNP. Salinas recibió durante los años 2010-2012 becas de la Sociedad Española de Cardiología: «Beca Cordis para formación en hemodinámica en centros nacionales».
CONFLICTO DE INTERESESNinguno.
Muchos profesionales de diferentes especialidades han contribuido al programa de TAVI del Hospital Universitario La Paz y merecen nuestro agradecimiento. En relación con este estudio, Diego Iglesias, Sergio García Blas, Omar Razzo, David Dobarro y David Filgueiras merecen un especial reconocimiento.