Es importante desarrollar estrategias que reduzcan los costes sanitarios y mejoren la atención de los pacientes. El objetivo de nuestro estudio es analizar la seguridad del implante ambulatorio de desfibriladores automáticos implantables.
MétodosSe estudió retrospectivamente a 401 pacientes consecutivos a los que se implantó un desfibrilador automático implantable entre 2007 y 2012. Se comparó la tasa de complicaciones relacionadas con la intervención de los 232 (58%) pacientes cuyo implante se programó como ambulatorio frente a los 169 (42%) intervenidos durante ingreso hospitalario.
ResultadosLa media de edad era 62 ± 14 años; 336 (84%) pacientes eran varones. Los pacientes ambulatorios tuvieron, en comparación con los hospitalizados, menor fracción de eyección del ventrículo izquierdo y mayor porcentaje de indicación por prevención primaria de muerte súbita. Sólo 21 pacientes (9%) del grupo ambulatorio requirieron ingreso hospitalario. La tasa de complicaciones hasta el tercer mes tras el implante fue similar en los dos grupos (el 6,0% en ambulatorios frente al 5,3% en ingresados; p = 0,763). En el análisis multivariable, solo el tratamiento anticoagulante previo se relacionó con la presencia de complicaciones (odds ratio = 3,2; intervalo de confianza del 95%, 1,4-7,4; p < 0,01), principalmente por un incremento en la tasa de hematomas de la bolsa del dispositivo. Cada implante ambulatorio supuso un ahorro de 735 euros.
ConclusionesEl implante ambulatorio de desfibrilador automático implantable es seguro y reduce los costes. En pacientes con tratamiento anticoagulante crónico, se incrementa el riesgo de complicaciones, por lo que debería recomendarse un control específico.
Palabras clave
El número de implantes de desfibrilador automático implan-table (DAI) ha aumentado progresivamente en los últimos años a medida que se ha confirmado su eficacia en la prevención de la muerte súbita y según se han ampliado las indicaciones1–4. Teniendo en cuenta el coste elevado de estos dispositivos, es importante desarrollar estrategias para reducir el gasto asociado a su implante5. Tradicionalmente los DAI se han implantado mediante ingreso hospitalario, principalmente para vigilar las complicaciones agudas que puedan derivarse del implante6. El objetivo principal del presente estudio es valorar la seguridad de realizar implantes de DAI ambulatorios. Además, de forma secundaria, analizamos los predictores de desarrollar complicaciones y valoramos la reducción de costes derivada de realizar el implante sin ingreso hospitalario.
MÉTODOSPacientesAnalizamos retrospectivamente todos los implantes de DAI realizados en nuestro centro entre octubre de 2007 (coincidiendo con la apertura del hospital de día de Cardiología) y marzo de 2012. Se excluyeron del análisis los implantes de DAI-resincronizador. Se analizaron en dos grupos separados: los implantes realizados vía hospital de día, sin ingreso hospitalario programado, y los implantes realizados con el paciente ingresado. La decisión de realizar el implante de manera ambulatoria o con ingreso correspondió al médico que solicitó el implante.
Protocolo de implante de desfibrilador automático implantableRecomendaciones generalesPara los pacientes en tratamiento con acenocumarol, se programó la suspensión del anticoagulante entre 3 y 5 días antes de la intervención y se inició heparina de bajo peso molecular a dosis anticoagulantes (enoxaparina 1mg/kg cada 12h) como terapia puente; la última dosis de enoxaparina se administraba la noche previa al implante. Al día siguiente del procedimiento, salvo indicación contraria, se recomendaba iniciar el acenocumarol y la heparina de bajo peso molecular hasta que el cociente internacional normalizado (INR) fuese > 2 (momento en que se suspendía la heparina). No se modificaba el tratamiento antiagregante. Ningún paciente estaba tomando alguno de los nuevos anticoagulantes orales. Todos los pacientes recibieron una dosis preoperatoria de cefazolina intravenosa (y en caso de alergia, vancomicina o eritromicina), con una segunda dosis a las 6h de la intervención. En nuestro centro, habitualmente se intenta el acceso mediante disección de la vena cefálica, y si no se consigue, se accede mediante punción de vena subclavia. En los casos en que la punción subclavia fue necesaria, se realizó una radiografía de tórax de control en las primeras 24h, para descartar neumotórax. No se realizó testado del umbral de desfibrilación en ningún caso. En todos los casos se realizó seguimiento del dispositivo a las 12 semanas del implante.
Estrategia de implante ambulatorioEn el hospital de día, antes del implante se revisa la historia clínica del paciente, se obtiene una vía periférica y se administra la profilaxis antibiótica. Tras la intervención, el paciente permanece en observación en el hospital de día al menos 6h, hasta administrar la segunda dosis de antibiótico. Al alta se recomienda mantener la compresión de la herida durante 24h y evitar mojarla durante las primeras 48h. En caso de punción subclavia, el paciente vuelve el día siguiente al hospital de día para control radiológico y se aprovecha para retirar la compresión y evaluar la herida. Si hay sospecha de complicación, el paciente queda ingresado.
Estrategia de implante hospitalizadoTras el implante, reposo en cama y compresión con vendaje durante las primeras 24h hasta la radiografía de control. Si no ocurre ninguna complicación, se recomienda el alta a las 24h del implante.
Análisis de complicacionesSe estudiaron todas las complicaciones ocurridas hasta la primera revisión del dispositivo (primeras 12 semanas): hematoma de la bolsa del dispositivo (con o sin necesidad de trasfusión o de evacuación del hematoma), infección de la bolsa o del dispositivo, neumotórax, hemotórax, perforación cardiaca, tamponamiento cardiaco, desplazamiento del electrodo, accidente cerebrovascular, embolia no cerebral o descompensación de insuficiencia cardiaca.
Análisis de costesUtilizamos los datos aportados por el Servicio de Control de Gestión de nuestro centro. Se contabilizaron los costes derivados del personal sanitario, servicios intermedios y estructura, material sanitario y productos farmacéuticos, así como los costes del laboratorio y radiología. Para realizar el cálculo, se eliminaron los costes derivados del propio implante (sala de electrofisiología y el coste del propio dispositivo). El Servicio de Control de Gestión analiza los costes cada año de forma independiente, por lo que —para que el cálculo fuese más sencillo y los datos, más homogéneos— nos recomendaron analizar a todos los pacientes de un mismo año. Por lo tanto, solo analizamos los costes del último año con todos los datos completos disponibles en el momento de solicitárselos (2010). Se comparó el coste de los casos en que el DAI se implantó a través del hospital de día (incluyendo los costes derivados de la visita programada al día siguiente y del ingreso en caso necesario) frente a los casos con ingreso programado para implante de DAI (excluyendo a los pacientes ingresados por otra causa a los que se implantó el DAI durante dicho ingreso).
Análisis estadísticoLas variables continuas se presentan como media ± desviación estándar y se compararon con el estadístico t de Student. Las variables categóricas se presentan como proporciones y se compararon con la prueba de la χ2 (o el test exacto de Fisher si alguna celda tenía un valor < 5). Todos los datos cumplían criterios de distribución normal (Kolmogorov-Smirnov). Para controlar el probable sesgo de selección de pacientes de menor riesgo para implante de DAI ambulatorio, realizamos un propensity score. Para ello, hicimos una regresión logística cuya variable dependiente era el implante ambulatorio o no y las independientes, aquellas con p < 0,25 en el análisis univariable o con plausible relación con el implante ambulatorio (fracción de eyección del ventrículo izquierdo, indicación en prevención primaria o secundaria, primoimplante o recambio de generador, sexo, edad, tratamiento anticoagulante, insuficiencia renal, diabetes mellitus, enfermedad pulmonar obstructiva crónica). De esta manera se obtuvo la variable PRE_1, que asignó a los pacientes una probabilidad determinada de que el implante se realizase ingresado. Posteriormente, para verificar la capacidad del propensity score para predecir implante ambulatorio o con ingreso, calculamos el área bajo la curva ROC con la variable PRE_1. El valor fue > 0,8 (0,86), que indica excelente capacidad discriminatoria. Para evaluar la presencia de predictores independientes de complicaciones, se llevó a cabo una regresión logística incluyendo las variables con p < 0,25 en el análisis univariable o con plausible relación con la presencia de complicaciones, y también la variable PRE_1 del propensity score (y así el modelo quedó ajustado por la probabilidad de ser asignado al grupo ambulatorio o con ingreso). Se usó el método de Holm para corregir el testado múltiple. Se consideró significativa un valor de p bilateral < 0,05. Todos los análisis estadísticos se llevaron a cabo con el software SPSS, versión 20.0 (SPSS Inc.; Chicago, Illinois, Estados Unidos).
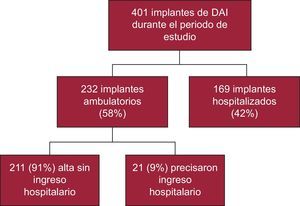
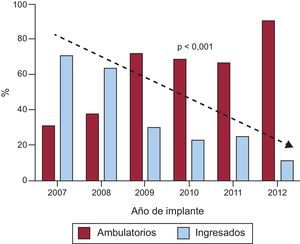
RESULTADOSDurante el periodo de estudio se realizaron 401 implantes de DAI, 232 (58%) en pacientes ambulatorios y 169 (42%) en sujetos hospitalizados (figura 1). De los pacientes hospitalizados, 91 ingresaron de manera programada para el implante y 78 habían ingresado por otra causa (generalmente por la taquiarritmia ventricular que motivaba el implante). La figura 2 muestra que la proporción de implantes ambulatorios aumentó significativamente cada año desde la apertura del hospital de día en 2007, de tal forma que en 2012 solo el 10% de los pacientes se encontraban ingresados cuando se les implantó el DAI.
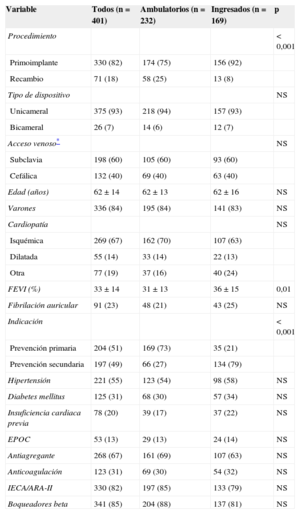
La tabla 1 muestra las características de la población, así como la comparación entre los pacientes con implante ambulatorio y los ingresados. Las únicas diferencias significativas entre los dos grupos son que los pacientes ambulatorios tenían menor fracción de eyección del ventrículo izquierdo y mayor proporción de recambio de generador e indicación en prevención primaria. La estancia media de los pacientes cuyo implante se realizó con ingreso fue de 3,9 ± 4,1 días (1,87 ± 4,3 días en los casos de ingreso programado).
Características clínicas y del implante. Diferencias entre implantes ambulatorios e ingresados
| Variable | Todos (n = 401) | Ambulatorios (n = 232) | Ingresados (n = 169) | p |
|---|---|---|---|---|
| Procedimiento | < 0,001 | |||
| Primoimplante | 330 (82) | 174 (75) | 156 (92) | |
| Recambio | 71 (18) | 58 (25) | 13 (8) | |
| Tipo de dispositivo | NS | |||
| Unicameral | 375 (93) | 218 (94) | 157 (93) | |
| Bicameral | 26 (7) | 14 (6) | 12 (7) | |
| Acceso venoso* | NS | |||
| Subclavia | 198 (60) | 105 (60) | 93 (60) | |
| Cefálica | 132 (40) | 69 (40) | 63 (40) | |
| Edad (años) | 62 ± 14 | 62 ± 13 | 62 ± 16 | NS |
| Varones | 336 (84) | 195 (84) | 141 (83) | NS |
| Cardiopatía | NS | |||
| Isquémica | 269 (67) | 162 (70) | 107 (63) | |
| Dilatada | 55 (14) | 33 (14) | 22 (13) | |
| Otra | 77 (19) | 37 (16) | 40 (24) | |
| FEVI (%) | 33 ± 14 | 31 ± 13 | 36 ± 15 | 0,01 |
| Fibrilación auricular | 91 (23) | 48 (21) | 43 (25) | NS |
| Indicación | < 0,001 | |||
| Prevención primaria | 204 (51) | 169 (73) | 35 (21) | |
| Prevención secundaria | 197 (49) | 66 (27) | 134 (79) | |
| Hipertensión | 221 (55) | 123 (54) | 98 (58) | NS |
| Diabetes mellitus | 125 (31) | 68 (30) | 57 (34) | NS |
| Insuficiencia cardiaca previa | 78 (20) | 39 (17) | 37 (22) | NS |
| EPOC | 53 (13) | 29 (13) | 24 (14) | NS |
| Antiagregante | 268 (67) | 161 (69) | 107 (63) | NS |
| Anticoagulación | 123 (31) | 69 (30) | 54 (32) | NS |
| IECA/ARA-II | 330 (82) | 197 (85) | 133 (79) | NS |
| Boqueadores beta | 341 (85) | 204 (88) | 137 (81) | NS |
ARA-II: antagonistas del receptor de la angiotensina II; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima de conversión de la angiotensina.
Como se ve en la figura 1, de los 232 implantes ambulatorios, solo tuvieron que permanecer ingresados 21 (9%). Las razones de que ingresaran fueron: hematoma de la bolsa en 2 casos, neumotórax en 1, motivos logísticos o sociales en 3, accidente isquémico transitorio en 1, edema agudo de pulmón en 1 y decisión del médico responsable (sin complicación inmediata observada) en 13. A todos estos pacientes se les dio el alta entre 1 y 6 días tras el implante y sin consecuencias a largo plazo. No hubo diferencias estadísticamente significativas entre estos pacientes y aquellos a quienes se pudo dar el alta directamente.
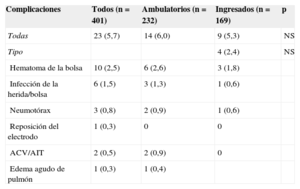
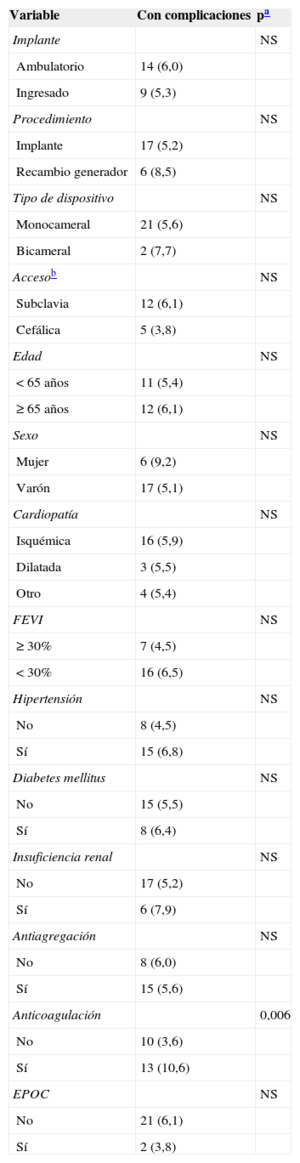
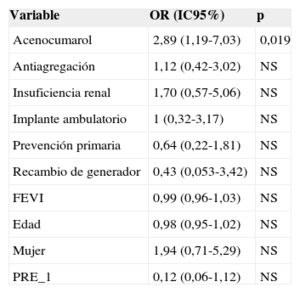
La tabla 2 muestra que hubo 23 (5,7%) complicaciones relacionadas con el implante del DAI, sin que hubiese diferencias significativas entre la tasa de complicaciones de los implantes ambulatorios y los ingresados. Tampoco hubo diferencias en el porcentaje de complicaciones al comparar los implantes ambulatorios y los ingresados de manera programada para el implante (el 6,0 frente al 5,5%; p = 0,853). No hubo muertes asociadas al procedimiento. Hubo 10 hematomas de la herida, pero solo un caso precisó transfusión de hematíes. Dos pacientes mostraron síntomas compatibles con accidente cerebrovascular (uno de ellos tenía antecedente de fibrilación auricular e indicación de anticoagulación oral). Los síntomas remitieron completamente en menos de 24h en ambos casos. El único caso que precisó recolocación del electrodo se dio en el grupo de ingreso hospitalario. El análisis de la relación entre diversas variables (según se indica en «Métodos») y la presencia de complicaciones se muestra en las tablas 3 y 4 (univariable) (multivariable). El único factor que mostró relación con complicaciones es el tratamiento con anticoagulantes orales.
Complicaciones totales y comparación entre ambos grupos de pacientes
| Complicaciones | Todos (n = 401) | Ambulatorios (n = 232) | Ingresados (n = 169) | p |
|---|---|---|---|---|
| Todas | 23 (5,7) | 14 (6,0) | 9 (5,3) | NS |
| Tipo | 4 (2,4) | NS | ||
| Hematoma de la bolsa | 10 (2,5) | 6 (2,6) | 3 (1,8) | |
| Infección de la herida/bolsa | 6 (1,5) | 3 (1,3) | 1 (0,6) | |
| Neumotórax | 3 (0,8) | 2 (0,9) | 1 (0,6) | |
| Reposición del electrodo | 1 (0,3) | 0 | 0 | |
| ACV/AIT | 2 (0,5) | 2 (0,9) | 0 | |
| Edema agudo de pulmón | 1 (0,3) | 1 (0,4) |
ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio; NS: sin diferencias significativas.
Los valores expresan n (%).
Análisis univariable de predictores de complicaciones por el implante
| Variable | Con complicaciones | pa |
|---|---|---|
| Implante | NS | |
| Ambulatorio | 14 (6,0) | |
| Ingresado | 9 (5,3) | |
| Procedimiento | NS | |
| Implante | 17 (5,2) | |
| Recambio generador | 6 (8,5) | |
| Tipo de dispositivo | NS | |
| Monocameral | 21 (5,6) | |
| Bicameral | 2 (7,7) | |
| Accesob | NS | |
| Subclavia | 12 (6,1) | |
| Cefálica | 5 (3,8) | |
| Edad | NS | |
| < 65 años | 11 (5,4) | |
| ≥ 65 años | 12 (6,1) | |
| Sexo | NS | |
| Mujer | 6 (9,2) | |
| Varón | 17 (5,1) | |
| Cardiopatía | NS | |
| Isquémica | 16 (5,9) | |
| Dilatada | 3 (5,5) | |
| Otro | 4 (5,4) | |
| FEVI | NS | |
| ≥ 30% | 7 (4,5) | |
| < 30% | 16 (6,5) | |
| Hipertensión | NS | |
| No | 8 (4,5) | |
| Sí | 15 (6,8) | |
| Diabetes mellitus | NS | |
| No | 15 (5,5) | |
| Sí | 8 (6,4) | |
| Insuficiencia renal | NS | |
| No | 17 (5,2) | |
| Sí | 6 (7,9) | |
| Antiagregación | NS | |
| No | 8 (6,0) | |
| Sí | 15 (5,6) | |
| Anticoagulación | 0,006 | |
| No | 10 (3,6) | |
| Sí | 13 (10,6) | |
| EPOC | NS | |
| No | 21 (6,1) | |
| Sí | 2 (3,8) |
EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; NS: sin diferencias significativas.
Los valores expresan n (%).
Análisis multivariable (regresión logística) de predictores de complicaciones
| Variable | OR (IC95%) | p |
|---|---|---|
| Acenocumarol | 2,89 (1,19-7,03) | 0,019 |
| Antiagregación | 1,12 (0,42-3,02) | NS |
| Insuficiencia renal | 1,70 (0,57-5,06) | NS |
| Implante ambulatorio | 1 (0,32-3,17) | NS |
| Prevención primaria | 0,64 (0,22-1,81) | NS |
| Recambio de generador | 0,43 (0,053-3,42) | NS |
| FEVI | 0,99 (0,96-1,03) | NS |
| Edad | 0,98 (0,95-1,02) | NS |
| Mujer | 1,94 (0,71-5,29) | NS |
| PRE_1 | 0,12 (0,06-1,12) | NS |
FEVI: fracción de eyección del ventrículo izquierdo; IC95%: intervalo de confianza del 95%; NS: sin diferencias significativas; OR: odds ratio; PRE_1: la variable obtenida en el propensity score, que asigna a los pacientes una probabilidad determinada de que el implante se realizase con ingreso.
En el análisis de costes, objetivamos que en 2010 el coste medio (excluidos los gastos derivados de la sala de electrofisiología y el precio del dispositivo) por cada implante realizado en el hospital de día fue de 122 ± 148 euros y de 857 ± 412 euros el de los implantes programados con hospitalización (452 ± 289 euros por día de ingreso). Es decir, cada implante realizado ambulatoriamente supuso un ahorro de 735 euros.
DISCUSIÓNLa práctica habitual para el implante de DAI es ingresar al paciente para observación de posibles complicaciones6. Dado el número creciente de implantes en los últimos años y que el coste-beneficio de los dispositivos se ha objetado en algunos estudios7,8, es importante buscar estrategias que traten de reducir los costes. En nuestra experiencia, el implante ambulatorio de DAI es seguro. Y esta seguridad también fue percibida por los médicos que indicaron el implante, de modo que el número de procedimientos ambulatorios fue aumentando progresivamente hasta representar cerca del 90% del total de implantes, como se muestra en la figura 2.
Las características de la población estudiada son similares a las de otros registros1. La mayoría de los implantes fueron por prevención primaria y la cardiopatía subyacente más frecuente fue la isquémica. En los pacientes ingresados fue más frecuente la prevención secundaria, puesto que en muchos casos el implante tuvo lugar tras un ingreso por un evento arrítmico. Por otro lado, la fracción de eyección del ventrículo izquierdo en el grupo ambulatorio fue menor, dado que en este grupo la mayoría de los implantes fueron por prevención primaria, lo cual en general exige una fracción de eyección de ventrículo izquierdo más deprimida.
La incidencia de complicaciones tras el implante de DAI es variable según las publicaciones, en función del tipo de complicaciones que se incluyan en el análisis. En nuestra serie, la cifra (5,7%) es similar a lo descrito en otras series de pacientes9,10. En el caso de los marcapasos, la seguridad del implante ambulatorio ya se ha descrito en varios estudios11–13. En cuanto a los DAI, la evidencia es más escasa. En un estudio prospectivo, con 71 pacientes aleatorizados a recibir el alta el mismo día o ingresar durante 24h, no se observaron diferencias en la incidencia de complicaciones14. No obstante, en ese caso se trataba de una población seleccionada y de bajo riesgo (se excluyeron los implantes con punción subclavia, dependencia del marcapasos o indicación de anticoagulación oral). Nuestra serie refleja una población menos seleccionada y, pese a incluir a pacientes de mayor riesgo, tampoco se observaron diferencias en cuanto a la incidencia de complicaciones entre el grupo ambulatorio y el de ingresados. En otro estudio publicado recientemente, con diseño y número de pacientes similares al nuestro (aunque únicamente con implantes por prevención primaria), Darda et al han descrito la seguridad del implante ambulatorio en un grupo de 198 pacientes dados de alta el mismo día, en los que la incidencia de complicaciones fue del 3% (sin que se observasen diferencias en comparación con un grupo de pacientes similares cuyo implante se hizo con ingreso hospitalario)15. Los autores comentan que las complicaciones relevantes tras el implante son identificables en el corto periodo de observación posterior o aparecen más tardíamente, con lo cual el ingreso no aportaría ningún beneficio en este sentido. La incidencia de hematoma de la bolsa en ese estudio (2,8%) fue casi idéntica a la de nuestra serie (2,6%). En el caso de la infección del dispositivo, la incidencia del 1,3% en nuestro grupo de pacientes ambulatorios es similar a la descrita en otras publicaciones16,17 y numéricamente inferior a la del grupo ingresado (1,8%). De hecho, es posible que evitar el ambiente hospitalario y la exposición a gérmenes nosocomiales tras el implante pueda reducir su incidencia. Otra complicación que podría darse, debido a la movilización más precoz que conlleva el alta el mismo día del implante, es la dislocación del electrodo, pero en nuestra serie y los dos estudios citados14,15 no se observó un aumento de la necesidad de recolocar el electrodo. De hecho, en el estudio de Choudhuri et al se realizó monitorización a distancia de los parámetros del electrodo y no se observaron diferencias entre los pacientes ambulatorios y los ingresados14. Los resultados de un recientemente publicado registro con datos obtenidos del National Cardiovascular Data Registry (NCDR), con más de 200.000 implantes de DAI en Estados Unidos, muestran una tasa de complicaciones de solo el 1,8%18. Pero estos resultados, como los propios autores admiten, subestiman la tasa de complicaciones y no se puede compararlos con los nuestros. Por un lado, solo recogen complicaciones intrahospitalarias y no tras el alta, como es el caso de nuestro estudio (p. ej., cabe destacar que no incluyen ni un solo caso de endocarditis). Por otro, la forma de recoger los datos hace que no puedan ser tan exhaustivos al recoger las complicaciones como cuando se dispone de la historia clínica completa del paciente (como es nuestro caso). Así solo presentan un 0,3% de hematomas, lo cual, como ya hemos mencionado, está muy por debajo de lo observado en la mayoría de las series (lo que seguramente indica que se recogieron solo las formas más graves).
El único predictor de complicaciones fue el tratamiento con anticoagulación oral, al igual que en la serie de Darda et al15. En nuestro caso se interrumpió el tratamiento anticoagulante y se utilizó heparina como terapia puente. Esta estrategia de manejo de los pacientes con anticoagulación crónica se ha relacionado con un aumento de las complicaciones en comparación con mantener el anticoagulante oral en los implantes de marcapasos con ingreso hospitalario19–21. Tal vez mantener la anticoagulación oral podría reducir los eventos adversos tras el implante ambulatorio de DAI, pero aún se debe estudir dicha hipótesis. Otra alternativa que se podría estudiar en el futuro es valorar si el uso de los nuevos anticoagulante orales modifica la presencia complicaciones en el implante de dispositivos cardiacos. En cualquier caso, parece que a los pacientes con indicación de anticoagulación oral se los debe considerar como una población de riesgo, y en consecuencia se debe manejarlos con precaución.
Finalmente, teniendo en cuenta el número creciente de implantes y el contexto económico actual, es importante buscar estrategias que optimicen los recursos sanitarios. En nuestro centro, durante 2010 cada implante programado con ingreso supuso el gasto de 735 euros más. Extrapolando el ahorro de ese año a los 232 implantes ambulatorios de nuestro estudio, el ahorro total obtenido sería de 170.520 euros. Por lo tanto, el implante ambulatorio de DAI parece una estrategia segura y con gran potencial para reducir los costes derivados de la hospitalización tras el implante. Esto se añadiría a la simplificación y el abaratamiento progresivos de la técnica, desde los primeros implantes de DAI epicárdicos realizados en quirófano a la era actual en que la mayoría de los implantes se practican en salas de electrofisiología1 y sin necesidad de testar el umbral de desfibrilación22. Y a ello se están añadiendo estrategias que ya son realidad, como la monitorización a distancia23,24 y el desfibrilador subcutáneo25,26.
LimitacionesLa principal limitación es que se trata de un estudio no aleatorizado, por lo que los pacientes a los que se implantó el DAI en el hospital de día podrían tener menor riesgo y, por lo tanto, menos complicaciones. Como se describe en «Métodos», para controlar este sesgo de selección se realizó un propensity score. En el presente análisis se decidió incluir todo tipo de implantes, tanto ambulatorios como con ingreso (recambios, primoimplantes, recolocaciones de electrodo), para tener el mayor número de pacientes posible y representar el espectro clínico más amplio. El número de implantes de DAI bicameral fue bajo (solo un 7% de los implantes), por lo que los resultados probablemente no serían aplicables a este tipo de implantes. Otra limitación es que se realizó en un solo centro con amplia experiencia en el implante de estos dispositivos, lo cual podría no hacer extrapolables los resultados a centros de otras características. En cuanto a la técnica de implante, el acceso por vena cefálica puede implicar una menor tasa de complicaciones en nuestra serie de pacientes, aunque en la serie ya mencionada, publicada recientemente, solo utilizaron la vía subclavia, y sus datos son similares15. Aun así, solo se consiguió acceso por vía cefálica en el 40% de los casos, algo que podría estar relacionado con el grosor del electrodo del DAI, mayor que el de los marcapasos. Por otro lado, dado que el beneficio de evaluar el umbral de desfibrilación del DAI tras el implante no está claramente validado22, en nuestro centro no lo testamos sistemáticamente. Esto podría hacer no extrapolables los resultados a pacientes en los que sí se testa dicho umbral.
CONCLUSIONESEl implante ambulatorio de DAI no aumenta la tasa de complicaciones y reduce los costes derivados del implante. El único predictor de complicaciones es el tratamiento anticoagulante oral, por lo que se ha de buscar estrategias destinadas a optimizar el manejo de estos pacientes.
CONFLICTO DE INTERESESNinguno.
Agradecemos la colaboración de Alfonso Cuadrado Rodríguez, del Servicio de Control de Gestión, por su ayuda en el análisis del coste económico.