Full English text available from: www.revespcardiol.org/en
CONTEXTOS CLÍNICOSIntervencionismo en el síndrome coronario agudoAlgunos datos indican que la ciclosporina puede disminuir el daño por reperfusión y el tamaño del infarto de miocardio1,2. El estudio multicéntrico CIRCUS3 aleatorizó a 970 pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST) anterior tratados con intervención coronaria percutánea (ICP) primaria en las primeras 12 h de evolución y con una oclusión completa del vaso culpable a recibir ciclosporina (2,5 mg/kg en bolo intravenoso) o placebo antes de la recanalización del vaso. La hipótesis fue evaluar si la ciclosporina puede mejorar la evolución clínica y prevenir el remodelado ventricular en el IAMCEST. El objetivo primario (combinado de muerte por cualquier causa, insuficiencia cardiaca, rehospitalización o remodelado ventricular izquierdo con incremento del volumen telediastólico del ventrículo izquierdo ≥ 15% a 1 año) ocurrió en el 59,0 y el 58,1% de los grupos a ciclosporina y control respectivamente (odds ratio [OR]=1,04; intervalo de confianza del 95% [IC95%], 0,78-1,39; p=0,77). El tratamiento con ciclosporina tampoco redujo ninguno de los componentes del objetivo primario por separado.
El estudio TOTAL4 aleatorizó a 10.732 pacientes con IAMCEST tratados con ICP primaria a una estrategia de tromboaspiración sistemática frente a ICP convencional, con la hipótesis de que la tromboaspiración manual podría reducir la embolización distal y mejorar la perfusión microvascular. El objetivo primario fue un combinado de muerte de causa cardiaca, reinfarto, shock cardiogénico o insuficiencia cardiaca grave a los 180 días, y el objetivo de seguridad fue los ictus a los 30 días. El objetivo primario ocurrió en el 6,9% de los pacientes del grupo de trombectomía frente al 7,0% del grupo de ICP convencional (OR=0,99; IC95%, 0,85-1,15; p=0,86). Las tasas de muerte cardiaca (trombectomía frente a ICP, el 3,1 frente al 3,5%; OR=0,90; IC95%, 0,73-1,12; p=0,34) y el objetivo primario más trombosis de stent o revascularización del vaso causal (el 9,9 frente al 9,8%; OR=1,00; IC95%, 0,89-1,14; p=0,95) también fueron similares4.
Hubo más ictus en los primeros 30 días en el grupo de tromboaspiración (el 0,7 frente al 0,3%; OR=2,06; IC95%, 1,13-3,75; p=0,02), sin que quede claro el motivo de este hallazgo. En el seguimiento a 1 año, se mantenían los mismos resultados, por lo que no se recomienda utilizar sistemáticamente la tromboaspiración en el IAMCEST5, aunque queda por definir su papel para determinado perfil de pacientes y lesiones (figura 1).
El registro ESTROFA-MI6, de pacientes mayores de 75 años, recoge de manera retrospectiva el tratamiento antitrombótico utilizado en el contexto de la ICP primaria por IAMCEST. Se incluyó a 2.131 pacientes, 221 (10,3%) tratados con bivalirudina, 1.374 (64,5%) solo con heparina no fraccionada y 536 (25,2%) con heparina no fraccionada y abciximab, con media de edad de 81±5, 81,3±4,8 y 79,8±4,0 años respectivamente (p<0,001). Al año de seguimiento, las supervivencias libres de infarto o muerte cardiaca fueron de 85,0, el 80,3 y el 83,1% (p=0,03), y la necesidad de nueva revascularización, el 2,5, el 3,0 y el 1,5% (p=0,4) respectivamente. La incidencia de trombosis de stent definitiva o probable fue del 2,5, el 2,5 y el 3,1% (p=0,2), y la incidencia de hemorragia > 2 según los criterios BARC (Bleeding Academic Research Consortium)7 fue del 0,7, el 1,4 y el 1,0% (p=0,8) respectivamente. Ninguna de las estrategias resultó ser un predictor independiente de eventos cardiacos mayores en al análisis multivariable, aunque el uso de bivalirudina se asoció con menor incidencia de muerte cardiaca sin incrementar significativamente las trombosis de stents. También se analizó la influencia de la tromboaspiración en 2 grupos emparejados por flujo TIMI (Thrombolysis In Myocardial Infarction) 0-1 basal (560 pacientes tratados con trombectomía y 490 sin ella), pero no se encontraron diferencias significativas en muerte cardiaca, reinfarto, necesidad de nueva revascularización o trombosis de stent6.
Intervencionismo percutáneo en enfermedad coronaria: acceso vascular y uso de fármacosEl estudio MATRIX8 aleatorizó a más de 8.400 pacientes con síndrome coronario agudo (IAMCEST o infarto agudo de miocardio sin elevación del segmento ST) programados para coronariografía e ICP a acceso radial o femoral. El objetivo coprimario a los 30 días era un combinado de eventos cardiovasculares graves (muerte, infarto o ictus) y un combinado de eventos clínicos graves (eventos cardiovasculares graves y hemorragias graves según la escala BARC no relacionados con cirugía coronaria) y el análisis fue por intención de tratar. En el grupo de acceso radial, el 8,8% de los pacientes sufrieron un evento cardiovascular mayor, frente al 10,3% del grupo de acceso femoral (OR=0,85; IC95%, 0,74-0,99; p=0,0307). Ocurrieron eventos clínicos graves al 9,8% del grupo de acceso radial y el 11,7% del grupo de femoral (OR=0,83; IC95%, 0,73-0,96; p=0,0092). Las diferencias se basaron en las hemorragias BARC graves no relacionados con cirugía coronaria (el 1,6 frente al 2,3%; riesgo relativo [RR]=0,67; IC95%, 0,49-0,92; p=0,013) y en la mortalidad total (el 1,6 frente al 2,2%; RR=0,72; IC95%, 0,53-0,99; p=0,045). Las conclusiones del estudio indican que, en pacientes con síndrome coronario agudo tratados con ICP, el acceso radial disminuye los eventos clínicos graves respecto al acceso femoral por la reducción de hemorragias graves y mortalidad por cualquier causa8. También se aleatorizó a más de 7.200 pacientes del mismo estudio a recibir bivalirudina o heparina no fraccionada como tratamiento antitrombótico durante la ICP, y se analizaron los eventos en ambos grupos. La tasa de eventos cardiovasculares graves no fue significativamente diferente entre ambos fármacos (el 10,3 y el 10,9%; RR=0,94; IC95%, 0,81-1,09; p=0,44); tampoco la tasa de eventos clínicos graves (el 11,2 y el 12,4%; RR=0,89; IC95%, 0,78-1,03; p=0,12). Tampoco hubo diferencias significativas en la trombosis de stent o en la necesidad de revascularización urgente9.
El estudio multicéntrico y aleatorizado RIVER-PCI10 ha evaluado la hipótesis de que el tratamiento antiisquémico con ranolazina (dosis de 1.000 mg al día en 2 tomas) podría mejorar el pronóstico de los pacientes con enfermedad coronaria tratados con ICP pero con revascularización incompleta (definida como presencia de una o más lesiones con estenosis ≥ 50% en una arteria coronaria nativa con diámetro ≥ 2 mm). El objetivo primario era el tiempo hasta la aparición de un evento isquémico o la necesidad de nueva revascularización, y el análisis fue por intención de tratar. Se incluyó a más de 2.600 pacientes; tras un seguimiento medio de 643 días, el objetivo primario ocurrió en el 26% de los pacientes asignados a ranolazina y el 28% de los asignados a placebo (OR=0,95; IC95%, 0,82-1,10; p=0,48).
La incidencia de nueva revascularización o ingreso hospitalario por un evento isquémico no fue significativamente diferente entre ambos grupos. Sin embargo, el 14,3% de los pacientes del grupo de ranolazina dejaron de seguir el tratamiento por causa de un evento adverso, frente al 10,6% del grupo de placebo (p=0,04)10.
El estudio BRAVO-311 se diseñó para evaluar si la bivalirudina es una alternativa mejor que la heparina como tratamiento anticoagulante en pacientes sometidos a implante percutáneo de válvula aórtica. Se aleatorizó a 802 pacientes con estenosis aórtica grave a los que se realizó implante transfemoral de una prótesis aórtica. Los objetivos primarios del estudio fueron la hemorragia mayor en las primeras 48 h o antes del alta hospitalaria y los eventos clínicos graves a los 30 días (combinación de eventos cardiovasculares graves y hemorragias mayores). El uso de bivalirudina no resultó en tasas de hemorragia significativamente menores a las 48 h (el 6,9 frente al 9,0%; RR=0,77; IC95%, 0,48-1,23; p=0,27) o de eventos clínicos graves a los 30 días (el 14,4 frente al 16,1%; RR=0,89; IC95%, 0,64-1,24; p=0,50).
Las tasas de eventos cardiovasculares graves a las 48 h tampoco fueron significativamente distintas (el 3,5 frente al 4,8%; RR=0,73; IC95%, 0,37-1,43; p=0,35). Aunque no se demostró la superioridad de la bivalirudina sobre la heparina no fraccionada, se alcanzaron los criterios de no inferioridad. Se concluye que la heparina no fraccionada, mucho más barata, debe seguir siendo la primera elección en este tipo de intervenciones, pero que la bivalirudina podría utilizarse para pacientes no susceptibles de tratamiento con heparina11.
Stents farmacoactivosEl estudio TUXEDO12 aleatorizó a 1.830 pacientes con diabetes mellitus y enfermedad coronaria programados para ICP a recibir stent farmacoactivo (SF) liberador de paclitaxel o de everolimus. Se trata de un ensayo con un diseño de no inferioridad, cuyo objetivo primario es el fracaso del vaso tratado, definido como un combinado de muerte cardiaca, infarto o necesidad de revascularización del vaso tratado, con un seguimiento de 1 año.
Al año, los SF de paclitaxel no alcanzaron el criterio de no inferioridad frente a los SF de everolimus con respecto al objetivo primario (el 5,6 frente al 2,9%; RR=1,89; IC95%, 1,20-2,99; p=0,38 para no inferioridad). El fracaso del vaso tratado al año fue significativamente mayor en el grupo de paclitaxel (p=0,005), con más trombosis de stent (el 2,1 frente al 0,4%; p=0,002) y mayor necesidad de nuevas revascularizaciones del vaso (el 3,4 frente al 1,2%; p=0,002). Por lo tanto, para los pacientes con diabetes mellitus y enfermedad coronaria tratada con ICP, el uso de SF con everolimus proporciona mejores resultados que el uso de SF con paclitaxel12.
El estudio LEADERS-FREE13 incluyó a más de 2.400 pacientes con alto riesgo de hemorragia según unos criterios específicos (edad > 75 años, necesidad de anticoagulación oral crónica, anemia, etc.) y programados para ICP; se los aleatorizó a recibir SF liberador de biolimus A9 (sin polímero) o un stent metálico convencional muy similar. Todos los pacientes recibieron doble terapia antiagregante durante solo 1 mes. El objetivo primario de seguridad fue un combinado de muerte cardiaca, infarto o trombosis del stent. El objetivo primario de eficacia fue la necesidad de revascularización de la lesión tratada. Tras un seguimiento de 1 año, el objetivo primario de seguridad ocurrió en el 9,4% de los pacientes del grupo de SF y el 12,9% de los del grupo de stent convencional (OR=0,71; IC95%, 0,56-0,91; p<0,001 para no inferioridad y p=0,005 para superioridad). Durante ese periodo, se precisó nueva revascularización de la lesión en el 5,1% de los pacientes del grupo de SF y el 9,8% del grupo de stent convencional (OR=0,50; IC95%, 0,37-0,69; p<0,001). Se concluye que para los pacientes con alto riesgo de hemorragia tratados con ICP, un SF sin polímero y liberador de biolimus A9 es superior a un stent metálico convencional tanto en eficacia como en seguridad cuando se utiliza doble terapia antiagregante durante solo 1 mes.
Stents bioabsorbibles (bioresorbable vascular scaffold)El estudio ABSORB III14 se diseñó para comparar la eficacia y la seguridad del dispositivo farmacoactivo bioabsorbible Absorb (liberador de everolimus) frente a un SF de cromo-cobalto liberador de everolimus. Se aleatorizó a 2.008 pacientes con angina estable o inestable a recibir durante la ICP el dispositivo bioabsorbible o el SF liberador de everolimus en proporción 2:1. El objetivo primario, estudiado para no inferioridad y superioridad, fue el fracaso de la lesión tratada (muerte cardiaca, infarto o revascularización de la lesión tratada) al cabo de 1 año. Este objetivo apareció en el 7,8% del grupo de Absorb y el 6,1% del de SF (IC95%, –0,5 a 3,9; p=0,007 para no inferioridad y p=0,16 para superioridad). No hubo diferencias significativas entre ambos grupos en las tasas de muerte cardiaca (el 0,6 y el 0,1% respectivamente; p=0,29), infarto relacionado con el vaso tratado (el 6,0 y el 4,6%; p=0,18), revascularización de la lesión tratada (el 3,0 y el 2,5%; p=0,50) y trombosis del stent al año (el 1,5 y el 0,7%; p=0,13). Se concluye que a 1 año el dispositivo farmacoactivo bioabsorbible no es inferior a un SF liberador de everolimus en el tratamiento de lesiones coronarias no complejas con respecto al fracaso de la lesión tratada14.
El estudio ABSORB Japan15 es un ensayo clínico multicéntrico y aleatorizado (2:1), solicitado por la agencia reguladora japonesa para la aprobación del uso de Absorb. Para ello se comparan los resultados clínicos y angiográficos al año con los obtenidos en los pacientes tratados con el SF de cromo-cobalto liberador de everolimus, con diseño de no inferioridad. El objetivo primario fue el fracaso de la lesión tratada a los 12 meses, que engloba muerte cardiaca, infarto del vaso tratado y nueva revascularización de la lesión tratada. Como objetivo secundario se escogió la pérdida luminal tardía (late lumen loss) del segmento tratado a los 13 meses. Se incluyó a 400 pacientes y el objetivo primario fue muy similar en ambos grupos (el 4,2 frente al 3,8%), la trombosis definitiva o probable idéntica (el 1,5% en cada grupo) y la necesidad de nueva revascularización por isquemia similar (el 1,1 frente al 1,5%). La pérdida luminal tardía también fue muy similar (0,13±0,30 frente a 0,12±0,32 mm). Los autores concluyen que los resultados clínicos y angiográficos de ambos dispositivos son virtualmente idénticos en la población seleccionada.
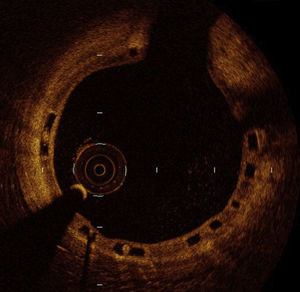
El estudio ABSORB-STEMI TROFI16 es un ensayo clínico multicéntrico que incluyó solo a pacientes con IAMCEST tratados con ICP primaria aleatorizados a recibir un dispositivo farmacoactivo bioabsorbible Absorb frente a un SF de cromo-cobalto liberador de everolimus. El objetivo primario era el grado de reparación vascular a los 6 meses determinado por tomografía de coherencia óptica (OCT), basada en la presencia intraluminal de material y en la aposición y la cobertura de los struts del dispositivo (figura 2). Se incluyó a 191 pacientes de perfil clínico favorable, con elevada tasa de éxito del implante del dispositivo (el 96 y el 100% respectivamente). A los 6 meses se pudo evaluar el objetivo primario en cerca del 90% de los pacientes, y la puntuación de reparación vascular (healing score) fue menor en el grupo de Absorb (1,74±2,39 frente a 2,80±4,44; p<0,001). La pérdida luminal tardía por angiografía fue significativamente superior en el grupo de Absorb (0,20±0,31 frente a 0,08±0,28 mm; p=0,01). La tasa de eventos clínicos a los 6 meses fue muy baja (el 1,1 frente al 0,0%), con solo 1 caso de trombosis subaguda. Los autores concluyen que se confirma un elevado y similar grado de reparación vascular con ambos dispositivos, evaluado por este healing score a los 6 meses tras ICP primaria en IAMCEST.
El estudio BIOSOLVE II17, prospectivo y multicéntrico, buscaba evaluar la seguridad y la eficacia de un dispositivo farmacoactivo (liberador de sirolimus), metálico (magnesio) y bioabsorbible de segunda generación en pacientes con lesiones coronarias nativas (diámetro de referencia, 2,2-3,7 mm). Se programó un seguimiento angiográfico a los 6 meses con valoración por imagen intracoronaria en un subgrupo de pacientes. Se incluyó a 123 pacientes, y como objetivo primario se estudió la pérdida luminal tardía en el segmento tratado a los 6 meses, que fue de 0,27±0,37mm. El estudio con ecografía intravascular (IVUS) demostró un área intraluminal conservada a los 6 meses (6,24±1,15mm2 tras ICP frente a 6,21±1,22 mm2 a los 6 meses), con una pequeña área neointimal media (0,08±0,09mm2). La OCT no detectó masas intraluminales. Se describió fracaso de la lesión tratada en el 3% de los pacientes, y no hubo ninguna trombosis definitiva o probable. Los autores concluyen que este nuevo dispositivo farmacoactivo metálico y bioabsorbible (figura 3) es eficaz y seguro, y podría representar una alternativa a los dispositivos farmacoactivos poliméricos bioabsorbibles para el tratamiento de la enfermedad coronaria obstructiva17.
TÉCNICAS DE DIAGNÓSTICO INTRACORONARIOEl estudio IVUS-XPL18, aleatorizado y multicéntrico, ha evaluado la hipótesis del posible beneficio clínico a largo plazo de guiar con IVUS la ICP de lesiones coronarias largas (longitud ≥ 28 mm) con SF en lugar de solo con angiografía. El objetivo primario fue un combinado de eventos cardiacos graves (muerte cardiaca, infarto o revascularización relacionados con la lesión tratada) al año de la ICP, analizados por intención de tratar. Se incluyó a 1.400 pacientes y el seguimiento al año se completó en el 95%. Se habían producido eventos cardiacos graves al año en el 2,9% del grupo de ICP guiada por IVUS y el 5,8% del guiado por angiografía (OR=0,48; IC95%, 0,28-0,83; p=0,007). La diferencia se debió a un menor riesgo de nueva revascularización por isquemia de la lesión tratada para los pacientes en que se utilizó IVUS (el 2,5 frente al 5,0%; OR=0,51; IC95%, 0,28-0,91; p=0,02), sin que hubiera diferencias significativas en las tasas de muerte cardiaca o infarto relacionado con la lesión tratada entre los 2 grupos. La única diferencia significativa en el tratamiento entre ambos grupos fue el mayor uso de posdilatación del SF en el grupo de IVUS (el 76 frente al 57%; p<0,001).
El estudio ILUMIEN II19 busca determinar si la guía de la ICP con OCT resulta en un grado de expansión del stent similar que guiada por IVUS, puesto que se considera que la expansión obtenida es el mayor predictor de eventos adversos (trombosis y reestenosis). Para ello se utilizó a pacientes del estudio ILUMIEN I20 (ICP guiada por OCT y reserva fraccional de flujo) y pacientes del estudio ADAPT-DES21 (ICP guiada por IVUS). Se estudió la expansión del stent en 940 pacientes con un análisis de covariables ajustadas y en 572 pacientes emparejados por propensión19. En el análisis emparejado no hubo diferencias significativas en el grado de expansión del stent entre la OCT y la IVUS (mediana, el 72,8 frente al 70,6%; p=0,29). Tampoco se detectaron diferencias tras ajustar por diferencias basales en toda la población del estudio (p=0,84). Aunque la OCT detectó mayor prevalencia de mala aposición del stent, prolapso de material y disecciones en el borde del stent, las tasas de mala aposición grave, prolapso de material o disecciones fueron similares entre ambos grupos. Por lo tanto, se concluye que ambas técnicas proporcionan un grado de expansión del stent comparable20.
INTERVENCIONISMO CARDIACO ESTRUCTURALImplante percutáneo de válvula aórticaLa válvula aórtica percutánea SAPIEN 3 (expandible por balón) se ha evaluado en 583 pacientes (de alto riesgo o inoperables) incluidos en el estudio prospectivo PARTNER II SAPIEN 322. La nueva válvula implementa mejoras como menor perfil de acceso, menor tamaño del stent y sellado externo para reducir la regurgitación paravalvular. El abordaje fue transfemoral en el 84% de los casos, transapical en el 10% y transaórtico en el 6%. La media de edad era 82,6 años (el 58% varones) y la puntuación puntuación de la Society of Thoracic Surgeons media, el 8,4%. La supervivencia media al año fue del 85,6%, con una mortalidad cardiaca del 8,1% y una incidencia de ictus del 4,3%. La necesidad de marcapasos permanente fue del 16,9% al año. Los autores concluyen que estos resultados al año indican que el implante percutáneo de válvula aórtica es el tratamiento de elección para pacientes con estenosis aórtica grave de alto riesgo o inoperables.
El estudio PARTNER 123 ha demostrado que la mortalidad a 1, 2 y 3 años es similar con la sustitución valvular quirúrgica y la percutánea en pacientes de alto riesgo con estenosis aórtica grave. Se han presentado los resultados a 5 años de los 699 pacientes incluidos. El objetivo principal del ensayo era la mortalidad por cualquier causa. A los 5 años, el riesgo de muerte fue del 67,8% en el grupo de sustitución percutánea y del 62,4% en el de sustitución quirúrgica (OR=1,04; IC95%, 0,86-1,24; p=0,76). No se registró deterioro estructural valvular en ningún paciente, aunque la aparición de insuficiencia aórtica moderada o grave fue más frecuente en el grupo percutáneo (el 14 frente al 1%; p<0,001) y se asoció a mayor mortalidad (el 72,4% con insuficiencia aortica moderada o grave frente al 56,6% con insuficiencia aortica leve o nula; p=0,003). Estos datos confirman los resultados clínicos similares a largo plazo de la sustitución valvular percutánea frente a la quirúrgica en pacientes de alto riesgo.
Reparación mitral percutáneaEl registro alemán TRAMI (Transcatheter Mitral Valve Interventions)24 se diseñó para evaluar la seguridad y la eficacia del intervencionismo mitral percutáneo con clip mitral. Se ha incluido de manera prospectiva a 828 pacientes (media de edad, 76 años; EuroScore logístico, 20%) tratados con MitraClip entre agosto de 2010 y julio de 2013. Se presentan los datos de 749 pacientes (91%) tras 1 año de seguimiento: el 63,3% estaba en clase funcional I-II de la New York Heart Association (basalmente solo eran el 11%) y la mortalidad al año fue del 20,3%. Los predictores de mortalidad en el análisis multivariable fueron una clase funcional IV de la New York Heart Association (OR=1,62; IC95%, 1,10-2,40; p=0,02), anemia (OR=2,44; IC95%, 1,16-5,12; p=0,02), intervención previa sobre la válvula aórtica (OR=2,12; IC95%, 1,32-3,41; p=0,002), creatinina sérica ≥ 1, 5 mg/dl (OR=1,77; IC95%, 1,24-2,54; p=0,002), enfermedad arterial periférica (OR=2,12; IC95%, 1,41-3,20; p=0,0003), fracción de eyección del ventrículo izquierdo<30% (OR=1,58; IC95%, 1,10-2,31; p=0,01), insuficiencia tricuspídea grave (OR=1,84; IC95%, 1,23-2,77; p=0,003) y un procedimiento fallido definido como conversión a cirugía, fracaso en el implante del clip o insuficiencia mitral grave residual (OR=4,36; p < 0,0001). Los autores concluyen que un alto porcentaje de los pacientes obtuvieron una significativa mejoría clínica al año tras el implante del MitraClip, y que un procedimiento fallido se asoció a la mayor mortalidad en esta serie.
NOVEDADES EN EL INTERVENCIONISMO DE CARDIOPATÍAS CONGÉNITASDurante 2014 y 2015 han aparecido interesantes novedades en la literatura médica sobre tratamiento percutáneo de las lesiones cardiacas congénitas. Patel et al25 revisan las opciones percutáneas de reemplazo valvular en las 4 válvulas y reflexionan sobre la posibilidad de expandir las indicaciones a pacientes más jóvenes con valvulopatía congénita sin comorbilidad grave, pero con un riesgo quirúrgico significativo (disfunción ventricular, múltiples reintervenciones).
La estenosis en una válvula aórtica bicúspide se ha considerado en estos últimos años como una contraindicación para implante percutáneo de prótesis. Sin embargo, Kochman et al26 describen una evolución similar en 28 pacientes con válvula bicúspide sometidos a este procedimiento, comparados con un grupo de control de 84 pacientes con estenosis aórtica y válvula tricúspide, durante un seguimiento de 12 meses.
El acceso yugular se utiliza en pocos pacientes que requieren implante percutáneo de válvulas pulmonares en el tracto de salida del ventrículo derecho. Zampi et al27 describen en qué situaciones se debe usar el acceso transyugular como primera elección: pacientes más jóvenes (menores de 11 años), en insuficiencia tricuspídea moderada o grave y en presiones elevadas en el ventrículo derecho, tras analizar una serie de 81 pacientes, de los que en 14 se utilizó el acceso yugular al fracasar el acceso transfemoral.
Awad et al28 describen la utilidad de la ecocardiografía intracardiaca durante el implante percutáneo de válvulas pulmonares, estableciendo de forma satisfactoria los gradientes y la existencia de insuficiencia en el tracto de salida del ventrículo derecho, antes y después del implante, y disminuyendo la necesidad de fluoroscopia y de realizar medidas de presiones en retirada a través de la endoprótesis implantada.
El seguimiento de las prótesis pulmonares percutáneas mediante tomografía computarizada no es habitual en nuestro entorno, y para el seguimiento se usa más frecuentemente la resonancia magnética, ya que esta valora mejor la función del ventrículo derecho y los volúmenes ventriculares diastólicos y sistólicos. Sin embargo, el estudio mediante tomografía computarizada torácica puede ser un detector de necesidad de reintervención en el caso de la válvula Edwards SAPIEN pulmonar percutánea; la pérdida de su simetría y su forma circular, así como unos diámetros inferiores a los nominales para cada uno de los tamaños disponibles, puede ser un predictor de necesidad de sobreexpansión con balón o necesidad de un procedimiento valve-in-valve durante el seguimiento, como indican Muller et al29.
Aunque hay publicadas series más numerosas, Mallula et al30 presentan una de las pocas series en que se compara el resultado de implantar stent ductal con la realización de una fistula quirúrgica en 2 grupos de pacientes homogéneos con atresia pulmonar y comunicación interventricular. El tiempo de hospitalización fue de 10 días con el stent ductal frente a 23 días con la fístula quirúrgica. La única muerte posprocedimiento se produjo en el grupo de fístula, aunque durante el seguimiento tras el alta hospitalaria necesitaron reintervencion 7 lactantes con stent ductal y 2 del grupo de fístula quirúrgica. La angioplastia de las cardiopatías congénitas en el posquirúrgico inmediato ha estado sujeta a cierta controversia. En los últimos años se aconsejaba un periodo mayor de 4 semanas después de la intervención para dilatar la sutura quirúrgica con seguridad. Sin embargo, Nicholson et al31 describen un total de 91 cateterismos intervencionistas en arterias pulmonares y arco aórtico (dilatación o implante de stents) realizados sin complicaciones menos de 30 días después de la cirugía.
La necesidad de implantar stents en pacientes pequeños había sido vetada por muchos autores, con el argumento de que no siempre se podría sobredilatar hasta conseguir el diámetro final necesario, al terminar el crecimiento del niño. Sin embargo Gil-Jaurena et al32 describen una serie de 35 pacientes a los que se retiró (total o parcialmente) por cirugía 43 stents previamente implantados en distintas localizaciones durante una cirugía correctora, sin dejar lesiones residuales significativas.
CONFLICTO DE INTERESESNinguno.