El síndrome de Bayés es una nueva entidad clínica, caracterizada por la combinación de bloqueo interauricular (BIA) avanzado en el electrocardiograma de superficie con fibrilación auricular (FA) y otras arritmias auriculares. Este síndrome se asocia con un riesgo incrementado de ictus, demencia y mortalidad. El BIA avanzado se diagnostica con la presencia de una onda P ≥ 120ms de morfología bifásica (±) en derivaciones de cara inferior. Se produce por un bloqueo completo del haz de Bachmann que causa una despolarización retrógrada de la aurícula izquierda desde zonas cercanas a la unión auriculoventricular. La miocardiopatía auricular fibrótica es el sustrato anatómico del BIA avanzado. La disincronía inducida por el BIA avanzado funciona como desencadenante y mecanismo de mantenimiento de la FA. Esta alteración de la arquitectura auricular produce remodelado auricular, estasis sanguínea e hipercoagulabilidad, lo cual desencadena la cascada trombogénica. El BIA avanzado, incluso sin arritmias auriculares documentadas, también se ha relacionado con FA, ictus, demencia y mortalidad. Sin embargo, todavía no se ha demostrado el beneficio de la anticoagulación para los pacientes sin FA documentada. Por lo tanto, es recomendable una búsqueda proactiva de FA en los pacientes con BIA avanzado.
Palabras clave
En 1988, Bayés de Luna et al.1 mostraron que los pacientes con bloqueo interauricular (BIA) avanzado presentaban con más frecuencia arritmias supraventriculares que los que tenían BIA parcial. Sin embargo, hasta que se publicó un artículo de consenso sobre BIA en 20122, solo unos pocos autores, fundamentalmente los grupos de Spodick3, García-Cosío4, Platonov5 y el nuestro6,7 se habían interesado por el tema. A partir de dicho artículo de consenso, hubo un creciente interés, y Conde y Baranchuk8 acuñaron para esta combinación el nombre «síndrome de Bayés», rápidamente aceptado por la comunidad científica9–11.
ACTIVACIÓN AURICULARLa onda P nace en el nódulo sinusal, desde donde se origina un asa de activación auricular que en el plano frontal se dirige, con rotación antihoraria, hacia abajo y a la izquierda, lo que origina una onda P positiva en las derivaciones II y aVF, variable en III y aVL, y negativa en aVR. La conducción del estímulo del nódulo sinusal al nódulo auriculoventricular se realiza sin auténticos haces, mientras que la conducción de la aurícula derecha a la izquierda se hace fundamentalmente por la parte alta de la aurícula a través del haz o región de Bachmann, la principal vía de conducción entre las 2 aurículas. La parte final de dicho haz se bifurca y abraza el cuello de la orejuela12,13. En cerca del 30% de los casos, también hay fibras en la zona posterior e inferior del tabique, que pueden conducir el estímulo de la aurícula derecha a la izquierda5. Sin embargo, el resto del septo es de tejido conjuntivo y, por lo tanto, no permite la transmisión del impulso. Por ello, si hay un bloqueo completo de la región de Bachmann, la activación de la aurícula izquierda es retrógrada desde la zona cercana a la unión auriculoventricular (seno coronario y fosa oval), con la consiguiente anomalía en el electrocardiograma (P±en derivaciones inferiores). Como otros tipos de bloqueo cardiacos, el BIA puede ser transitorio, se puede conseguir experimentalmente14,15 y puede presentarse en ausencia cardiopatía estructural reflejada, en este caso, en crecimiento auricular izquierdo.
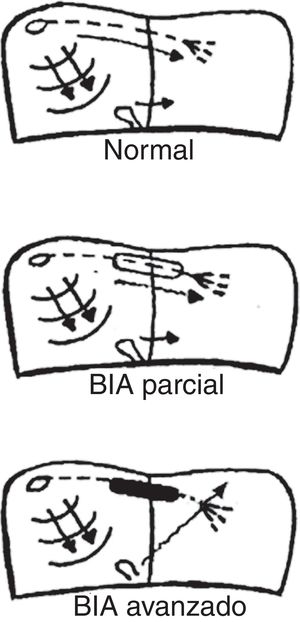
TIPOS DE BLOQUEO INTERAURICULAR Y CRITERIOS ELECTROCARDIOGRÁFICOSEl tipo de conducción auricular del estímulo determina el tipo de BIA (figura 1). Por lo tanto, tenemos:
- •
BIA parcial. El estímulo se conduce desde la aurícula derecha a la aurícula izquierda por el haz de Bachmann, pero con un retraso.
- •
BIA avanzado. El estímulo no se conduce por el haz de Bachmann. La activación de la aurícula izquierda es retrógrada a través de la musculatura del seno coronario y la fosa oval.
También debemos señalar que el BIA puede ser intermitente, ya que a veces puede suceder que el estímulo quede bloqueado y a veces conduce en un mismo trazado electrocardiográfico. Asimismo se debe tener en cuenta que el BIA puede ser progresivo y, con los años, pasar de parcial a avanzado.
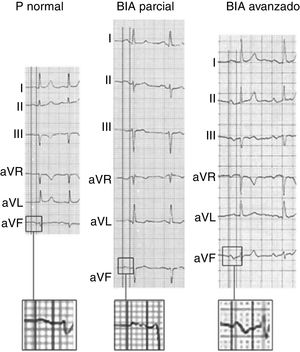
Para el diagnóstico de BIA, el electrocardiograma de superficie debe mostrar una onda P ≥ 120ms y la morfología que permite diagnosticar el grado de bloqueo2,16–18 (figura 2):
- •
BIA parcial: onda P positiva en derivaciones inferiores, frecuentemente bimodal («con muesca») en algunas derivaciones del plano frontal y horizontal.
- •
BIA avanzado: onda P bifásica (±) en derivaciones inferiores.
Ejemplos de onda P normal, bloqueo interauricular (BIA) parcial y avanzado. Adaptado con permiso de Martínez-Sellés et al.18.
También hemos descrito recientemente más morfologías atípicas de BIA avanzado19, de las que no hablaremos en la presente revisión, ya que no se ha demostrado hasta ahora que tengan trascendencia clínica y, además, son poco frecuentes.
FISIOPATOLOGÍA Y CONSECUENCIAS DEL BLOQUEO INTERAURICULAR AVANZADOTanto la FA como el BIA avanzado tienen como sustrato anatómico la miocardiopatía auricular fibrótica20 que, junto con la disincronía auricular21 en los casos de BIA avanzado, se traduce en una aurícula izquierda hipocontráctil que propicia la estasis sanguínea y favorece el remodelado auricular. En estas circunstancias, y a través de la activación de la trombina por los receptores activados por la proteasa, sigue un estado de hipercoagulación que incrementa aún más la fibrosis y el remodelado auricular y precipita la cascada trombogénica y la aparición de embolia sistémica22.
La resonancia magnética es la técnica de elección para detectar miocardiopatía auricular fibrótica23, el sustrato anatomopatológico de la mayoría de los casos de BIA avanzado y de FA. Los pacientes con BIA avanzado pueden presentar un alto grado de fibrosis incluso sin FA documentada24. La ecocardiografía con la técnica de speckle-tracking también permite valorar la fibrosis auricular y tiene implicaciones pronósticas en lo que respecta a recurrencias de la FA25–27.
Hasta hace poco, se consideraba que la FA era la causa final que originaba las embolias sistémicas. Sin embargo, varios estudios en pacientes con Holter implantado han mostrado la ausencia de una relación temporal de los episodios de FA paroxística con la aparición de ictus28–30. Por lo tanto, la FA es solo un factor de riesgo, como lo son el BIA avanzado y otros, como la edad, la hipertensión arterial, la diabetes o la obesidad. De ahí la importancia de la fibrosis auricular y de su relación con la aparición de la estasis que favorece la formación de trombos en la aurícula izquierda y existe tanto en la FA como en el BIA avanzado. De hecho, el novedoso concepto de insuficiencia auricular31 incluye la fibrosis auricular con, a menudo, dilatación auricular, los trastornos de conducción interauricular y, por lo tanto, el síndrome de Bayés entre ellos.
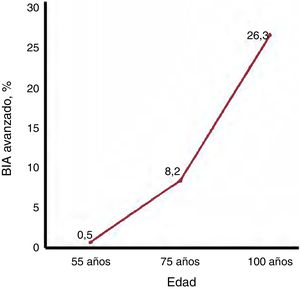
EPIDEMIOLOGÍA DEL BLOQUEO INTERAURICULAR AVANZADOLa prevalencia del BIA avanzado en la población general en la mediana edad (45-64 años) es de solo el 0,5%32, pero sube al 8,2% de los septuagenarios y alcanza el 26,3% de los centenarios18 (figura 3). Es importante señalar que la asociación con la edad es incluso más marcada de lo que reflejan estas cifras ya que, como la FA aumenta también con la edad, la prevalencia de BIA avanzado en los pacientes que siguen en ritmo sinusal es superior a las cifras generales.
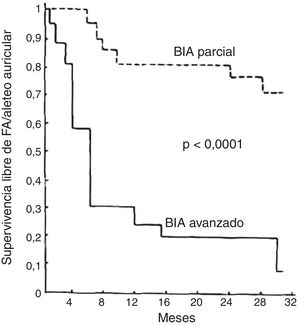
BLOQUEO INTERAURICULAR AVANZADO Y RIESGO DE FIBRILACIÓN AURICULAR, ICTUS Y MUERTEEn la mediana edad, el BIA avanzado triplica el riesgo de FA y casi duplica el riesgo de ictus32,33, lo que explica aproximadamente la mitad de los casos de FA y un cuarto de los ictus que se presentan a esas edades. La duración de la onda P también se asocia con mortalidad cardiovascular34 y muerte súbita cardiaca35. En edades muy avanzadas la presencia de BIA también se asocia con la mortalidad total18. Desde la descripción original de la asociación del BIA avanzado con las arritmias supraventriculares1 (figura 4), la asociación del BIA avanzado con el pronóstico se ha constatado en distintas situaciones clínicas1,18,32,33,36–60 (tabla 1) y la asociación con FA e ictus se ha confirmado en un metanálisis61.
Supervivencia libre de taquiarritmias supraventriculares (fibrilación auricular [FA]/aleteo auricular) en pacientes con bloqueo interauricular (BIA) avanzado en comparación con un grupo similar de pacientes con BIA parcial en el primer trabajo que describió esta asociación. Adaptado con permiso de Bayés de Luna et al.1.
Estudios que han mostrado asociación del bloqueo interauricular avanzado con el pronóstico (fibrilación auricular, ictus y mortalidad)
| Situación clínica | Referencias |
|---|---|
| Población general | O’Neal et al.32 (2016), O’Neal et al.33 (2016), Massó-van-Roessel et al.36 (2017) |
| Atención primaria | Skov et al.37 (2018) |
| Centenarios | Martínez-Sellés et al.18 (2016) |
| Cardioversión farmacológica de la fibrilación auricular | Enriquez et al.38 (2014) |
| Ablación del istmo cavotricuspídeo | Enriquez et al.39 (2015) |
| Ablación de la fibrilación auricular | Caldwell et al.40 (2014), Wu et al.41 (2016), Gul et al.42 (2017) |
| Ablación de Wolff-Parkinson-White | Wu et al.43 (2019) |
| Enfermedad coronaria y carotídea | Alexander et al.44 (2018) |
| Síndrome coronario agudo | Alexander et al.45 (2017), Bernal et al.46 (2018), Çinier et al.47 (2018), Bruna et al.48 (2019) |
| Tako-tsubo | Martín-Demiguel et al.49 (2019) |
| Insuficiencia cardiaca | Sadiq et al.50 (2015), Escobar-Robledo et al.51 (2018) |
| Cirugía cardiaca | Martínez-Sellés et al.52 (2017) |
| Cirugía no cardiaca | Lacalzada-Almeida et al.53 (2019) |
| Miocardiopatía chagásica | Enriquez et al.54 (2014) |
| Valvulopatía y miocardiopatía | Bayés de Luna et al.1 (1988) |
| Ictus | Ariyarajah et al.55 (2007), Cotter et al.56 (2013), Baturova et al.57 (2019), García-Talavera et al.58 (2019) |
| Pacientes hospitalizados | Wu et al.59 (2016) |
| Apnea del sueño | Yeung et al.60 (2018) |
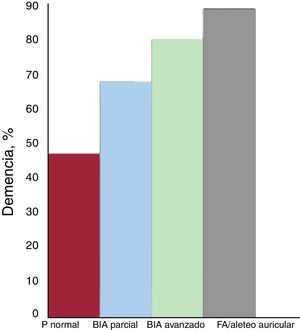
La asociación de FA con el deterioro cognitivo leve y la demencia es ya indudable62. Aunque los mecanismos fisiopatológicos que justifican esta asociación no están totalmente aclarados, probablemente sean multifactoriales e incluyan desde los más evidentes, como el ictus isquémico sintomático y los infartos/microinfartos cerebrales silentes, hasta hemorragias cerebrales y la hipoperfusión cerebral por alteraciones hemodinámicas que conllevan reducción del gasto cardiaco y disminución del flujo arterial cerebral diastólico. En el caso del BIA avanzado, la asociación parece ser muy similar. En el estudio Caracterización científica del corazón del centenario (4C)18, la prevalencia de demencia se incrementaba progresivamente al pasar de onda P normal a BIA parcial, BIA avanzado y FA (figura 5). Probablemente esta asociación se deba a infartos cerebrales silentes, aunque otros factores como la hipoperfusión cerebral crónica podrían tener parte. Esta relación BIA avanzado-demencia indica la necesidad de someter a un cribado cognitivo sistemático a los pacientes con BIA avanzado. Además, en los pacientes con disfunción cognitiva también debería descartarse un BIA avanzado.
Prevalencia de la demencia en el registro 4C18 en función de la presencia y el tipo de bloqueo interauricular (BIA) y de la fibrilación auricular (FA)/aleteo auricular.
Se debe tratar a los pacientes BIA avanzado y episodios previos de FA documentada (síndrome de Bayés) como a otros pacientes con antecedente de FA. En lo que respecta a la estrategia, la presencia de BIA avanzado es un predictor independiente de recurrencia de FA, lo que en algunos casos puede inclinar la balanza hacia el control de frecuencia.
Los pacientes con BIA avanzado sin episodios previos de FA documentada también presentan un riesgo aumentado de ictus. En particular si se suman otros factores de riesgo, como edad avanzada, diabetes, hipertensión arterial, cardiopatía estructural y extrasistolia supraventricular frecuente. Sin embargo, en estos momentos no se dispone de ensayos clínicos que avalen el uso de anticoagulantes en ausencia de FA documentada. Por ello, es importante la monitorización para buscar episodios de FA que puedan avalar la anticoagulación de estos pacientes63. Creemos que sería deseable realizar un estudio aleatorizado, con un brazo de un anticoagulante oral de acción directa y otro de placebo, en pacientes con BIA avanzado que, además, tengan otros de los factores de riesgo mencionados64–66. También podría ser interesante investigar cómo se podría reducir la fibrosis auricular con fármacos antifibróticos.
CONCLUSIONESLa onda P no suele despertar la atención de los clínicos cuando valoran un electrocardiograma. Sin embargo, el diagnóstico de BIA avanzado no tiene solo interés académico, ya que se asocia con arritmias supraventriculares (síndrome de Bayés), ictus, mortalidad y demencia.
CONFLICTO DE INTERESESLos autores no tienen conflictos de intereses.





![Supervivencia libre de taquiarritmias supraventriculares (fibrilación auricular [FA]/aleteo auricular) en pacientes con bloqueo interauricular (BIA) avanzado en comparación con un grupo similar de pacientes con BIA parcial en el primer trabajo que describió esta asociación. Adaptado con permiso de Bayés de Luna et al.1. Supervivencia libre de taquiarritmias supraventriculares (fibrilación auricular [FA]/aleteo auricular) en pacientes con bloqueo interauricular (BIA) avanzado en comparación con un grupo similar de pacientes con BIA parcial en el primer trabajo que describió esta asociación. Adaptado con permiso de Bayés de Luna et al.1.](https://static.elsevier.es/multimedia/03008932/0000007300000009/v1_202008242155/S0300893220302037/v1_202008242155/es/main.assets/thumbnail/gr4.jpeg?xkr=eyJpdiI6IjNmVDFrdE4rVkNLWGdxbUZsV0NpTVE9PSIsInZhbHVlIjoiZURZZW1rMmh4UWppaWw3K2NuazVtNnlON2xkSGJJcEJubnN2UHdRb2dFYz0iLCJtYWMiOiIxNGQyZmFiNGJiMDgzYjNiMjU2NjRmYTYzYjFjZDU2MTlhN2UyMDU4MWUyZTAzNTE0MjliYTBkYTc3ZGNlNzg0IiwidGFnIjoiIn0=)
