Palabras clave
INTRODUCCIÓN
Tradicionalmente, las personas afectadas de diabetes mellitus tipo 1 (DM1) presentaban un peso normal o bajo y una tendencia tardía a la hipertensión arterial y la dislipemia. Hasta hace pocos años, las principales causas de muerte en la DM1 eran las derivadas de las complicaciones microvasculares, en especial la nefropatía1. Aunque los avances terapéuticos de la DM1 y los principales factores de riesgo cardiovascular se han acompañado de significativos descensos de las tasas de mortalidad y de complicaciones microvasculares2-5, no se ha observado una tendencia análoga en la enfermedad cardiovascular6.
Aunque la DM1 obedece a la destrucción inmunitaria de las células beta pancreáticas y suele presentarse a edades tempranas, los pacientes que la padecen no están exentos de contraer resistencia a la insulina en algún momento evolutivo de la enfermedad7-9, lo que se conoce como «diabetes doble». Este fenómeno suele aparecer en pacientes con antecedentes familiares de diabetes mellitus tipo 2 (DM2) y se asocia a un mayor índice de masa corporal, mayores requerimientos de insulina y peor control metabólico10. Además de la resistencia a la insulina, otros factores que podrían explicar que la enfermedad cardiovascular sea la principal causa de muerte en estos pacientes son las complicaciones crónicas de la DM1 como la nefropatía11 y la menor edad de inicio de la enfermedad y, en consecuencia, un periodo de exposición a los principales factores de riesgo cardiovascular potencialmente más largo, junto con un deficiente control de éstos12,13. Consecuentemente, en los últimos años las características fenotípicas y el perfil de riesgo cardiovascular de los pacientes con DM1 son cada vez más similares a las de la DM2.
Desde la descripción del síndrome metabólico por Reaven en 198814, múltiples estudios han dejado patente su relación con la morbimortalidad cardiovascular15-18, datos especialmente relevantes por su elevada prevalencia. El 10,2% de la población laboral española presenta síndrome metabólico, y estas cifras aumentan hasta el 58,4 y el 50,4% en pacientes con DM2 o glucemia basal alterada, respectivamente19. La mayor parte de los estudios se han realizado en pacientes mayores de 40 años, muchos de ellos afectos de DM2 o con glucemia basal alterada, mientras que son escasos los datos en la DM1. Dada la escasez de estudios al respecto en nuestro medio, en el presente trabajo se evalúa la prevalencia de síndrome metabólico en pacientes con DM1 y los posibles factores relacionados.
MÉTODOS
Pacientes
Se realizó un estudio transversal de los pacientes con DM1 atendidos consecutivamente en la Consulta Externa de Endocrinología del Hospital del Mar de Barcelona entre enero y diciembre de 2008. Se consideró DM1 autoinmunitaria cuando se cumplían los criterios diagnósticos de diabetes mellitus20 junto con positividad de los anticuerpos anti-GAD/65Ks o anti-IA2 al inicio y una concentración de péptido C libre < 1,1 ng/ml a los 6 min de la administración de 1 mg de glucagón intravenoso. Se excluyó a los pacientes no caucásicos, los pacientes con variaciones en la concentración de glucohemoglobina > 1% en tres determinaciones bimensuales, las mujeres gestantes, los pacientes con consumo excesivo de alcohol y/o insuficiencia renal crónica terminal y a los trasplantados renales o en programa de hemodiálisis. Ningún paciente seguía tratamiento con fármacos sensibilizadores a la insulina como las tiazolidinedionas o la metformina. El protocolo de estudio, aprobado por el Comité de Ética del centro, incluía un examen físico y una extracción sanguínea. Todos los participantes eran mayores de 18 años, con un tiempo de evolución de la diabetes superior a 6 meses.
De cada paciente se recogieron la edad, el sexo, el tiempo transcurrido desde el diagnóstico de la diabetes, los antecedentes de episodios cardiovasculares mayores (infarto agudo de miocardio, cirugía de revascularización coronaria, angioplastia, ictus, accidente cerebrovascular isquémico transitorio y enfermedad vascular periférica, definida como presencia de claudicación intermitente o amputación), así como la presencia de complicaciones crónicas microangiopáticas de la diabetes (microalbuminuria o macroalbuminuria, retinopatía, neuropatía periférica o autonómica). La presencia de complicaciones fue evaluada por un diabetólogo experto (JJC), excepto la retinopatía, que fue valorada por un oftalmólogo. Se aplicaron los criterios de la American Diabetes Association para el diagnóstico clínico de las complicaciones20, y se estimaron los requerimientos de insulina en unidades por kilogramo de peso (U/kg/día). El examen físico incluyó la medida del peso, la talla y el perímetro de cintura abdominal, así como la determinación de la presión arterial según las técnicas estandarizadas.
El estadio renal se clasificó en función de la excreción urinaria de albúmina (EUA): a) la ausencia de nefropatía se definió como normoalbuminuria (EUA < 30 mg/24 h); b) la nefropatía incipiente, como microalbuminuria (EUA 30-300 mg/24 h), y c) la nefropatía establecida, como macroalbuminuria (EUA > 300 mg/24 h). La EUA se expresó como la media de tres muestras de orina de 24 h tomadas en el domicilio durante un periodo de actividad normal en dos determinaciones separadas por 1 mes de intervalo.
Determinaciones
A los pacientes incluidos en el estudio se les extrajo sangre venosa tras 12 h de ayuno. Se determinaron las concentraciones de colesterol total y triglicéridos mediante métodos enzimáticos en un analizador automático Cobas Mira (Baxter Diagnostics AG, Düdingen, Suiza) y el colesterol de las lipoproteínas de alta densidad (cHDL), mediante separación por precipitación con ácido fosfotúngstico y cloruro de magnesio. La glucemia se determinó por el método de la oxidasa. La glucohemoglobina se cuantificó mediante cromatografía (Biosystem, Barcelona, España) y la excreción urinaria de albúmina, por nefelometría (coeficiente de variación interanalítica, 2%). Se determinó el péptido C libre mediante radioinmunoanálisis a los 6 min de la administración de 1 mg de glucagón intravenoso, en situación de ayunas y con una glucemia basal < 180 mg/dl para evitar la glucotoxicidad en la célula beta, al menos 1 mes después del inicio de la terapia con insulina. La dosis previa de insulina se administró la noche anterior.
Criterios de síndrome metabólico
Según los criterios modificados del National Cholesterol Education Program-Adult Treatment Panel III (NCEP-ATP III)21, se efectuó el diagnóstico de síndrome metabólico cuando el paciente presentaba tres o más de los siguientes factores: glucemia plasmática en ayunas ≥ 100 mg/dl o tratamiento con fármacos hipoglucemiantes, presión arterial ≥ 130/85 mmHg o tratamiento farmacológico antihipertensivo, trigliceridemia plasmática en ayunas ≥ 150 mg/dl (1,7 mmol/l) o tratamiento farmacológico para la hipertrigliceridemia, cHDL < 40 mg/dl (1,03 mmol/l) en varones y < 50 mg/dl (1,3 mmol/l) en mujeres o tratamiento farmacológico para incrementar la concentración de cHDL, y un perímetro de cintura abdominal ≥ 102 cm en varones y ≥ 88 cm en mujeres.
Análisis estadístico
Aceptando un riesgo alfa de 0,05 para una precisión de ±10% en un contraste bilateral para una proporción estimada de síndrome metabólico del 40%, se precisaría una muestra aleatoria poblacional de 93 sujetos, asumiendo que la población es de 100.000 sujetos.
Se utilizó la prueba de la t de Student para la comparación de medias y la prueba de la χ2 para el análisis de las variables categóricas, así como el test de la U de Mann-Whitney para las variables que no siguieran una distribución normal, y el coeficiente de correlación de Pearson para establecer relaciones entre variables cuantitativas. Para evaluar los factores asociados con la presencia de síndrome metabólico (variable dependiente), se aplicó un modelo de regresión logística múltiple que incluía como variables independientes las que mostraron un valor de p < 0,1 en el análisis univariable. Para el análisis de los resultados se empleó el programa estadístico SPSS, versión 12.0 para Windows.
RESULTADOS
De los 165 pacientes atendidos durante 2008 en la Consulta Externa de Endocrinología, se excluyó a 56 por falta de confirmación del diagnóstico de DM1 autoinmunitaria, variaciones de la concentración de glucohemoglobina, excesivo consumo de alcohol y/o insuficiencia renal terminal. De los 109 pacientes elegibles, 91 (83,5%) completaron el protocolo de estudio y constituyeron la muestra definitiva. La edad (media ± desviación estándar) de los pacientes fue 39,7 ± 13,2 años; eran 53 varones y 38 mujeres, con una duración media de la DM1 de 16,7 ± 12,9 años y una concentración media de glucohemoglobina de 7,29% ± 1,4%.
Todos los pacientes cumplían el criterio de glucemia plasmática en ayunas elevada; 57 (62,6%) cumplían dos o más; 29 (31,9%), tres o más; 11 (12,1%), cuatro o más, y 2 (2,2%) cumplían todos los criterios de síndrome metabólico. Por lo tanto, 29 pacientes (17 varones, 12 mujeres) presentaban un síndrome metabólico según los criterios modificados del NCEP-ATP III21, lo que supone una prevalencia general del 31,9% (intervalo de confianza [IC] del 95%, 22,3%-41,5%). La tabla 1 refleja la prevalencia de cada uno de los componentes del síndrome metabólico en el grupo total de pacientes con DM1.
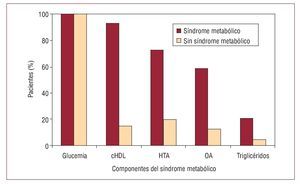
El criterio más frecuente entre los pacientes con síndrome metabólico, además de la glucemia, fue la concentración de cHDL, presente en el 93,1% de los casos, seguido de la hipertensión arterial (72,4%), la obesidad abdominal (58,6%) y la hipertrigliceridemia (20,7%). Estos porcentajes contrastan con los observados en los pacientes con DM1 sin síndrome metabólico (fig. 1).
Fig. 1. Proporción de pacientes que cumplen los diferentes criterios de síndrome metabólico. cHDL: colesterol de las lipoproteínas de alta densidad; HTA: hipertensión arterial; OA: obesidad abdominal.
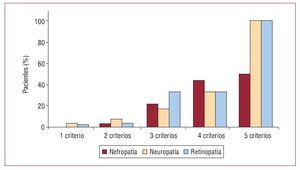
Los pacientes afectos de DM1 y síndrome metabólico tenían mayor edad, más tiempo de evolución de la diabetes, mayor índice de masa corporal y más prevalencia de sobrepeso que aquellos sin síndrome metabólico (tabla 2). No hubo diferencias en el porcentaje de complicaciones macroangiopáticas; sin embargo, los pacientes con DM1 y síndrome metabólico mostraron una prevalencia significativamente mayor de complicaciones microangiopáticas (retinopatía, neuropatía y nefropatía) que aquellos sin síndrome metabólico. Además, se constató una relación directa entre el número de componentes del síndrome metabólico y la prevalencia de microangiopatía, que llegó a ser del 100% en los pacientes que cumplían todos los criterios diagnósticos de síndrome metabólico (fig. 2). Por otra parte, los requerimientos diarios de insulina fueron similares en los pacientes con y sin síndrome metabólico (0,69 ± 0,2 frente a 0,72 ± 0,3 U/kg/día).
Fig. 2. Prevalencia de complicaciones microvasculares de acuerdo con el número de componentes del síndrome metabólico.
En el modelo logístico de regresión múltiple, la edad, el índice de masa corporal y la glucohemoglobina mantuvieron una asociación significativa e independiente con la presencia de síndrome metabólico (tabla 3).
DISCUSIÓN
El presente estudio refleja una prevalencia de síndrome metabólico en pacientes con DM1 del 31,9% (el 31,5% de las mujeres y el 32% de los varones). En estudios con población americana y DM1, oscila entre el 21 y el 8% en función de los criterios diagnósticos utilizados22. En Europa, estudios como el FinnDiane23 muestran una prevalencia de síndrome metabólico del 39% según los criterios del NCEP-ATP III. Se han referido datos similares en el área mediterránea, donde empleando los mismos criterios la prevalencia es del 40,8%24.
De todos los componentes de síndrome metabólico (independientemente de la glucemia, presente en todos los sujetos), el más frecuente fue la hipoalfalipoproteinemia. En población afecta de DM1 de nuestro entorno se han descrito prevalencias de cHDL bajo (< 35 mg/dl en varones y < 45 mg/dl en mujeres) cercanas al 12% en pacientes con buen control metabólico y al 20% en aquellos con peor control25.
De cada 3 pacientes con DM1 y síndrome metabólico, 2 presentaban obesidad abdominal según el perímetro de cintura abdominal. Estos datos concuerdan con los obtenidos en la cohorte del DCCT durante el seguimiento26, en la que el promedio de aumento ponderal tras la insulinización fue de 14 kg. Hay que destacar que en el presente estudio no hubo diferencias en los requerimientos diarios de insulina entre los pacientes con y sin obesidad abdominal (0,69 ± 0,15 frente a 0,72 ± 0,34 U/kg/ día), lo que indica que factores como los hábitos dietéticos, el ejercicio o los antecedentes familiares deben de intervenir en el desarrollo de la obesidad visceral.
En cuanto a la repercusión del síndrome metabólico en las complicaciones crónicas, la proporción de pacientes con microangiopatía es claramente mayor entre los que lo sufren, lo que confirma los resultados descritos en otras series europeas, en las que se ha llegado a reflejar una prevalencia de síndrome metabólico de hasta el 62% en pacientes con macroalbuminuria, y una razón de riesgos de 3,75 (IC del 95%, 2,89-4,85) para nefropatía en caso de síndrome metabólico23. En el presente estudio, la proporción de pacientes con microangiopatía aumenta de manera paralela al número de componentes del síndrome metabólico, y llega a ser del 100% en los sujetos que cumplían los cinco criterios diagnósticos.
Por otro lado, estudios con un gran número de pacientes y seguimiento a largo plazo han puesto de manifiesto también la relación entre la resistencia a la insulina, el síndrome metabólico y la macroangiopatía12,27,28, hecho no constatado en el presente estudio. En este sentido, el escaso número de casos en ambos grupos, la media de edad de los pacientes, el buen control metabólico y el tiempo medio de evolución de la diabetes relativamente corto (16,7 años) han podido contribuir a la ausencia de diferencias significativas en las complicaciones macrovasculares. Además, la mayor parte de estos pacientes fueron diagnosticados después de conocerse los resultados del estudio DCCT, por lo que han seguido terapias de insulina intensificadas desde el diagnóstico, lo que ha demostrado reducir la incidencia de episodios cardiovasculares graves en un 42% a 20 años29. Por último, se han aplicado criterios estrictos para el diagnóstico de la DM1 autoinmunitaria, con lo que se excluyó a los pacientes jóvenes con DM2, en los que la prevalencia de macroangiopatía al diagnóstico puede llegar hasta el 20% debido a la demora entre el inicio de la hiperglucemia y el diagnóstico30 por la intensa asociación entre la DM2, el síndrome metabólico y la enfermedad cardiovascular31.
El modelo de regresión logística múltiple pone de manifiesto que el grado de control de la glucemia, evaluado mediante la glucohemoglobina, es la variable que más influye en el desarrollo de síndrome metabólico, seguido del índice de masa corporal y la edad. En estudios previos se había señalado que el control metabólico no influye11, pero es de destacar que la glucohemoglobina en éstos era superior al 10%, prácticamente un 3% superior a la del presente estudio.
Limitaciones
Las limitaciones del presente estudio se derivan de su diseño transversal, por lo que no debemos olvidar, por un lado, las posibles variaciones temporales en los parámetros evaluados y, por otro, que los hallazgos descritos representan sólo asociaciones y no implican causalidad. El tamaño muestral resulta de aplicar criterios estrictos para el diagnóstico de DM1 autoinmunitaria y excluir a los pacientes con escaso tiempo de evolución para evitar los efectos de la insulinopenia en la glucohemoglobina y las variables antropométricas. En cualquier caso, las características basales de los pacientes incluidos en el estudio son las propias de la población con DM1 de nuestro entorno32.
CONCLUSIONES
El síndrome metabólico es frecuente en los pacientes con DM1, está presente en un tercio de los pacientes con diabetes mellitus de nuestro medio, especialmente los de mayor edad, mayor índice de masa corporal y peor control metabólico. La presencia de síndrome metabólico en este grupo de pacientes se asocia con las complicaciones microvasculares.
ABREVIATURAS
DE: desviación estándar.
EUA: excreción urinaria de albúmina.
HDL: lipoproteínas de alta densidad.
NCEP-ATP III: National Cholesterol Education
Program-Adult Treatment Panel III.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. J. Pedro-Botet.
Departamento de Medicina. Hospital del Mar. Pg. Marítim, 25-29. 08003 Barcelona. España.
Correo electrónico: 86620@imas.imim.es
Recibido el 23 de julio de 2009.
Aceptado para su publicación el 1 de diciembre de 2009.