El implante valvular aórtico transcatéter es actualmente una opción terapéutica aceptada para pacientes con estenosis aórtica grave sintomática y alto riesgo quirúrgico. En particular, se ha demostrado en ensayos aleatorizados que el implante valvular aórtico transcatéter reduce la mortalidad respecto al tratamiento médico de pacientes inoperables y que es no inferior a la cirugía convencional para pacientes de alto riesgo quirúrgico. Desde sus inicios, el implante valvular aórtico transcatéter mostró tener un gran potencial, por lo que se ha puesto mucho interés en diseñar nuevos dispositivos con el objetivo de mejorar los resultados e incrementar las indicaciones en anatomías cada vez más complejas y en pacientes con múltiples comorbilidades. En esta revisión, se presentan los avances en el diseño de nuevas prótesis transcatéter y se discute la evidencia actual sobre estas prótesis de nueva generación.
Palabras clave
Desde que Alain Cribier realizó el primer implante valvular aórtico transcatéter (TAVI) en 20021, esta técnica ha tenido amplia expansión, ya que actualmente hay más de 60.000 implantes realizados2–17. Actualmente el TAVI está indicado para pacientes con estenosis aórtica grave (EAoG) sintomática que no son candidatos a cirugía o tienen alto riesgo. Dos válvulas acaparan la práctica totalidad de la experiencia: la Edwards SAPIEN® Transcatheter Heart Valve (Edwards Lifesciences; Irvine, California, Estados Unidos) y la Medtronic CoreValve® (Medtronic; Minneapolis, Minnesota, Estados Unidos).
Las modificaciones efectuadas, que han mejorado sus características técnicas, y la mayor experiencia de hemodinamistas y cirujanos cardiacos en el implante han llevado a una significativa mejora en los resultados clínicos respecto a los de los dispositivos comercializados inicialmente. Pese a ello, el TAVI sigue teniendo limitaciones que impiden ampliar la indicación a pacientes de menor riesgo quirúrgico. Dichas complicaciones son las fugas perivalvulares, las complicaciones vasculares, las alteraciones del tejido de conducción que conllevan implante de marcapasos, el ictus y la oclusión coronaria.
En los últimos años, se han comercializado o están en fase de investigación y diseño nuevas prótesis de segunda generación, cuyo objetivo es minimizar dichas complicaciones y permitir un implante más sencillo y predecible con que ampliar la indicación de TAVI a un mayor número de pacientes. En esta revisión se presentan las características técnicas y la evidencia científica actual de las diferentes prótesis disponibles y las que están en fase de desarrollo.
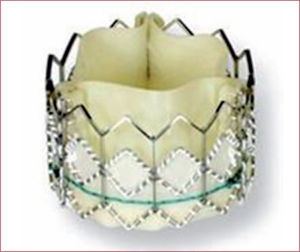
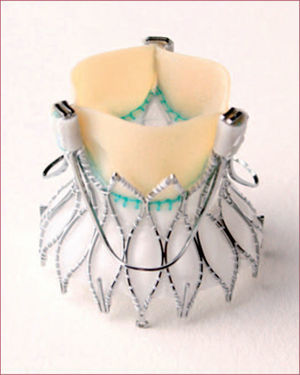
Prótesis de primera generaciónEdwards Sapien®CaracterísticasLa Edwards SAPIEN® THV es una prótesis expandible con balón compuesta por tres velos de pericardio bovino suturados a un stent de acero inoxidable. La válvula debe fijarse al balón inmediatamente antes del implante. Para el implante es preciso realizar estimulación ventricular rápida. Esta prótesis recibió la marca de conformidad europea CE en 2007 para el implante transfemoral (TF); en 2010, para el implante por vía subclavia, y en 2011, para el acceso aórtico directo; en 2010 la recibió el modelo actual, la válvula Edwards SAPIEN® XT (figura 1). En esta, el stent es de cromo-cobalto, lo que permite una estructura más abierta, con menos struts y más finos, lo que ha permitido una reducción de su perfil sin pérdida de fuerza radial. Otro cambio importante se produjo en el sistema de liberación, el Novaflex®. Con este sistema, la válvula se monta sobre el balón en la aorta descendente, lo que ha permitido reducir el perfil del introductor. El nuevo introductor eSheath® tiene un diámetro basal de 16 Fr que aumenta transitoriamente a 18–19 Fr con el paso del dispositivo en función del tamaño de la prótesis. La prótesis Edwards SAPIEN® XT utiliza para el implante transapical (TA) el catéter de liberación Ascendra II, con un diámetro externo de 26 Fr. La prótesis Edwards SAPIEN® XT dispone de los tamaños de 23, 26 y 29mm y cubre medidas de anillo aórtico entre 18 y 27
Evidencia científicaEn el ensayo multicéntrico aleatorizado PARTNER, con la prótesis Edwards SAPIEN® HTV, los pacientes considerados inoperables18 (PARTNER IB) se beneficiaron claramente del TAVI comparado con el tratamiento médico, que incluía valvuloplastia aórtica. Al cabo de 1 año, la mortalidad fue del 31% con TAVI y el 51% con tratamiento médico. Dichos resultados se mantenían a los 2 años: el 68 y el 43,3%19. El ensayo PARTNER IA20 comparó el TAVI con la cirugía convencional de recambio valvular en pacientes de alto riesgo. El TAVI fue no inferior al tratamiento quirúrgico en la mortalidad a 1 año: el 24,2 y el 26,8% respectivamente20. Dichos resultados se mantenían a los 2 años, con una mortalidad global del 33,9% en el grupo de TAVI y el 35% en el grupo de cirugía. No obstante, en un análisis de objetivos secundarios, se observó mayor número de accidentes isquémicos cerebrales, complicaciones vasculares y regurgitación aórtica en el grupo tratado con TAVI que en el tratado con cirugía. En noviembre de 2011, la Food and Drug Administration de Estados Unidos aprobó el uso de esta válvula para pacientes inoperables y en 2012, para pacientes de alto riesgo.
Tras la comercialización de la nueva prótesis Edwards SAPIEN® XT, se realizaron varios registros, los más importantes son el SOURCE XT21 y el SENTINEL22, que incluyeron a 2.688 y 2.604 pacientes respectivamente. Se observó una elevada tasa de éxito en el implante (95-100%). En el registro SOURCE XT21 se observó menor mortalidad a los 30 días (el 4,3% TF; el 9,9% TA) que en el registro SOURCE (un 3-9% TF y un 8-18% TA), posiblemente influida en parte por un EuroSCORE logístico medio discretamente inferior en los pacientes del registro SOURCE XT. La diferencia de mortalidad se mantenía a los 2 años (el 27,7% en SOURCE XT y el 31,5% en SOURCE). La incidencia de ictus (el 1,7 y el 2,2%) y de marcapasos (6%) no ha presentado variaciones significativas respecto a la prótesis previa. Tampoco ha variado la incidencia de fuga periprotésica moderada/grave, que se mantiene en tasas del 6% al año. Sí se ha reducido la incidencia de complicaciones vasculares mayores, con unas tasas del 7,3% en el registro SOURCE XT y del 2,9% en el registro SENTINEL.
Actualmente se están llevando a cabo dos ensayos clínicos con la prótesis SAPIEN® XT. El primero, el PARTNER II, está dividido en dos cohortes. En la cohorte A, se distribuye aleatoriamente 1:1 a 2.000 pacientes de riesgo quirúrgico intermedio (escala de riesgo quirúrgico de la Society of Thoracic Surgeons [STS] > 4) a TAVI con SAPIEN® XT o a cirugía, con un seguimiento mínimo de 2 años. En la cohorte B, se aleatoriza a 500 pacientes inoperables a implante de TAVI con prótesis Edwards SAPIEN® XT o Edwards SAPIEN® THV, con el objetivo de comparar la seguridad y la eficacia de ambos dispositivos.
El segundo es el Aspirin Versus Aspirin and Clopidogrel Following Transcatheter Aortic Valve Implantation (ARTE). Este ensayo compara la eficacia del ácido acetilsalicílico con la combinación de ácido acetilsalicílico y clopidogrel como estrategia antitrombótica en 200 pacientes sometidos a TAVI con prótesis SAPIEN® XT.
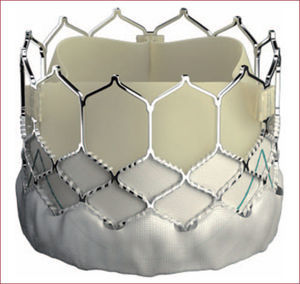
Medtronic CoreValve®CaracterísticasLa prótesis CoreValve® (Medtronic Inc.; Minneapolis, Minnesota, Estados Unidos) (figura 2) consiste en tres valvas de pericardio porcino suturadas sobre un stent autoexpandible de nitinol. A bajas temperaturas, el nitinol es muy moldeable y la prótesis se puede comprimir e introducir dentro del catéter de liberación. A temperatura corporal, la prótesis recupera su forma predefinida. El perfil externo es de 18 Fr y lleva incluido el sistema de liberación AccuTrak®, que aumenta la estabilidad durante la liberación. Una vez implantada la prótesis, la válvula queda situada en posición supranular para optimizar el área efectiva. La prótesis presenta una estructura con celdas más amplias a nivel proximal para facilitar el acceso a los ostium coronarios. Para el implante no se requiere sobrestimulación ventricular rápida y, una vez que se han liberado dos tercios de la prótesis, la válvula ya funciona. En ese momento, se puede retirar ligeramente la prótesis en caso de que el implante se haya realizado bajo, pero no se puede recapturar dentro del catéter de liberación. En caso necesario, se puede recapturar dentro del introductor a nivel de la aorta abdominal. La prótesis está disponible en tamaños de 23, 26, 29 y 31mm, lo que cubre medidas del anillo entre 18 y 31mm.
Evidencia científicaLa eficacia y la seguridad de la prótesis CoreValve® en pacientes de riesgo quirúrgico extremo se estudió en el CoreValve Extreme Risk Pivotal Trial23. En este estudio multicéntrico, el objetivo principal era muerte o accidente cerebrovascular (ACV) a los 12 meses del implante. Los resultados se compararon con un grupo preespecificado, ya que no se consideró ético realizar un estudio aleatorizado para comparar con el tratamiento médico, dados los resultados obtenidos en el estudio PARTNER B18. La tasa de mortalidad o ACV a los 12 meses fue del 26%, significativamente menor que la del grupo de comparación (43%). Las complicaciones a 30 días incluyeron el 12,7% de complicaciones hemorrágicas mayores, el 8,2% de complicaciones vasculares mayores y una tasa de implante de marcapasos del 21,6%. La tasa de regurgitación aórtica fue menor a los 12 meses del implante (4,2%) que al alta (10,7%).
En el ensayo multicéntrico aleatorizado US CoreValve® Pivotal Trial24, se comparó el implante de CoreValve® con la cirugía de recambio valvular en pacientes de alto riesgo quirúrgico. Al cabo de 1 año, la mortalidad por cualquier causa fue significativamente menor entre los pacientes tratados con CoreValve® que entre los tratados con cirugía (el 14,2 y el 19,1%), con una reducción absoluta del 4,9%. Los análisis secundarios indican una reducción de la tasa de eventos cardiovasculares y cerebrovasculares mayores entre los pacientes tratados con TAVI.
A diferencia del ensayo PARTNER IA20, en el US CoreValve Pivotal Trial no se observaron diferencias significativas en la aparición de ictus (el 4,9% con TAVI y el 6,2% con cirugía; p = 0,46). Las complicaciones vasculares mayores, la necesidad de marcapasos y la incidencia de fuga periprotésica moderada/grave fueron significativamente más frecuentes en el grupo de TAVI. Por otra parte, el sangrado, la lesión renal aguda y la fibrilación auricular fueron significativamente más frecuentes en el grupo de cirugía. A raíz de los resultados de este estudio, en enero de 2014 la prótesis CoreValve® recibió la aprobación de la Food and Drug Administration para su utilización en Estados Unidos.
Se han publicado múltiples registros llevados a cabo con distintas prótesis (tabla 1). El mayor es el registro ADVANCE25, que incluyó a 1.015 pacientes. En estos registros se ha documentado una alta tasa de éxito del implante (90-98%), con una mortalidad baja a 30 días (4,5-15%) y a 1 año (11,4-28,1%) respecto a la mortalidad esperable según el EuroSCORE logístico y comparable con la mortalidad observada con la prótesis de Edwards. La incidencia de ictus se mantuvo en resultados aceptables (un 1,7-4,5% en la mayoría de los registros). La incidencia de complicaciones vasculares mayores fue también baja (1,9-10,9%). Se ha observado mayor incidencia de marcapasos, que se atribuye a un implante más profundo a nivel del tracto de salida del ventrículo izquierdo. En este sentido, los resultados del registro ADVANCE II26 mostraron una incidencia de marcapasos del 13,3% si la profundidad del implante en el tracto de salida era < 6mm, mientras que ascendía al 21,4% si era > 6mm. En el análisis multivariable, el único predictor de necesidad de marcapasos fue la profundidad del implante en el tracto de salida.
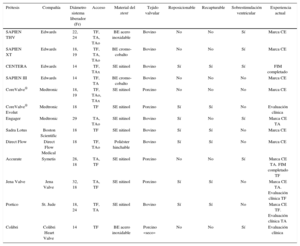
Características de las principales prótesis aórticas transcatéter.
| Prótesis | Compañía | Diámetro sistema liberador (Fr) | Acceso | Material del stent | Tejido valvular | Reposicionable | Recapturable | Sobrestimulación ventricular | Experiencia actual |
|---|---|---|---|---|---|---|---|---|---|
| SAPIEN THV | Edwards | 22, 24 | TF, TA, TAo | BE acero inoxidable | Bovino | No | No | Sí | Marca CE |
| SAPIEN XT | Edwards | 18, 19 | TF, TA, TAo | BE cromo-cobalto | Bovino | No | No | Sí | Marca CE |
| CENTERA | Edwards | 14 | TF, TAx | SE nitinol | Bovino | Sí | Sí | Sí | FIM completado |
| SAPIEN III | Edwards | 14 | TF, TA | BE cromo-cobalto | Bovino | No | No | No | Marca CE |
| CoreValve® | Medtronic | 18, 19 | TF, TAo, TAx | SE nitinol | Porcino | No | No | No | Marca CE |
| CoreValve® Evolut | Medtronic | 18 | TF | SE nitinol | Porcino | Sí | Sí | No | Evaluación clínica |
| Engager | Medtronic | 29 | TA, TAo | SE nitinol | Bovino | Sí | No | Sí | Marca CE TA |
| Sadra Lotus | Boston Scientific | 18 | TF | SE nitinol | Bovino | Sí | Sí | No | Marca CE |
| Direct Flow | Direct Flow Medical | 18 | TF, TAo | Poliéster hinchable | Bovino | Sí | Sí | No | Marca CE |
| Accurate | Symetis | 28, 18 | TA, TF | SE nitinol | Porcino | No | No | Sí | Marca CE TA. FIM completado TF |
| Jena Valve | Jena Valve | 32, 18 | TA, TF | SE nitinol | Porcino | Sí | Sí | No | Marca CE TA. Evaluación clínica TF |
| Portico | St. Jude | 18, 24 | TF, TA | SE nitinol | Bovino | Sí | Sí | No | Marca CE TF. Evaluación clínica TA |
| Colibri | Colibri Heart Valve | 14 | TF | BE acero inoxidable | Porcino «seco» | No | No | Sí | Evaluación clínica |
BE: expandible con balón; CE: Conformidad Europea; SE: autoexpandible; TA: transapical; TAx: transaxilar; TF: transfemoral.
Con la prótesis CoreValve® también se dispone de datos de seguimiento a más largo plazo. En el Registro Italiano27 se describe una supervivencia a los 3 años del 59,7%, con una mortalidad de causa cardiaca del 13,5%. No se señalaron casos de deterioro estructural de la válvula.
Hay en proceso dos ensayos clínicos con la prótesis CoreValve®: el primero, el Nordic Aortic Valve Intervention Trial (NOTION) (NCT01057173), es un ensayo aleatorizado que compara el TAVI con CoreValve® y la cirugía en 280 pacientes mayores de 70 años de cualquier perfil de riesgo. El segundo es el Surgical Replacement and Transcatheter Aortic Valve Implantation (SURTAVI) (NCT0586910), un ensayo aleatorizado que compara el TAVI con prótesis CoreValve® y la cirugía en pacientes con EAoG de riesgo intermedio (puntuación de riesgo de la STS del 4–10%); se espera incluir a 2.500 pacientes.
Comparación de las válvulas Edwards SAPIEN® XT y Medtronic CoreValve®El ensayo clínico CHOICE28 es el único que ha comparado directamente ambas prótesis. Es un ensayo multicéntrico que ha aleatorizado a 241 pacientes con estenosis aórtica y riesgo quirúrgico intermedio-alto a TAVI con prótesis Edwards SAPIEN® XT o CoreValve®. El objetivo primario fue el éxito del implante, definido como el correcto implante de la prótesis sin fuga periprotésica moderada-grave ni necesidad de una segunda prótesis y con correcto funcionamiento de la misma área valvular aórtica > 1,2cm2 (gradiente medio < 20mmHg). El objetivo primario fue significativamente superior con la prótesis Edwards que con la CoreValve® (el 95 y el 76% respectivamente; p < 0,001) debido a la menor incidencia de fugas periprotésicas moderadas-graves (el 4 y el 18%; p < 0,001) y la menor necesidad de implantar una segunda prótesis (el 0,8 y el 5,8%; p = 0,03). Sin embargo, no hubo diferencias significativas en la mortalidad a 30 días ni en la mejoría clínica. La incidencia de marcapasos fue significativamente superior con la prótesis CoreValve® (el 38 y el 17%; p = 0,001), y la incidencia de ictus fue superior con la prótesis de Edwards, aunque no significativamente (el 5,8 y el 2,6%; p = 0,33).
Otro ensayo clínico, el Edwards SAPIEN Periprosthetic Leakage Evaluation Versus Medtronic CoreValve in Transfemoral Aortic Valve Implantation (ELECT) (NCT01982032), está actualmente en fase de inclusión. Es un ensayo aleatorizado, cuyo objetivo primario es comparar la incidencia de fuga periprotésica valorada por ecocardiograma transesofágico tridimensional en pacientes sometidos a TAVI con prótesis Edwards SAPIEN® XT comparada con CoreValve®.
Prótesis de segunda generaciónEdwards Sapien® 3El nuevo modelo de prótesis de Edwards (figura 3), también expandible con balón, incorpora modificaciones en el diseño del stent y las valvas que permiten reducir su perfil. Además, las celdas proximales son más abiertas para facilitar el acceso a los ostium coronarios. Se ha diseñado para implante TF, TA y transaórtico. Otra novedad es que el stent incorpora en la porción ventricular un recubrimiento externo de tetrafolato de polietileno para disminuir la fuga periprotésica. Además, el balón incorpora una marca radiopaca en el centro para facilitar el posicionamiento. El nuevo sistema de liberación TF (Comander) incorpora un catéter balón interno con la punta conificada para facilitar el cruce de la válvula aórtica nativa, sobre el que va crimpada la prótesis, y un catéter dirigible externo. Presenta además un mecanismo que permite gran precisión en el avance y la retirada de la prótesis una vez situada a nivel del anillo aórtico, que evita tener que mover todo el sistema de liberación. Finalmente, el introductor eSheath® ha reducido su perfil basal hasta 14 Fr. El sistema de liberación TA Certitude® también muestra una reducción de su perfil (18 Fr) y mayor flexibilidad. Esta prótesis ha recibido recientemente la marca CE. Está disponible en diámetros de 23, 26 y 29mm, que cubre diámetros de anillo de 18 a 27mm.
El primer registro en humanos29 incluyó a 15 pacientes, todos para implante por vía TF. La prótesis se implantó con éxito en todos los pacientes; a los 30 días no había habido muertes (puntuación de riesgo STS basal, 5,4%), complicaciones vasculares ni ictus. Un paciente requirió implante de marcapasos (6,7%). No se requirió posdilatación y los pacientes recibieron el alta hospitalaria tras una mediana de 3 (2–12) días. Recientemente se han comunicado los resultados a 30 días del registro SAPIEN 330, en el que se incluyó a 150 pacientes (50 de alto riesgo y 100 de riesgo intermedio-alto). El acceso fue por vía TF en un 64% y por vía TA en un 36%. El éxito del implante fue del 94%. Un 3,3% requirió posdilatación. La mortalidad a 30 días fue del 5,3%, claramente superior en el grupo TA (TF, 2,1%; TA, 11,1%). La incidencia de ictus fue del 2,7% (TF, 1%; TA, 5,6%). La incidencia de complicaciones vasculares mayores fue del 6%, paradójicamente superior de forma no significativa en el grupo de TA (TF, 5,2%; TA, 7,4%). La incidencia de marcapasos fue del 13,3%. La incidencia de fuga periprótesica moderada a 30 días fue del 3,4% (TF, 2,6%; TA, 5,4%). No se observaron fugas graves.
Edwards Centera®La prótesis Edwards CENTERA® (Edwards Lifesciences) es una prótesis autoexpandible y reposicionable de bajo perfil que puede implantarse con un solo operador por vía TF con un sistema motorizado de liberación de 14 Fr (figura 4). Está compuesta por un stent autoexpandible de nitinol sobre el que va suturada la válvula, formada por tres valvas de pericardio bovino a nivel anular. El catéter de liberación es dirigible para facilitar el paso por el arco aórtico y permitir un posicionamiento más coaxial. Una vez posicionada a nivel del anillo, la liberación y la recaptura de la prótesis se realizan mediante un sistema motorizado que permite un posicionamiento lo más preciso posible. La prótesis se puede reposicionar y recapturar hasta su liberación completa y no requiere sobrestimulación ventricular durante el implante. El introductor es el mismo eSheath de 14 Fr usado para el implante de la SAPIEN 3. Estará disponible en diámetros de 23, 26 y 29mm. Todavía no dispone de marca CE.
Evidencia científicaEn un primer registro31, se implantó la prótesis de 26mm a 15 pacientes, con éxito en todos. La supervivencia a 1 año fue del 80%. Se observó fuga periprótesica moderada en solo 1 paciente (8%) y ningún caso de fuga grave; 4 pacientes (27%) requirieron marcapasos. Con el objetivo de reducir esta complicación, se realizaron modificaciones en el sistema de liberación para mejorar la coaxialidad con la válvula nativa y se redujo el diámetro del borde ventricular del stent para reducir el estrés mecánico en el tejido de conducción. En la primera experiencia32 con esta segunda generación de la prótesis CENTERA se incluyó a 19 pacientes, de los que 5 recibieron todavía la válvula de primera generación y 15, la de segunda generación. El implante se realizó con éxito en todos los pacientes. La mortalidad a 30 días fue del 5,3%. No se observaron fugas periprotésicas moderadas o graves ni complicaciones vasculares mayores. La incidencia de marcapasos se redujo a 3 pacientes, todos ellos con la primera generación de la prótesis. Ninguno de los 15 pacientes a los que se implantó la prótesis de segunda generación requirió marcapasos. Actualmente está en proceso el estudio Safety and Performance of the Edwards CENTERA Self-Expanding Transcatheter Heart Valve (NCT01808274), que incluirá a 150 pacientes en 15 centros de toda Europa y está en fase de inclusión.
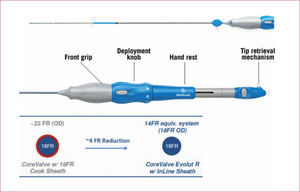
Medtronic CoreValve® EvolutLa prótesis Evolut® es la siguiente generación de la familia CoreValve®. Es totalmente recuperable y, por lo tanto, reposicionable. Se ha rediseñado completamente el stent de nitinol, con lo que ha aumentado su capacidad de adaptación al anillo valvular. Se ha reducido su longitud un 10% para optimizar la navegabilidad, el tamaño de las celdas ha aumentado para facilitar el acceso a las coronarias y el recubrimiento interno de pericardio se extiende unos milímetros en la base de la prótesis para mejorar el sellado y reducir la fuga periprotésica. El mecanismo de sujeción al sistema de liberación también se ha rediseñado, lo que hace que su liberación sea muy consistente. El nuevo sistema de liberación, EnVeo® (figura 5)33, tiene un diámetro externo de 14 Fr gracias al nuevo introductor InLine®, que permite el implante sin utilizar un introductor de 18 Fr. Además permite una liberación muy precisa, con una relación 1:1 entre la acción del operador y la retirada (o avance) de la cápsula de liberación de la prótesis. La prótesis tiene la marca CE y está disponible en tamaños de 23, 26, 29 y 31mm.
Hay dos estudios en proceso: el Evolut® CE (NCT01876420) y el Evolut® US. El estudio europeo es multicéntrico, de un solo brazo y no aleatorizado y tiene como objetivo evaluar la seguridad (mortalidad por cualquier causa y ACV a los 30 días) y el comportamiento clínico (éxito del dispositivo según los criterios del VARC II e incidencia de insuficiencia aórtica precoz evaluada por ecografía) en 60 pacientes con EAoG sintomática y riesgo quirúrgico alto o extremo. El periodo de inclusión ha terminado.
El Evolut® US (NCT02207562) es un estudio multicéntrico, de un solo brazo y no aleatorizado en 25 hospitales en Estados Unidos; tiene como objetivo evaluar la seguridad y la eficacia de la prótesis a lo largo de 5 años de seguimiento en un mínimo de 150 pacientes y un máximo de 250 con EAoG sintomática y riesgo quirúrgico alto o extremo a los que se implantó la prótesis. Los objetivos primarios son los mismos que en el estudio previo. Aún está en fase de inclusión.
Direct Flow MedicalLa prótesis Direct Flow (Direct Flow Medical Inc.; Santa Rosa, California, Estados Unidos) es la primera prótesis no metálica (figura 6). Consiste en una válvula trivalva de pericardio bovino montada entre dos anillos hinchables de poliéster, que están conectados a tres tubos que permiten controlar el posicionamiento y el inflado de los anillos. La válvula se puede liberar vía TF o transaórtica y recibió la marca CE en enero de 2013. Para su implante, la válvula se progresa al ventrículo, se infla el anillo ventricular con una mezcla de contraste y suero salino para permitir la visualización con escopia, se tira entonces de la válvula y, una vez en posición, se infla el anillo aórtico. La válvula ya es competente cuando se hinchan los anillos de la válvula. Una vez comprobada la posición, se cambia la mezcla de contraste y suero por un polímero que se solidifica y permite el anclaje de la válvula. No se requiere sobrestimulación ventricular y la válvula se puede reposicionar y recapturar hasta el momento de su liberación completa. Se implanta a través de un sistema de liberación flexible y de bajo perfil (18 Fr) para minimizar las complicaciones vasculares. Estarán disponibles los tamaños de 23, 25, 27 y 29mm, que cubren diámetros de anillo entre 19 y 28mm.
Se han publicado recientemente los resultados a 12 meses del registro DISCOVER34, que incluyó a 100 pacientes con EAoG de alto riesgo. Se observó una supervivencia a 30 días y a 1 año del 98 y el 90% respectivamente. No se observaron fugas periprotésicas moderadas o graves en ningún paciente y los gradientes y el área valvular se pueden superponer a los de las demás prótesis. En una cohorte preespecificada de 54 pacientes, solo se observó una complicación vascular mayor (6%). La incidencia de marcapasos fue del 17%. Esta alta incidencia se ha atribuido a la poca experiencia en el implante. Así, en el más reciente registro SALUS Trial35, en el que se incluyó a 30 pacientes en centros de Estados Unidos ya entrenados en la nueva técnica de implante (inner curve technique36), se observó una disminución importante (de hasta el 3%) en la necesidad de marcapasos. No se observó fuga periprótesica moderada o grave en ningún paciente y la incidencia de complicaciones vasculares mayores fue del 6%. Ya hay resultados del seguimiento a 2 años, sin evidencia de deterioro estructural de la válvula37.
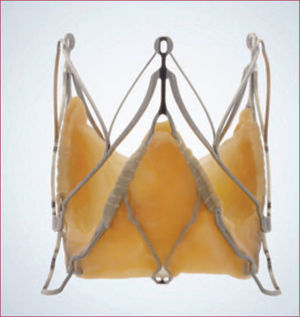
Portico®La prótesis Portico® (St. Jude Medical; St. Paul, Minnesota, Estados Unidos) consiste en una válvula trivalva de pericardio bovino suturada a un stent autoexpandible de nitinol, con una estructura de celda abierta para facilitar el acceso a los ostium coronarios (figura 7). Las valvas están situadas muy próximas al borde ventricular del stent para minimizar la protrusión al tracto de salida del ventrículo izquierdo. Así, aunque el diseño es parecido al de la prótesis CoreValve®, la principal diferencia es la posición anular de las valvas en la Portico® respecto a la posición supraanular en la CoreValve®. Esto podría ayudar a reducir la necesidad de marcapasos. Está diseñada para acceso TF (18 Fr) y TA (24 Fr con un sistema de liberación sin introductor). Es reposicionable y recapturable hasta su liberación completa. Ha recibido la marca CE para el acceso TF y está disponible en 23, 25, 27 y 29mm.
En septiembre de 2014, la Compañía St. Jude suspendió la comercialización mundial de esta válvula al observarse un problema con la movilidad de las valvas, que se cree debido a la presencia en ellas de un trombo que limita su movimiento.
Evidencia científicaUn primer estudio en humanos38 incluyó a 10 pacientes a los que se implantó la prótesis de 23mm. La válvula se implantó con éxito en todos los pacientes, pero uno requirió una segunda prótesis. Ningún paciente presentó complicaciones vasculares, fuga periprotésica significativa o necesidad de marcapasos. Recientemente se comunicaron los resultados a 1 año del estudio Portico TF CE39, que incluyó a 83 pacientes tratados con las válvulas de 23 y 25mm. Se pudo implantar la válvula en todos los pacientes, aunque 4 (4,8%) requirieron una segunda válvula. La mortalidad global a 30 días y a 1 año fue del 3,6 y el 8,4% respectivamente. Se observó un 6% de complicaciones vasculares mayores y un 10,8% de necesidad de marcapasos. Al año no se objetivó fuga periprotésica significativa. Los gradientes y el área valvular se pueden superponer a los obtenidos con las otras prótesis.
Sadra Lotus®La prótesis Sadra Lotus® (Boston Scientific; Natick, Massachuetts, Estados Unidos) consiste en una válvula trivalva de pericardio bovino suturada en un stent autoexpandible de nitinol (figura 8). Presenta una membrana externa en la parte ventricular para reducir las fugas periprotésicas. A diferencia de las otras prótesis autoexpandibles, esta va acoplada a un sistema de tres brazos que anclan el stent. Así, en el momento en que se retrae el catéter de liberación, la prótesis se expande en una posición elongada. Posteriormente, se comprime la prótesis mediante el sistema de anclaje, lo que a su vez favorece una mayor expansión final con más fuerza radial. Se implanta por vía TF a través de un sistema de liberación de 18 Fr. La válvula tiene una marca radiopaca central para facilitar el posicionamiento. Es totalmente reposicionable y recapturable hasta el momento en que se desengancha del sistema de anclaje. Una vez que la válvula se empieza a liberar del catéter de liberación, ya es competente. No precisa sobrestimulación ventricular. Ha recibido la marca CE y está disponible en tamaños de 23 y 27mm y próximamente también de 25mm.
Evidencia científicaEl primer registro realizado fue el REPRISE I40, que incluyó a 11 pacientes. Se consiguió implante con éxito en 10 pacientes (correcta posición, gradiente medio < 20mmHg y sin necesidad de segunda prótesis). Un paciente presentó una complicación vascular mayor y 4 requirieron marcapasos. Ningún paciente presentaba fuga periprotésica moderada-grave y el gradiente medio y el área valvular se pueden superponer a los de otras prótesis.
El registro REPRISE II41 incluyó a 120 pacientes. El éxito del implante fue del 99,2%. La mortalidad a 30 días fue del 4,2%; la incidencia de ictus, del 1,7%. A los 6 meses la incidencia de fuga periprotésica moderada era del 1,1% y no se observó ninguna fuga grave. El 29,4% de los pacientes requirieron implante de marcapasos. Actualmente se ha puesto en marcha el estudio RESPOND Post Market, que está en fase de inclusión de 1.000 pacientes.
Symetis Accurate®La prótesis Symetis Accurate® (Symetis SA; Ecublens, Suiza) consiste en una válvula trivalva de pericardio porcino suturada sobre un stent autoexpandible de nitinol (figura 9). El stent está conectado en el extremo aórtico con tres arcos que proporcionan una mayor estabilidad durante el implante. La corona inferior del stent lleva acoplada en su parte externa una camisa de pericardio para minimizar las fugas periprotésicas. Está disponible para implante TA (28 Fr; recibió la marca CE en 2011) y TF (18 Fr; pendiente de obtener la marca CE). Está disponible en tres tamaños (23, 25 y 27mm) y es compatible con anillos de 21 a 27mm. A diferencia de las demás prótesis autoexpandibles, la liberación se inicia por los arcos de estabilización y la corona superior del stent en la aorta ascendente. Tiene dos marcas radiopacas que ayudan en el posicionamiento. Una vez desplegada la corona superior y atrapadas las cúspides de la válvula nativa, se empuja (TF) o se tira (TA) del sistema y se despliega la parte ventricular del stent. No es recapturable.
Evidencia científicaLa prótesis TA es con la que más experiencia hay. Recientemente se han comunicado los resultados del registro SAVI42, que incluyó a 250 pacientes, con un éxito del implante del 98% y una mortalidad global a 30 días del 6,8%. La incidencia de marcapasos fue del 10%; un 2,5% de los pacientes presentaron fuga periprotésica moderada y no se observaron fugas graves.
En cuanto a la prótesis TF, recientemente se han comunicado los resultados del estudio CE Mark43 en 89 pacientes, con éxito del implante en el 94% y mortalidad a 30 días del 3%. Las incidencias de complicaciones vasculares mayores e ictus fueron del 3,4 y el 2,2% respectivamente. La necesidad de marcapasos fue del 9%. Un 4,9% presentaba fuga periprotésica moderada, pero no se observaron fugas graves. Tras los resultados de este estudio se espera que en breve se obtenga la marca CE para la válvula TF.
JenaValveLa prótesis JenaValve (JenaValve; Múnich, Alemania) es una válvula trivalva de pericardio porcino suturada sobre un stent autoexpandible de nitinol, que tiene tres postes metálicos que abrazan las valvas nativas durante el implante (figura 10). El primer paso del implante es liberar los postes, que se sitúan a nivel de los senos aórticos; posteriormente se libera el stent de nitinol a nivel anular, el stent se expande y las valvas de la válvula nativa quedan fijadas entre el stent y los postes. Actualmente solo dispone de marca CE la válvula de implante TA (32 Fr). Por su estructura singular, esta prótesis puede ser atractiva para el tratamiento de la insuficiencia aórtica pura. La prótesis TF (18 Fr) todavía no dispone de marca CE.
Evidencia científicaEl JUPITER44 es el registro más grande realizado con la prótesis TA, incluyó a 180 pacientes con EAoG y a una cohorte de 50 pacientes con insuficiencia aórtica pura que está todavía en fase de inclusión. En la cohorte de 180 pacientes, el éxito del implante fue del 95%; la incidencia de ictus, del 1,1% y el implante de marcapasos, del 14,4%. La mortalidad a 30 días fue del 11,1%. Solo se observó un 0,6% de fuga periprotésica moderada y ninguna grave. Actualmente está en proceso el primer estudio en humanos por vía TF.
Engager®La prótesis Engager® (Medtronic Inc.; Minneapolis, Minnesota, Estados Unidos) consiste en una válvula trivalva de pericardio bovino montada en un stent autoexpandible de nitinol cubierto con una camisa de poliéster para reducir la incidencia de fugas (figura 11). Se puede implantar por vía TA (29 Fr), para lo cual dispone ya de marca CE, o por vía transaórtica; el estudio para conseguir la marca CE todavía está pendiente de completarse. En la parte aórtica, el stent lleva acoplada una estructura de tres brazos que, como primer paso, se anclan en los senos aórticos, abrazando las valvas nativas y permitiendo la correcta alineación de la válvula y una altura del implante predecible para evitar la oclusión coronaria. Posteriormente se libera la válvula con necesidad de sobrestimulación ventricular. Se puede reposicionar, pero no recapturar.
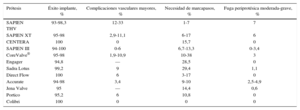
Resumen de la experiencia clínica publicada con las diferentes prótesis aórticas transcatéter.
| Prótesis | Éxito implante, % | Complicaciones vasculares mayores, % | Necesidad de marcapasos, % | Fuga periprotésica moderada-grave, % |
|---|---|---|---|---|
| SAPIEN THV | 93-98,3 | 12-33 | 1-7 | 7 |
| SAPIEN XT | 95-98 | 2,9-11,1 | 6-17 | 6 |
| CENTERA | 100 | 0 | 15,7 | 0 |
| SAPIEN III | 94-100 | 0-6 | 6,7-13,3 | 0-3,4 |
| CoreValve® | 95-98 | 1,9-10,9 | 10-38 | 3 |
| Engager | 94,8 | — | 28,5 | 0 |
| Sadra Lotus | 99,2 | 9 | 29,4 | 1,1 |
| Direct Flow | 100 | 6 | 3-17 | 0 |
| Accurate | 94-98 | 3,4 | 9-10 | 2,5-4,9 |
| Jena Valve | 95 | — | 14,4 | 0,6 |
| Portico | 95,2 | 6 | 10,8 | 0 |
| Colibri | 100 | 0 | 0 | 0 |
El estudio Engager CE Pivotal45 incluyó a 124 pacientes, con éxito del implante en el 94,8% y mortalidad a 30 días del 8,1%. La incidencia de ictus fue del 1,7% y la de marcapasos, del 28,5%. No se observó fuga periprotésica significativa. Actualmente está en proceso el estudio Engager Direct Aortic (NCT01789567), con los primeros 20 pacientes para implante transaórtico.
Otras prótesisActualmente hay numerosos modelos en fase de desarrollo o investigación preclínica. La prótesis Colibri (Colibri Heart Valves, LLC; Broomfield, Colorado, Estados Unidos) es una prótesis de bajo perfil (14 Fr) expandible con balón, que va premontada sobre un catéter de liberación ya lista para su uso. Ya hay resultados sobre los primeros 5 pacientes implantados, y son buenos46.
Otras válvulas en fase de investigación preclínica son la Optimum (Thubrikar Aortic Valve Inc.; Rapid City, South Dakota, Estados Unidos), la UCL (University College of London; Londres, Reino Unido) la Trinity Flexx (Transcatheter Technologies; Regensburg, Alemania), la Vanguard II (ValveXchange Inc.; Greenwood Village, Colorado, Estados Unidos) y la HLT (Heart Leaflet Technologies Inc.; Maple Grove, Minnesota, Estados Unidos).
ConclusionesEl TAVI se ha establecido como una alternativa menos invasiva para el tratamiento de la EAoG de pacientes inoperables o de alto riesgo. A pesar de esto, las prótesis de primera generación presentan algunas limitaciones (fuga periprotésica, complicaciones vasculares, marcapasos) que hacen que su uso no se pueda generalizar a un perfil de pacientes más amplio. Actualmente se dispone ya de un amplio número de prótesis de segunda generación y de otras que están en fase de desarrollo con el objetivo de disminuir estas complicaciones y hacer que el procedimiento sea más sencillo y predecible. Aunque la experiencia clínica todavía es escasa, están ya en proceso numerosos registros y ensayos clínicos cuyo fin es aumentar la evidencia sobre la eficacia de estos nuevos dispositivos y comprobar si se puede ampliar así la indicación de TAVI a otros grupos de pacientes (menor riesgo, insuficiencia aórtica pura, etc.). Por lo tanto, el futuro próximo se presenta muy prometedor, con gran cantidad de nuevos dispositivos y datos de ensayos clínicos que proporcionarán evidencia para expandir las indicaciones del TAVI y establecer su posición final en el tratamiento de la valvulopatía aórtica.
Conflicto de interesesNinguno.