A fin de entender la evolución de la sustitución convencional de la válvula aórtica (SVAo) en España, se llevó a cabo un análisis nacional para investigar, entre 1998 y 2017: a) el volumen de procedimientos; b) perfil de riesgo de los pacientes; c) mortalidad hospitalaria, y d) tipo de prótesis aórtica utilizada.
MétodosSe incluyeron todos los episodios de pacientes sometidos a SVAo del Conjunto Mínimo Básico de Datos (Ministerio de Sanidad, Consumo y Bienestar Social de España) entre enero de 1998 y diciembre de 2017. La duración del estudio se dividió en 4 periodos de 5 años. Se analizaron las tendencias en número de intervenciones, comorbilidades y mortalidad hospitalaria. Mediante análisis multivariante, se identificaron los factores asociados con la mortalidad hospitalaria y el tipo de prótesis utilizada. Se compararon los índices de mortalidad ajustada por el riesgo en el periodo de estudio.
ResultadosEn el periodo de estudio, se sometieron a SVAo 73.668 pacientes. El número de SVAo/año aumentó desde 16.363 entre 1998 y 2002 a 22.685 entre 2013 y 2017. Se incrementó la prevalencia de todas las comorbilidades salvo las de infarto de miocardio e ingreso urgente. El índice de Charlson empeoró entre el primer (1998-2002) y el cuarto (2013-2017) periodo: 2,3 ± 1,4 frente a 3,6 ± 1,7 (p < 0,001). La mortalidad disminuyó del 7,2 al 3,3% (p <0,001), y el índice de mortalidad ajustada por el riesgo, de 1,3 a 0,7. La proporción de bioprótesis aumentó del 20,7% (1998-2002) al 59,6% (2013-2017) (p <0,001).
ConclusionesSe detectó un aumento del volumen anual de SVAo en España, con un empeoramiento del perfil de riesgo y más pacientes con bioprótesis. Se observó una reducción muy relevante de la mortalidad hospitalaria.
Palabras clave
Puesto que mejora los síntomas y aumenta la esperanza de vida, la sustitución valvular aórtica (SVAo) es una indicación de clase I para tratar la estenosis y la insuficiencia aórticas graves1 cuando son sintomáticas o se asocian con disfunción del ventrículo izquierdo. Varios registros nacionales han informado de la evolución de la SVAo en otros países2–5. Esta información es válida para ilustrar los cambios que tienen lugar en la práctica clínica de todo el país con el paso del tiempo.
España carece de registros clínicos nacionales específicos de pacientes sometidos a SVAo. La Sociedad Española de Cirugía Torácica y Cardiovascular (SECTCV) comunica cada año la actividad de los hospitales de todo el país6, pero la información es voluntaria, agregada por centro y no auditada. Por otro lado, los centros médicos del Sistema Nacional de Salud (SNS) español envían información de las altas de cada uno de los episodios clínicos al registro del Conjunto Mínimo Básico de Datos (CMBD) del Ministerio de Sanidad. Esta base de datos contiene datos anónimos y codificados según la CIE-9 y la CIE-10. Aunque el uso de dichas fuentes de datos administrativos no dedicados al análisis de indicadores en la cirugía cardiaca es controvertido7, en distintos estudios8–12 basados en el CMBD se ha validado su utilidad para evaluar los procesos clínicos en España.
Así pues, se estudiaron los cambios en la SVAo ocurridos en este país entre 1998 y 2017 según la información obtenida del CMBD del Ministerio de Sanidad de España para comprender los cambios ocurridos en la práctica clínica a lo largo del tiempo. Más concretamente, se investigaron: a) las tendencias en el volumen de intervenciones de SVAo; b) la mortalidad hospitalaria y sus predictores, y c) los factores asociados con el tipo de prótesis (mecánica frente a biológica).
MÉTODOSFuentes de información y selección de los pacientesSe recuperaron del CMBD los registros de todos los episodios ocurridos entre 1998 y 2017. Estos registros tenían que incluir los códigos procedimentales 35.21 o 35.22 de la CIE-9 o los códigos 02RF07Z, 02RF08Z, 02RF0KZ, 02RF47Z, 02RF48Z, 02RF4KZ, X2RF032, X2RF432, 02RF0JZ o 02RF4J de la CIE-10 Z.
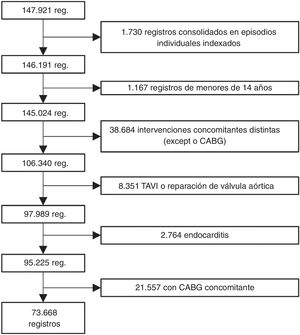
A continuación, se excluyó a todos los pacientes a los que se había practicado cualquier otra intervención cardiaca mayor durante el mismo ingreso (operaciones de otras válvulas, reparación torácica de los grandes vasos o cirugía de revascularización coronaria [CABG]). Tampoco se tuvo en cuenta a los pacientes de menos de 18 años o sometidos a cualquier tipo de reparación de una cardiopatía congénita. También se excluyó a los pacientes sometidos a implante percutáneo de válvula aórtica (TAVI), valvuloplastia o reparación de la válvula aórtica o que hubieran sufrido endocarditis. Para excluir el TAVI, se eliminaron todos los registros con los códigos 35.05 y 35.06 de la CIE-9 o los códigos 02RF37Z, 02RF38Z, 02RF3JZ, 02RF3KZ, X2RF332, 02RF37H, 02RF38H, 02RF3JH de la CIE-10 o el 02RF3KH a partir de 2013 y los que habían recibido una válvula biológica aórtica (código 35.22) sin circulación extracorpórea (código 39.61) antes de 2014 (a partir de 2014, ya se incluyó una codificación específica para el TAVI en la CIE-9). Puesto que en la CIE-9 no es posible diferenciar entre bioprótesis y homoinjertos aórticos, a efectos de este estudio se consideró que en ambos casos se trataba de bioprótesis. No obstante, la proporción de homoinjertos codificados como bioprótesis debe de ser reducida, porque se ha excluido la endocarditis y los homoinjertos son un implante poco frecuente en España para cualquier otra indicación13. El algoritmo de selección de los pacientes se muestra en la figura 1.
Se consideró episodio índice el primer ingreso de un paciente durante el periodo de estudio y los episodios concatenados de transferencia entre hospitales se consideraron un episodio único con una fecha de ingreso igual a la del primer episodio concatenado y una fecha de alta igual a la del último12.
El periodo de tiempo total (1998-2017) se dividió en 4 intervalos de 5 años (1998-2002, 2003-2007, 2008-2012 y 2013-2017). Las enfermedades concomitantes, la mortalidad y el tipo de prótesis de válvula aórtica se analizaron en función del intervalo de tiempo.
Volumen nacional de intervenciones de sustitución valvular aórtica quirúrgica y perfil de riesgo de los pacientesPara calcular el número de SVAo anuales por millón de habitantes, se utilizaron datos de la población española proporcionados por el Instituto Nacional de Estadística de España14. Los hospitales que realizan SVAo se clasificaron de acuerdo con la distribución del volumen medio de intervenciones anuales en cada periodo (centros de poco volumen si el promedio anual de intervenciones en un periodo se hallaba en el cuartil 1, centros de poco volumen o intermedio si el promedio anual de intervenciones en un periodo se hallaba en el cuartil 2, y así sucesivamente) (figura 1 del material adicional).
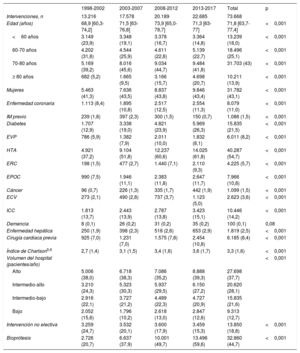
Se clasificó a los pacientes en 4 grupos en función de la edad (≤ 60, 60-70, 70-80 y > 80 años). En estos grupos, se analizaron las tendencias en la prevalencia de varias enfermedades concomitantes (tabla 1). Se calculó el índice de comorbilidad de Charlson modificado por edad15,16 y se dividió a la población en 4 grupos según su cuartil. Durante todo el periodo del estudio se investigaron los predictores de mortalidad, las variabilidades en esta y las tendencias en la mortalidad ajustada por riesgo.
Variaciones en la comorbilidad durante el periodo de estudio
| 1998-2002 | 2003-2007 | 2008-2012 | 2013-2017 | Total | p | |
|---|---|---|---|---|---|---|
| Intervenciones, n | 13.216 | 17.578 | 20.189 | 22.685 | 73.668 | |
| Edad (años) | 68,9 [60,3-74,2] | 71,5 [63-76,8] | 73,9 [65,0-78,7] | 71,3 [63-77] | 71,8 [63,7-77,4] | <0,001 |
| <60 años | 3.149 (23,9) | 3.348 (19,1) | 3.378 (16,7) | 3.364 (14,8) | 13.239 (18,0) | <0,001 |
| 60-70 años | 4.202 (31,8) | 4.544 (25,9) | 4.611 (22,8) | 5.139 (22,7) | 18.496 (25,1) | <0,001 |
| 70-80 años | 5.169 (39,2) | 8.016 (45,6) | 9.034 (44,7) | 9.484 (41,8) | 31.703 (43) | <0,001 |
| ≥ 80 años | 682 (5,2) | 1.665 (9,5) | 3.166 (15,7) | 4.698 (20,7) | 10.211 (13,9) | <0,001 |
| Mujeres | 5.463 (41,3) | 7.636 (43,5) | 8.837 (43,8) | 9.846 (43,4) | 31.782 (43,1) | <0,001 |
| Enfermedad coronaria | 1.113 (8,4) | 1.895 (10,8) | 2.517 (12,5) | 2.554 (11,3) | 8.079 (11,0) | <0,001 |
| IM previo | 239 (1,8) | 397 (2,3) | 300 (1,5) | 150 (0,7) | 1.086 (1,5) | <0,001 |
| Diabetes | 1.707 (12,9) | 3.338 (19,0) | 4.821 (23,9) | 5.969 (26,3) | 15.835 (21,5) | <0,001 |
| EVP | 786 (5,9) | 1.382 (7,9) | 2.011 (10,0) | 1.832 (8,1) | 6.011 (8,2) | <0,001 |
| HTA | 4.921 (37,2) | 9.104 (51,8) | 12.237 (60,6) | 14.025 (61,8) | 40.287 (54,7) | <0,001 |
| ERC | 198 (1,5) | 477 (2,7) | 1.440 (7,1) | 2.110 (9,3) | 4.225 (5,7) | <0,001 |
| EPOC | 990 (7,5) | 1.946 (11,1) | 2.383 (11,8) | 2.647 (11,7) | 7.966 (10,8) | <0,001 |
| Cáncer | 96 (0,7) | 226 (1,3) | 335 (1,7) | 442 (1,9) | 1.099 (1,5) | <0,001 |
| ECV | 273 (2,1) | 490 (2,8) | 737 (3,7) | 1.123 (5,0) | 2.623 (3,6) | <0,001 |
| ICC | 1.813 (13,7) | 2.443 (13,9) | 2.787 (13,8) | 3.423 (15,1) | 10.446 (14,2) | <0,001 |
| Demencia | 8 (0,1) | 26 (0,2) | 31 (0,2) | 35 (0,2) | 100 (0,1) | 0,08 |
| Enfermedad hepática | 250 (1,9) | 398 (2,3) | 518 (2,6) | 653 (2,9) | 1.819 (2,5) | <0,001 |
| Cirugía cardiaca previa | 925 (7,0) | 1.231 (7,0) | 1.575 (7,8) | 2.454 (10,8) | 6.185 (8,4) | <0,001 |
| Índice de Charlson5,6 | 2,7 (1,4) | 3,1 (1,5) | 3,4 (1,6) | 3,6 (1,7) | 3,3 (1,6) | <0,001 |
| Volumen del hospital (pacientes/año) | <0,001 | |||||
| Alto | 5.006 (38,0) | 6.718 (38,3) | 7.086 (35,2) | 8.888 (39,3) | 27.698 (37,7) | |
| Intermedio-alto | 3.210 (24,3) | 5.323 (30,3) | 5.937 (29,5) | 6.150 (27,2) | 20.620 (28,1) | |
| Intermedio-bajo | 2.916 (22,1) | 3.727 (21,2) | 4.489 (22,3) | 4.727 (20,9) | 15.835 (21,6) | |
| Bajo | 2.052 (15,6) | 1.796 (10,2) | 2.618 (13,0) | 2.847 (12,6) | 9.313 (12,7) | |
| Intervención no electiva | 3.259 (24,7) | 3.532 (20,1) | 3.600 (17,9) | 3.459 (15,3) | 13.850 (18,8) | <0,001 |
| Bioprótesis | 2.726 (20,7) | 6.637 (37,9) | 10.001 (49,7) | 13.496 (59,6) | 32.860 (44,7) | <0,001 |
ECV: enfermedad cerebrovascular; EPOC: enfermedad pulmonar obstructiva crónica; ERC: enfermedad renal crónica moderada o grave; EVP: enfermedad vascular periférica; HTA: hipertensión arterial; ICC: insuficiencia cardiaca congestiva; IM: infarto de miocardio.
Los análisis se han realizado teniendo en cuenta solo los datos no ausentes. Los valores expresan n (%) o mediana [rango intercuartílico].
Se estudiaron los cambios en la proporción y los factores asociados con el tipo de prótesis aórtica (mecánica o biológica). Los códigos 35.21, 02RF07Z, 02RF08Z, 02RF0KZ, 02RF47Z, 02RF48Z, 02RF4KZ, X2RF032 y X2RF432 se utilizaron para identificar las prótesis biológicas y los homoinjertos, y los códigos 35.22, 02RF0JZ y 02RF4JZ para identificar las prótesis mecánicas.
Análisis estadísticoLas variables categóricas se presentaron como frecuencias absolutas y relativas y se compararon con una prueba de la χ2. La normalidad de las variables cuantitativas se analizó con gráficos de normalidad. Los datos expresan media ± desviación estándar o mediana [intervalo intercuartílico]. Las variables cuantitativas se compararon con ANOVA o mediante pruebas no paramétricas de la mediana si la distribución no era normal. Se realizaron otros análisis para comprobar las tendencias lineales. Se calculó la reducción del riesgo relativo (RRR) y la odds ratio (OR) para estimar el grado de asociación entre las variables iniciales y la mortalidad.
Se aplicó un análisis de regresión de joinpoint para estudiar las tendencias variantes en la mortalidad a lo largo del tiempo e identificar en qué momentos cambió la tendencia17. Se calculó el cambio anual de porcentaje (PCA), así como el PCA de los periodos establecidos por el análisis de joinpoint. Los análisis de regresión de joinpoint se realizaron con el Joinpoint Regression Program, versión 4.8.0.1, proporcionado por el Programa de Vigilancia, Epidemiología y Resultados Finales (Instituto Nacional del Cáncer). Puede hallarse más información sobre la regresión de joinpoint en la figura 2 del material adicional.
Mediante regresión logística binaria, por pasos y multivariante, se estudiaron los factores asociados con la mortalidad hospitalaria. Las variables del modelo se seleccionaron según criterios teóricos o en función de si estaban relacionadas (p <0,05) con la variable dependiente en un análisis univariante previo. Se estudió el rendimiento del modelo multivariante utilizando el área bajo la curva y la prueba de Hosmer-Lemeshow.
Para ajustar la mortalidad a la comorbilidad del paciente, se calcularon los riesgos de mortalidad predichos con distintos modelos de regresión logística multivariantes. Se seleccionó el mejor modelo considerando los criterios de información de Akaike y el área bajo las curvas ROC (receiver operating characteristic). Con la probabilidad de la mortalidad hospitalaria predicha con este modelo, se calculó el índice de mortalidad ajustada por riesgo (IMAR). El IMAR representa el cociente entre la mortalidad observada y los riesgos predichos por el modelo logístico. Puede hallarse más información sobre la construcción del IMAR en las figuras 3 y 4 del material adicional.
Se estudiaron las variaciones en la proporción de prótesis biológicas y mecánicas, y se detectaron los factores asociados con el tipo de prótesis implantada mediante regresión logística binaria por pasos. Las variables del modelo se seleccionaron según criterios teóricos o en función de si estaban relacionadas de manera significativa (p <0,05) con la variable dependiente en un análisis univariante previo.
Todos los análisis estadísticos se realizaron utilizando la versión 15.0 de STATA (StataCorp, Estados Unidos).
RESULTADOSVolumen de intervencionesLa base de datos CMBD consta de 147.921 registros de pacientes sometidos a SVAo entre 1998 y 2017. De estos, 95.225 se sometieron a SVAo con o sin CABG. Por último, 77.668 (77,4%) se sometieron solo a SVAo (figura 1).
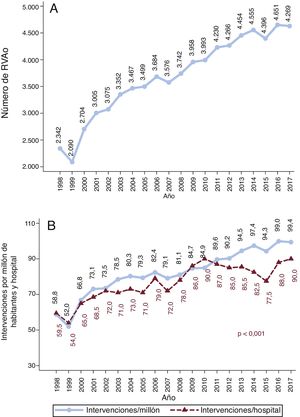
El volumen de SVAo y el número de intervenciones por millón de habitantes aumentaron de manera lineal a lo largo del tiempo (figura 2). Las intervenciones de SVAo fueron comunicadas por 40 hospitales en 1998 frente a 50 en 2017. La mediana de intervenciones por centro y año aumentó progresivamente —de 59,5 en 1998 a 90 en 2017 (p <0,001)—, pero a una menor velocidad que el número de intervenciones por millón de habitantes (figura 2B). La mediana de intervenciones por año y por institución fue 61,8 [53,2-88,2], 71,6 [56,8-103], 90 [66,8-112,4] y 84 [71,6-117,4] en el primero, el segundo, el tercero y el cuarto periodo respectivamente (pLT <0,001) (figura 1 del material adicional).
Perfiles de riesgo y comorbilidadLa edad aumentó en 3 años (68,9 frente a 71,3; pLT <0,001) entre el primer y el último periodo. Además, 31.782 de los pacientes eran mujeres (43,1%). Se observó un empeoramiento del perfil de riesgo de los pacientes, con una prevalencia aumentada de casi todas las enfermedades concomitantes (tabla 1). El índice de Charlson modificado por edad empeoró y pasó de 2,7 ± 1,4 a 3,6 ± 1,7 (p <0,001).
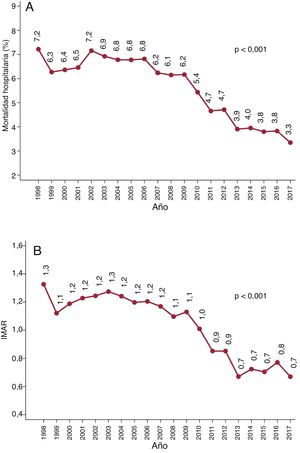
Mortalidad hospitalariaLa mortalidad hospitalaria se redujo en más de la mitad y pasó del 7,2% (169 de 2.342) en 1998 al 3,3% en 2017 (155 de 4.629) (RRR, 69,7%; pLT <0,001) (figura 3A). Esta disminución tuvo lugar en todos los grupos de edad (figura 3B): en los menores de 60 años (el 4,9 frente al 1,4%; pLT <0,001), los de 60-70 años (el 6,2 frente al 3,3%; pLT <0,001), los de 70-80 años (el 9,5 frente al 3,6%; pLT <0,001), y en los mayores de 80 años (el 11,8 frente al 4,3%; pLT <0,001). En la tabla 1 del material adicional, se proporciona más información sobre la mortalidad.
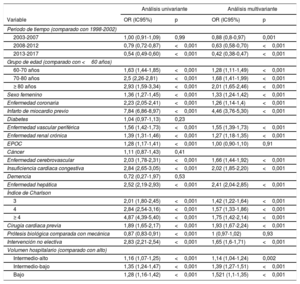
El periodo de estudio y el volumen del hospital, entre otros, se asociaron con la mortalidad (tabla 2). En el modelo logístico multivariante que incluía los factores asociados con la mortalidad, se observó un rendimiento bastante bueno (área bajo la curva, 0,76; intervalo de confianza del 95% [IC95%], 0,75-0,76; Hosmer-Lemeshow, p=0,23).
Predictores de la mortalidad en el posoperatorio hospitalario
| Análisis univariante | Análisis multivariante | |||
|---|---|---|---|---|
| Variable | OR (IC95%) | p | OR (IC95%) | p |
| Periodo de tiempo (comparado con 1998-2002) | ||||
| 2003-2007 | 1,00 (0,91-1,09) | 0,99 | 0,88 (0,8-0,97) | 0,001 |
| 2008-2012 | 0,79 (0,72-0,87) | <0,001 | 0,63 (0,58-0,70) | <0,001 |
| 2013-2017 | 0,54 (0,49-0,60) | <0,001 | 0,42 (0,38-0,47) | <0,001 |
| Grupo de edad (comparado con <60 años) | ||||
| 60-70 años | 1,63 (1,44-1,85) | <0,001 | 1,28 (1,11-1,49) | <0,001 |
| 70-80 años | 2,5 (2,26-2,81) | <0,001 | 1,68 (1,41-1,99) | <0,001 |
| ≥ 80 años | 2,93 (1,59-3,34) | <0,001 | 2,01 (1,65-2,46) | <0,001 |
| Sexo femenino | 1,36 (1,27-1,45) | <0,001 | 1,33 (1,24-1,42) | <0,001 |
| Enfermedad coronaria | 2,23 (2,05-2,41) | <0,001 | 1,26 (1,14-1,4) | <0,001 |
| Infarto de miocardio previo | 7,84 (6,86-8,97) | <0,001 | 4,46 (3,76-5,30) | <0,001 |
| Diabetes | 1,04 (0,97-1,13) | 0,23 | ||
| Enfermedad vascular periférica | 1,56 (1,42-1,73) | <0,001 | 1,55 (1,39-1,73) | <0,001 |
| Enfermedad renal crónica | 1,39 (1,31-1,46) | <0,001 | 1,27 (1,18-1,35) | <0,001 |
| EPOC | 1,28 (1,17-1,41) | <0,001 | 1,00 (0,90-1,10) | 0,91 |
| Cáncer | 1,11 (0,87-1,43) | 0,41 | ||
| Enfermedad cerebrovascular | 2,03 (1,78-2,31) | <0,001 | 1,66 (1,44-1,92) | <0,001 |
| Insuficiencia cardiaca congestiva | 2,84 (2,65-3,05) | <0,001 | 2,02 (1,85-2,20) | <0,001 |
| Demencia | 0,72 (0,27-1,97) | 0,53 | ||
| Enfermedad hepática | 2,52 (2,19-2,93) | <0,001 | 2,41 (2,04-2,85) | <0,001 |
| Índice de Charlson | ||||
| 3 | 2,01 (1,80-2,45) | <0,001 | 1,42 (1,22-1,64) | <0,001 |
| 4 | 2,84 (2,54-3,16) | <0,001 | 1,57 (1,33-1,86) | <0,001 |
| ≥ 4 | 4,87 (4,39-5,40) | <0,001 | 1,75 (1,42-2,14) | <0,001 |
| Cirugía cardiaca previa | 1,89 (1,65-2,17) | <0,001 | 1,93 (1,67-2,24) | <0,001 |
| Prótesis biológica comparada con mecánica | 0,87 (0,83-0,91) | <0,001 | 1 (0,97-1,02) | 0,93 |
| Intervención no electiva | 2,83 (2,21-2,54) | <0,001 | 1,65 (1,6-1,71) | <0,001 |
| Volumen hospitalario (comparado con alto) | ||||
| Intermedio-alto | 1,16 (1,07-1,25) | <0,001 | 1,14 (1,04-1,24) | 0,002 |
| Intermedio-bajo | 1,35 (1,24-1,47) | <0,001 | 1,39 (1,27-1,51) | <0,001 |
| Bajo | 1,28 (1,16-1,42) | <0,001 | 1,521 (1,1-1,35) | <0,001 |
EPOC: enfermedad pulmonar obstructiva crónica; IC95%: intervalo de confianza del 95%; OR: odds ratio.
Análisis univariante con regresión logística y análisis multivariante con regresión logística progresiva.
El PCA global en la mortalidad fue de −3,6 (IC95%, −4,5 a −2,7). En 2006 se detectó una variación significativa del PCA: entre 1998 y 2006, el PCA fue 0,4 (IC95%, −1,3 a 2,1). Entre 2006 y 2017, fue de 6,3 (IC95%, −7,5 a −5,1) (figura 2 del material adicional).
Se detectó una disminución lineal del IMAR entre 1998 (1,3) y 2017 (0,7) (pLT <0,001), que coincide con el empeoramiento observado del perfil de riesgo de los pacientes y la mortalidad reducida (figura 3B). Puede hallarse más información relacionada con el rendimiento del modelo utilizado para calcular el IMAR en la figura 3 del material adicional.
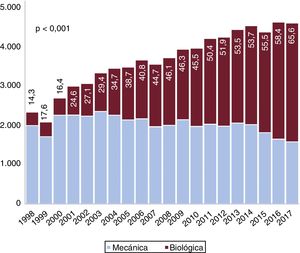
Tipo de prótesisEn total, recibieron bioprótesis 32.860 pacientes (44,7%). Los varones recibieron prótesis mecánicas con mayor frecuencia que las mujeres (el 58,8 frente al 50,7%; p <0,001).
Entre 1998 y 2002, el 20,7% de las prótesis implantadas fueron válvulas biológicas. Esta proporción aumentó de manera lineal: entre 2003 y 2007 (37,9%), entre 2008 y 2012 (49,7%) y entre 2013 y 2017 (59,6%) (pLT <0,001). Tal como se muestra en la tabla 1 y la figura 4, se observó una disminución en la proporción de prótesis mecánicas respecto a las biológicas. Como era de esperar, el uso de prótesis mecánicas fue mayor entre los menores de 65 años (86,7%, 17.757 de 20.488) que entre los de 65 años o más (43,2%, 22.877 de 53.006) (p <0,001). A lo largo de toda la serie se observó un aumento progresivo del uso de bioprótesis en los 2 grupos (figura 4A del material adicional) (p <0,001). También se detectó una relación inversa entre el volumen de actividad hospitalaria y el empleo de bioprótesis (figura 4B del material adicional) (pLTs <0,001).
Los factores relacionados con el implante de prótesis biológicas se muestran en la tabla 2 del material adicional.
DISCUSIÓNSe ha analizado una cohorte grande de pacientes sometidos a SVAo en España. Entre 1998 y 2017, hubo un aumento significativo del número de intervenciones y un empeoramiento del perfil de riesgo de los pacientes (tabla 1). Sin embargo, la mortalidad se redujo el 69,7% durante el periodo de estudio. Además, se observó un mayor uso de prótesis biológicas, en particular entre los pacientes de más de 65 años. Consideramos que esta información es valiosa porque la SVAo ha sido las últimas 2 décadas la intervención de válvula cardiaca realizada con más frecuencia en España.
Los datos analizados en este estudio se extrajeron de una base de datos administrativa obligatoria nacional. Son conocidas las limitaciones inherentes al análisis de datos administrativos. Mack et al.7 mostraron, tras comparar bases de datos clínicos y administrativos de Estados Unidos, que había una diferencia de hasta el 21% en el volumen de intervenciones de CABG y de casi el 20% en la mortalidad. Con datos del CMBD, Gutacker et al.11 también clasificaron erróneamente a más del 25% de los pacientes a los que se realizó una CABG porque los códigos de procedimiento asociados no se excluyeron durante la selección de pacientes. Conociendo estas limitaciones, se seleccionó meticulosamente a los pacientes y se revisaron todos los códigos de intervención: así, solo 73.668 pacientes de los 147.921 registros recuperados originalmente correspondieron a una SVAo aislada. La mayor parte de los demás se sometieron a una intervención combinada (figura 1). Este volumen de intervenciones fue muy similar a las comunicadas por el Registro Nacional de la Sociedad Española de Cirugía Torácica-Cardiovascular (SECTCV)6,18,19.
El número de SVAo por millón de habitantes es menor en España que en otros países (figura 2B). Dunning et al.3 observaron en Reino Unido un volumen medio de 100,8 SVAo/millón de habitantes/año entre 2004 y 2009, mientras que en España fue de apenas 80 por millón de habitantes. En Alemania4,5, el número de SVAo con o sin CABG fue de aproximadamente 137,7/millón de habitantes en 2015 comparado con los 94,3 de España. El reducido número de intervenciones de cirugía cardiaca por millón de habitantes en España es un fenómeno bien conocido20.
En España, el perfil de los pacientes que se sometieron a una SVAo aislada empeoró de manera significativa entre 1998 y 2017 (tabla 2). La mediana de edad aumentó en 3 años entre el primer periodo y el cuarto (68,9 frente a 71,3 años; pLT <0,001), la proporción de octogenarios se cuadriplicó (el 5,2 frente al 20,7%; pLT <0,001), la proporción de pacientes con diabetes se duplicó (el 12,9 frente al 26,3%; pLT <0,001) y la enfermedad renal crónica entre moderada y grave se sextuplicó (el 1,5 frente al 9,3%; pLT <0,001). En otros países, ya se ha observado un empeoramiento progresivo del perfil de riesgo de la SVAo. Un registro de más de 100.000 pacientes sometidos a intervenciones en Estados Unidos de 1997 a 200621 reveló un aumento similar al de España de la mediana de edad, la proporción de mujeres y la prevalencia de enfermedad vascular periférica.
Por otro lado, el perfil de riesgo de los pacientes que se sometían a SVAo en España es distinto del de otros países. La mediana de edad de los pacientes españoles fue mayor que la de las series británica3, alemana4,5 y estadounidense21 en los mismos periodos de tiempo. Las mujeres eran más frecuentes en España que en Alemania o Reino Unido. Las prevalencias de diabetes y enfermedad pulmonar obstructiva crónica fueron altas comparadas con las de Alemania y menores que en Reino Unido o Estados Unidos. Es difícil hacer una comparación ajustada del riesgo inicial de los pacientes debido al origen administrativo de los datos presentados en este estudio, aunque los distintos perfiles de riesgo de cada país pueden explicar en parte las diferencias en la mortalidad hospitalaria: por ejemplo, la mortalidad sin ajustar fue del 2,3% en Alemania entre 2011 y 2013, pero del 4,4% en España5. En el periodo 2004-2009, la mortalidad hospitalaria tras SVAo fue del 4,1% en Reino Unido y del 6,4% en España3.
Los resultados de esta gran cohorte son particularmente valiosos para el análisis de tendencias. Entre 1998 y 2017, se observó una reducción significativa de la mortalidad (el 7,2 frente al 3,3%; pLT <0,001) y la IMAR (1,3 frente a 0,7; pLT <0,001) (figura 3). También se detectó una disminución de la mortalidad en todos los subgrupos de pacientes (tabla 1 del material adicional). Esta disminución de la mortalidad fue similar en intensidad a la observada en otras cohortes. Por ejemplo, en el registro de Reino Unido, la mortalidad disminuyó del 4,4 al 3,7% a lo largo de 5 años (p <0,001)3.
Se detectó una reducción relevante del PCA medio en la mortalidad desde el 2006 (figura 2 del material adicional). Esto podría explicarse por las mejoras en el propio proceso quirúrgico y por la mayor indicación de TAVI para pacientes con peores perfiles, que podrían no haberse sometido a SVAo y, por lo tanto, haber mejorado los resultados quirúrgicos en general. No obstante, en este estudio no se demuestra apropiadamente el impacto del TAVI en la SVAo, ya que la mayor expansión del TAVI entre los pacientes de riesgo bajo e intermedio se observó a partir de 2017 y 2018 cuando surgió la evidencia que respaldaba la técnica22–24.
La proporción de válvulas biológicas implantadas en España fue del 44,7%, que es un porcentaje bajo comparado con otros países desarrollados (figura 4). En Reino Unido, el 71,8% de los pacientes sometidos a SVAo entre 2004 y 2009 recibieron bioprótesis. En el mismo periodo, la proporción fue del 42% en España3. En 2006, el 78,4% de las prótesis implantadas fueron biológicas en Estados Unidos, frente al 40,6% en España25 (tabla 1 y figura 4 del material adicional). También se observaron porcentajes más altos de bioprótesis en Alemania y Suecia4,26,27. Las válvulas mecánicas están recomendadas para los pacientes más jóvenes según la guía europea para el tratamiento de las valvulopatías1,28. No obstante, en la literatura médica hay controversia sobre sus pros y contras: Goldstone et al.25 detectaron un aumento de la mortalidad a largo plazo en los menores de 55 años a los que se implantaron prótesis biológicas frente a prótesis mecánicas (hazard ratio [HR] = 1,23; IC95%, 1,02-1,48). Glaser et al.26 también observaron un aumento de la mortalidad en los pacientes de 50-69 años a los que implantaron bioprótesis (HR = 1,34; IC95%, 1,09-1,66). Esto podría justificar en parte el escaso empleo en España de prótesis biológicas en menores de 65 años. Incluso cuando las bioprótesis fueron las más implantadas (2013-2017), solo 1 de cada 5 pacientes (20,7%) de menos de 65 años recibió una. El uso de prótesis biológicas en personas de más de 65 años es también notablemente bajo (56,9%) respecto a otros países desarrollados3–5,25–27, a pesar de un aumento a lo largo del tiempo: el 28,8% en el periodo 1998-2002, el 49,3% en 2003-2007, el 61,8% en 2008-2012 y el 71,5% en 2013-2017 (pLT <0,001) (figura 4 del material adicional).
LimitacionesLas interpretaciones clínicas de los datos administrativos siempre deberían tomarse con precaución, independientemente de cuán cuidadosamente se hayan obtenido. Los errores de codificación en la información clínica y la falta de disponibilidad de los códigos de la CIE-9/CIE-10 para satisfacer toda la variedad de procedimientos y diagnósticos impidieron definir apropiadamente las variables para ajustar el riesgo inicial de los pacientes. Por la misma razón, no fue posible calcular las puntuaciones de riesgo o de fragilidad ante una SVAo (como el EuroSCORE29, el índice de Katz o la puntuación de Fried), que podrían haber contribuido a definir mejor el riesgo inicial. Dada la información disponible en el CMBD, la lesión de la válvula nativa (estenosis o insuficiencia) y su etiología son desconocidas. Los análisis estratificados en función de estas variables habrían añadido, sin lugar a duda, información valiosa al estudio.
No se dispone de información suficiente para explicar las diferencias en la elección entre las prótesis biológicas y las mecánicas con respecto a otros países y según la capacidad del centro. El número de SVAo comunicado en España podría haberse subestimado porque no se han recogido los registros de los hospitales que no notifican al CMBD. Según el Ministerio de Sanidad de España e informes recientes, se han omitido algunos registros de algunas comunidades autónomas en 2016 y 2017 por la conversión de la CIE-9 a la CIE-1030. Así pues, también podría haberse subestimado el número de intervenciones realizadas durante estos 2 años.
CONCLUSIONESSe detectó un aumento lineal del volumen anual de SVAo en España entre 1998 y 2017, con un incremento de los pacientes que recibieron bioprótesis. A pesar de un empeoramiento del perfil de riesgo de los pacientes, la mortalidad hospitalaria se redujo considerablemente.
AGRADECIMIENTOSSe agradece a la Unidad de Información y Estadística Sanitaria del Ministerio de Sanidad, Consumo y Bienestar Social de España la calidad de la información proporcionada para realizar esta investigación.
FINANCIACIÓNEsta investigación fue financiada en parte por Edwards Lifesciences. La empresa participó en el diseño del alcance y la metodología de la investigación.
CONFLICTO DE INTERESESLos autores declaran no tener conflicto de intereses alguno con respecto al contenido de este manuscrito.
- -
La SVAo es una indicación para tratar la enfermedad grave de la válvula aórtica. Durante décadas ha sido la intervención valvular realizada con mayor frecuencia en España.
- -
Todavía no se ha realizado ningún análisis sistemático nacional sobre la calidad de la intervención de SVAo.
- -
Aporta una perspectiva de los cambios en la SVAo ocurridos en España en las últimas 2 décadas: se observaron aumentos del número de intervenciones y de las válvulas biológicas frente a las prótesis mecánicas. A pesar del empeoramiento del perfil de riesgo, se redujo considerablemente la mortalidad hospitalaria.