El implante percutáneo de válvula aórtica se utiliza de manera creciente en pacientes con estenosis aórtica. Los trastornos de la conducción intraventricular y los implantes de marcapasos permanente tras la intervención siguen siendo motivo de gran preocupación. Recientemente, la válvula protésica Edwards SAPIEN XT ha sido reemplazada por la SAPIEN 3. El objetivo de este estudio es determinar la incidencia de trastornos de la conducción intraventricular de nueva aparición y la necesidad de implantes de marcapasos permanente comparando los dos dispositivos.
MétodosSe analizó a los últimos 103 pacientes consecutivos a los que se realizó implante percutáneo de válvula aórtica SAPIEN XT antes de que se utilizara la válvula SAPIEN 3 y a los 105 pacientes consecutivos a los que se implantó la válvula SAPIEN 3. Con objeto de analizar los implantes de marcapasos permanentes y los trastornos de la conducción intraventricular de nueva aparición, se excluyó del estudio a los pacientes en los que se daban estas características en situación basal. Se registraron electrocardiogramas en situación basal, después de la intervención y antes del alta.
ResultadosEl uso del dispositivo SAPIEN 3 se asoció a un porcentaje superior de éxitos de implante del dispositivo (el 100 frente al 92%; p=0,005) y un porcentaje inferior de fuga paravalvular (0 frente al 7%; p<0,001). La incidencia de implantes de marcapasos permanente fue del 12,6% (23 de 183), sin que se apreciaran diferencias entre los dos grupos (SAPIEN 3, el 12,5% [12 de 96]; SAPIEN XT, el 12,6% [11 de 87]; p=0,99). El uso del dispositivo SAPIEN 3 se asoció a mayor frecuencia de trastornos de la conducción intraventricular de nueva aparición (el 49 frente al 27%; p=0,007) como consecuencia de la mayor frecuencia de bloqueos fasciculares (el 17 frente al 5%; p=0,021). No hubo diferencia estadísticamente significativa por lo que respecta a los bloqueos de rama izquierda transitorios frente a persistentes (el 29% [20 de 69] frente al 19% [12 de 64]; p=0,168) al comparar el SAPIEN 3 con el SAPIEN XT (el 28% [19 de 69] frente al 17% [11 de 64]; p=0,154).
ConclusionesSe observó una tendencia a mayor frecuencia de trastornos de la conducción intraventricular de nueva aparición con SAPIEN 3 que con SAPIEN XT, si bien esto no conllevó mayor frecuencia de implante de marcapasos permanentes.
Palabras clave
El implante percutáneo de válvula aórtica (TAVI) se utiliza cada vez más como estrategia terapéutica para pacientes con estenosis aórtica sintomática grave de alto riesgo y ha mostrado unos resultados clínicos alentadores en amplios registros de pacientes1,2 y ensayos3,4. Sin embargo, la aparición de trastornos de la conducción intraventricular (TCIV) después de la intervención y la necesidad de implantar un marcapasos permanente siguen siendo preocupaciones graves.
Los TCIV de nueva aparición, en especial por lo que respecta al bloqueo de rama izquierda del haz de His (BRIHH) de nueva aparición, se da en un porcentaje considerable de pacientes después de TAVI (entre un 8 y un 30% de los casos)5,6 cuando se emplea una válvula expandible con balón7–9, lo que puede afectar de forma negativa a la recuperación de la función ventricular izquierda y aumentar el riesgo de que sea necesario implantar un marcapasos permanente10,11.
Además, la aparición de trastornos auriculoventriculares de alto grado que motiven el implante de un marcapasos permanente es una complicación frecuente asociada al TAVI, con una incidencia que va del 3 al 11,5% con las válvulas de balón expandible3,12.
Recientemente se ha introducido en Alemania un dispositivo de balón expandible de nueva generación, el Edwards SAPIEN 3 (Edwards Lifesciences; Irvine, California, Estados Unidos)13 que sustituye al dispositivo SAPIEN XT. El SAPIEN 3 tiene un armazón de metal más alto e incorpora un faldón externo que rodea el armazón de la válvula y se ha diseñado para evitar la fuga paravalvular. La incidencia de TCIV de nueva aparición y la frecuencia con que se implantan marcapasos permanentes con este nuevo dispositivo están aún en estudio. Idealmente, la mejora hemodinámica de los nuevos dispositivos no debería asociarse con mayor frecuencia de TCIV.
En este estudio se evalúa la incidencia de TCIV de nueva aparición y la necesidad de implantar marcapasos permanente usando el dispositivo SAPIEN 3 comparado con la válvula SAPIEN XT en una cohorte de pacientes consecutivos tratados con TAVI.
MÉTODOSPoblaciones de pacientes e implante percutáneo de válvula aórticaSe incluyó prospectivamente en el estudio a un total de 222 pacientes tratados con TAVI en la Klinik für Herz- und Kreislauferkrankungen, Deutsches Herzzentrum München durante un periodo de 12 meses (SAPIEN XT, n=103, del 2 de julio de 2013 al 11 de febrero de 2014 y SAPIEN 3, n=105, del 31 de enero al 26 de junio de 2014). No se incluyó a los pacientes en los que se utilizó otro tipo de válvulas (n=14).
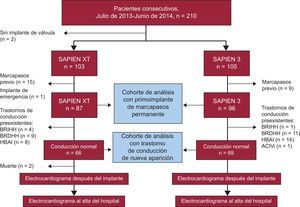
Para determinar la incidencia de primoimplantes de marcapasos permanentes después del TAVI, se excluyó a los pacientes portadores de marcapasos (n=24) así como a 1 paciente al que se practicó un TAVI en una intervención de emergencia. Además, para analizar la incidencia de TCIV de nueva aparición después del TAVI, se excluyó a los pacientes con TCIV basal (n=48) (figura 1).
Diseño del estudio y diagrama de flujo de los pacientes. En total, se consideró adecuados para TAVI por vía transfemoral empleando una válvula Edwards durante el intervalo de observación preespecificado a 210 pacientes. De ellos, se trató a 103 y 105 pacientes con las válvulas SAPIEN XT y SAPIEN 3 respectivamente. En 2 pacientes no se realizó el TAVI por falta de una vía de acceso adecuada (n=1) y por la corta distancia hasta el ostium coronario (n=1). Tras la exclusión de los pacientes ya portadores de marcapasos permanente y el paciente al que el TAVI se practicó de emergencia, hubo 183 pacientes con un primoimplante de marcapasos permanente analizables para comparar los 2 dispositivos de TAVI. Se analizaron los TCIV de nueva aparición en los pacientes con ECG basales normales (n=135). BRDHH: bloqueo de rama derecha del haz de His; BRIHH: bloqueo de rama izquierda del haz de His; HBAI: hemibloqueo anterior izquierdo; TAVI: impante precutáneo de válvula aórtica; TCIVi: trastorno de conducción intraventricular inespecífico.
El TAVI se llevó a cabo en un quirófano híbrido, con abordaje transfemoral en todos los pacientes.
Tomografía computarizada multicorte y elección del tamaño de la prótesisSe realizaron las mediciones del anillo aórtico en una reconstrucción en múltiples planos, siguiendo lo establecido en la guía de la Society of Cardiovascular Computed Tomography14. Se obtuvo el área y el perímetro del anillo aórtico virtual mediante planimetría directa. Se determinaron los diámetros mínimo y máximo y se calculó el diámetro efectivo mediante la suma de los diámetros mínimo y máximo dividida por 2. Se calculó la excentricidad del anillo aórtico mediante el índice de excentricidad empleando la fórmula 1–diámetro mínimo/diámetro máximo. Cuanto más próximo a cero está este índice, más circular es el anillo aórtico. Se utilizó un programa informático dedicado aprobado por la Food and Drug Administration (OsiriX MD 3.9.4, Pixmeo; Suiza). Los respectivos tamaños de prótesis se eligieron siguiendo las recomendaciones de los fabricantes, pero la decisión final se tomó según el criterio de los médicos que realizaban la intervención.
Las válvulas cardiacas SAPIEN XT y SAPIEN 3 se distribuyen en tamaños de 23, 26 y 29mm, que cubren áreas nominales de 4,15, 5,31 y 6,21cm2 y de 4,06, 5,19 y 6,48cm2 respectivamente. Se calculó el porcentaje de exceso de tamaño según el área utilizando la fórmula (área protésica nominal/área anular del paciente–1)×100.
Análisis de los electrocardiogramas e implante de marcapasos permanentesSe obtuvieron ECG al menos en tres momentos de valoración: al ingreso (al menos 24h antes del TAVI), inmediatamente después del implante y antes del alta. Los datos de los ECG fueron revisados por dos médicos a los que se ocultaron los datos clínicos, atendiendo a las recomendaciones vigentes15. Los casos controvertidos se resolvieron por consenso. Se evaluaron las siguientes variables electrocardiográficas en todos los momentos de valoración: ritmo (ritmo sinusal, fibrilación o aleteo auricular), frecuencia cardiaca, duración de los intervalos PQ y QRS, alteraciones de la conducción auriculoventricular (ninguna, grado I, II y III), y TCIV (bloqueo completo de rama del haz de His, incluido el BRIHH y de rama derecha del haz de His por separado), bloqueos fasciculares (incluido el hemibloqueo anterior izquierdo y el hemibloqueo posterior izquierdo y el bloqueo incompleto de rama izquierda y derecha del haz de His) y los TCIV inespecíficos. Los TCIV de nueva aparición observados después del TAVI pero no en el momento del alta se clasificaron como transitorios, mientras que los TCIV que se mantenían al alta se consideraron persistentes.
La decisión de implantar un marcapasos permanente se dejó al criterio de los médicos encargados del tratamiento de los pacientes. En todos los casos se registraron las indicaciones para ello. En los pacientes con conducción intraventricular basal normal a los que se implantó marcapasos permanente después del TAVI, se utilizó el último ECG disponible antes del implante de marcapasos permanente para el análisis del TCIV de nueva aparición.
Seguimiento y definición de los resultadosSe registraron prospectivamente todos los datos basales, de la intervención, postoperatorios y electrocardiográficos. Por lo que respecta a los resultados durante la hospitalización, el éxito del dispositivo y las complicaciones de la intervención se clasificaron empleando los criterios actualizados definidos por el Valve Academic Research Consortium16.
Análisis estadísticoLas variables continuas se expresan en forma de media±desviación estándar o mediana [intervalo intercuartílico] y se comparan con la prueba de la t de Student para muestras apareadas o no apareadas o con la prueba de la U de Mann-Whitney, según corresponda. Las variables discretas se compararon con la prueba de la χ2 o la exacta de Fisher, según fuera apropiado. Para evaluar la influencia de la curva de aprendizaje con el nuevo dispositivo, se dividió la cohorte de pacientes en cuartiles y se analizó la incidencia de primoimplantes de marcapasos permanentes y de BRIHH de nueva aparición persistentes. Se consideró estadísticamente significativo un valor de p bilateral < 0,05. Se utilizó el programa SPSS 20 (IBM Corporation; Estados Unidos).
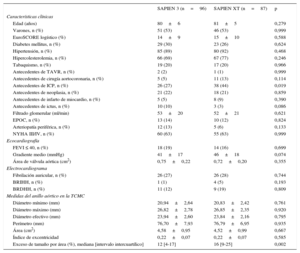
RESULTADOSCaracterísticas basalesEn la tabla 1 se presentan las características basales según el tipo de prótesis utilizado. No hubo diferencias estadísticamente significativas entre los dos grupos, excepto por la mayor tasa de antecedentes de intervención coronaria percutánea en la cohorte de SAPIEN XT (el 44 frente al 27%; p=0,019).
Características basales de los subgrupos de SAPIEN 3 y SAPIEN XT
| SAPIEN 3 (n=96) | SAPIEN XT (n=87) | p | |
|---|---|---|---|
| Características clínicas | |||
| Edad (años) | 80±6 | 81±5 | 0,279 |
| Varones, n (%) | 51 (53) | 46 (53) | 0,999 |
| EuroSCORE logístico (%) | 14±9 | 15±10 | 0,588 |
| Diabetes mellitus, n (%) | 29 (30) | 23 (26) | 0,624 |
| Hipertensión, n (%) | 85 (89) | 80 (92) | 0,468 |
| Hipercolesterolemia, n (%) | 66 (69) | 67 (77) | 0,246 |
| Tabaquismo, n (%) | 19 (20) | 17 (20) | 0,966 |
| Antecedentes de TAVR, n (%) | 2 (2) | 1 (1) | 0,999 |
| Antecedentes de cirugía aortocoronaria, n (%) | 5 (5) | 11 (13) | 0,114 |
| Antecedentes de ICP, n (%) | 26 (27) | 38 (44) | 0,019 |
| Antecedentes de neoplasia, n (%) | 21 (22) | 18 (21) | 0,859 |
| Antecedentes de infarto de miocardio, n (%) | 5 (5) | 8 (9) | 0,390 |
| Antecedentes de ictus, n (%) | 10 (10) | 3 (3) | 0,086 |
| Filtrado glomerular (ml/min) | 53±20 | 52±21 | 0,621 |
| EPOC, n (%) | 13 (14) | 10 (12) | 0,824 |
| Arteriopatía periférica, n (%) | 12 (13) | 5 (6) | 0,133 |
| NYHA III/IV, n (%) | 60 (63) | 55 (63) | 0,999 |
| Ecocardiografía | |||
| FEVI ≤ 40, n (%) | 18 (19) | 14 (16) | 0,699 |
| Gradiente medio (mmHg) | 41±17 | 46±18 | 0,074 |
| Área de válvula aórtica (cm2) | 0,75±0,22 | 0,72±0,20 | 0,355 |
| Electrocardiograma | |||
| Fibrilación auricular, n (%) | 26 (27) | 26 (28) | 0,744 |
| BRIHH, n (%) | 1 (1) | 4 (5) | 0,193 |
| BRDHH, n (%) | 11 (12) | 9 (19) | 0,809 |
| Medidas del anillo aórtico en la TCMC | |||
| Diámetro mínimo (mm) | 20,94±2,64 | 20,83±2,42 | 0,761 |
| Diámetro máximo (mm) | 26,82±2,78 | 26,85±2,35 | 0,920 |
| Diámetro efectivo (mm) | 23,94±2,60 | 23,84±2,16 | 0,795 |
| Perímetro (mm) | 76,70±7,93 | 76,79±6,95 | 0,935 |
| Área (cm2) | 4,58±0,95 | 4,52±0,99 | 0,667 |
| Índice de excentricidad | 0,22±0,07 | 0,22±0,07 | 0,585 |
| Exceso de tamaño por área (%), mediana [intervalo intercuartílico] | 12 [4-17] | 16 [9-25] | 0,002 |
BRDHH: bloque de rama derecha del haz de His; BRIHH: bloque de rama izquierda del haz de His; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervencionismo coronario percutáneo; NYHA: clase funcional de la New York Heart Association; TAVR: recambio percutáneo de válvula aórtica; TCMC: tomografía computarizada multicorte.
Diabetes mellitus: diabetes mellitus tanto insulinodependiente como no insulinodependiente. Hipertensión: presión arterial en reposo > 140/90mmHg o medicación con fármacos antihipertensivos. Hipercolesterolemia: colesterol total > 200mg/dl o medicación con inhibidores de síntesis de colesterol. Tabaquismo: fumadores actuales y exfumadores. FA indica el ritmo en el ECG al ingreso.
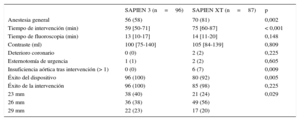
Se realizó un número significativamente superior de intervenciones con sedación consciente al emplear el dispositivo SAPIEN 3. El uso de la válvula SAPIEN 3 se asoció a una tasa de éxito de implante del dispositivo significativamente superior (el 100 frente al 92%; p=0,005) y menor prevalencia de insuficiencia aórtica de grado > 1 tras la intervención (0 frente al 7%; p=0,009). El tiempo de intervención fue significativamente menos para los pacientes tratados con la prótesis SAPIEN 3 que para los tratados con su predecesora (59 frente a 75min; p<0,001) (tabla 2). Aunque las mediciones del anillo aórtico en la tomografía computarizada (TC) multicorte no mostraron diferencias entre los dos grupos, el exceso de tamaño por área fue significativamente mayor en el caso del dispositivo SAPIEN XT que con el SAPIEN 3 (el 16 frente al 12%; p=0,002) (tabla 1).
Datos de intervención de las cohortes de SAPIEN 3 y SAPIEN XT
| SAPIEN 3 (n=96) | SAPIEN XT (n=87) | p | |
|---|---|---|---|
| Anestesia general | 56 (58) | 70 (81) | 0,002 |
| Tiempo de intervención (min) | 59 [50-71] | 75 [60-87] | < 0,001 |
| Tiempo de fluoroscopia (min) | 13 [10-17] | 14 [11-20] | 0,148 |
| Contraste (ml) | 100 [75-140] | 105 [84-139] | 0,809 |
| Deterioro coronario | 0 (0) | 2 (2) | 0,225 |
| Esternotomía de urgencia | 1 (1) | 2 (2) | 0,605 |
| Insuficiencia aórtica tras intervención (> 1) | 0 (0) | 6 (7) | 0,009 |
| Éxito del dispositivo | 96 (100) | 80 (92) | 0,005 |
| Éxito de la intervención | 96 (100) | 85 (98) | 0,225 |
| 23 mm | 38 (40) | 21 (24) | 0,029 |
| 26 mm | 36 (38) | 49 (56) | |
| 29 mm | 22 (23) | 17 (20) |
Los valores expresan n (%) o mediana [intervalo intercuartílico].
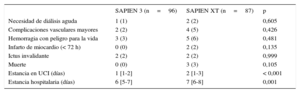
Los pacientes tratados con el dispositivo SAPIEN 3 tuvieron estancias en la unidad de cuidados intensivos y en el hospital significativamente más breves (1 frente a 2 días; p<0,001; y 6 frente a 7 días; p<0,001). No hubo diferencia estadísticamente significativa entre los dos grupos por lo que respecta a los eventos ocurridos durante la hospitalización (tabla 3).
Eventos intrahospitalarios en los subgrupos de SAPIEN 3 y SAPIEN XT
| SAPIEN 3 (n=96) | SAPIEN XT (n=87) | p | |
|---|---|---|---|
| Necesidad de diálisis aguda | 1 (1) | 2 (2) | 0,605 |
| Complicaciones vasculares mayores | 2 (2) | 4 (5) | 0,426 |
| Hemorragia con peligro para la vida | 3 (3) | 5 (6) | 0,481 |
| Infarto de miocardio (< 72 h) | 0 (0) | 2 (2) | 0,135 |
| Ictus invalidante | 2 (2) | 2 (2) | 0,999 |
| Muerte | 0 (0) | 3 (3) | 0,105 |
| Estancia en UCI (días) | 1 [1-2] | 2 [1-3] | < 0,001 |
| Estancia hospitalaria (días) | 6 [5-7] | 7 [6-8] | 0,001 |
UCI: unidad de cuidados intensivos.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
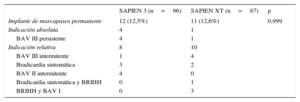
La incidencia de implante de un marcapasos permanente después del TAVI fue del 12,5% del grupo de pacientes tratados con el dispositivo SAPIEN 3 (12 de 96) y el 12,6% del grupo de SAPIEN XT (11 de 87). Las características basales de los pacientes con y sin implante de marcapasos permanente después del TAVI se presentan en la . Las razones para el implante de marcapasos permanente después del TAVI se muestran en la tabla 4. No hubo diferencias significativas entre los dos grupos por lo que respecta a las indicaciones relativas y absolutas para el implante de marcapasos permanente. Entre los pacientes en los que fue necesario el implante de marcapasos permanente había menos casos de conducción normal (10 de 23 [44%] frente a 125 de 160 [78%]; p<0,001), más bloqueos de rama derecha del haz de His (8 de 23 [35%] frente a 12 de 160 [8%]; p<0,001) y un intervalo QRS de mayor duración (113±26 frente a 99±20ms; p=0,023) en comparación con los pacientes que no necesitaron marcapasos permanente. Los datos de la TC multicorte y el porcentaje de exceso de tamaño por área no mostraron diferencias entre los pacientes que necesitaron marcapasos permanente y los que no ().
Incidencia y razones para implantar marcapasos permanente tras un implante percutáneo de válvula aórtica
| SAPIEN 3 (n=96) | SAPIEN XT (n=87) | p | |
|---|---|---|---|
| Implante de marcapasos permanente | 12 (12,5%) | 11 (12,6%) | 0,999 |
| Indicación absoluta | 4 | 1 | |
| BAV III persistente | 4 | 1 | |
| Indicación relativa | 8 | 10 | |
| BAV III intermitente | 1 | 4 | |
| Bradicardia sintomática | 3 | 2 | |
| BAV II intermitente | 4 | 0 | |
| Bradicardia sintomática y BRIHH | 0 | 1 | |
| BRIHH y BAV I | 0 | 3 |
BAV: bloqueo auriculoventricular; BRIHH: bloqueo de rama izquierda del haz de His.
La incidencia y las razones para implar marcapasos permanente tras un implante percutáneo de válvula aórtica en ambas cohortes se determinó después de haber excluido a los pacientes portadores de marcapasos (n=24) en situación basal.
La tasa de implante de marcapasos permanente en la cohorte del dispositivo SAPIEN 3 se mantuvo estable en los tres terciles consecutivos, lo cual indica que no había disminución de la tasa de implante de marcapasos permanente con el aumento de la experiencia en el uso del nuevo dispositivo (tendencia, p=0,803).
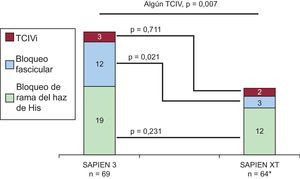
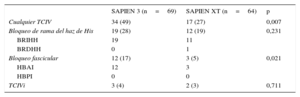
Trastornos de la conducción intraventricular de nueva apariciónEn total, se trató con TAVI a 135 pacientes sin TCIV en el ECG basal; de ellos, 66 y 69 fueron tratados con las válvulas SAPIEN XT y SAPIEN 3 respectivamente. No se dispuso de datos electrocardiográficos de seguimiento de 2 pacientes tratados con SAPIEN XT debido al fallecimiento de los pacientes durante la intervención. Los casos de TCIV de nueva aparición antes del alta hospitalaria observados con los dos dispositivos se muestran en la figura 2 y la tabla 5. En general, los pacientes tratados con la válvula SAPIEN 3 presentaron una tasa significativamente inferior de conducción intraventricular normal (el 51 frente al 73%; p=0,007), lo que se debió principalmente a una tasa significativamente superior de casos de hemibloqueo anterior izquierdo de nueva aparición (el 17 frente al 5%; p=0,021). La incidencia del bloqueo de rama de nueva aparición no mostró diferencias entre los dos dispositivos.
TCIV de nueva aparición con el dispositivo SAPIEN 3 en comparación con el SAPIEN XT. En los gráficos se muestra el número absoluto de TCIV respectivos; 35 (51%) y 47 (73%) pacientes de las cohortes de SAPIEN 3 y SAPIEN XT respectivamente no presentaban TCIV de nueva aparición al alta hospitalaria (p=0,007) (véase información más detallada en la tabla 5). TCIV: trastorno de la conducción intraventricular; TCIVi: trastorno inespecífico de la conducción intraventricular.
* En dos pacientes no se dispuso de datos electrocardiográficos al alta porque fallecieron durante la intervención.
Trastornos de la conducción intraventricular de nueva aparición al alta, según se empleara SAPIEN 3 o SAPIEN XT
| SAPIEN 3 (n=69) | SAPIEN XT (n=64) | p | |
|---|---|---|---|
| Cualquier TCIV | 34 (49) | 17 (27) | 0,007 |
| Bloqueo de rama del haz de His | 19 (28) | 12 (19) | 0,231 |
| BRIHH | 19 | 11 | |
| BRDHH | 0 | 1 | |
| Bloqueo fascicular | 12 (17) | 3 (5) | 0,021 |
| HBAI | 12 | 3 | |
| HBPI | 0 | 0 | |
| TCIVi | 3 (4) | 2 (3) | 0,711 |
BRDHH: bloqueo de rama derecha del haz de His; BRIHH: bloqueo de rama izquierda del haz de His; HBAI: hemibloqueo anterior izquierdo; HBPI: hemibloqueo posterior izquierdo; TCIV: trastorno de conducción intraventricular; TCIVi: trastornos de conducción intraventricular inespecíficos.
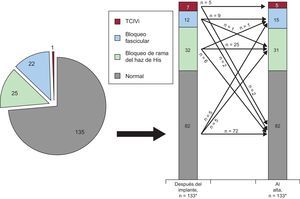
La tendencia observada en los TCIV de nueva aparición desde la fase posterior a la intervención hasta el alta hospitalaria en el conjunto de la población de pacientes estudiados se muestra en la figura 3. Se produjo BRIHH transitorio o BRIHH persistente de nueva aparición en el 24% (32 de 133) y en el 22% (30 de 133) respectivamente. Hubo tendencia a unas cifras más altas de casos de BRIHH transitorios (el 29% [20 de 69] frente al 19% [12 de 64]; p=0,168) y de BRIHH persistentes (el 28% [19 de 69] frente al 17% [11 de 64]; p=0,154) entre los pacientes tratados con SAPIEN 3 que entre los tratados con SAPIEN XT, si bien la diferencia no fue estadísticamente significativa. Los datos estratificados de los pacientes tratados con SAPIEN 3 y SAPIEN XT se presentan en la .
Tendencia en los TCIV de nueva aparición después de un implante percutáneo de válvula aórtica en el conjunto de la población en estudio. En los gráficos se muestra el número absoluto de TCIV respectivos. TCIV: trastorno de la conducción intraventricular; TCIVi: trastorno inespecífico de la conducción intraventricular.
* En dos pacientes no se dispuso de datos electrocardiográficos al alta porque fallecieron durante la intervención.
Con objeto de analizar si el BRIHH persistente de nueva aparición se veía afectado por la experiencia del médico con el nuevo dispositivo, se examinaron los terciles de pacientes consecutivos, pero en la cohorte del SAPIEN 3 se observó una tasa estable en el tiempo (tendencia, p=0,876).
DISCUSIÓNRecientemente, el dispositivo Edwards SAPIEN 3ha reemplazado a la válvula SAPIEN XT en Europa. El presente estudio describe la experiencia inicial con este nuevo dispositivo y se centra en la incidencia de TCIV de nueva aparición y el implante de marcapasos permanentes en comparación con su predecesora. Se observó una tendencia a mayor tasa de TCIV de nueva aparición en la cohorte del dispositivo SAPIEN 3, mientras que las tasas de implante de marcapasos permanente fueron similares a las de SAPIEN XT.
Implante de marcapasos permanente después del implante percutáneo de válvula aórticaLa incidencia de implante de marcapasos permanente con la válvula SAPIEN XT se sitúa entre el 5 y el 12%3,17. En nuestros pacientes, la tasa de implante de marcapasos permanente con la válvula SAPIEN XT fue similar a la descrita en esas observaciones previas. Nuestro análisis confirmó también que el bloqueo de rama derecha del haz de His preexistente se asocia a la necesidad de implante de marcapasos permanente después del TAVI18,19.
La dependencia de la estimulación por marcapasos puede limitar el beneficio clínico aportado por el TAVI como consecuencia de la falta de sincronía auriculoventricular y el ritmo de marcapasos con estimulación ventricular derecha20, aunque algunos autores no han observado efecto del implante de marcapasos permanente en los resultados clínicos en cuanto a supervivencia12,21. Además, se ha identificado que el implante de marcapasos permanente después de TAVI es una causa importante de prolongación de la estancia en el hospital, con el consiguiente aumento de los costes de la intervención22. Así pues, la necesidad de implante de marcapasos permanente como aspecto específico de los resultados clínicos tras el TAVI es de gran importancia.
En este estudio se aportan datos sobre la tasa de implante de marcapasos permanente con el nuevo dispositivo SAPIEN 3. Tiene interés señalar que, a pesar de la tendencia a mayor tasa de TCIV de nueva aparición, el uso del dispositivo SAPIEN 3 no conllevó mayor tasa de implante de marcapasos permanente durante la hospitalización en comparación con lo observado con su predecesor, el SAPIEN XT. Por lo que respecta a los implantes de marcapasos después del TAVI con el dispositivo SAPIEN 3, nuestros datos van en la misma línea que los que están apareciendo, que indican una tasa de entre el 13 y el 30%23–25.
En la literatura a menudo no se muestran las indicaciones específicas para el implante de marcapasos permanente después del TAVI. Aunque hay indicaciones absolutas como, por ejemplo, el bloqueo auriculoventricular completo persistente, hay varios escenarios clínicos que suponen una indicación relativa. Hasta la fecha no se ha alcanzado un consenso respecto a unas indicaciones claras para el implante de marcapasos permanente después del TAVI. Las recomendaciones actuales incluyen la monitorización electrocardiográfica de los pacientes con TAVI y se reconoce que hay una parte de pacientes de riesgo más alto que pueden requerir una monitorización prolongada26. También está apareciendo evidencia de que los trastornos de la conducción auriculoventricular tras el TAVI pueden resolverse con el paso del tiempo. De hecho, en un estudio se describió la resolución del bloqueo auriculoventricular perioperatorio en más de la mitad de los pacientes tras implante de una válvula autoexpandible27. En el presente estudio, las indicaciones para implantar un marcapasos permanente se dejaron al criterio del médico encargado del tratamiento del paciente. Presentamos un número considerable de pacientes con una indicación relativa para el implante de marcapasos permanente. Debido al riesgo aumentado de eventos de la población con TAVI de alto riesgo, nuestro criterio para el implante de marcapasos permanente fue más liberal.
Bloqueo de rama izquierda del haz de nueva aparición tras el implante percutáneo de válvula aórtica. Incidencia y repercusiones clínicasEl BRIHH de nueva aparición es una observación frecuente después del TAVI empleando válvulas de balón expandible7–9 y se lo considera consecuencia directa de la lesión causada por la intervención en el sistema de conducción. De hecho, la mayor parte de los trastornos de conducción se producen ya durante la valvuloplastia28, y se ha descrito una tendencia a la reversión en un pequeño porcentaje de pacientes6. En este estudio se observó que un 22% de los casos de BRIHH aparecidos después del TAVI se resolvieron antes del alta hospitalaria. Sin embargo, 6 pacientes sin BRIHH después del TAVI sufrieron un BRIHH antes del alta, con lo que el número absoluto de casos de BRIHH completo al alta no mostró diferencias significativas.
La trascendencia clínica del BRIHH después del TAVI sigue en estudio. Si bien no se ha observado repercusión en la mortalidad, la evidencia existente indica que el BRIHH de nueva aparición después del TAVI puede asociarse a mayor riesgo de implante tardío de marcapasos permanente y deterioro de la recuperación de la función del ventrículo izquierdo6,8,10,11.
La incidencia de BRIHH de nueva aparición después del TAVI con el dispositivo SAPIEN XT oscila entre el 8 y el 30%5,6. Nuestro estudio presenta la incidencia de TCIV de nueva aparición con tendencia no significativa a mayor incidencia de BRIHH persistente de nueva aparición del 28% con el dispositivo SAPIEN 3, en comparación con el 17% observado en el grupo del SAPIEN XT. Además, hubo un aumento significativo de la tasa total de TCIV de nueva aparición en el grupo del SAPIEN 3.
Los posibles mecanismos subyacentes a estas observaciones pueden deberse a diferencias en el diseño de las prótesis y los mecanismos de implante. El dispositivo SAPIEN 3 se caracteriza por tener un armazón metálico más alto que la válvula SAPIEN XT y un faldón externo para minimizar las fugas paravalvulares. Las diferencias en el despliegue de la válvula, con un mayor escorzo del dispositivo SAPIEN 3 dentro del infundíbulo de salida del ventrículo izquierdo durante el implante, pueden llevar a un aumento del traumatismo mecánico producido en el sistema específico de conducción del corazón, lo que podría explicar la mayor incidencia de bloqueos fasciculares observada en este estudio. Otro factor relevante puede ser la altura del implante dentro del anillo aórtico, que no se analizó en el presente estudio. Por último, será preciso confirmar la idoneidad de los algoritmos de determinación del tamaño proporcionados por el fabricante. La investigación futura deberá abordar también la identificación de los mecanismos fisiopatológicos subyacentes.
Puntos fuertes y limitacionesEl presente estudio tiene la limitación de su tamaño muestral y que no se basa en una comparación aleatorizada de los dos dispositivos. Los resultados del estudio se ven reforzados por el hecho de que el mismo equipo realizó todas las intervenciones en un centro con gran experiencia en el TAVI y que las tasas de TCIV registrados con el dispositivo SAPIEN XT son similares a otros datos publicados con anterioridad. Sin embargo, no puede descartarse por completo la influencia de una curva de aprendizaje en el grupo del dispositivo SAPIEN 3 debido a la experiencia previa con el dispositivo SAPIEN XT. Además, aunque el BRIHH de nueva aparición aumentó en un 58% en la cohorte del SAPIEN 3 comparada con nuestra cohorte de SAPIEN XT, la incidencia del 28% observada está dentro de la gama de valores descritos con anterioridad para la válvula SAPIEN XT5,6. En consecuencia, las tasas de BRIHH con el uso del dispositivo SAPIEN 3 en otros centros pueden presentar diferencias considerables.
Se ha identificado que la profundidad de implante es un factor predictor de la aparición de nuevos trastornos de la conducción6,29,30. Lamentablemente, no se dispuso de este parámetro en todos los pacientes del estudio.
Aunque la tasa de primoimplantes de marcapasos permanente durante la hospitalización no mostró diferencias, está por determinar la posible influencia de la mayor tasa de trastornos de la conducción de nueva aparición en la incidencia de implante tardío de marcapasos permanente con el empleo del SAPIEN 3, y para ello serán necesarios estudios más amplios con seguimiento a largo plazo.
CONCLUSIONESEn nuestra experiencia inicial se observó una tendencia a mayor tasa de TCIV de nueva aparición con el uso del dispositivo SAPIEN 3; sin embargo, se observó una tasa de implante de marcapasos permanente similar a la registrada con su predecesora, la válvula SAPIEN XT. Está justificada la realización de nuevos estudios centrados en los posibles mecanismos subyacentes y las posibles estrategias para reducir la incidencia de TCIV de nueva aparición.
CONFLICTO DE INTERESESC. Hengstenberg y A.M. Kasel son proctor de Edwards Lifesciences.