Son escasos los datos sobre la duración y el impacto pronóstico del tratamiento antiagregante plaquetario doble (TAPD) tras una intervención coronaria percutánea (ICP) del tronco coronario izquierdo (TCI) con stents farmacoactivos de segunda generación. El objetivo de este estudio es investigar los patrones de prescripción y el efecto pronóstico a largo plazo de la duración del TAPD en pacientes sometidos a ICP del TCI con stents farmacoactivos segunda generación.
MétodosA partir de los datos individuales de los registros IRIS-MAIN y KOMATE, se incluyó a 1.827 pacientes sometidos a ICP del TCI con stents farmacoactivos de segunda generación de los que hubiese información válida sobre la duración del TAPD. El objetivo de eficacia fue la aparición de eventos cardiovasculares adversos mayores (MACE) (un combinado de muerte cardiaca, infarto de miocardio y trombosis del stent) y el de seguridad fue la presencia de hemorragia mayor según TIMI.
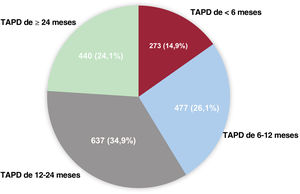
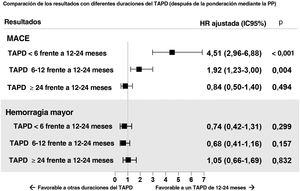
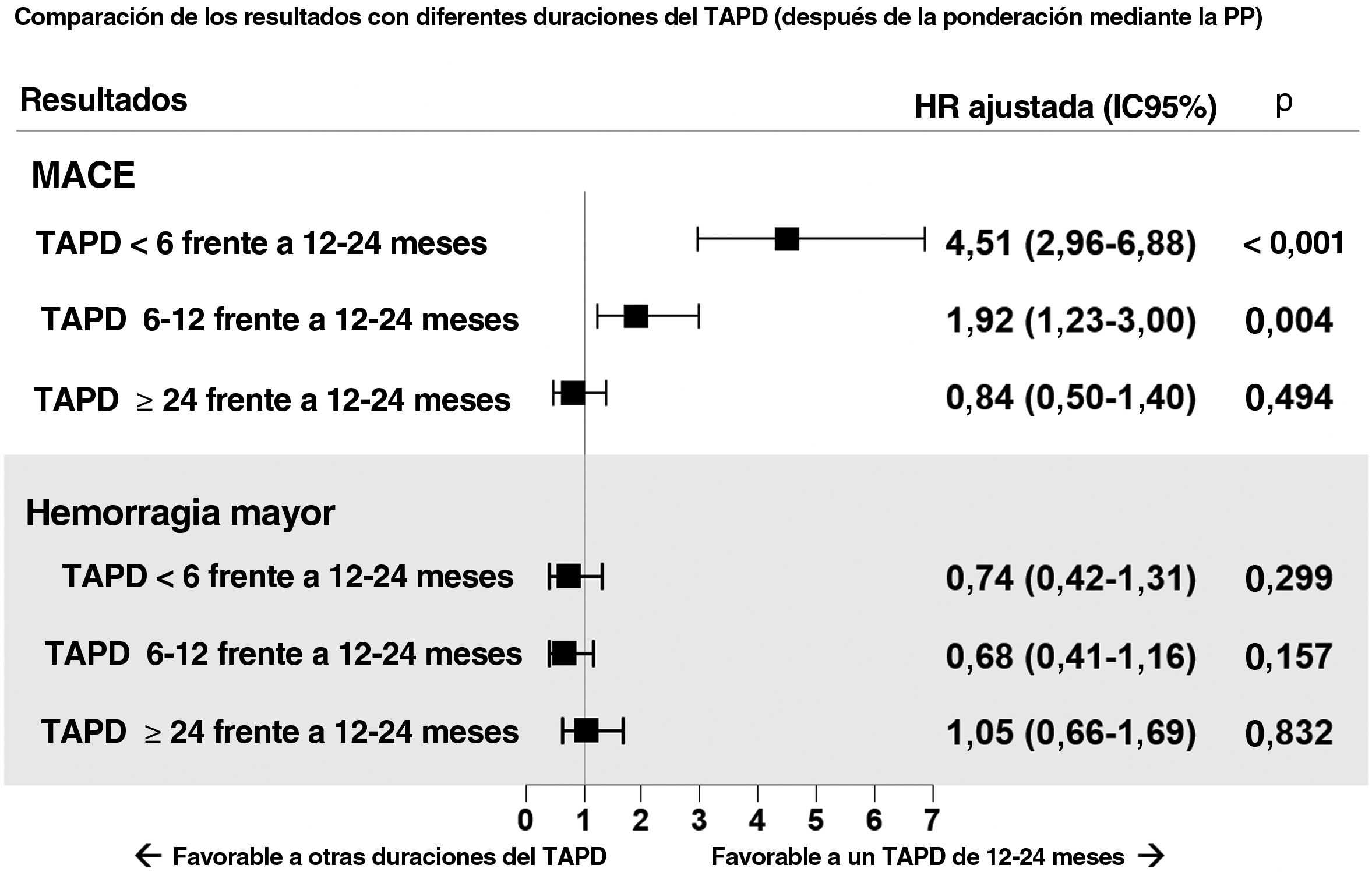
ResultadosLas duraciones del TAPD fueron <6 meses (n=273), de 6-12 meses (n=477), de 12-24 meses (n=637) y ≥ 24 meses (n=440). La mediana de la duración del seguimiento fue de 3,9 [intervalo intercuartílico, 3,01-5,00] años. El TAPD prolongado se asoció con menor incidencia de MACE. En el análisis de puntuación de propensión multigrupo, las HR ajustadas de los MACE fueron significativamente mayores con los TAPD de menos de 6 meses y de 6-12 meses (HR=4,51; IC95%, 2,96-6,88) frente al TAPD de 12-24 meses (HR=1,92; IC95%, 1,23-3,00). No hubo diferencias en la HR de hemorragia mayor entre los grupos evaluados.
ConclusionesLa duración del TAPD tras la ICP para la enfermedad del TCI es muy variable. Aunque debe considerarse en función de la situación clínica de cada paciente, un TAPD de menos de 12 meses se asoció con mayor incidencia de MACE.
Palabras clave
El seguimiento ampliado reciente de ensayos clínicos aleatorizados de referencia ha puesto de manifiesto que la intervención coronaria percutánea (ICP) con el empleo de stents farmacoactivos (SFA) se asocia a una incidencia de los objetivos «duros» y la mortalidad similar a la observada con la cirugía de revascularización coronaria en los pacientes con una afectación del tronco coronario izquierdo (TCI) y una complejidad anatómica de baja a intermedia1–3. Las guías de práctica clínica actuales recomiendan generalmente la duración del tratamiento antiagregante plaquetario doble (TAPD) en los pacientes a los que se practica una ICP con un SFA en función de la forma de presentación clínica inicial, e incluyen el empleo de un TAPD durante un mínimo de 6 meses para la angina estable crónica y de 12 meses para el síndrome coronario agudo (SCA)4. Sin embargo, solamente se dispone de datos limitados sobre la duración óptima del TAPD en los pacientes a los que se practica una ICP para lesiones complejas, como la afectación de múltiples vasos, las lesiones de bifurcaciones y las oclusiones totales crónicas o la afectación del TCI.
Aunque algunos estudios previos sugirieron que una duración prolongada del TAPD podría asociarse a mejores resultados clínicos en los pacientes a los que se practica una ICP compleja5,6, la proporción de casos de ICP-TCI fue limitada, y la mayor parte de los estudios utilizaron SFA de primera generación. En este contexto clínico, investigamos el patrón de uso existente en la práctica clínica y el efecto pronóstico a largo plazo de la duración del TAPD en pacientes a los que se practicó una ICP con un SFA de segunda generación para una afectación del TCI, utilizando los datos a nivel de paciente individual combinados de 2 grandes registros contemporáneos de la ICP en la práctica clínica real.
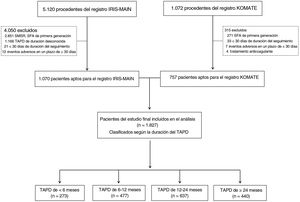
MÉTODOSParticipantes y diseño del estudioEl diseño y las características de inclusión de 2 registros multicéntricos (IRIS-MAIN y KOMATE) se han descrito ya en publicaciones anteriores7,8. De forma resumida, el IRIS-MAIN es un registro observacional, multinacional, no aleatorizado, en el que se recogen datos de pacientes consecutivos con una afectación del TCI sin protección. Otra población de estudio fue la derivada del registro KOMATE, en el que participan 8 centros de intervención coronaria de Corea. Ambas fuentes de datos utilizaron un diseño de acceso no restringido, o all-comers (inclusión de todos los pacientes sin haberlos seleccionado) para evaluar las características, los tratamientos y los resultados clínicos de los pacientes con afectación del TCI en la práctica clínica real. En la combinación de datos de paciente individual incluimos solo a los pacientes con una afectación del TCI tratados con un SFA de segunda generación y para los que se dispuso de una información exacta sobre la duración del TAPD después de la intervención. Los criterios de exclusión fueron mínimos: pacientes tratados con un stent metálico sin recubrimiento (SMSR) o con un SFA de primera generación. Excluimos también a los pacientes en los que no se pudo valorar con exactitud la efectividad del TAPD (con pérdida del seguimiento en los primeros 30 días, con eventos intrahospitalarios en los 30 primeros días). En la figura 1 muestra el diagrama de flujo del presente análisis. El estudio fue aprobado por el comité de ética de investigación de cada uno de los centros participantes para el uso de los datos combinados, y todos los pacientes dieron su consentimiento informado por escrito. El estudio se llevó a cabo cumpliendo la Declaración de Helsinki y fue aprobado por los comités de ética de investigación de cada centro participante, y se obtuvo el consentimiento informado por escrito de todos los participantes.
Diagrama de flujo del estudio. IRIS-MAIN: Interventional Cardiology Research Incorporation Society-Left Main Revascularization Study; KOMATE: Korean Multicenter Angioplasty Team Study; SFA: stent farmacoactivo; SMSR: stent metálico sin recubrimiento; TAPD: tratamiento antiagregante plaquetario doble.
Todas las intervenciones de ICP se llevaron a cabo siguiendo las directrices locales y con el empleo de técnicas estándares. Se mantuvo la anticoagulación durante la intervención con el empleo de heparina no fraccionada o heparina de bajo peso molecular, para alcanzar un tiempo de coagulación activado de 250 a 300 s. Otros factores de la intervención, como la vía de acceso, la estrategia de uso de stents, la técnica de implante de stents y el uso de ecografía intravascular, se dejaron al criterio del operador. Aunque la duración del TAPD (ácido acetilsalicílico más inhibidores de P2Y12 [clopidogrel, ticagrelor o prasugrel]) se recomendó en general según lo indicado en las guías de práctica clínica actuales4, la duración final se dejó al criterio del médico encargado del tratamiento, que tuvo en cuenta las características clínicas del paciente, las características de la intervención y la presencia de otros trastornos médicos. El criterio de duración del TAPD permitía un margen de hasta 2 meses más respecto a la fecha de uso, en función del momento en el que se realizara la visita en el departamento de consultas ambulatorias. Todos los datos clínicos, angiográficos, de la intervención y de los resultados se obtuvieron con el empleo de un sistema de notificación a través de Internet. Con objeto de identificar el uso del tratamiento antiagregante plaquetario, se obtuvieron las fechas y la duración de las prescripciones de fármacos antiagregantes plaquetarios a través del sistema de prescripción electrónico de cada hospital. Se obtuvo información adicional mediante consultas adicionales de las historias clínicas electrónicas o mediante contactos telefónicos, en caso necesario.
Resultados clínicos y definicionesEl objetivo de eficacia del estudio fueron los eventos adversos cardiovasculares mayores (MACE), definidos como la combinación de la muerte de causa cardiaca, el infarto agudo de miocardio mortal o no mortal y las trombosis del stent. Los objetivos secundarios fueron la mortalidad por cualquier causa y la revascularización del vaso diana. El infarto agudo de miocardio mortal o no mortal se definió como un aumento de la creatina-cinasa de banda miocárdica o de la troponina hasta el centil 99 del límite superior de la normalidad, con síntomas isquémicos o signos electrocardiográficos indicativos de isquemia, sin relación con la intervención índice (es decir, no se tuvo en cuenta el infarto de miocardio en la intervención). La trombosis de stent se definió como una trombosis de stent definitiva según la definición del Academic Research Consortium9. El objetivo de seguridad fue la hemorragia mayor. Los eventos hemorrágicos se definieron como la hemorragia de carácter menor o mayor según los criterios de hemorragia de Thrombolysis in Myocardial Infarction (TIMI)10. Todos los resultados clínicos fueron validados («adjudicados») de manera independiente por un grupo independiente de clínicos que no conocían la duración del TAPD ni el tipo de SFA.
Análisis estadísticoLas variables continuas se presentan en forma de media± desviación estándar y se analizaron con un ANOVA de 1 vía. Las variables cualitativas se presentan mediante frecuencias (porcentajes) y se analizaron con pruebas de χ2. Se elaboraron curvas de supervivencia con el empleo de un análisis de Kaplan-Meier, y se analizaron con pruebas de orden logarítmico (log-rank). Se utilizó un análisis de regresión de riesgos proporcionales de Cox para identificar los factores predictivos independientes de los objetivos principales y para calcular los valores de hazard ratio (HR) y los intervalos de confianza del 95% (IC95%) para los resultados clínicos. Con objeto de reducir al mínimo los factores de confusión y el sesgo de selección residual en las comparaciones de tratamientos observacionales, se aplicó un método de ponderación mediante puntuación de propensión para introducir un control respecto a los desequilibrios existentes en diversas características iniciales entre los diferentes grupos de duración del TAPD. Para las comparaciones de grupos múltiples, se calcularon puntuaciones de propensión múltiples utilizando el método del conjunto de herramientas para la ponderación y el análisis de grupos no equivalentes (Toolkit for Weighting and Analysis of Nonequivalent Groups, TWANG), y se calcularon las correspondientes probabilidades inversas de ponderación del tratamiento (los recíprocos de las puntuaciones de propensión) utilizando modelos de remuestreo generalizados a través de un método de estimación iterativa11. Para calcular la puntuación de propensión, se incluyeron las características clave clínicas, anatómicas y de la intervención, como edad, sexo, hipertensión, diabetes mellitus, dislipidemia, tabaquismo, SCA, enfermedad renal crónica, enfermedad multivaso, estrategia de uso de stents, ICP previa y ecografía intravascular. Se evaluó el equilibrio en las covariables previas al tratamiento, y se alcanzó una mejora significativa en la situación inicial tras la ponderación. Además, el rendimiento de este modelo de propensión se confirmó comparando las distribuciones de diferencias medias estandarizadas de las covariables y las puntuaciones de propensión entre esos grupos antes y después de las probabilidades inversas de ponderación del tratamiento.
Se utilizaron modelos de regresión de Cox con pruebas de interacción para evaluar la uniformidad de los efectos del tratamiento en múltiples subgrupos. El análisis estadístico se hizo con el programa IBM SPSS versión 23.0 (IBM, Estados Unidos) y el programa R versión 3.5.2 (R Project for Statistical Computing).
RESULTADOSPatrón de duración del TAPD y características inicialesEntre julio de 2006 y agosto de 2017, 1.827 pacientes con lesiones de afectación del TCI tratados mediante ICP con SFA de segunda generación y para los que se dispuso de datos válidos se incluyeron en los conjuntos de datos de análisis finales (figura 1). El patrón de duración del TAPD en la práctica clínica en estos pacientes se muestra en la figura 2. La mediana de duración del TAPD fue de 398 (rango intercuartílico [RIC], 360-730) días para el conjunto de la población. Según la duración del TAPD, se clasificó a los pacientes en 4 grupos: TAPD <6 meses (n=273), 6 a 12 meses (n=477), 1.224 meses (n=637) y ≥ 24 meses (n=440). La mediana de duración del TAPD fue de 99 (RIC, 36,7-180) días en el TAPD de <6 meses, 365 (RIC, 341-365) días en el TAPD de 6 a 12 meses, 523,5 (RIC, 397-730) días en el TAPD de 12 a 24 meses y 1095 (RIC, 1.004-1.316,5) días en el TAPD de ≥ 24 meses, respectivamente. Dado que incluimos en el estudio a pacientes correspondientes a un periodo de tiempo prolongado (2006-2017), investigamos el patrón de duración del TAPD en 2 periodos diferentes (2006-2011 y 2012-2017). La mediana de duración del TAPD fue mayor en el periodo de 2006 a 2011 (RIC, 497 días) en comparación con el periodo de 2012 a 2017 (RIC, 381 días). El patrón de uso del TAPD fue el mismo en los 2 periodos, como se muestra en la figura 1 del material adicional.
Las características clínicas iniciales de la población del estudio fueron las que se muestran en la tabla 1. Las características clínicas fueron similares en los 4 grupos, excepto por la dislipidemia y los antecedentes de ICP previa. La duración del TAPD tendió a ser significativamente inferior en los pacientes con angina estable, en comparación con los pacientes con SCA. El TAPD y las características de la intervención en la población del estudio se muestran en la tabla 2. Por lo que respecta a los inhibidores de P2Y12, se trató a la mayoría de los pacientes con clopidogrel (94,6%), y se usó ticagrelor y prasugrel en el 4,1 y el 1,3% de los pacientes, respectivamente.
Características iniciales de los pacientes según la duración del TAPD
| Población total (N=1827) | TAPD <6 meses (n=273) | TAPD 6-12 meses (n=477) | TAPD 12-24 meses (n=637) | TAPD ≥ 24 meses (n=440) | DME (sin emparejamiento) | p (sin emparejamiento) | DME (después de ponderación mediante PP) | p (después de ponderación mediante PP) | |
|---|---|---|---|---|---|---|---|---|---|
| Edad, años | 64,3±10,6 | 65,0±11,3 | 63,5±10,7 | 64,8±10,7 | 64,1±9,7 | 0,077 | 0,136 | 0,008 | 0,997 |
| Sexo masculino | 1395 (76,4) | 205 (75,1) | 380 (79,7) | 479 (75,2) | 331 (75,2) | 0,057 | 0,27 | 0,014 | 0,983 |
| Diabetes mellitus | 609 (33,3) | 87 (31,9) | 158 (33,1) | 204 (32) | 160 (36,4) | 0,049 | 0,461 | 0,028 | 0,914 |
| Hipertensión | 1146 (62,7) | 165 (60,4) | 302 (63,3) | 401 (63) | 278 (63,2) | 0,025 | 0,865 | 0,012 | 0,993 |
| Dislipemia | 1120 (61,3) | 189 (69,2) | 292 (61,2) | 354 (55,6) | 285 (64,8) | 0,153 | <0,0001 | 0,041 | 0,763 |
| Enfermedad renal crónica | 137 (7,5) | 20 (7,3) | 34 (7,1) | 53 (8,3) | 30 (6,8) | 0,031 | 0,796 | 0,019 | 0,949 |
| Tabaquismo | 422 (23,1) | 57 (20,9) | 130 (27,3) | 141 (22,1) | 94 (21,4) | 0,076 | 0,091 | 0,029 | 0,895 |
| ICP previa | 326 (17,8) | 45 (16,5) | 72 (15,1) | 109 (17,1) | 100 (22,7) | 0,105 | 0,017 | 0,017 | 0,970 |
| CABG previa | 60 (3,3) | 6 (2,2) | 19 (4) | 20 (3,1) | 15 (3,4) | 0,032 | 0,612 | 0,039 | 0,791 |
| Indicación clínica para la ICP | |||||||||
| Angina estable | 450 (24,6) | 45 (16,5) | 119 (25) | 187 (29,3) | 99 (22,5) | 0,162 | <0,0001 | 0,058 | 0,421 |
| Síndrome coronario agudo | 1377 (75,4) | 228 (83,5) | 358 (75) | 450 (70,7) | 341 (77,5) | 0,131 | 0,001 | 0,036 | 0,777 |
| Angina inestable | 1060 (77) | 171 (75) | 271 (75,7) | 340 (75,6) | 278 (81,5) | 0,112 | 0,008 | 0,072 | 0,370 |
| IAMSEST | 222 (16,1) | 41 (18) | 66 (18,4) | 72 (16) | 43 (12,6) | 0,096 | 0,103 | 0,074 | 0,181 |
| IAMCEST | 95 (6,9) | 16 (7) | 21 (5,9) | 38 (8,4) | 20 (5,9) | 0,050 | 0,58 | 0,045 | 0,679 |
| Media de fracción de eyección, % | 59,5±12,5 | 59,0±13,1 | 59,8±13,1 | 59,4±13,3 | 59,7±10,2 | 0,059 | 0,871 | 0,065 | 0,402 |
CABG: cirugía de revascularización coronaria; DME: diferencia media estandarizada; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; TAPD: tratamiento antiagregante plaquetario doble. Los valores se presentan en forma de número (%) o media ± desviación estándar.
TAPD y características de la intervención según la duración del TAPD
| Población total (n=1827) | TAPD <6 meses (n=273) | TAPD 6-12 meses (n=477) | TAPD 12-24 meses (n=637) | TAPD ≥ 24 meses (n=440) | DME (sin emparejamiento) | p (sin emparejamiento) | DME (después de ponderación mediante PP) | p (después de ponderación mediante PP) | |
|---|---|---|---|---|---|---|---|---|---|
| Duración del TAPD, d | 589,3±443,9 | 105,1±64,1 | 336,9±52,7 | 546,3±145,4 | 1225,6±400,2 | 3,181 | <0,0001 | 3,224 | <0,0001 |
| Puntuación DAPT | 0,52±1,30 | 0,45±1,36 | 0,74±1,36 | 0,48±1,27 | 0,39±1,21 | 0,134 | <0,0001 | 0,042 | 0,627 |
| Inhibidor de P2Y12 | 0,074 | 0,299 | 0,070 | 0,284 | |||||
| Clopidogrel | 1729 (94,6) | 255 (93,4) | 458 (96) | 596 (93,6) | 420 (95,5) | ||||
| Ticagrelor | 75 (4,1) | 14 (5,1) | 17 (3,6) | 31 (4,9) | 13 (3) | ||||
| Prasugrel | 23 (1,3) | 4 (1,5) | 2 (0,4) | 10 (1,6) | 7 (1,6) | ||||
| Enfermedad multivaso | 1281 (70,1) | 177 (64,8) | 339 (71,1) | 447 (70,2) | 318 (72,3) | 0,067 | 0,186 | 0,056 | 0,369 |
| Extensión de la enfermedad | |||||||||
| Tronco coronario izquierdo solamente | 133 (7,3) | 25 (9,3) | 34 (7,2) | 41 (6,4) | 33 (7,5) | 0,056 | 0,502 | 0,028 | 0,873 |
| Tronco coronario izquierdo con 1 VA | 459 (25,3) | 73 (27,2) | 114 (24,2) | 173 (27,2) | 99 (22,5) | 0,066 | 0,281 | 0,047 | 0,554 |
| Tronco coronario izquierdo con 2 VA | 667 (36,7) | 88 (32,8) | 184 (39,1) | 219 (34,4) | 176 (40) | 0,087 | 0,094 | 0,054 | 0,446 |
| Tronco coronario izquierdo con 3 VA | 557 (30,7) | 82 (30,6) | 139 (29,5) | 204 (32) | 132 (30) | 0,028 | 0,816 | 0,031 | 0,847 |
| Afectación de ACD | 805 (44,3) | 120 (44,8) | 202 (42,9) | 286 (44,9) | 197 (44,8) | 0,018 | 0,911 | 0,040 | 0,818 |
| Localización de la lesión en el tronco coronario izquierdo | |||||||||
| Ostium del tronco | 651 (35,8) | 111 (41,4) | 165 (35) | 209 (32,8) | 166 (37,7) | 0,092 | 0,072 | 0,087 | 0,143 |
| Bifurcación distal | 1244 (68,1) | 182 (66,7) | 325 (68,1) | 435 (68,3) | 302 (68,6) | 0,017 | 0,955 | 0,017 | 0,975 |
| Técnica de implante de stents | 0,109 | 0,003 | 0,039 | 0,742 | |||||
| Estrategia de 1 stent | 1512 (83,3) | 216 (80,6) | 381 (80,9) | 558 (87,7) | 357 (81,1) | ||||
| Estrategia de 2 stents | 303 (16,7) | 52 (19,4) | 90 (19,1) | 78 (12,3) | 83 (18,9) | ||||
| Número total de stents por paciente | 2,21±1,22 | 2,17±1,26 | 2,19±1,16 | 2,16±1,23 | 2,32±1,24 | 0,073 | 0,156 | 0,068 | 0,344 |
| Promedio de diámetro del stent en el VP, mm | 3,57±0,43 | 3,51±0,47 | 3,47±0,47 | 3,66±0,38 | 3,63±0,39 | 0,175 | <0,0001 | 0,168 | <0,001 |
| Promedio de longitud del stent en el VP, mm | 21,88±7,64 | 21,85±7,63 | 21,89±7,83 | 20,95±7,38 | 22,92±7,62 | 0,106 | 0,008 | 0,116 | 0,028 |
| Diámetro del balón de posdilatación, mm | 3,71±0,56 | 3,67±0,56 | 3,63±0,58 | 3,71±0,55 | 3,81±0,54 | 0,174 | <0,0001 | 0,134 | <0,001 |
| Presión del balón de posdilatación, mmHg | 15,61±4,60 | 15,13±4,47 | 15,17±4,12 | 15,83±4,74 | 16,09±4,94 | 0,104 | 0,011 | 0,115 | 0,031 |
| ISBK | 848 (46,5) | 164 (60,3) | 213 (44,7) | 250 (39,3) | 221 (50,2) | 0,219 | <0,0001 | 0,191 | <0,001 |
| IVUS | 1107 (60,7) | 160 (58,8) | 264 (55,3) | 395 (62,1) | 288 (65,5) | 0,103 | 0,013 | 0,027 | 0,901 |
ACD: arteria coronaria derecha; ISBK: inflado simultáneo de dos globos (kissing-balloon) final; IVUS: ecografía intracoronaria; TAPD: tratamiento antiagregante plaquetario doble; VA: vaso afectado; VP: vaso principal.
Los valores se presentan en forma de número (%) o de media±desviación estándar.
El porcentaje de casos de afectación de múltiples vasos más bajo fue el observado en el grupo de TAPD de <6 meses, y el más alto el del grupo de TAPD de ≥ 24 meses. La extensión de la EC fue similar en los 4 grupos. La afectación de bifurcación distal menos frecuente fue la del grupo de TAPD de <6 meses y la más frecuente la del grupo de TAPD ≥ 24 meses. El promedio de diámetro del stent y del diámetro de balón de posdilatación fueron máximos en el grupo de TAPD ≥ 24 meses. La presión del balón de posdilatación fue máxima en el grupo de TAPD de ≥ 24 meses. Los pacientes a los que se practicó una ICP con ecografía intravascular tuvieron una probabilidad significativamente superior de ser tratados con TAPD durante ≥ 24 meses.
Resultados clínicos según la duración del TAPDLa mediana de duración del seguimiento en el conjunto de todos los pacientes fue de 47,9 (36,7-60,8) meses. El número de pacientes en los que hubo una pérdida del seguimiento fue de 73 de un total de 1.827 (3,99%). En primer lugar, ajustamos los modelos log-lineales de riesgos proporcionales de Cox según los parámetros iniciales y de la intervención, con curvas spline de lámina fina (thin-plate spline) a la duración del TAPD (figura 3). Al analizar el riesgo de MACE y de hemorragia mayor según la duración del TAPD como variable continua, el riesgo de MACE mostró una reducción progresiva, pero el riesgo de hemorragia mayor aumentó con>12 meses de TAPD. Investigamos modelos log-lineales de riesgos proporcionales de Cox con curvas spline de lámina fina para la duración del TAPD según las estrategias de uso de stents y en presencia o ausencia de lesiones de bifurcación. Con independencia de esos factores, los resultados continuaron siendo uniformes (figura 2 del material adicional).
Curvas spline. Relaciones entre duración y respuesta entre la duración del TAPD y los MACE (A), y entre la duración del TAPD y la hemorragia mayor (B), después de la ponderación mediante PP, evaluadas con un modelo log-lineal, con curvas spline de lámina fina. HR: hazard ratio; MACE: evento cardiovascular adverso mayor; PP: puntuación de propensión; TAPD: tratamiento antiagregante plaquetario doble.
Los valores de incidencia acumulada de resultados clínicos según las categorías de duración del TAPD se muestran en la tabla 3 y en la figura 2 del material adicional. Las tasas acumuladas de MACE mostraron una mayor frecuencia en el grupo de TAPD de <6 meses que en los demás grupos de TAPD (valor mínimo para el grupo de TAPD de ≥ 24 meses [1,6%] y valor máximo para el grupo de TAPD de <6 meses [5,1%]). Hubo una ausencia de diferencias en la incidencia acumulada de hemorragia mayor (mínima para el grupo de TAPD de <6 meses [1,1%] y máxima para el grupo de TAPD de ≥ 24 meses [3,6%]).
Resultados clínicos según la duración del TAPD
| TAPD <6 meses(n=273) | TAPD 6-12 meses(n=477) | TAPD 12-24 meses(n=637) | TAPD ≥ 24 meses(n=440) | p | |
|---|---|---|---|---|---|
| Evento adverso cardiovascular mayor* | 5,1 (2,0-8,0) | 3,1 (2,0-5,0) | 2,0 (1,0-3,0) | 1,6 (0,0-3,0) | 0,02 |
| Muerte de causa cardiaca | 3,7 (1,0-6,0) | 2,5 (1,0-4,0) | 1,1 (0,0-2,0) | 1,1 (0,0-2,0) | 0,03 |
| Infarto de miocardio | 2,6 (1,0-4,0) | 1,0 (0,0-2,0) | 1,7 (1,0-3,0) | 1,1 (0,0-2,0) | 0,35 |
| Trombosis del stent | 1,5 (0,0-3,0) | 0,6 (0,0-1,0) | 0,3 (0,0-1,0) | 0,2 (0,0-1,0) | 0,12 |
| Muerte por cualquier causa | 12,5 (9,0-16,0) | 6,7 (4,0-9,0) | 5,3 (4,0-7,0) | 3,9 (2,0-6,0) | <0,0001 |
| Revascularización del vaso diana | 11,0 (7,0-15,0) | 5,0 (3,0-7,0) | 4,4 (3,0-6,0) | 8,4 (6,0-11,0) | <0,0001 |
| Hemorragia mayor | 1,1 (0,0-2,0) | 1,3 (0,0-2,0) | 2,8 (2,0-4,0) | 3,6 (2,0-5,0) | 0,07 |
| Hemorragia menor | 5,9 (3,0-9,0) | 4,0 (2,0-6,0) | 2,8 (2,0-4,0) | 3,2 (2,0-5,0) | 0,14 |
TAPD: tratamiento antiagregante plaquetario doble.
Los valores se presentan en forma de tasa acumulada (intervalo de confianza del 95%). Las tasas acumuladas (intervalos de confianza del 95%) de eventos se basan en las estimaciones de Kaplan-Meier.
El equilibrio de distribución de las puntuaciones de propensión según la duración del TAPD antes y después de aplicar la ponderación se muestra en el figura 4 del material adicional. En la figura 4 se muestran los riesgos ajustados de eventos clínicos adversos según las diferentes categorías de duración del TAPD tras la aplicación de una ponderación por puntuación de propensión de tratamiento múltiples. Tomando el grupo de TAPD de 12 a 24 meses como grupo de referencia, los valores de hazard ratio ajustada para los MACE fueron significativamente mayores en el grupo de TAPD de <6 meses y el grupo de TAPD de 6 a 12 meses en comparación con el grupo de TAPD de 12 a 24 meses (HR, 4,51; IC95%, 2,96-6,88 y HR 1,92; IC95%, 1,23-3,00). Los eventos de hemorragia mayor tendieron a ser más probables en el grupo de ≥ 24 meses en comparación con los grupos de menor duración del TAPD. El análisis multivariante reveló que la diabetes mellitus y la enfermedad renal crónica eran factores predictivos independientes para los MACE (tabla 1 del material adicional).
DISCUSIÓNEn este análisis agrupado a nivel de pacientes individuales basado en 2 registros de la práctica clínica real contemporáneos y de gran tamaño, la duración del TAPD fue sumamente variable. Aunque la duración del TAPD debe interpretarse en el contexto de la situación clínica de cada paciente, el empleo de <12 meses de TAPD se asoció a una mayor incidencia de MACE.
Las lesiones del TCI constituyen uno de los subgrupos anatómicos más complejos en las situaciones clínicas que se dan en la práctica clínica real. Estudios clínicos recientes han sugerido que la ICP con SFA de segunda generación para la afectación del TCI proporciona resultados de la intervención y resultados clínicos a largo plazo favorables2,3. Sin embargo, ha habido pocos estudios sobre la duración prolongada del TAPD y sobre el efecto del TAPD en la práctica clínica actual de la ICP con SFA de segunda generación para el tratamiento de la afectación del TCI. En un estudio reciente, el uso del TAPD durante> 12 meses tras una intervención índice se asoció a una reducción del riesgo de eventos isquémicos en los pacientes en los que se implantaron stents en la bifurcación del TCI, en comparación con lo observado con un TAPD de ≤ 12 meses12. Sin embargo, este estudio podría haberse visto afectado negativamente por el uso de SFA de primera generación, la exclusión de las lesiones del ostium y del eje del TCI, y la falta de evaluación de los eventos hemorrágicos. Además, dado que se excluyeron los eventos que se produjeron en un plazo de 12 meses, no fue posible evaluar la relación exacta entre la duración menor o mayor del TAPD y los eventos clínicos. En cambio, en el informe del reciente ensayo EXCEL, no se observó que la continuación del TAPD más allá de 12 meses se asociara a una reducción del riesgo de eventos isquémicos (muerte, infarto de miocardio o ictus) después de una ICP con stents liberadores de everolimus en pacientes con afectación del TCI13. Sin embargo, ese estudio fue un análisis de subgrupos, que incluyó un número relativamente limitado de pacientes y nuevamente, no hubo una evaluación de los eventos hemorrágicos. En el presente estudio, investigamos los resultados clínicos, incluidos los eventos isquémicos y hemorrágicos, según las diferentes duraciones del TAPD en los pacientes tratados con una ICP con un SFA de segunda generación contemporáneo para una afectación del TCI, utilizando los datos de grandes registros de la práctica clínica real. Después de la ICP, el TAPD se mantuvo en la mayor parte de los pacientes (84,8%) durante un mínimo de 6 meses, según lo indicado por las guías actuales. Después de la ponderación mediante puntuación de propensión para múltiples tratamientos, y tomando el grupo de TAPD de 12 a 24 meses como grupo de referencia, el empleo de TAPD durante <12 meses mostró una asociación significativa con un mayor riesgo de MACE, sin que se apreciara un beneficio clínico ni una reducción de los eventos de hemorragia mayor.
Recientemente, varios ensayos clínicos aleatorizados han descrito el posible beneficio de una reducción de la duración del TAPD en pacientes tratados con SFA de segunda generación contemporáneos14,15. La mayor parte de los estudios han mostrado que el tratamiento antiagregante plaquetario en monoterapia se asoció a una menor incidencia de hemorragias clínicamente trascendentes, en comparación con el TAPD, pero con un mayor riesgo de eventos isquémicos. Sin embargo, los resultados observados en varios estudios respecto a la reducción de la duración del TAPD en grupo de ICP complejas, fueron contradictorios y el número de pacientes con afectación del TCI fue demasiado bajo para poder aportar una perspectiva interpretable clínicamente. En el análisis de subgrupos del registro RAIN, la incidencia de MACE fue significativamente mayor en el grupo de TAPD de ≤ 3 meses en comparación con los grupos de TAPD de 3 a 12 y de> 12 meses, y ello se debió principalmente a las diferencias en los infartos de miocardio y la trombosis de stent16. Teóricamente, a pesar del uso de SFA de segunda generación, la ICP para una afectación del TCI es más probable que presente una mala aposición del stent debido a su mayor diámetro y a la bifurcación, en comparación con lo que se observa en lesiones que no afectan al TCI, lo cual podría comportar una cobertura de pilares insuficiente y un posible riesgo de formación de un trombo. En estudios previos, en especial en pacientes con una estrategia de uso de 2 stents, que implica una alta probabilidad de mala aposición e infraexpansión del stent, los eventos isquémicos mortales aumentaron sustancialmente al suspender el TAPD17. En nuestro estudio se observó una asociación similar entre un TAPD de menor duración y una mayor frecuencia de eventos isquémicos, lo cual podría tener una importancia clínica capital por lo que respecta a la duración óptima del TAPD en los pacientes con una ICP compleja para una afectación del TCI. En el ensayo IDEAL-LM, la ICP con el SFA de platino-cromo con recubrimiento de polímero biodegradable seguido de 4 meses de TAPD fue no inferior al uso del SFA de cobalto-cromo de polímero persistente seguido de 12 meses de TAPD por lo que respecta a los MACE a los 2 años. Sin embargo, dado que las tasas de eventos fueron inferiores a las predichas, el ensayo tiene un poder estadístico insuficiente, y cada uno de los diversos componentes de los MACE tendió a ser numéricamente superior con el SFA de polímero biodegradable con 4 meses de TAPD18.
Se han presentado varios sistemas de puntuación (por ejemplo, puntuación DAPT, puntuación PRECISE-DAPT) y se han diseñado estudios de valoración para determinar la duración óptima del TAPD19,20. En un estudio previo, el TAPD de> 12 meses se asoció a una tasa de MACE inferior a la del TAPD de ≤ 12 meses en una población con una puntuación DAPT ≥ 2, pero no así en una población con una puntuación DAPT <212. La eficacia y la seguridad de una duración corta del TAPD tras una ICP por una afectación del TCI requieren mayor investigación y los estudios futuros deberán centrarse en el riesgo de eventos isquémicos y hemorrágicos de cada paciente individual.
LimitacionesNuestro estudio tiene varias limitaciones. En primer lugar, aunque se llevó a cabo un análisis del tratamiento mediante puntuación de propensión múltiple, este estudio fue de tipo observacional y no aleatorizado; por consiguiente, podría verse afectado por las limitaciones inherentes a ello, incluido el sesgo de selección y los factores de confusión no medidos. Así pues, los resultados globales observados deben interpretarse tan solo como provisionales y generadores de hipótesis. Estos resultados deberán confirmarse o refutarse mediante ensayos clínicos aleatorizados grandes. En segundo lugar, dado el número limitado de eventos clínicos, nuestro estudio tuvo un poder estadístico insuficiente para detectar diferencias de trascendencia clínica respecto a los objetivos «duros» como la muerte, la trombosis del stent o la hemorragia mayor. En tercer lugar, no pudimos clasificar los objetivos hemorrágicos aplicando otras clasificaciones como la de la International Society on Thrombosis and Hemostasis (ISTH) o la Bleeding Risk Estimation y la nueva clasificación del Bleeding Academic Research Consortium (BARC) debido a la información limitada disponible en nuestros datos observacionales multicéntricos. En cuarto lugar, no pudimos medir de forma sistemática la información detallada sobre la carga ateroesclerótica y la complejidad, con una puntuación como SYNTAX. En quinto lugar, la población de estudio se incluyó en el estudio a lo largo de un periodo de tiempo amplio (2006-2017). Esto puede haber introducido una cierta heterogeneidad en la población del estudio debido a los cambios en la práctica clínica y las mejoras en la tecnología de la ICP. En sexto lugar, no incluimos datos sobre los fármacos anticoagulantes orales utilizados. Por último, en el presente estudio, los inhibidores de P2Y12 potentes, como prasugrel y ticagrelor, se usaron de manera menos frecuente. En un reciente estudio se ha observado que la monoterapia con los nuevos inhibidores de P2Y12 redujo los eventos hemorrágicos mayores sin aumentar los eventos isquémicos en pacientes con una ICP compleja21. Este concepto deberá evaluarse con mayor detalle en los pacientes con una ICP compleja, incluida la afectación del TCI.
CONCLUSIONESEn este análisis combinado de datos a nivel de pacientes individuales de 2 grandes registros de la práctica clínica real, aunque la duración del TAPD debía considerarse en el contexto de la situación clínica de cada paciente, un TAPD durante <12 meses mostró una asociación significativa con un mayor riesgo de MACE en los pacientes a los que se practicó una ICP con un SFA de segunda generación por una afectación del TCI. Serán necesarios futuros ensayos clínicos aleatorizados para determinar la duración óptima del TAPD en los pacientes tratados con una ICP compleja, incluida la afectación del TCI.
FINANCIACIÓNEste trabajo contó con el apoyo de la CardioVascular Research Foundation, Seúl, República de Corea (2015-09) y del Korea Health Technology R&D Project a través del Korea Health Industry Development Institute (KHIDI), financiado por el Ministerio de Salud y Bienestar (HI20C1566), el Ministerio de Ciencia y TIC (2017M3A9E9073585) y el Cardiovascular Research Center (Seúl, República de Corea).
CONTRIBUCIÓN DE LOS AUTORESS. Cho, D.Y. Kang, J.S. Kim y D.W. Park diseñaron el estudio; T.S. Kang, J.M. Ahn, P.H. Lee, S.J. Kim, S.W. Lee, Y.H. Kim, C.W. Lee, S.W. Park, S.J. Lee, S.J. Hong, C.M. Ahn, B.K. Kim, Y.G. Ko, D. Choi, Y. Jang, M.K. Hong y S.J. Park participaron en la obtención e interpretación de los datos; S. Cho e I.S. Kim realizaron los análisis estadísticos; S. Cho, D.Y. Kang, J.S.Kim, D.W. Park y C.M. Ahn participaron en la elaboración de la discusión; S. Cho y J.S. Kim elaboraron la versión inicial del manuscrito; S. Cho, J.S. Kim y D.W. Park revisaron el manuscrito. Todos los autores leyeron y aprobaron el manuscrito final.
CONFLICTO DE INTERESESNinguno.
- –
Aunque algunos estudios previos han sugerido que una duración prolongada del TAPD podría asociarse a un mejor resultado clínico en los pacientes a los que se practica una ICP compleja, la proporción de casos ICP-TCI fue limitada y la mayor parte de los estudios han utilizado SFA de primera generación.
- –
En este análisis agrupado de los datos a nivel de pacientes individuales de 2 grandes registros contemporáneos de la práctica clínica real, observamos que la duración del TAPD fue sumamente variable. Aunque la duración del TAPD debe interpretarse en el contexto de la situación clínica de cada paciente, el empleo de <12 meses de TAPD se asoció a una mayor incidencia de MACE.
- –
Serán necesarios nuevos ensayos clínicos aleatorizados para determinar la duración óptima del TAPD en pacientes a los que se practica una ICP por una afectación del TCI.