HeartLogic es un algoritmo multiparamétrico incorporado a desfibriladores automáticos implantables (DAI). La alerta asociada predice descompensaciones de insuficiencia cardiaca (IC). Nuestro objetivo es analizar la asociación entre alertas y eventos clínicos bajo un protocolo de seguimiento común en un registro multicéntrico.
MétodosSe evaluaron la fase 1 (investigadores ciegos al estado de la alerta) y las fases 2 y 3 (tras la activación de HeartLogic, según práctica local y un protocolo común respectivamente).
ResultadosSe incluyó a 288 pacientes en 15 centros. En fase 1, tras una media de observación de 10 meses, hubo 73 alertas (0,72 alertas/paciente-año), con 8 hospitalizaciones y 2 visitas a urgencias por IC (0,10 eventos/año-paciente). No hubo hospitalizaciones fuera del periodo de alerta. Las fases activas tuvieron una media de seguimiento de 16 (IC95%, 15-22) meses, con 277 alertas (0,89 alertas/año-paciente); 33 se asociaron con hospitalizaciones o muerte por IC, 46 con descompensaciones menores y 78 con otros eventos. La tasa de alertas inexplicables fue 0,39/año-paciente. Fuera del estado de alerta solo hubo una hospitalización y una descompensación menor. La mayoría de las alertas (el 82% en fase 2 y el 81% en fase 3; p=0,861) se gestionaron a distancia. La mediana de NT-proBNP fue superior en estado de alerta que fuera de él (7.378 frente a 1.210 pg/ml; p <0,001).
ConclusionesEl índice HeartLogic se asoció con descompensaciones de IC y otros eventos relevantes, con baja tasa de alertas inexplicables. Un protocolo estandarizado permitió detectar y actuar a distancia con seguridad sobre las alertas.
Palabras clave
Vídeo del artículo
La insuficiencia cardiaca (IC) supone un desafío sociosanitario por su gran prevalencia, su gravedad clínica y sus costes asociados1–5. La mayoría de los pacientes sufren descompensaciones que en muchas ocasiones causan hospitalizaciones6. Estos episodios, además de que producen el mayor coste relacionado con la enfermedad, tienen un impacto negativo en la calidad de vida y el pronóstico de los pacientes7. Es preciso desarrollar estrategias encaminadas a evitar descompensaciones o a la identificación que permita una intervención temprana y se evite la hospitalización.
Los datos que indican una descompensación que el paciente puede reconocer, como la ganancia ponderal o los edemas, se presentan con escaso margen temporal previo a la necesidad de hospitalización urgente, lo que limita su utilidad para intervenir y evitar el ingreso8. Por ello, se han desarrollado dispositivos para facilitar la detección temprana de la descompensación mediante la identificación de cambios fisiopatológicos que anteceden en semanas a la hospitalización, como son el incremento de las presiones de llenado ventricular, el aumento del tono simpático o el descenso en la impedancia torácica8.
HeartLogic es un algoritmo incorporado a algunos desfibriladores automáticos implantables (DAI) simples o con terapia de resincronización cardiaca (TRC) de Boston Scientific (St. Paul, Estados Unidos) que mide y combina en un valor numérico único (índice HeartLogic) 5 parámetros (sonidos cardiacos, impedancia torácica, volumen y frecuencia respiratorios, actividad física y frecuencia cardiaca nocturna), cuya información puede visualizarse a través de la plataforma LATITUDE de monitorización a distancia. En el estudio MultiSENSE se validó para el diagnóstico precoz de descompensación de IC9. Sin embargo, la experiencia en vida real con este instrumento es escasa10–12, por lo que se diseñó el estudio RE-HEART para aportar información sobre la utilidad clínica de HeartLogic.
MÉTODOSRE-HEART es un registro multicéntrico observacional, prospectivo y retrospectivo aprobado por el Comité de Ética de la Investigación con medicamentos (CEIm) del Hospital Universitario 12 de Octubre con número 19/327.
Población del estudioSe incluye a todos los pacientes mayores de 18 años portadores de DAI o DAI-TRC con HeartLogic implementado y capacidad de monitorización a distancia a través de la plataforma LATITUDE, historia de IC con fracción de eyección del ventrículo izquierdo reducida (≤ 35%) en el momento del implante y capaces de acudir a consulta externa o aportar la información requerida en caso de ser atendidos en otro centro, con pronóstico de vida superior a 1 año y previa firma del consentimiento informado.
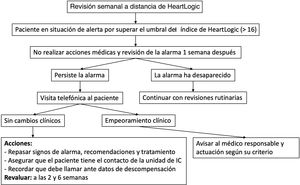
Fases del estudioEn septiembre de 2019 se inició el seguimiento prospectivo de 1 año (fase 3), incluyendo tanto a los pacientes que ya tenían dispositivo como a los nuevos implantes. Durante este periodo se añadieron nuevos pacientes de los centros y no se requirió un tiempo mínimo de seguimiento. El protocolo de seguimiento estandarizado empleado por todos los centros, que puede cumplir enfermería, se muestra en la figura 1 y la .
Dado que la plataforma LATITUDE permite la revisión del registro histórico de valores del índice HeartLogic del año previo, además se realizó un análisis retrospectivo, que para cada paciente y/o centro podría aplicar a 2 situaciones: a) un periodo (fase 1) en que el paciente tenía implantado el dispositivo, pero el centro no disponía de acceso a la plataforma para visualizar el índice HeartLogic, en cuyo caso los investigadores no podían actuar en función del índice HeartLogic, dado que eran ciegos a él, pero sí pudieron revisar sus valores a posteriori, y b) un periodo (fase 2) en que el centro tenía activada la plataforma para visualizar el índice HeartLogic y actuaba según su protocolo local.
EventosPara definir los eventos de interés, se empleó el mismo criterio que en el estudio MultiSENSE9. Así, las descompensaciones de IC se clasificaron como:
- •
Mayores: hospitalización por IC, visita imprevista que requiere tratamiento endovenoso o muerte por IC.
- •
Menores: datos clínicos de empeoramiento agudo de la enfermedad que a criterio del investigador requiriese ajuste de tratamiento para la IC.
Las alertas de HeartLogic se clasificaron como:
- •
Verdaderas: cuando el inicio de la alerta (el momento de traspasar el umbral preestablecido de índice HeartLogic de 16) se produjera antes de la descompensación de IC. En caso de que la alerta hubiera finalizado antes de la descompensación, el intervalo entre ambos debía ser <30 días.
- •
Justificadas: cuando se identificaran condiciones clínicas relevantes (transgresión dietética o medicamentosa, descenso en el porcentaje de resincronización, entrada en fibrilación auricular, anemia, infección…) que podrían producir una descompensación de IC, pero sin datos de esta en el momento de la valoración. La entrada en el periodo de alarma del índice HeartLogic puede ser anterior o posterior a la causa identificada, y se estableció un amplitud de±30 días.
- •
Inexplicadas: cuando no se cumpliera ninguno de los criterios enumerados.
También se registraron los eventos de IC no asociados con alerta en el índice HeartLogic (falsos negativos).
Además, para comparar la precisión diagnóstica de la fracción aminoterminal del propéptido natriurético cerebral (tipo B) (NT-proBNP) y del índice HeartLogic para confirmar o descartar una descompensación de IC, se realizó una determinación de NT-proBNP en situación basal y en caso de descompensación.
Análisis estadísticoLas variables continuas con distribución normal se muestran como media±desviación estándar o como mediana [intervalo intercuartílico] en caso de distribución no normal. La normalidad de la distribución se probó mediante la prueba de Kolmogorov-Smirnov. Las variables categóricas se expresan como porcentajes.
Las diferencias en las proporciones se compararon mediante la prueba de la χ2. Todos los análisis estadísticos se realizaron con el programa R, versión 4.0.2 (The R Foundation for Statistical Computing Platform, Austria).
RESULTADOSSe incluyó a 288 pacientes de 15 centros españoles entre septiembre de 2019 y septiembre de 2020 (véase la lista completa de los hospitales participantes en el material adicional). Las características basales de los pacientes se muestran en la tabla 1.
Características basales de los pacientes
| Pacientes, n | 288 |
| Varones | 222 (77) |
| Edad (años) | 68±10 |
| Nivel educativo | |
| Sin escolarizar | 25 (9) |
| Educación básica | 144 (50) |
| Bachillerato o formación profesional | 91 (32) |
| Universitario | 28 (10) |
| Convivencia | |
| Familia | 260 (90) |
| Residencia | 1 (1) |
| Solo | 25 (9) |
| Vivienda compartida | 1 (1) |
| Cuidador dedicado | 66 (23) |
| Índice de masa corporal | 28±4 |
| Cardiopatía isquémica como causa de disfunción del VI | 151 (52) |
| Clase funcional de la NYHA | |
| I | 47 (16) |
| II | 166 (58) |
| III | 75 (26) |
| FEVI <35% | 217 (75) |
| Comorbilidades | |
| Antecedente de fibrilación auricular | 112 (39) |
| Fibrilación auricular en el implante | 66 (23) |
| HTA | 214 (74) |
| Diabetes | 116 (40) |
| Dislipemia | 169 (59) |
| Consumo de tabaco | 175 (64) |
| Fumadores | 31 (11) |
| Exfumadores | 144 (53) |
| EPOC | 48 (17) |
| Enfermedad renal crónica | 77 (27) |
| En hemodiálisis | 5 (2) |
| Ictus previo | 31 (11) |
| SAHS | 33 (11) |
| Tratamiento médico | |
| Bloqueadores beta | 274 (95) |
| IECA, ARA-II o sacubitrilo-valsartán | 265 (92) |
| Sacubitrilo-valsartán | 145 (50) |
| ARM | 215 (75) |
| Diuréticos | 207 (72) |
| Amiodarona | 64 (22) |
| Ivabradina | 35 (12) |
| Datos analíticos | |
| NT-proBNP (pg/ml) | 1.234 [626-2.425] |
| Creatinina (mg/dl) | 1,27±0,82 |
| Tasa de filtrado glomerular (ml/min) | 63±22 |
| Dispositivos implantados | |
| DAI-TRC | 234 (81) |
| DAI en prevención primaria | 241 (84) |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralocorticoides; DAI: desfibrilador automático implantable; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HTA: hipertensión arterial; IECA: inhibidores de la enzima de conversión de la angiotensina; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral (tipo B); NYHA: New York Heart Association; SAHS: síndrome de apneas-hipopneas del sueño; TRC: terapia de resincronización cardiaca; VI: ventrículo izquierdo.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
A la fase 1 contribuyeron 101 pacientes, con una media de observación de 10 (intervalo de confianza del 95% [IC95%], 5-19) meses; 94 formaron parte de la fase 2, con una media de seguimiento de 7 (IC95%, 3-10) meses, y 267 pacientes integraron la fase 3, con una media de seguimiento de 13 (IC95%, 11-13) meses. La mediana de seguimiento de la combinación de las 2 fases activas (fases 2 y 3) fue de 16 (IC95%, 15-22) meses.
Fase ciega del estudio (fase 1)El índice HeartLogic cruzó el valor umbral 73 veces en 39 pacientes (0,72 alertas/año-paciente). El tiempo en alerta fue el 8% del periodo de observación. Durante esta fase, 9 pacientes experimentaron 8 hospitalizaciones y 2 estancias en urgencias por IC (0,10 eventos/año-paciente).
Estos eventos se asociaron con el estado de alerta en HeartLogic, con una tasa de eventos en estado de alerta de 1,23/año-paciente. Otros eventos asociados con las alertas fueron 3 visitas no planificadas a consulta por IC descompensada y 7 hospitalizaciones por motivo diferente de la IC. En las 53 alertas restantes, no se detectaron eventos clínicos relacionados, por lo que podrían considerarse inexplicables (0,52 alertas/año-paciente). Sin embargo, no se produjeron hospitalizaciones por IC fuera del estado de alerta de HeartLogic.
Eventos detectados durante las fases activas del estudio (fases 2 y 3)Durante estas 2 fases (figura 2) analizadas conjuntamente, se notificaron 277 alertas de HeartLogic en 136 pacientes (0,89 alertas/año-paciente). El tiempo en estado de alerta fue el 11% del periodo de observación. Se asociaron con hospitalizaciones 33 alertas de HeartLogic (27 por IC y 6 muertes por IC) y con visitas no planificadas (presenciales o telefónicas) por descompensación de IC, 46; así, fueron 79 alertas verdaderas. Hubo 0,11 eventos mayores de IC/año-paciente. La media de tiempo desde la entrada en alerta hasta la hospitalización por IC fue de 20±15 días.
Alertas y eventos detectados durante las fases activas del estudio (fases 2 y 3). Las alertas inexplicables fueron las que no se pudo relacionar con un evento clínico relevante. Las alertas justificadas fueron las relacionadas con eventos clínicos de interés como, por ejemplo, las transgresiones dietéticas/medicamentosas o los cambios en el estilo de vida, pero sin datos claros de IC en ese momento. IC: insuficiencia cardiaca; FV: fibrilación ventricular; TV: taquicardia ventricular.
Se registraron 78 alertas justificadas asociadas con otros eventos, mientras que no se halló explicación para 120 alertas (0,39 alertas/año-paciente).
Fuera del periodo de alerta solo se produjo 1 hospitalización por IC y 1 visita no planificada a consulta por IC descompensada.
La tabla 2 muestra los índices diagnósticos de HeartLogic en ambos periodos.
Valores de los índices diagnósticos de HeartLogic en las distintas fases del estudio
| Fase 1 (ciega) | Fases 2-3 (activas) | |
|---|---|---|
| Sensibilidad | 100% | 98% |
| Especificidada | 93% | 90% |
| Valor predictivo positivob | 18% | 29% |
| Valor predictivo positivoc | 27% | 57% |
| Valor predictivo negativod | 100% | 99,9% |
| Tasa de alertas inexplicadas | 0,52 alertas/año-paciente | 0,39 alertas/año-paciente |
| Tasa de alertas falsas positivase | 0,59 alertas/año-paciente | 0,64 alertas/año-paciente |
IC: insuficiencia cardiaca.
Según la definición del estudio MultiSENSE9: verdaderos negativos / (verdaderos negativos+falsos positivos) durante periodos sin insuficiencia cardiaca (excluyendo los periodos desde 30 días antes hasta 15 días después de un evento de IC). Los días se clasificaron individualmente como verdaderos negativos si el índice de HeartLogic no estaba en estado de alerta y como falsos positivos si estaba en estado de alerta.
Según la definición del estudio MultiSENSE9: verdaderos negativos / (verdaderos negativos + falsos negativos).
De las 44 alertas de HeartLogic notificadas en 32 pacientes durante la fase 2, se realizó una consulta (telefónica o presencial) a 32 (73%). Durante la fase 3 esto ocurrió con más frecuencia, en 198 de las 233 alertas (85%; p=0,047) acontecidas en 130 pacientes.
Las alertas provocaron actuaciones médicas (ajustes de tratamiento o intervenciones educativas) en el 27% de los casos durante la fase 2 y en el 39% durante la fase 3 (p=0,138).
Hubo 4 hospitalizaciones por IC (0,07 eventos/paciente-año) en la fase 2 y 23 (0,09 eventos/paciente-año) en la fase 3 (p=0,724).
De las 44 alertas en fase 2, 36 (82%) no requirieron visitas presenciales en consulta y pudieron gestionarse a distancia. Durante la fase 3, las visitas a distancia fueron 188 (81%) de 233 alertas (p=0,861). El número total de contactos telefónicos con pacientes durante la fase 2 fue 35 (0,65 contactos/paciente-año) y durante la fase 3, 287 (1,12 contactos/paciente-año; p=0,002).
La carga de trabajo estimada para la revisión de las alertas HeartLogic y la gestión de estas (tabla 3), una vez entrenado el personal responsable, fue de 1 h semanal para un seguimiento de 30 pacientes en el centro.
Gestión de las alertas durante las fases activas y eventos relacionados
| Fase 2 (7 meses) | Fase 3 (13 meses) | p | |
|---|---|---|---|
| Alertas, total (alertas/paciente-año) | 44 (0,81) | 233 (0,91) | 0,509 |
| Gestión de las alertas a distancia | 36 (82%) | 188 (81%) | 0,861 |
| Número de contactos telefónicos por paciente al año | 0,65 | 1,12 | 0,002 |
| Alertas sobre las que se actuó | 12 (27%) | 91 (39%) | 0,138 |
| Acciones realizadas | |||
| Ajuste de diuréticos u otros fármacos | 11 (92%) | 75 (82%) | 0,685 |
| Cambios en programación dispositivos | 1 (8%) | 13 (14%) | 1,000 |
| Refuerzo de formación del paciente sobre IC | 1 (8%) | 6 (7%) | 0,591 |
| Remisión al hospital por causa diferente de la IC | 2 (25%) | 10 (11%) | 0,629 |
| Cardioversión | - | 4 (4%) | 1,000 |
| CPAP | - | 2 (2%) | 1,000 |
| Ablación del NAV | - | 1 (1%) | 1,000 |
| Eventos | |||
| Descompensación menor de IC | 7 | 39 | |
| Hospitalización por IC | 4 | 23 | |
| Muerte por IC | - | 6 | |
| Hospitalización por otras causas | 3 | 7 | |
| Muerte por otras causas | 1 | 3 | |
CPAP: continuous positive airway pressure; IC: insuficiencia cardiaca; NAV: nódulo auriculoventricular.
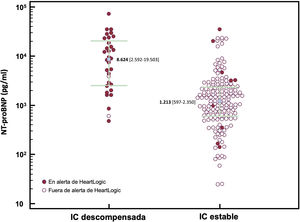
Se realizaron 194 determinaciones plasmáticas de NT-proBNP, 32 de ellas en contexto de descompensación de IC (figura 3).
Gráfico de dispersión de NT-proBNP y alertas de HeartLogic. El 94% de las descompensaciones de IC se asociaron con un índice de HeartLogic elevado, mientras que solo el 6% de los pacientes estables se encontraban en periodo de alerta (p <0,001; especificidad, 94%). La mediana de NT-proBNP en situación de alerta del índice HeartLogic fue mayor que cuando el paciente se encontraba fuera de esa situación (7.378 frente a 1.210 pg/ml; p <0,001). La mediana de NT-proBNP durante las descompensaciones fue mayor que en fase estable (8.624 frente a 1.213 pg/ml; p <0,001). IC: insuficiencia cardiaca; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral (tipo B).
La mediana de NT-proBNP fue 8.624 [2.592-19.503] pg/ml en el momento de la descompensación y 1.213 [597-2.350] pg/ml (p <0,001) en situación estable.
Las determinaciones de NT-proBNP realizadas con el índice HeartLogic en estado de alerta fueron 39. Las medianas de NT-proBNP en alerta y fuera de esta fueron 7.378 [2.214-19.377] y 1.210 [599-2.276] pg/ml (p <0,001).
DISCUSIÓNLos principales hallazgos de este estudio son la capacidad de HeartLogic para identificar a distancia eventos de IC y otras situaciones clínicas en un entorno de práctica clínica real.
En la fase 1, la tasa de eventos durante el estado de alerta fue 12 veces superior al observado durante todo ese periodo (0,10 frente a 1,23 eventos/año-paciente), lo cual identifica una mayor vulnerabilidad a las descompensaciones en esta etapa. Durante las fases 2-3, más de la mitad de las alertas estuvieron relacionadas con descompensación de IC o tenían justificación. La baja tasa de eventos de IC está en consonancia con otros estudios9,11,12 y puede explicarse por el alto porcentaje de tratamientos pronósticos y dispositivos en nuestra población.
Por otra parte, la tasa de alertas inexplicadas en fase 1 fue de 0,52/año-paciente y en las fases prospectivas fue 0,39, menor que la reportada en el estudio MultiSENSE (1,47). Esto puede explicarse en parte porque nuestro estudio incluye eventos menores de descompensación de IC y otros eventos clínicos relevantes. Se decidió incluir en el análisis las descompensaciones menores, con tratamiento ambulatorio, dado que es una práctica frecuente en nuestro medio, muchas veces apoyada por el hospital de día. A su vez, es relevante la capacidad de HeartLogic para identificar otras situaciones clínicas, como transgresiones medicamentosas o dietéticas, infecciones respiratorias o la entrada en fibrilación auricular, dado que son condiciones que pueden descompensar la IC y requieren intervención y vigilancia estrecha hasta su resolución.
En consonancia con otros estudios de seguimiento a distancia, el ajuste del tratamiento diurético fue la acción clínica más frecuente. No obstante, la posibilidad de revisar en la plataforma LATITUDE el funcionamiento global del dispositivo y los eventos arrítmicos permitió realizar otras intervenciones, como modificaciones en la programación, cardioversión de arritmias auriculares o la ablación del nódulo auriculoventricular.
Cabe destacar los altos valores de sensibilidad y valor predictivo negativo, que reflejan la baja probabilidad de descompensación de IC fuera del periodo de alerta. En nuestro estudio, fuera del estado de alerta no hubo hospitalizaciones en la fase 1 y solo se produjeron 1 hospitalización y 1 consulta por IC descompensada en la fase activa. Igualmente, la especificidad en ambos periodos fue elevada. Sin embargo, el valor predictivo positivo fue menor, en parte influido por una baja tasa de eventos de IC.
Estos datos apoyan que HeartLogic es útil para la monitorización a distancia de los pacientes con IC, especialmente en situaciones como la generada por la pandemia de COVID-19, tanto por su capacidad para detectar precozmente la descompensación como para determinar la estabilidad del paciente fuera de los periodos de alerta, lo que permitiría espaciar revisiones, evitar contactos innecesarios con el hospital y limitar los costes mientras el paciente esté fuera de alerta, dada su baja probabilidad de eventos. Otro dato de interés derivado de nuestro estudio es que se pudo gestionar por teléfono más del 80% de las alertas.
Los 15 centros participantes representan un amplio espectro del territorio nacional. A la luz de estos datos, las unidades que decidan emplear el índice HeartLogic en la gestión de sus pacientes podrían valorar el empleo del algoritmo de tratamiento utilizado en RE-HEART, dado que el presente estudio supone una validación clínica en vida real con las tasas de utilidad reportadas.
La posibilidad de revisar el valor del índice HeartLogic hasta 1 año antes permitió estudiar su relación con descompensaciones de IC en un escenario único, en el que el personal clínico era ciego a la herramienta y por ello no podía actuar en consecuencia (fase 1). Tras la «apertura» de HeartLogic, se diferenciaron una fase en que el centro actuó según el protocolo local (fase 2) y otra con el protocolo común (fase 3) durante 1 año.
En el estudio MultiSENSE el tiempo medio desde la entrada en alerta HeartLogic hasta el evento de IC fue de 34 días (en nuestro estudio, 20±15 días), por lo que se consideró prudente establecer una revisión semanal del índice HeartLogic. Esto supuso una carga de trabajo razonable, que se estima en 1 h semanal para un volumen de 30 pacientes en seguimiento, y aunque en la fase 3 provocó un número de llamadas mayor que en la fase 2, resultó en poco más de 1 llamada anual por paciente. Además, en nuestro estudio el tiempo en estado de alerta fue solo del 8% en fase 1 y del 11% en fases 2-3, menor que el 17% descrito en el estudio MultiSENSE.
La posibilidad de predecir una descompensación de IC, o detectarla precozmente para intervenir y evitar una hospitalización resulta atractiva. Es lógico pensar que los avances tecnológicos pueden ayudar al tratamiento de los pacientes que padecen IC. Las experiencias iniciales con sensores incluidos en los DAI para identificar signos tempranos de descompensación fueron desalentadoras por su baja sensibilidad (20-34%)13–17. Sin embargo, una evaluación multiparamétrica podría mejorar el rendimiento de los sistemas de detección de descompensación.
El estudio MultiSENSE validó el algoritmo HeartLogic, que incorpora diferentes variables detectadas por el DAI (con o sin TRC) con una sensibilidad del 70%, una tasa de alertas inexplicadas aceptable (1,47 por paciente y año) y un valor predictivo negativo cercano al 100%. Entre las ventajas de HeartLogic, se encuentran que no precisa el implante de un nuevo dispositivo (lo que elimina los riesgos y los costes asociados), no requiere colaboración ni formación del paciente y su carácter multiparamétrico «alimentado» de 5 variables relacionadas con la IC que, aportan información continua y adaptada individualmente9. Datos recientes apuntan a que el uso de HeartLogic puede disminuir las hospitalizaciones por IC y ahorrar costes relacionados con la enfermedad12.
Por último, aunque se ha reportado que el riesgo de descompensación es mayor en los pacientes en estado de alerta y con valores basales de NT-proBNP> 1.000 pg/ml18, este es el primer trabajo en indicar que los valores de NT-proBNP pueden ser significativamente superiores en alerta de HeartLogic que fuera de la alerta, lo cual respaldaría que este sea un periodo de mayor riesgo de descompensación.
LimitacionesEl presente trabajo tiene las limitaciones propias de un estudio observacional. Además, el carácter retrospectivo de las fases 1 y 2 supone que puede haberse infradetectado eventos menores de descompensación de la IC, aunque esto reforzaría los resultados globales alcanzados.
No se puede excluir que durante la fase activa, en algunos casos, la llamada del equipo asistencial al detectarse la entrada en periodo de alerta haya sugestionado sobre el evento asociado. Sin embargo, se procuró adjudicar dichos eventos cuando las pruebas objetivas concordaban, y para el caso de la descompensación de IC solo si fue necesario modificar el tratamiento. También es posible que se haya generado una sobreactuación en relación con la alerta en este periodo. Asimismo, la sensibilidad estimada puede verse disminuida como consecuencia de una actuación temprana que haya evitado un potencial evento de descompensación de IC.
A pesar de que el protocolo del estudio solicitaba a los investigadores medir la NT-proBNP basal y ante descompensaciones, solo se obtuvieron valores de una parte de ellos, por lo que el análisis relacionado debe interpretarse con cautela.
Como es obvio, estos resultados se obtuvieron de pacientes seleccionados que tuvieran implantado un DAI o DAI-TRC con el algoritmo de HeartLogic integrado. No obstante, el alto número de centros y pacientes participantes refleja un amplio espectro de la población con IC en España.
Por último, aunque este estudio refuerza su valor como instrumento útil para la identificación de una descompensación inminente de IC, su impacto pronóstico requiere el análisis de un mayor tamaño muestral y está pendiente de evaluación con los resultados de ensayos clínicos dirigidos.
CONCLUSIONESLa experiencia en práctica clínica real de un amplio grupo de centros españoles con el uso de HeartLogic mostró una buena correlación con eventos de descompensación de IC, congruente con unos valores más elevados de NT-proBNP durante las alertas y otras condiciones clínicas relevantes, con una baja tasa de alertas inexplicadas. Los datos avalan que es muy poco probable que se produzca una descompensación de IC fuera del periodo de alerta.
La gran mayoría de las alertas pudieron resolverse por teléfono y la acción más frecuente fue el ajuste del tratamiento diurético.
- –
HeartLogic es un algoritmo disponible en algunos DAI y DAI-TRC que ayuda a predecir una descompensación de IC con una antelación aproximada de 1 mes. La tasa de alertas inapropiadas reportada es de 1,47 por paciente y año. Los pacientes que están en alerta de HeartLogic con NT-proBNP> 1.000 pg/ml son los que tienen más riesgo de una descompensación de IC.
- –
El registro RE-HEART es un estudio clínico amplio de HeartLogic en la práctica clínica. Muestra la experiencia de 15 centros y 288 pacientes recogida durante 1 año de manera prospectiva con un protocolo común y 1 año retrospectivo. Más de la mitad de las alertas detectadas identificaron una inminente descompensación de IC u otros problemas clínicos relevantes, que pudieron resolverse por teléfono en más del 80%. La tasa de alertas inapropiadas fue baja y la posibilidad de descompensación fuera de alerta, anecdótica. Se describe por primera vez unos valores de NT-proBNP más altos durante la alerta de HeartLogic que fuera de ella.
Ninguna.
CONTRIBUCIÓN DE LOS AUTORESJ. de Juan Bagudá y R. Salguero Bodes diseñaron el estudio, participaron en el análisis de los datos y redactaron el documento original. J.F. Delgado Jiménez colaboró con la redacción final del documento. Todos los autores contribuyeron incluyendo a pacientes en la base de datos y revisaron críticamente y aprobaron el documento final.
CONFLICTO DE INTERESESJ. de Juan Bagudá declara honorarios por labores de consultoría y ponencias de Boston Scientific. R. Cózar León declara honorarios por labores de consultoría de Boston Scientific. F. Arribas Ynsaurriaga declara honorarios por labores de consultoría y ponencias de Boston Scientific, Medtronic y Abbott. R. Salguero Bodes declara honorarios por labores de consultoría de Boston Scientific. El resto de los autores declaran no tener conflictos de intereses.
Los autores agradecen la colaboración de Noelia de la Torre, Carlos Briz, Monica Campari y Sergio Valsecchi en el diseño del estudio, la interpretación de los datos y la revisión crítica del artículo.
Se puede consultar material adicional a este artículo en su versión electrónica disponible en https://doi.org/10.1016/j.recesp.2021.09.008