Evaluar si una puntuación de riesgo genético (GRS) mejora la predicción de eventos recurrentes en pacientes jóvenes con infarto agudo de miocardio (IAM) e identifica una forma de aterosclerosis más agresiva.
MétodosSe diseñó un estudio prospectivo con pacientes <55 años, no diabéticos, ingresados por IAM. Se realizó un test genético, una tomografía computarizada cardiaca y determinación de varios biomarcadores. Se analizó la asociación de un GRS compuesto por 11 variantes genéticas con la aparición de un objetivo primario combinado (muerte cardiovascular, evento recurrente u hospitalización cardiovascular).
ResultadosSe siguió a 81 pacientes durante una mediana de 4,1 años, y se documentaron 24 eventos. La prevalencia de variantes de riesgo fue superior en 9 de los 11 alelos frente a población general. El GRS se asoció con recurrencias, particularmente cuando los niveles basales de colesterol-LDL estaban elevados. En el modelo multivariado, teniendo como referencia el tercil de bajo riesgo genético, el HR para el grupo de riesgo intermedio fue de 10,2 (IC95% 1,1-100,3; p=0,04) y de alto riesgo 20,7 (2,4-181,0; p=0,006) si el colesterol-LDL era≥2,8 mmol/l (≥ 110mg/dl). La incorporación del GRS al modelo multivariado mejoró el estadístico C (ΔC-statistic=0,086), el cNRI (30%) y el IDI (0,05). El TC cardiaco detectó ateromatosis calcificada frecuentemente, pero tuvo un valor pronóstico limitado. No se detectó una asociación entre metaloproteinasas, GRS y recurrencias.
ConclusionesEn una población de pacientes jóvenes no diabéticos con IAM, una puntuación de riesgo genético puede predecir recurrencias y mejorar los modelos clínicos de estratificación pronóstica, especialmente en aquellos pacientes con colesterol-LDL basal elevado.
Palabras clave
La enfermedad coronaria (EC) sigue siendo la primera causa de muerte en el mundo1. La EC tiene una etiología compleja en la que intervienen factores de riesgo ambiental y susceptibilidad genética. Se ha afirmado que la predisposición genética explica de un 40 a un 50% de la variabilidad en la aparición de EC2. Los pacientes jóvenes (menores de 55 años) con infarto agudo de miocardio (IAM) normalmente carecen de la mayoría de los factores de riesgo clínico y hasta el momento del episodio casi siempre se encuentran en una situación de riesgo cardiovascular bajo según las escalas de clasificación clínicas. Los estudios de asociación de genoma completo (genome-wide association studies [GWAS]) han identificado sistemáticamente en la población general más de 57 locus que predisponen a EC/IAM tanto mediada por factores de riesgo cardiovascular como independiente3. La importancia de los mecanismos etiopatogénicos de origen genético de la EC aumenta en los pacientes con eventos clínicos precoces. No obstante, las guías de práctica clínica no incluyen los estudios genéticos para evaluar el riesgo cardiovascular en prevención primaria o secundaria4,5.
La EC no es infrecuente en la población joven y los pacientes de menos de 45 años representan un 10% de los ingresos hospitalarios por IAM6, con una probabilidad significativamente alta de recurrencia de eventos cardiovasculares a lo largo de la vida a pesar del tratamiento7,8.
Los factores de riesgo cardiovascular clásicos son muy importantes como objetivos terapéuticos tras un IAM y también se han utilizado para concebir puntuaciones de predicción del riesgo en futuros eventos coronarios (p. ej., el Global Registry of Acute Coronary Events [GRACE]). No obstante, su capacidad predictiva es pequeña y no tienen en cuenta el riesgo de origen genético9.
La relación entre la estratificación de riesgo genético y la incidencia de EC se ha estudiado de manera prospectiva en la población general, con resultados en general positivos. Los avances en las pruebas genéticas han hecho asequibles estos estudios, aunque la rentabilidad sigue siendo un problema10,11.
Actualmente, hay una necesidad no cubierta de identificar a pacientes con enfermedad cardiovascular establecida en alto riesgo de sufrir eventos cardiovasculares recurrentes y que podrían beneficiarse de una prevención secundaria más intensa. Los pacientes jóvenes con enfermedad cardiovascular emergen como uno de los principales focos de atención, puesto que tienen un pronóstico desfavorable a largo plazo, con una probabilidad alta de futuras recurrencias12. En este contexto, las escalas y puntuaciones de riesgo genético (GRS) compuestas por polimorfismos de un solo nucleótido (SNP) podrían ser útiles para evaluar el riesgo residual a lo largo de la vida.
El objetivo del estudio es determinar si una GRS basada en SNP puede predecir la recurrencia a largo plazo de eventos cardiovasculares tras un IAM en una cohorte de pacientes jóvenes sin diabetes y con una probabilidad elevada de susceptibilidad genética, y en consecuencia mejorar la estratificación del riesgo. También se pretende determinar si una mala puntuación en GRS se asocia con una forma más agresiva de EC con un estudio exhaustivo de la morfología de la placa y el calcio coronario mediante tomografía computarizada (TC), angiografía invasiva y parámetros biohumorales del metabolismo de la matriz extracelular.
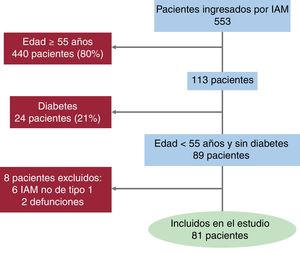
MÉTODOSDiseño del estudioSe llevó a cabo un estudio prospectivo con inclusión consecutiva de pacientes no diabéticos de menos de 55 años, hospitalizados por IAM de tipo 1 en un hospital terciario. Los criterios de inclusión fueron: a) tener entre 18 y 55 años; b) IAM de tipo 1, tanto síndrome coronario agudo (SCA) con elevación del ST como sin elevación, y c) realización de cateterismo. Los criterios de exclusión fueron: a) tener más de 55 años, y b) diabetes documentada o sus criterios diagnósticos según la definición de la Sociedad Europea de Cardiología/European Association for the Study of Diabetes. Se obtuvieron datos clínicos, demográficos, ecocardiográficos y angiográficos completos. En el momento del ingreso se extrajeron muestras de sangre para el estudio genético y el análisis de metaloproteinasas y se almacenaron en el biobanco local. Se realizó una TC cardiaca para analizar la cuantificación de calcio y una angiografía coronaria no invasiva al inicio del seguimiento, salvo contraindicación clínica. El protocolo del estudio fue aprobado por el comité ético (referencia 175/13) y cumple con la Declaración de Helsinki. Todos los participantes proporcionaron su consentimiento informado.
ObjetivosEl objetivo primario del estudio, denominado evento recurrente, se definió como un combinado de mortalidad cardiovascular, SCA u hospitalización cardiovascular. El SCA recurrente incluye el IAM y la angina inestable. Los procedimientos ambulatorios diferidos destinados a la revascularización de lesiones no responsables del evento inicial no se consideraron recurrencias. Todos los resultados fueron revisados por 2 cardiólogos. Se realizó seguimiento clínico cada 6 meses. La definición de cada covariable fue estandarizada para el análisis.
GenotipadoLa extracción de ADN se realizó siguiendo técnicas estándar. El genotipado se llevó a cabo en el laboratorio Gen inCode (Barcelona, España), utilizando matrices Affymetrix Axiom3 diseñadas al efecto. Las matrices de todo el genoma proporcionaron genotipos de gran calidad, con altas tasas de genotipado correcto (100%) y reproducibilidad de SNP (100%). La asignación de genotipo se hizo a partir de matrices utilizando IMPUTE2 v2.2.2 y con 1.000 genomas como matriz de referencia. Las variantes genéticas (tabla 1) se determinaron utilizando una plataforma comercial llamada Cardio inCode Score (Gen inCode, España), que incluye 11 variantes genéticas asociadas con EC, pero no con factores de riesgo clásicos, en función de los datos disponibles en el catálogo de GWAS revisado en agosto de 2010 y descritos en GWAS (rs10455872 en LPA, rs12526453 en PHACTR1, rs1333049 en CDKN2A/B, rs17465637 en MIA3, rs501120 en CXCL12, rs6725887 en WDR12, rs9818870 en MRAS y rs9982601 en SLC5A3/KCNE2) que incluyen también un haplotipo en el gen ALOX5AP (Hap B, compuesto por: rs10507391-A, rs93155050-A y rs17222842-G), el cual se ha visto que está relacionado con la EC en distintas poblaciones13-15. Este haplotipo no se encontró en GWAS porque las variantes genéticas individuales suelen analizarse sin tener en cuenta los haplotipos. La matriz proporcionó una tasa de genotipado correcto del 100%. Se utilizó la prueba exacta para calcular el equilibrio de Hardy-Weinberg en cada una de las variantes teniendo en cuenta un valor de p < 0,05 / 11 para determinar la significación estadística ante comparaciones múltiples16.
Variables genéticas analizadas
| Banda | rsID | Locus del gen | Cromosoma | AR/ASR (FAR) | H-Wp |
|---|---|---|---|---|---|
| 1q41 | rs17465637 | MIA3 | 1 | C/A (0,69) | 0,925 |
| 2q33.2 | rs6725887 | WDR12 | 2 | C/T (0,18) | 1 |
| 3q22.3 | rs9818870 | MRAS | 3 | T/C (0,13) | — |
| 6q25.3 | rs10455872 | SLC22A3-LPAL2-LPA | 6 | G/A (0,11) | 0,072 |
| 6p24.1 | rs12526453 | PHACTR1 | 6 | C/G (0,66) | 0,674 |
| 9p21.3 | rs1333049 | CDKN2B-AS1 | 9 | C/G (0,39) | 0,512 |
| 10q11.21 | rs501120 | CXCL12 | 10 | T/C (0,84) | 0,037 |
| 21q22.11 | rs9982601 | KCNE2-SCL5A3 | 21 | T/C (0,13) | — |
| 13q12.3 | rs10507391 | ALOX5AP (haplotipo) | 13 | A/T (0,36) | 0,589 |
| rs17222842 | ALOX5AP (haplotipo) | 13 | G/A (0,92) | 0,822 | |
| rs9315050 | ALOX5AP (haplotipo) | 13 | G/A (0,07) | 0,616 |
AR: alelo con riesgo; ASR: alelo sin riesgo; FAR: frecuencia alelos con riesgo; H-W: equilibrio de Hardy-Weinberg.
p < 0,0045, significación estadística.
Se calculó una GRS utilizando la siguiente fórmula: GRS =∑i=1nSNPi donde se incluyó la suma del número de alelos de riesgo descritos en la tabla 1 (con los valores 0, 1 o 2) en todas las variantes genéticas (n). Para el análisis, se dividió a los pacientes en terciles en función de su GRS.
Tomografía computarizada cardiacaSe realizó a todos los participantes una TC después de la revascularización miocárdica y antes del alta hospitalaria, excepto contraindicación clínica. Se realizó la cuantificación de calcio de las arterias coronarias (CAC) y una angiografía coronaria no invasiva utilizando una TC con multidetectores de 128 cortes. Interpretaron las imágenes 2 investigadores por separado. El registro de CAC y la interpretación de las imágenes de la TC se llevaron a cabo siguiendo un protocolo estandarizado y validado17. La cantidad de calcio se cuantificó con el método de Agatston; los stents se excluyeron del análisis.
Biomarcadores del metabolismo de la matriz extracelularLas muestras de sangre venosa se obtuvieron durante las primeras 24 h del ingreso. Con una demora <30 min desde la extracción, se centrifugaron a 100 g durante 15 min. Se retiró el suero y se guardó a −80°C en el biobanco local. Se analizaron las metaloproteinasas (MMP) 1, 2, 7, 9 y 10 y el inhibidor tisular de la metaloproteinasa 1 de la matriz (TIMP-1) en el Laboratorio de Aterosclerosis del CIMA-Universidad de Navarra. Las MMP 1, 2, 7, 9 y 10 se analizaron en suero mediante un test multiplex basado en microesferas y utilizando la tecnología Luminex, de Merck (MILLIPLEX MAP, Darmstadt, Alemania). Las concentraciones de TIMP-1 se analizaron mediante inmunoanálisis de adsorción enzimática (Quantikine; R&D Systems, Mineápolis, Minesota, Estados Unidos). Los coeficientes de variación analítica e interanalítica fueron <6%.
Análisis estadísticoPara el análisis estadístico, se dividió el GRS en 3 terciles y se trazaron las curvas de supervivencia de Kaplan-Meier para el objetivo primario. El GRS de bajo riesgo se utilizó como el grupo de referencia. Se construyeron varios modelos de regresión de Cox: a) un modelo univariante con todas las variables de interés recogidas; b) un modelo clínico multivariante donde se probaron la puntuación de riesgo GRACE ya validada y las variables estadísticamente relacionadas con el objetivo combinado en el análisis univariante, y se utilizó el método de eliminación hacia atrás para seleccionar las covariables finalmente incluidas, y c) el modelo multivariante anterior con la adición de los terciles de la GRS. Se estudió la interacción. El porcentaje de riesgo con la puntuación de riesgo GRACE se calculó utilizando un nomograma para los resultados de mortalidad o IAM a 3 años. La bondad de ajuste se evaluó con el cociente de probabilidad y el estadístico C. Se compararon los modelos multivariantes con y sin el GRS con el método del índice de mejora de discriminación integrada (IDI), que compara la diferencia promedio en la predicción correcta del riesgo en pacientes que sufren recurrencia de un evento cardiovascular con la de aquellos que no, y el índice continuo de reclasificación neta (cNRI), detallado en 18. Los valores ausentes (< 3%) se analizaron utilizando una técnica de asignación múltiple basada en el método de Markov. Se trataba de un estudio exploratorio y generador de hipótesis; en consecuencia, no se calculó de antemano el tamaño formal de la muestra. Los análisis estadísticos se realizaron utilizando el software SPSS, versión 22.0 (SPSS Inc., Chicago, Illinois, Estados Unidos) y la versión 3.3.2 de R.
RESULTADOSPerfil del pacienteEntre agosto de 2013 y diciembre de 2014, después del cribado inicial se incluyó en el estudio a un total de 81 pacientes (el 89% varones) de 48±6 años (figura 1). Los factores de riesgo cardiovascular y las características clínicas se muestran en la tabla 2 y en la . El factor de riesgo más habitual fue el tabaquismo (65%), seguido de la hipertensión y la dislipemia, con un 38 y un 33% respectivamente. De cada 4 pacientes, 1 se hallaba en la franja de obesidad, y el 29% presentaba antecedentes familiares de EC prematura (IAM en familiares de primer rango varones menores de 55 años o mujeres menores de 65). Todos los pacientes eran de ascendencia europea y ninguno padecía hipercolesterolemia familiar según los criterios de la Dutch Lipid Clinic Network (DLCN) ().
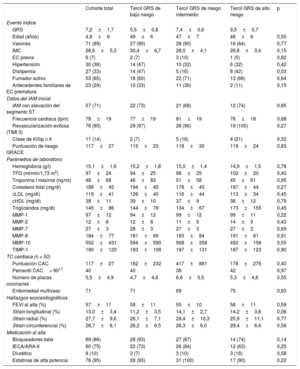
Características iniciales de los pacientes en función del tercil de escala de riesgo genético al que pertenezcan (n = 81)
| Cohorte total | Tercil GRS de bajo riesgo | Tercil GRS de riesgo intermedio | Tercil GRS de alto riesgo | p | |
|---|---|---|---|---|---|
| Evento índice | |||||
| GRS | 7,2±1,7 | 5,5±0,8 | 7,4±0,6 | 9,5±0,7 | |
| Edad (años) | 4,8±6 | 49±6 | 47±7 | 48±6 | 0,50 |
| Varones | 71 (89) | 27 (90) | 28 (90) | 16 (84) | 0,77 |
| IMC | 28,6±5,3 | 30,4±6,7 | 28,0±4,1 | 26,8±3,4 | 0,15 |
| EC previa | 6 (7) | 2 (7) | 3 (10) | 1 (5) | 0,82 |
| Hipertensión | 30 (38) | 14 (47) | 10 (32) | 6 (32) | 0,42 |
| Dislipemia | 27 (33) | 14 (47) | 5 (16) | 8 (42) | 0,03 |
| Fumador activo | 53 (65) | 18 (60) | 22 (71) | 13 (68) | 0,64 |
| Antecedentes familiares de EC prematura | 23 (29) | 10 (33) | 11 (36) | 2 (11) | 0,15 |
| Datos del IAM inicial | |||||
| IAM con elevación del segmento ST | 57 (71) | 22 (73) | 21 (68) | 12 (74) | 0,85 |
| Frecuencia cardiaca (lpm) | 78±19 | 77±19 | 81±19 | 76±18 | 0,68 |
| Revascularización exitosa (TIMI 3) | 76 (95) | 29 (97) | 28 (90) | 19 (100) | 0,27 |
| Clase de Killip ≥ II | 11 (14) | 2 (7) | 5 (16) | 4 (21) | 0,32 |
| Puntuación de riesgo GRACE | 117±27 | 115±23 | 118±30 | 119±24 | 0,83 |
| Parámetros de laboratorio | |||||
| Hemoglobina (g/l) | 15,1±1,6 | 15,2±1,8 | 15,0±1,4 | 14,9±1,5 | 0,78 |
| TFG (ml/min/1,73 m2) | 97±24 | 94±25 | 98±25 | 103±20 | 0,40 |
| Troponina I máxima (ng/ml) | 48±68 | 46±83 | 51±58 | 45±61 | 0,95 |
| Colesterol total (mg/dl) | 188±45 | 194±45 | 178±45 | 197±44 | 0,27 |
| cLDL (mg/dl) | 119±41 | 126±40 | 116±44 | 113±34 | 0,45 |
| cHDL (mg/dl) | 38±11 | 39±10 | 37±9 | 38±12 | 0,79 |
| Triglicéridos (mg/dl) | 145±96 | 144±78 | 134±67 | 173±155 | 0,45 |
| MMP-1 | 97±12 | 94±12 | 99±12 | 99±11 | 0,22 |
| MMP-2 | 12±8 | 12±8 | 11±9 | 14±9 | 0,43 |
| MMP-7 | 27±3 | 28±3 | 27±3 | 27±2 | 0,69 |
| MMP-9 | 184±77 | 181±69 | 183±84 | 191±81 | 0,91 |
| MMP-10 | 552±431 | 594±590 | 568±358 | 450±158 | 0,55 |
| TIMP-1 | 190±120 | 183±108 | 197±131 | 187±123 | 0,90 |
| TC cardiaca (n = 50) | |||||
| Puntuación CAC | 117±27 | 162±232 | 417±881 | 178±276 | 0,40 |
| Percentil CAC> 9017 | 40 | 40 | 38 | 42 | 0,97 |
| Número de placas coronarias | 5,5±4,9 | 4,7±4,6 | 6,6±5,5 | 5,3±4,6 | 0,55 |
| Enfermedad multivaso | 71 | 71 | 69 | 75 | 0,93 |
| Hallazgos ecocardiográficos | |||||
| FEVI al alta (%) | 57±11 | 58±11 | 55±10 | 58±11 | 0,59 |
| Strain longitudinal (%) | 13,0±3,4 | 11,2±3,5 | 14,1±2,7 | 14,2±3,8 | 0,06 |
| Strain radial (%) | 27,7±9,6 | 26,1±7,1 | 28,4±10,3 | 25,9±11,1 | 0,77 |
| Strain circunferencial (%) | 26,7±6,1 | 26,2±6,5 | 26,3±6,0 | 29,4±6,4 | 0,58 |
| Medicación al alta | |||||
| Bloqueadores beta | 69 (86) | 28 (93) | 27 (87) | 14 (74) | 0,14 |
| IECA/ARA-II | 60 (75) | 22 (73) | 26 (84) | 12 (63) | 0,25 |
| Diurético | 8 (10) | 2 (7) | 3 (10) | 3 (16) | 0,58 |
| Estatinas de alta potencia | 76 (95) | 28 (93) | 31 (100) | 17 (90) | 0,22 |
ARA-II: antagonistas del receptor de la angiotensina II; CAC: calcio coronario; cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; EC: enfermedad coronaria; FEVI: fracción de eyección del ventrículo izquierdo; GRS: escala de riesgo genético; IAM: infarto agudo de miocardio; IECA: inhibidor enzima de conversión de la angiotensina; IMC: índice de masa corporal; MMP: metaloproteinasa; TC: tomografía computarizada; TFG: tasa de filtrado glomerular; TIMI: Thrombolysis in Myocardial Infarction; TIMP-1: inhibidor tisular de la metaloproteinasa 1 de la matriz.
Los valores expresan media±desviación estándar para variables continuas y n (%) para variables categóricas.
La forma de presentación más habitual fue el IAM con elevación del segmento ST (un 72% de los casos). La mediana [intervalo intercuartílico] de hospitalización fue de 2,5 [2-4] días. El 32% tenía estenosis significativas en arteria no culpable, determinadas mediante angiografía invasiva, y el 4%, enfermedad de 3 vasos. El tratamiento al alta se adhirió a las recomendaciones vigentes.
Tras una mediana de seguimiento de 4,1 [3,5-4,4] años, hubo 24 eventos (30%) del objetivo primario combinado. La morbilidad y la mortalidad fueron casi exclusivamente cardiacas. Todos los participantes completaron un seguimiento de al menos 3 años, y entre los pacientes con eventos cardiovasculares recurrentes, el tiempo promedio hasta el objetivo primario fue de 1,1±0,8 años.
En el análisis univariante, la existencia de antecedentes de EC (hazard ratio [HR] = 3,4; intervalo de confianza del 95% [IC95%], 1,2-9,9; p = 0,02), la dislipemia (HR = 5,0; IC95%, 1,8-14,2; p = 0,001) y el abuso de cocaína previo (HR = 5,1; IC95%, 1,7-15,1; p = 0,001) se relacionaron de manera significativa con el objetivo combinado. Las características clínicas al ingreso que se relacionaron con recurrencia de eventos cardiovasculares fueron la clase Killip (por cada aumento de 1 punto, HR = 2,3; IC95%, 1,4-3,7; p <0,001), la revascularización subóptima definida como flujo Thrombolysis in Myocardial Infarction (TIMI) final <3 (HR = 8,9; IC95%, 2,9-26,9; p = 0,01), la hemoglobina baja (por cada disminución de 1 punto, HR = 1,4; IC95%, 1,2-1,7; p <0,001) y la necesidad de fármacos diuréticos durante el ingreso (HR = 4,2; IC95%, 1,5-11,3; p <0,002).
Se construyó un modelo clínico multivariante que comprobó todas las variables que habían sido significativas en el análisis univariante. Solo la puntuación de riesgo GRACE y el colesterol unido a lipoproteínas de baja densidad (cLDL) se mantuvieron en el modelo final, el cual mostraba una área bajo la curva ROC de 0,78 para la predicción del objetivo primario a los 3 años.
GenéticaSe evaluó la prevalencia de cada SNP que formaba el GRS en nuestra población comparándola con una cohorte de más de 15.400 secuencias de exomas de sujetos no emparentados y de origen europeo no finés incluidos en la base de datos sobre genómica humana (Genome Aggregation Database [gnomAD]). En la población de este estudio se observaba una prevalencia claramente mayor en 9 de cada 11 alelos de riesgo analizados ().
Cuando se examinaron los 8 SNP y las 3 variantes de haplotipos, se examinaron por separado y, tras aplicar la corrección de Bonferroni para comparaciones múltiples, se constató que ninguno de ellos analizado individualmente llegaba a asociarse de manera estadísticamente significativa con las recurrencias en el seguimiento ().
El GRS promedio de la población en estudio fue de 7,2±1,7. Cuando se dividió en terciles en función del GRS, las características del evento inicial no eran significativamente distintas (tabla 2). Tal como era de esperar por el diseño (selección de componentes del SNP en la plataforma Cardio inCode), el GRS no se relacionó con los factores de riesgo clásicos o con antecedentes familiares de EC prematura. La puntuación de riesgo GRACE, determinada al ingreso, no difirió en función del tercil de riesgo genético.
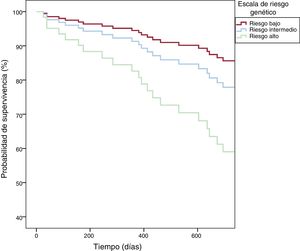
Se constató una relación significativa entre el GRS y los eventos cardiovasculares recurrentes en el modelo de regresión de Cox multivariante (que incluía GRACE y el cLDL) (tabla 3, , y ). Las curvas de Kaplan-Meier mostraron una tendencia clara hacia la mayor presencia de recurrencias en pacientes con una GRS intermedia o alta (figura 2). Los valores de cLDL al ingreso mostraron una fuerte interacción entre los pacientes con GRS de alto riesgo, de tal modo que en este grupo tener el cLDL elevado incrementa la HR de eventos recurrentes (). Entre los pacientes con cLDL basal ≥ 110 mg/dl (≥ 2,8 mmol/l), la HR de eventos recurrentes fue 10,2 (IC95%, 1,1-100,3; p=0,04) para la categoría de riesgo genético intermedio y 20,7 (2,4-181,0; p=0,006) para la GRS de alto riesgo comparadas con el grupo de bajo riesgo. Por el contrario, la categoría de riesgo genético no contribuyó a la predicción de recurrencias cuando el cLDL era <110mg/dl (2,8 mmol/l). No se observaron diferencias significativas en la reducción absoluta o relativa del cLDL a los 6 meses según el tercil de la GRS ().
Análisis de regresión de Cox entre los terciles de la GRS y el riesgo de eventos recurrentes
| Análisis univariante | Análisis multivariante* | ||||
|---|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p* | ||
| GRS | |||||
| GRS baja | 1 | 1 | |||
| GRS intermedia | 2,0 (0,07-5,8) | 0,21 | cLDL ≤ 110 mg/dl (≤ 2,8 mmol/l) | 1,0 (0,3-4,0) | |
| > 110 mg/dl (≥2,8 mmol/l) | 10,2 (1,1-100,3) | 0,04 | |||
| GRS alta | 3,0 (1,0-9,2) | 0,05 | cLDL ≤ 110 mg/dl (≤ 2,8 mmol/l) | 0,3 (0,1-1,9) | |
| > 110 mg/dl (≥ 2,8 mmol/l) | 20,7 (2,4-181,0) | 0,006 | |||
cLDL: colesterol unido a proteínas de baja densidad; GRACE: Global Registry of Acute Coronary Events; GRS: escala de riesgo genético; HR: hazard ratio; IC95%: intervalo de confianza del 95%.
La adición de la GRS al modelo clínico de regresión de Cox multivariante (que incluía la puntuación de riesgo GRACE y el cLDL) mostró una mejora en el área bajo la curva (0,83 frente a 0,78) (figura 3A). El estadístico C para el modelo clínico de regresión de Cox multivariante fue 0,710, mientras que la adición de la GRS lo aumentó a 0,796 (ΔC = 0,086; IC95%, 0,006-0,187). El cNRI fue del 30% a 3 años (IC95%, 0-52%, p=0,05) mientras que el IDI mostró una sustancial capacidad predictiva incremental (0,05) cuando se añadió la GRS al modelo clínico multivariante (figura 3B y tabla 4).
A: curvas de características operativas del receptor (receiver operating characteristic [ROC]) para el modelo de regresión de Cox multivariante (incluidos el cLDL y la puntuación de riesgo GRACE) en rojo y para el modelo multivariante con adición de la GRS en azul. B: función de distribución empírica de ^D para T0 ≤ t0 (línea gruesa) y T0> t0 (línea fina) para evaluar el IDI y el cNRI, tal como describieron Uno et al.18. T0 se refiere al momento en que tiene lugar el evento, mientras que t0 refleja un momento puntual concreto. Los pacientes que sufren un evento en t0 pueden definirse como casos (T0 ≤ t0) y los que no, como controles (T0> t0). ^D se refiere al cambio entre los 2 modelos y visualmente evalúa la mejora en los sistemas de predicción del riesgo (véase ). ABC: área bajo la curva; cLDL: colesterol unido a lipoproteínas de baja densidad; cNRI, índice continuo de reclasificación neta; GRACE: Global Registry of Acute Coronary Events; GRS: escala de riesgo genético; IDI: mejora de discriminación integrada. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Evaluación del valor incremental de la GRS para el modelo multivariante
| Estimación | IC95% | p | |
|---|---|---|---|
| Modelo de regresión de Cox multivariante con estadístico C | 0,710 | 0,62-0,79 | – |
| Modelo de regresión de Cox multivariante con estadístico C y con la GRS | 0,796 | 0,70-0,89 | – |
| Δ estadístico C | 0,086 | 0,01-0,19 | 0,04 |
| cNRI (%) | 30 | 0-52 | 0,05 |
| Índice IDI | 0,05 | 0,00-0,16 | 0,049 |
cNRI: índice continuo de reclasificación neta; GRS: escala de riesgo genético; IC95%: intervalo de confianza del 95%; IDI: mejora de discriminación integrada.
La tabla muestra el estadístico C y el índice IDI y el cNRI para comparar los 2 modelos de regresión de Cox multivariantes: con GRS frente a sin GRS con datos de supervivencia censurados.
Se realizó una TC cardiaca a 50 pacientes (62%). La puntuación de CAC era alta (117±27), con tan solo un 30% de pacientes sin calcificación coronaria. Más de dos terceras partes mostraban un percentil de CAC> 75 y el 42%,> 90. Se observó calcificación extensa (puntuación de CAC> 400) en el 14% de los pacientes. Se consideró que la calidad de la TC cardiaca era óptima en la mayoría de los pacientes, y solo en el 9% se juzgó no diagnóstica. Se analizaron las lesiones que originaron estenosis ≥ 25%, con un resultado de 5,5 lesiones por paciente (media, 4). Con respecto a las características de la placa, solo el 29% de estas lesiones eran blandas o fibrosas, mientras que las lesiones calcificadas constituyeron la mayoría, con placas mixtas (26%) y exclusivamente calcificadas o duras (45%). No se observó ninguna relación entre el perfil del GRS y la puntuación de CAC, el número de estenosis coronarias evaluadas por TC o la enfermedad multivaso evaluada mediante angiografía coronaria.
Se apreció una tendencia interesante entre la enfermedad multivaso evaluada mediante TC y los eventos cardiovasculares recurrentes (HR = 2,1; IC95%, 0,9-4,8; p = 0,07), lo cual no se detectaba con la puntuación de CAC o las estenosis multivaso significativas determinadas mediante angiografía invasiva.
Biomarcadores del metabolismo de la matriz extracelularLos pacientes con un infarto de miocardio más grave, definido por una clasificación de Killip-Kimbal ≥ II, mostraban valores de MMP-7 y TIMP-1 en la fase aguda más altos que aquellos con Killip I (30,1±5,1 frente a 26,6±1,9; p=0,04, y 322±221 frente a 166±72; p = 0,04). Por otro lado, se constató una significativa correlación negativa entre la fracción de eyección del ventrículo izquierdo y las MMP-7, MMP-10 y TIMP-1. No obstante, no se observó asociación alguna entre las MMP y otras variables clínicas que indicaran una ateroesclerosis más extensa por la puntuación de calcio, el número de segmentos coronarios con estenosis o el GRS. En el modelo de regresión de Cox multivariante, las MMP no fueron predictoras independientes de recurrencia de eventos cardiovasculares.
DISCUSIÓNEl principal hallazgo del presente estudio es que la aplicación de una GRS a pacientes jóvenes sin diabetes que han sufrido un IAM puede ser de utilidad clínica para predecir recurrencia de eventos cardiovasculares, con independencia de otras variables clínicas. Cabe destacar que la importancia de tener una GRS intermedia o alta se limitó a los pacientes con el cLDL elevado, que actuó como modificador. Visto desde otra perspectiva, entre los pacientes con cLDL elevado, presentar un perfil genético desfavorable puede multiplicar el riesgo de recurrencias frente a aquellos que tienen una GRS baja. En consecuencia, los pacientes con el cLDL elevado serían quienes más se beneficiarían de un estudio genético, lo cual valida por primera vez una hipótesis que había permanecido sin confirmar19. Así pues, la posibilidad de identificar qué sujetos presentan mayor riesgo de recurrencias tras un infarto permitiría plantear una prevención secundaria más agresiva.
GenéticaEn el presente análisis, una GRS bien validada compuesta por 11 variables genéticas, incluidos 8 SNP y 1 haplotipo, fue predictiva de eventos cardiovasculares recurrentes durante un seguimiento de 4,1 años tras un IAM en pacientes jóvenes sin diabetes. Un perfil genético desfavorable se relacionó con un mayor riesgo de sufrir el objetivo primario, que se hallaba considerablemente aumentado cuando la concentración de cLDL estaba elevada, una hipótesis propuesta recientemente19. La inclusión de la GRS mejoró el estadístico C (ΔC = 0,086) en un modelo ajustado por la puntuación de riesgo GRACE y el cLDL. La población estudiada ya presentaba una probabilidad alta de susceptibilidad genética a EC, lo que se reflejó en la prevalencia casi 2 veces superior de la mayoría de las variantes de alelos de riesgo analizados, comparada con la población general de la misma etnia. Ya se había demostrado la utilidad clínica de esta GRS en prevención primaria; sin embargo, se desconocía su aplicabilidad en prevención secundaria.
Los SNP surgidos de los GWAS a gran escala se relacionan con la enfermedad ateroesclerótica principalmente a través de su influencia en los factores de riesgo y, en menor grado, directamente con el IAM20. Los hallazgos fisiopatológicos causados por la EC y el IAM difieren, con una mayor influencia de la trombosis en el IAM2. Esto podría explicar en parte los distintos resultados observados en prevención primaria y secundaria. Los SNP incluidos en el presente estudio actúan independientemente de los factores de riesgo clásico o se desconoce su mecanismo3.
Los estudios que evaluaban el uso de cada uno de los SNP en la predicción de recurrencia de eventos cardiovasculares tras un SCA mostraban inicialmente una buena capacidad predictiva, pero solían carecer de la confirmación posterior. En un estudio21, un SNP del locus 9p21 se asoció inicialmente con recurrencias tras el IAM, pero un metanálisis posterior descartó cualquier influencia significativa22. Otra variable puntual identificada en el gen AB0 mejoró débilmente un modelo de predicción de riesgo clínico de recurrencias en otro estudio23, aunque este hallazgo no se ha reproducido con posterioridad24.
Los SNP asociados a EC son frecuentes e individualmente solo explican un ligero aumento del riesgo. Esto ha llevado a la creación de las GRS compuestas por múltiples SNP. Muy pocos estudios han evaluado las GRS en prevención secundaria, con resultados contradictorios. Labos et al.25 fueron incapaces de hallar relación alguna entre una GRS de 30 SNP y recurrencias precoces (< 1 año tras el SCA). Aunque estos autores concluyen que la etiología de los eventos precoces puede diferir de la de los tardíos, con poca utilidad de la genética, hay algunas explicaciones posibles de este resultado: a) las variantes que componen esta GRS cubrían principalmente genes asociados con aterotrombosis, una de las principales dianas terapéuticas de los fármacos utilizados tras el IAM; es plausible que, una vez establecido el tratamiento específico, pudiera haberse controlado el riesgo asociado con estas variantes20; b) esta GRS carecía de una validación previa en la población general, y todos los SNP incluidos procedían de estudios GWAS, lo que explica tan solo el 10% de la susceptibilidad genética2. En nuestro estudio, se utilizó ex profeso una GRS validada previamente para EC, pero no relacionada a priori con factores de riesgo. Mega et al.19 observaron relación entre las categorías de riesgo genético utilizando una GRS de 27 SNP y la aparición de eventos incidentes y recurrentes entre pacientes incluidos en distintos ensayos clínicos con estatinas. Los beneficios de las estatinas fueron superiores en pacientes con riesgo genético intermedio o alto. Estos autores indican que una carga genética desfavorable debería constituir un foco de atención por sí mismo, ya que el riesgo de recurrencias está aumentado y el beneficio del tratamiento es mayor. Los resultados del presente estudio coinciden con esos hallazgos, y reproducen por primera vez la capacidad de una GRS para predecir eventos cardiovasculares recurrentes en prevención secundaria, relacionando el efecto con dislipemia. Por último, Vaara et al.24 evaluaron 2 GRS basadas en 47 y 153 SNP respectivamente; aunque la GRS47 mostró algunos resultados positivos, no fue así con la GRS153, en el que ninguno se relacionó con el objetivo combinado, y estos no mejoraron de manera relevante los modelos de predicción del riesgo; estos autores mencionan como limitación el reducido número de pacientes jóvenes, en quienes la asociación podría ser más fuerte.
Varios factores pueden haber influido en las divergencias en los resultados: primero, la heterogeneidad de las poblaciones y el seguimiento variable; segundo, las GRS compuestas por un mayor número de variantes cubren una mayor proporción de predisposición genética, pero se ha demostrado repetidamente una peor capacidad predictiva3; por último, aunque la mayor parte de los estudios han utilizado un objetivo combinado, estos varían en su definición de recurrencia, lo que limita las comparaciones.
De modo parecido que en estudios anteriores, no se observó relación alguna entre tener antecedentes familiares de EC y la GRS, lo que refleja el valor de los datos genómicos más allá de que el paciente declare antecedentes familiares3.
Tomografía computarizada cardiacaLa calcificación y la enfermedad multivaso o multisegmento fueron mayores de lo que previamente se había informado en esta población, frente a otros estudios que utilizaron angiografía coronaria invasiva para caracterizar las lesiones no responsables. Esto puede ser el reflejo de que, incluso en pacientes jóvenes con un inicio clínico brusco, la ateroesclerosis asintomática tiene una larga evolución previa. El valor clínico de la TC cardiaca en pacientes con SCA es escaso: aunque el número de placas coronarias mostró una tendencia hacia un mayor riesgo de eventos, la puntuación de calcio no lo hizo. Esto refleja probablemente la vía habitual del SCA, con rotura de placas en lesiones no estenóticas abundantes en lípidos antes que en lesiones crónicas y calcificadas. No se observó relación alguna entre el número de alelos de riesgo y la puntuación de CAC inicial o el número de placas detectadas mediante TC, en la primera descripción conjunta en la literatura entre pacientes con IAM.
Metabolismo de la matriz extracelularLas MMP son intermediarios en la rotura de placa y la aterotrombosis. Se hallan aumentadas tras un infarto de miocardio y se han propuesto como predictoras de insuficiencia cardiaca y remodelado adverso26. En este estudio, las MMP-7, MMP-10 y TIMP-1 se asociaron con una mayor gravedad del infarto en su fase aguda, pero no predijeron recuperación de la función ventricular izquierda o recurrencias durante el seguimiento.
Los puntos fuertes de este estudio son una población homogénea con una alta probabilidad de predisposición genética, información clínica y biohumoral exhaustiva y un seguimiento completo. La TC cardiaca con puntuación de calcio y análisis de placa permite realizar una perfecta caracterización de la enfermedad causante ligada al perfil genético de los pacientes.
LimitacionesEste estudio tiene algunas limitaciones. En primer lugar, dados los criterios de selección tan restrictivos, el número de pacientes es relativamente pequeño; la selección se basó en observaciones previas según las cuales en los jóvenes el riesgo de recurrencia suele depender en mayor medida de la contribución genética27; así pues, es posible que los resultados no puedan generalizarse a todo el espectro de edades, población diabética o etnias. En segundo lugar, se utilizó un objetivo combinado, como en estudios comparables, pero expuesto a recoger eventos no relacionados con el riesgo genético. Tercero, el gran uso de tratamiento médico óptimo pudo influir en una tasa de eventos durante el seguimiento menor que lo esperado.
CONCLUSIONESUna GRS combinada por 11 SNP identificó a los sujetos con mayor riesgo de recurrencias a largo plazo entre pacientes jóvenes no diabéticos con IAM y mejoró los modelos clínicos de estratificación del riesgo. Los pacientes con cLDL alto pueden obtener el mayor beneficio de este estudio genético. La TC cardiaca detectó frecuentemente calcificación coronaria con numerosas placas ateroescleróticas, pero su valor en la predicción de eventos a largo plazo resulto pequeño.
FINANCIACIÓNEste estudio fue financiado por el Instituto de Salud Carlos III (PI12/0564, PI14/01152 y PI15/00667), el Centro de Investigación Biomédica en Red de Enfermedades Cardiovasculares (CIBERCV) (CB16/11/00250), la Sociedad Española de Cardiología (2015/Cardiología clínica) y la Fundación Eugenio Rodríguez Pascual.
CONFLICTO DE INTERESESNinguno.
- –
Hay decenas de variantes genéticas comunes que se relacionan con la EC y cada una de ellas conlleva un ligero aumento del riesgo. Las GRS se han creado como una suma de múltiples locus para proporcionar una estimación general del riesgo individual. Las GRS se han evaluado favorablemente en población general para determinar el riesgo de un primer evento cardiovascular. No obstante, la utilidad de los marcadores de riesgo genético en la predicción de eventos recurrentes entre quienes ya han sufrido un infarto de miocardio sigue sin conocerse.
- –
Esta es la primera serie en población española que estudia una GRS multilocus en un grupo homogéneo de pacientes jóvenes, con una alta probabilidad de predisposición genética a la recurrencia y que ya habían sufrido un infarto de miocardio. La aplicación de una GRS fue clínicamente útil para predecir recurrencias cardiovasculares independientemente de otras variables y otros modelos de estratificación del riesgo clínico mejorados. El estudio sirve como demostración conceptual del uso de herramientas genéticas en la prevención secundaria tras un infarto de miocardio.








![A: curvas de características operativas del receptor (receiver operating characteristic [ROC]) para el modelo de regresión de Cox multivariante (incluidos el cLDL y la puntuación de riesgo GRACE) en rojo y para el modelo multivariante con adición de la GRS en azul. B: función de distribución empírica de ^D para T0 ≤ t0 (línea gruesa) y T0> t0 (línea fina) para evaluar el IDI y el cNRI, tal como describieron Uno et al.18. T0 se refiere al momento en que tiene lugar el evento, mientras que t0 refleja un momento puntual concreto. Los pacientes que sufren un evento en t0 pueden definirse como casos (T0 ≤ t0) y los que no, como controles (T0> t0). ^D se refiere al cambio entre los 2 modelos y visualmente evalúa la mejora en los sistemas de predicción del riesgo (véase «Métodos» del material adicional). ABC: área bajo la curva; cLDL: colesterol unido a lipoproteínas de baja densidad; cNRI, índice continuo de reclasificación neta; GRACE: Global Registry of Acute Coronary Events; GRS: escala de riesgo genético; IDI: mejora de discriminación integrada. Esta figura se muestra a todo color solo en la versión electrónica del artículo. A: curvas de características operativas del receptor (receiver operating characteristic [ROC]) para el modelo de regresión de Cox multivariante (incluidos el cLDL y la puntuación de riesgo GRACE) en rojo y para el modelo multivariante con adición de la GRS en azul. B: función de distribución empírica de ^D para T0 ≤ t0 (línea gruesa) y T0> t0 (línea fina) para evaluar el IDI y el cNRI, tal como describieron Uno et al.18. T0 se refiere al momento en que tiene lugar el evento, mientras que t0 refleja un momento puntual concreto. Los pacientes que sufren un evento en t0 pueden definirse como casos (T0 ≤ t0) y los que no, como controles (T0> t0). ^D se refiere al cambio entre los 2 modelos y visualmente evalúa la mejora en los sistemas de predicción del riesgo (véase «Métodos» del material adicional). ABC: área bajo la curva; cLDL: colesterol unido a lipoproteínas de baja densidad; cNRI, índice continuo de reclasificación neta; GRACE: Global Registry of Acute Coronary Events; GRS: escala de riesgo genético; IDI: mejora de discriminación integrada. Esta figura se muestra a todo color solo en la versión electrónica del artículo.](https://static.elsevier.es/multimedia/03008932/0000007300000008/v1_202007230623/S0300893219303756/v1_202007230623/es/main.assets/thumbnail/gr3.jpeg?xkr=eyJpdiI6InFHc0U0d2JuOUhEOW11aEpYc0xGS3c9PSIsInZhbHVlIjoiWGMvUG8yUWYvSVBQSnA2cFZLc0libnJib1hWWGQvRkRRdDJEWmp4TU0yVT0iLCJtYWMiOiI1MGZjN2Y0YTBhMjkwN2VjZTY4NTAxZmI5YjM0MjVjMDJkNjIxMDE3ODdmN2FhYWQxZWY2NGU1N2ZmOTBhNDg2IiwidGFnIjoiIn0=)