Palabras clave
INTRODUCCIÓN
La frecuencia y la mortalidad del accidente cerebrovascular (ACV) han declinado en los últimos 25 años en la mayoría de los países industrializados; sin embargo, la enfermedad cerebrovascular es la tercera causa de mortalidad en nuestro país y la primera entre las mujeres1. La prevalencia de la enfermedad es cercana a 7.000 casos por cada 100.000 habitantes mayores de 64 años2. Estas cifras implican que la prevención y el correcto tratamiento del paciente con ictus y de sus complicaciones tienen un alto impacto no sólo en el paciente y su entorno familiar, sino en el Sistema Nacional de Salud y, de una manera global, en la sociedad.
CONCEPTOS BÁSICOS DEL ICTUS PARA EL CARDIÓLOGO
De una manera muy general, podemos decir que las enfermedades cerebrovasculares están motivadas por una afección de la circulación cerebral que se traduce en una alteración definitiva o transitoria de la función del encéfalo. En función de la anatomía patológica global, se pueden dividir en diferentes grupos con distintas implicaciones clínicas (fig. 1).
Fig. 1. Clasificación clinicopatológica del accidente cerebrovascular ACV: accidente cerebrovascular; AIT: accidente isquémico transitorio *Adaptada de Díez Tejedor E, et al4
Isquemia cerebral
Se produce por una disminución del aporte circulatorio del encéfalo, ya sea cuantitativo o cualitativo. Clásicamente, la isquemia cerebral focalizada en un área localizada del encéfalo se divide en 2 grandes grupos3,4:
1. Accidente isquémico transitorio (AIT). Se produce una disfunción cerebral focal o monocular con una duración total de los síntomas menor de 24 h. Su origen es secundario a una trombosis o a una embolia arterial. Según la clínica desarrollada por el paciente se clasifica en 4 grandes grupos: retiniano, lacunar, hemisférico cortical y atípico. Siguiendo una clasificación topográfica que implica al territorio vascular afectado, se puede distinguir entre afección carotídea, vertebrobasilar o indeterminada.
2. Infarto. En este caso se produce una alteración del aporte sanguíneo a un territorio del encéfalo. Su síntomas superan las 24 h. Podemos diferenciar 5 subtipos nomológicos de importante significado clínico.
- Infarto aterotrombótico: suele ser un infarto de tamaño intermedio o grande con una topografía cortical o subcortical y una localización carotídea o vertebrobasilar. Un indicador básico es que el paciente presenta una arteriosclerosis que se manifesta clínicamente por la presencia de una enfermedad vascular periférica, alteraciones de los vasos coronarios, o bien oclusión o estenosis en las arterias cerebrales.
- Infarto cardioembólico: es un infarto de tamaño intermedio o grande, que presenta una topografía cortical, en el que no se encuentra ninguna otra etiología que no sea una cardiopatía embolígena.
- Infarto lacunar: infarto de pequeño tamaño en pacientes con antecedentes de hipertensión arterial u otros factores de riesgo. El infarto se localiza en el territorio de una arteria perforante cerebral y se acompaña de un síndrome lacunar clínico que se manifiesta por un síndrome sensitivo puro, hemiparesia atáxica y disartria-mano torpe, síndrome sensitivo motriz y hemiparesia motora pura.
- Infarto de causa inhabitual: es un infarto en el que se ha descartado cualquiera de los 3 orígenes etiológicos previos. Su origen esta ligado a numerosas enfermedades sistémicas, como neoplasias, síndrome mieloproliferativo, coagulopatías, conectivopatías o síndromes infecciosos. El infarto puede tener cualquier tamaño y estar localizado cortical o subcorticalmente en el territorio de afección carotidea o vertebrobasilar.
- Infarto cerebral de origen indeterminado: es el cajón de sastre en el que se incorporan todos los casos no incluidos en los apartados anteriores.
Enfermedad hemorrágica cerebrovascular
Se trata de una hemorragia dentro de la cavidad craneal secundaria a una extravasación sanguínea producida por la rotura de un vaso. Suele ser el origen etiológico del 20-25% de los ACV. En la mayoría de los casos se asocia a hipertensión arterial sistémica, seguida de malformaciones arteriovenosas, aneurismas, uso de anticoagulantes, enfermedades hematológicas y la ingestión de tóxicos, como la cocaína y el alcohol.
TÉCNICAS DE IMAGEN EN LA VALORACIÓN DEL PACIENTE CON ACV
Ante un paciente con un ACV se pone en marcha una batería de técnicas diagnósticas que van a tratar de definir el diagnóstico cierto, la severidad, el pronóstico y el resultado de la actuaciones terapéuticas (tablas 1 y 2).
Las técnicas de imagen han revolucionado la valoración del paciente con ACV. En líneas generales, las podemos agrupar en 3 grandes apartados:
1. Técnicas de neuroimagen.
2. Técnicas de imagen cardíaca: cardioembolia.
3. Eco-Doppler de troncos supraórticos y Doppler transcraneal (DTC).
Técnicas de neuroimagen
La valoración de la anatomía cerebral es básica en el análisis de los pacientes con ACV, no sólo para establecer un diagnóstico topográfico de la lesión, sino para definir el origen, realizar un diagnóstico diferencial y distinguir entre áreas no reversibles y con posibilidades de recuperación. Son muchos los métodos que podemos utilizar para la valoración del enfermo con ACV.
Tomografía computarizada (TC)
Sin duda es el procedimiento más ampliamente difundido en el estudio de pacientes con ACV y se debe realizar lo más tempranamente posible y de una manera sistemática a todo paciente con ACV. Su gran ventaja es la de establecer con gran especificidad el diagnóstico diferencial entre el ictus isquémico y el hemorrágico. Su limitación más importante es la baja sensibilidad en la detección temprana de tejido isquémico; así, hasta un 60% de los casos presentan TC craneales rigurosamente normales en las primeras horas del infarto.
Resonancia magnética craneal (RM)
No existe una superioridad real entre la resonancia magnética convencional y la TC craneal en la detección del infarto cerebral. Bryan et al5 han demostrado que en las primeras 3 h del accidente isquémico no existe una diferencia entre las secuencias convencionales de RM y TC sin contraste. No obstante, las nuevas técnicas de difusión por RM parecen ser superiores para detectar las fases tempranas de la isquemia. Así, se ha confirmado que las alteraciones de la difusión se detectan en menos de 1 h tras realizar oclusiones de la arteria cerebral media6,7. La sensibilidad y especificidad de estas técnicas en el ictus agudo son cercanas al 100%8,9 y los errores de diagnóstico corresponden en la mayoría de los casos a pequeñas lesiones lacunares localizadas en el tronco encefálico.
Por último, las técnicas modernas de RM permiten obtener información del espacio intravascular por medio de la inyección de contrastes paramagnéticos y evaluar de una manera directa y dinámica el estado de perfusión cerebral. Los estudios de perfusión-RM son, sin duda, los que ofrecen una mayor sensibilidad en la detección temprana de la isquemia. La combinación de los estudios de difusión y perfusión permite obtener información hemodinámica combinada muy útil para valorar los resultados terapéuticos: fibrinólisis frente a neuroprotectores.
Técnicas de imagen cardíaca: cardioembolia
La ecocardiografía transtorácica (ETT) y fundamentalmente la ecocardiografía transesofágica (ETE) desempeñan un papel básico en la búsqueda del origen de la fuente embólica cardíaca. Su aplicación sistemática en la valoración de pacientes con ictus ha permitido conocer el significado real de las viejas etiologías, que clásicamente se han considerado como origen de fuente embólica, así como reconocer nuevas etiologías, algunas con importantes implicaciones clínicas y con gran significado para el cardiólogo (tabla 3). En esta revisión dedicaremos un mención especial al reconocimiento de aquellas causas en las que el estudio con ecocardiografía es esencial para su valoración.
Calcificación valvular
Clásicamente, las técnicas radiográficas fueron las que primero demostraron in vivo la existencia de calcificaciones valvulares. Las técnicas de fluoroscopia con amplificación del campo permiten poner de manifiesto los depósitos de calcio en las válvulas o anillos valvulares10. Igualmente, la TC y cine-TC son métodos altamente sensibles para la visualización de las calcificaciones11. Sin embargo, la ecocardiografía es la técnica de elección para su diagnóstico, ya que permite valorar la localización del calcio en las sigmoideas aórticas, la válvula y el anillo mitral, con una clara definición de su extensión.
El mecanismo potencial por el que el calcio intracardíaco puede ser una causa de embolia ha sido muy controvertido. En primer lugar, la embolización de material calcificado es rara, pero se han descrito casos en el árbol cerebral, en embolias periféricas e incluso coronarias12-15. Lo más probable es que la embolia esté relacionada con la activación de las plaquetas y los depósitos de fibrina en la superficie irregular del calcio en contacto con el torrente sanguíneo16.
En el clásico trabajo de Nair17 se encontró ACV en un 10% de los pacientes con calcificación del anillo mitral y sólo en el 2% de 101 casos del grupo control, ajustados por edad y sexo18. Igualmente, en un estudio realizado en una población de ancianos con más de 80 años, el 20% de un grupo de más de 500 pacientes con calcificación del anillo mitral había tenido una tromboembolia periférica en comparación con el 12% del grupo control. En el estudio BAATAF, después de un seguimiento de 28 meses, el 7,8% de los pacientes con calcificación tenían eventos embólicos, en comparación con el 1,7% del grupo control19. Hay que considerar factores asociados que pueden introducir errores en la valoración de los resultados. Se ha demostrado que la fibrilación auricular es más frecuente en los pacientes con calcificación del anillo mitral y que podría ser ésta la causa real del accidente vascular20,18. Sin embargo, el estudio de Framingham21 ha demostrado que la incidencia de ACV es significativamente superior en pacientes con calcificación del anillo, ya que después de ajustar por variables como el sexo, la edad, la diabetes y la fibrilación auricular, el riesgo relativo es dos veces más alto en los pacientes con calcio.
No existe ningún trabajo que indique un beneficio terapéutico de ningún tipo en los pacientes con calcio en el anillo mitral, por lo que su diagnóstico no se debe traducir en ningún cambio o toma de decisiones terapéutica.
Strands
Los strands se caracterizan por ser filamentos móviles, finos, de 5-10 mm de longitud, habitualmente localizados en la cara auricular de la válvula mitral, aunque también pueden detectarse en la válvula aórtica, sobre todo en su cara ventricular, y en las prótesis cardíacas. La descripción anatómica de estas estructuras corresponde a Magarey, que en 1949 hizo un exhaustivo análisis en más de 250 piezas anatómicas definiéndolas como depósitos de fibrina endotelizados, presentes en la zona de coaptación de los velos valvulares y en probable relación con el aumento de estrés en las zonas de máxima tensión valvular22.
La ETE es la técnica diagnóstica de elección. Se debe ser muy cuidadoso y realizar el estudio con técnica esofágica multiplanar que nos permita efectuar un exhaustivo análisis de la válvula (fig. 2). En ocasiones se pueden presentar problemas diagnósticos en pacientes con sospecha clínica de endocarditis; habitualmente las verrugas son más gruesas e irregulares, aunque muchas veces no es posible establecer el diagnóstico definitivo.
Fig. 2.Strand en la cara ventricular de la válvula aórtica (flechas). VD: ventrículo derecho; VA: válvula aórtica.
La presencia de strands en el corazón izquierdo se ha ligado en algunos estudios al aumento de riesgo de ACV23,24. Sin embargo, estudios de seguimiento a largo plazo en pacientes en que incidentalmente se encontraron strands en la ETE demuestran que la probabilidad de padecer un ACV en un plazo de 4 años es muy baja, menor del 1%24. Igualmente, Cohen ha confirmado en enfermos ancianos que la presencia de strands no aumenta el riesgo de ACV24. Aunque algún trabajo puntual demuestra la desaparición de los strands tras tratamiento con dipiridamol25, en la actualidad no se ha establecido la necesidad del tratamiento profiláctico en pacientes con strands y ACV, así como el tipo de tratamiento que sería adecuado (anticoagulación frente a antiagregantes).
Contraste ecocardiográfico espontáneo
En el año 1983, nuestro grupo describió por primera vez el hallazgo de imágenes ecogénicas intracavitarias en la aurícula izquierda mediante ecocardiografía transtorácica en pacientes con valvulopatía mitral26,27. Con la llegada de la ETE y de las sondas de más alta frecuencia (5 MHz), el contraste espontáneo se ha convertido en un hallazgo mucho más frecuente (en el 30-70% de los pacientes con estenosis mitral en fibrilación auricular). Actualmente, la técnica habitual para detectar y valorar el contraste espontáneo es la ETE, en especial mediante sondas de alta frecuencia (fig. 3). La prevalencia de contraste espontáneo en la aurícula izquierda se encuentra en el 19-59%, dependiendo de las series y las circunstancias clínicas de los pacientes en estudio28-31. Se han descrito como factores asociados a la existencia de contraste espontáneo la fibrilación auricular, la dilatación de la aurícula izquierda y la reducción del flujo de la orejuela izquierda.
Fig. 3. Ecocardiografía transesofágica en un paciente con estenosis mitral. La cavidad auricular izquierda se encuentra rellena de ecocontraste espontáneo. AD: aurícula derecha; VM: válvula mitral; AI: aurícula izquierda.
La presencia de contraste espontáneo en la aurícula izquierda tiene lugar en el 30-70% de los pacientes con estenosis mitral y su frecuencia se encuentra en relación directa con la severidad de la estenosis. Por otra parte, existe contraste espontáneo en la aurícula izquierda en alrededor del 25% de los pacientes con fibrilación auricular no reumática y en el 50% de los pacientes con fibrilación auricular reumática28,31. Aunque la asociación entre el flúter auricular y la existencia de contraste espontáneo en la aurícula izquierda no es tan importante como en el caso de la fibrilación auricular, este hallazgo ecocardiográfico no es infrecuente en los pacientes con flúter auricular, con un 26% en el estudio de Irani32. La existencia de insuficiencia mitral parece asociarse con una menor prevalencia de contraste espontáneo en la aurícula izquierda33,34.
Se ha descrito ampliamente la relación existente entre la presencia de contraste espontáneo en la aurícula izquierda y la formación de trombos en esta cavidad26,27,35-37. Entre el 29 y el 60% de los pacientes con contraste espontáneo en la aurícula izquierda presentan trombos en esta cavidad35,31. Por otra parte, alrededor del 80% de los pacientes con trombos en la aurícula izquierda presentan contraste espontáneo en esta cavidad32,38. La existencia de contraste espontáneo en la aurícula izquierda se asocia con una mayor incidencia de ACV y otras embolias arteriales agudas, especialmente si además concurren otras condiciones, como dilatación de la aurícula izquierda y, sobre todo, fibrilación auricular39-41. Esto no sólo es así en pacientes con valvulopatía mitral, sino también en otras circunstancias. En el estudio de Shen et al, donde se estudió a 86 pacientes con miocardiopatía dilatada mediante ETE, 36 pacientes (42%) presentaron contraste espontáneo intracavitario, que estaba localizado en la aurícula izquierda en 35 de ellos. En este estudio, la existencia de contraste espontáneo se asoció con una mayor prevalencia de trombos intracavitarios y con una mayor incidencia de ACV42. En el estudio de Leung et al se analizó a 272 pacientes con fibrilación auricular no reumática mediante ETE43. Se observó contraste espontáneo en la aurícula izquierda en 161 pacientes (59%). Tras un seguimiento medio de 17,5 meses, la incidencia de ACV u otro tipo de embolia arterial aguda fue del 12% anual en los pacientes con contraste espontáneo en la aurícula izquierda. La mortalidad a largo plazo fue significativamente superior en los pacientes con contraste espontáneo. En este estudio, el único factor de riesgo independiente para la ocurrencia de eventos embólicos fue la existencia de contraste espontáneo en la aurícula izquierda43.
A pesar de la asociación entre el contraste espontáneo en la aurícula izquierda, la formación de trombos auriculares y la incidencia de tromboembolias sistémicas, aún no existen estudios que permitan identificar a los individuos en ritmo sinusal y con contraste espontáneo en la aurícula izquierda que podrían beneficiarse de la anticoagulación crónica.
Ateromas del arco aórtico
La primera evidencia clara de la posible asociación entre la presencia de placas ateromatosas de la aorta y accidente isquémico cerebral parte de los trabajos anatomopatológicos de Amarenco, que encontró, en un amplio grupo de 500 autopsias, placas ulceradas en el 26% de los pacientes con ACV y sólo el 5% del grupo control. Los pacientes de este estudio no tenían análisis ecocardiográficos ante mortem y, por tanto, la correlación entre estos hallazgos y la ETT era desconocida. A raíz de la llegada de la ETE (fig. 4), numerosos trabajos han confirmado que el riesgo de tener un ACV se multiplica entre 3 y 9 veces ante la presencia de un ateroma en el arco aórtico44-47. El aumento de riesgo más importante se produce cuando se seleccionan grupos en los que la ETE demuestra placas morfológicamente complejas, con ulceraciones y trombos sobreañadidos, lo que puede aumentar el riesgo hasta 17 veces48. Una vez detectadas las placas complejas, y de acuerdo con los resultados del estudio SPAF, la anticoagulación con warfarina y el mantenimiento de un INR entre 2 y 3 constituyen una alternativa para la reducción de los eventos embólicos49. Mayor controversia existe sobre la pauta a seguir en los pacientes con ACV en los que se demuestran placas grandes no complicadas (< 4 mm). Aunque existe alguna evidencia de que tal vez podrían beneficiarse de la anticoagulación con warfarina49, probablemente la opción más razonable sea utilizar antiagregantes y estatinas. Es sorprendente que hasta el momento no haya estudios controlados que definan el papel real de la antiagregación en la prevención de eventos en pacientes con placas complicadas. Por último, Stern50 ha sugerido la endarterectomía para la extracción de ateromas complicados, pero la morbilidad y mortalidad de esta cirugía no son despreciables por lo que debería reservarse únicamente para casos muy seleccionados.
Fig. 4. Ecocardiografía transesofágica de la aorta torácica en un caso de placa aórtica ulcerada y complicada.
Trombos ventriculares
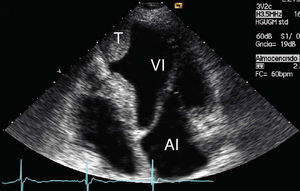
Ya sea en el seno del infarto agudo de miocardio o en el de la miocardiopatía dilatada, la ETT es el método diagnóstico de elección, y sólo excepcionalmente la ETE puede tener una utilidad real. El trombo se diagnostica ecocardiográficamente como una masa que ocupa un espacio en la cavidad ventricular, con evolucencia mayor que el miocardio adyacente y habitualmente localizado en un zona de mala contracción (fig. 5).
Fig. 5. Trombo apical (T) localizado en un aneurisma ventricular izquierdo postinfarto agudo de miocardio. AI: aurícula izquierda; VI: ventrículo izquierdo.
Un 1-2,5% de los pacientes con infarto agudo tienen un ACV, más de la mitad de los cuales suceden durante la primera semana y el resto dentro del primer mes. El riesgo permanece durante el primer trimestre y decrece progresivamente. Las causas que predisponen a la presencia de ACV en el seno de un infarto son bien conocidas e incluyen la localización de infarto (los infartos anteriores tienen 4 veces más trombos que los inferiores), la presencia de fibrilación auricular acompañante y la disfunción ventricular.
La ecocardiografía puede ser muy útil a la hora de establecer pautas de anticoagulación en el seno del infarto agudo. En el infarto inferior, la anticoagulación debe comenzarse si la ETT demuestra la presencia de trombos. En el infarto anterior se debe iniciar la anticoagulación hasta que la ETT descarte la existencia de trombo apical. La duración de la anticoagulación debe limitarse a 6 meses y deben analizarse las características evolutivas del trombo, la movilidad, la protrusión y el tamaño. La anticoagulación a más largo plazo parece ser especialmente beneficiosa en los casos con mala función ventricular y, así, en el estudio SAVE, cada disminución de 5% en la fracción de eyección estaba asociada a un incremento del riesgo del 18%51.
En los pacientes con miocardiopatía dilatada, el riesgo de accidente vascular periférico se sitúa entre el 2 y el 4% por año. De nuevo, la ETT es la técnica de elección para su detección. Existe una clara relación entre la fracción de eyección determinada por ecocardiografía y el riesgo de embolización. El estudio SOLVD52 ligaba esta relación básicamente al sexo femenino. No existen estudios que valoren la eficacia de la anticoagulación en pacientes con miocardiopatía dilatada. Sin embargo, la presencia de un trombo en el estudio ecocardiográfico debe plantear el inicio de la terapia con warfarina hasta su desaparición en estudios seriados53. En ausencia ecocardiográfica de trombos y si el paciente mantiene el ritmo sinusal y no tiene historia previa de embolización, el estudio SAVE51 demuestra la utilidad de la terapia preventiva con aspirina.
Endocarditis infecciosa
La embolia periférica es una de las complicaciones más frecuentes en pacientes con endocarditis infecciosa, aunque la verdadera incidencia es difícil de establecer puesto que en muchos casos la embolia puede ser subclínica. Sin embargo, estudios necroscópicos muestran hasta un 40% de embolización en el cerebro54. En nuestra serie, el 33% de los casos se iniciaron con alteraciones neurológicas55, aunque sólo en el 27% de los casos se demostraba la presencia de embolización sistémica. Habitualmente, el accidente embólico ocurre antes de que se establezca un diagnóstico correcto. Así, Steckelberg56 describe que la aparición de la complicación embólica disminuye con el tiempo en que se ha iniciado la terapia desde un 13 por 1.000 pacientes/día después de la primera semana de establecimiento de la terapia hasta menos de un 1,2% por 1.000 pacientes/día después de la segunda semana de tratamiento.
La ETE es, junto con los estudios microbiológicos, la herramienta básica para el diagnóstico de endocarditis. Se ha tratado de analizar si existen factores en el ecocardiograma que puedan identificar a un subgrupo de pacientes con riesgo de presentar embolización periférica. En primer lugar, la localización de la vegetación puede definir un primer grupo de riesgo, aunque es un tema que ha generado trabajos contradictorios. Rohmann et al57 han encontrado que el 25% de los pacientes con afección mitral tenían embolia periférica frente a sólo el 9,7% de los que presentaban endocarditis aórtica (p < 0,05); asimismo, la frecuencia de embolia aumentaba cuando la valva afectada era el velo anterior de la mitral (37%). Otos autores han comunicado datos similares58. Sin embargo, existen trabajos contradictorios y, así, los grupos de Mügge y Sanfilippo no encuentran relación entre la localización y el riesgo de embolización59,60.
Un dato que ha merecido especial atención en la bibliografía es la característica del tamaño y la movilidad de la vegetación en relación con el riesgo de embolización. En este sentido, ha habido trabajos con distintos resultados que se explican por la dificultad para estandarizar el tamaño de la verruga y la utilización de equipamientos diferentes. Sin embargo, existe un consenso general respecto a que las vegetaciones superiores a 10 mm tienen un mayor riesgo de tromboembolización. La cirugía cardíaca se debe indicar en los pacientes con recurrencia de la embolización, persistencia de cultivos positivos a pesar del tratamiento antibiótico, fallo cardíaco y abscesos, y puede ser aconsejada en caso de endocarditis fúngica.
Aneurisma del septo interauricular
El aneurisma del septo interauricular (ASI) es una protrusión del tabique interauricular superior a 10 mm en cualquiera de las cavidades auriculares. Su diagnóstico se establece por autopsia61 o por angiografía62. Sin embargo, su aparición en el escenario clínico está ligada al diagnóstico con ETT o con ETE (fig. 6), que se han convertido en las técnicas diagnósticas de elección; así, se ha descrito hasta en un 2,2% de la población normal en la que se realiza una ETE63. La importancia del ASI radica en que en el paciente joven con ACV, la frecuencia de aparición es hasta 4 veces superior a la de un grupo de pacientes normales ajustados por edad63.
Fig. 6. Ecocardiografía por vía subcostal que permite registrar la existencia de un aneurisma del septo interauricular que protruye hacia la aurícula derecha (AD). AI: aurícula izquierda.
El origen por el cual el ASI puede generar embolias periféricas ha sido muy discutido. Se ha propuesto que el aneurisma podría ser el lugar directo de la formación de los trombos. Sin embargo, en una serie de cerca de 200 pacientes con aneurisma sólo se pudo detectar trombos en el interior del mismo en un 1% de los casos64. Por otra parte, en muchos pacientes con ASI se asocia a otros orígenes de fuente embólica, como foramen oval permeable (FOP), fibrilación auricular y prolapso valvular mitral, que podrían ser la causa real del accidente embólico.
Recientemente la publicación de los resultados del ASA-FOP ha clarificado aspectos diagnósticos de importante repercusión clínica65. Se analizaron 581 pacientes con ACV de origen desconocido con un seguimiento de 4 años. El riesgo de recurrencia de ACV era muy bajo (2,3%) entre los pacientes con FOP, moderado en los pacientes con FOP y ASI (15,2%) y bajo en los pacientes con ninguna de estas anomalías (4,2%). No se encontró ninguna recurrencia entre los pacientes con únicamente ASI. Sólo el subgrupo de FOP y ASI tenía un riesgo de recurrencia superior (x4,2). Probablemente, la aspirina es el tratamiento de elección en los pacientes con ASI o FOP aislados. En los casos en que la ETE demuestre la combinación de ASI y FOP se debería llevar a cabo una terapia más agresiva, y es en estos pacientes en los que se podría plantear la combinación de antiagregantes, anticoagulación oral o cierre del FOP con métodos intervencionistas. Sin embargo, estas alternativas se deben evaluar a la luz de los resultados obtenidos en estudios aleatorizados.
Prolapso valvular mitral
Numerosos estudios han demostrado la asociación entre la presencia de prolapso mitral y ACV. Sin embargo, han surgido muchas discrepancias sobre el valor real de esta asociación, fundamentalmente porque los criterios diagnósticos de prolapso valvular mitral han sido muy variables y porque pueden estar presentes otras causas de tromboembolia en pacientes con prolapso mitral. Así, en el trabajo de Nishimura66, tras un análisis longitudinal de un importante grupo de pacientes, el 60% de los casos con ACV tenía fibrilación auricular acompañante, lo que hace difícil determinar la importancia causal directa del prolapso mitral.
A la vista del bajo riesgo absoluto de padecer un ACV y de las controversias generadas en el diagnóstico, lo que complica los resultados en diferentes trabajos, no resulta defendible la recomendación de tratamiento profiláctico primario en pacientes con prolapso mitral aislado.
En pacientes con prolapso mitral que desarrollan cuadros de isquemia retiniana o cerebral podría considerarse el tratamiento con antiagregantes. De los resultados de estudio SPAF se desprende que, en presencia de prolapso mitral con dilataciones de la aurícula izquierda importantes y/o arritmias auriculares, la warfarina podría estar recomendada67.
Foramen oval permeable
La ETE es el método de elección para la valoración de la permeabilidad del foramen oval. Aunque la técnica de Doppler color puede poner de manifiesto el cortocircuito, es la inyección venosa por una vía periférica del brazo y el registro con ETE lo que muestra una mayor sensibilidad para la detección de cortocircuitos mínimos. El estudio se realiza en condiciones basales y tras la maniobra de Valsalva, que consigue aumentar la presión de la aurícula derecha y registrar shunts interatriales no presentes en condiciones basales (fig. 7).
Fig. 7. Ecocardiografía transesofágica en un paciente con foramen oval permeable. Tras la inyección de contraste, se registra su paso a la cavidad auricular izquierda. AD: aurícula derecha; AO: aorta; AI: aurícula izquierda.
La ETE muestra que la incidencia de FOP se sitúa en el 3-39% de la población. Chen et al68,69 han demostrado que prácticamente todos los pacientes con FOP en cirugía o cateterismo eran identificados correctamente con ETE. La importancia del FOP se encuentra definida porque en estudios en pacientes con ACV agudo (ACVA) y controles menores de 55 años el FOP fue 3 veces más frecuente en los pacientes con episodios isquémicos cerebrales que en la población normal70. Por otra parte, en los pacientes en los que identificamos un FOP tras un episodio de ACVA, la tasa combinada de recurrencia es de un 3% anual.
El motivo por el cual el FOP podría causar un ACV ha sido una de las controversias todavía abiertas en el estudio del paciente con sospecha de cardioembolia. Se ha sugerido en primer lugar la posibilidad de la presencia de una embolia paradójica a través del FOP. Esta atractiva hipótesis tiene, sin embargo, notables puntos oscuros. Así, se debería exigir la presencia de una trombosis venosa profunda que fuese el origen de la embolia paradójica. Sin embargo, hay una creciente información en la bibliografía que confirma que la trombosis venosa profunda y la embolia pulmonar tienen una tasa muy baja en los pacientes con FOP y ACVA, lo que indicaría que en muchos casos el mecanismo causal es diferente71. Así, se ha sugerido la embolia directa de un trombo generado en la zona anormal del tabique72, la isquemia cerebral en relación con una mayor incidencia de fibrilación auricular paroxística en estos enfermos73 o, por último, la asociación frecuente con ASI, que sería el real origen de la tromboembolia74,75. Las pautas de actuación se corresponden con las indicadas en el ASI.
Alteraciones de la coagulación
Dentro de los estados de hipercoagulabilidad, sin duda, el síndrome antifosfolipídico es el ejemplo de trastorno de coagulación asociado a la presencia de cardioembolia y trombosis vascular. Galve et al, en uno de los grupos más activos en el estudio de este síndrome, encuentran en un 38% de casos con síndrome antifosfolipídico primario una afección de las válvulas mitral y aórtica76-79. Las lesiones se detectan ecocardiográficamente como un engrosamiento valvular localizado. Histológicamente, la lesión se encuentra definida por un denso tejido fibroso con plaquetas y trombos asociados en los márgenes de las masas. De manera excepcional se pueden encontrar trombos intracavitarios asociados en ausencia de otras lesiones cardíacas (fig. 8).
Fig. 8. Ecocardiografía transesofágica en un paciente con síndrome antifosfolipídico primario. Se registra un pequeño engrosamiento en el borde libre del velo anterior mitral. AI: aurícula izquierda; VI: ventrículo izquierdo.
El hallazgo aislado de anticuerpos antifosfolipídicos en ausencia de manifestación clínica no indica que el paciente deba recibir tratamiento. Los pacientes con manifestaciones de trombosis o accidente vascular probablemente precisen tratamiento con warfarina. Algunos autores recomiendan que el INR se mantenga entre 3 y 3,580. En los pacientes con hallazgos ecocardiográficos aislados no se debería iniciar ningún tipo de terapia específica.
Eco-Doppler de troncos supraaórticos y Doppler transcraneal
Diagnóstico y seguimiento del ictus
En los últimos años, el DTC se ha establecido como una técnica básica complementaria en los pacientes con ACV que permite detectar las estenosis intracraneales. Estudios de correlación con métodos invasivos con arteriografía demuestran una sensibilidad y especificidad muy elevadas81 en el diagnóstico de estenosis intracraneales. El DTC permite diagnosticar la oclusión aguda por medio del análisis por vía transtemporal de los flujos de la arteria cerebral media y su comparación con la arteria contralateral. El seguimiento tras el ACV permitirá valorar el momento en el que se produce la recanalización de la arteria, ya sea espontáneamente o por trombólisis. Hace poco, Demchuk et al81 han establecido una clasificación del grado de reperfusión sobre la base de las características del flujo evaluado con DTC y han confirmado que es un predictor de la severidad de la afección, la recuperación temprana y la mortalidad en pacientes tratados con fibrinólisis. Sin embargo, la utilidad del DTC es limitada en el territorio de la arteria basilar por la dificultad técnica de estudiar dicha arteria en todo su trayecto.
Estudio del foramen oval permeable
Un método alternativo a la ETE muy importante para la valoración del FOP es la detección de las microcavitaciones en la circulación cerebral tras la inyección intravenosa por una vía periférica de suero fisiológico agitado. Las señales detectadas están generadas por las microburbujas que, en su interacción con el ultrasonido, producen una señal transitoria de alta intensidad en el registro Doppler conocida con el nombre de HITS (High Intensity Transient Signal). Serena et al82 han demostrado que es posible valorar la severidad del shunt a través del foramen oval, y lo que es más importante, definir un grupo de pacientes con alto riesgo de padecer ACV. La severidad del shunt se establecía en el recuento de señales Doppler detectadas en la arteria cerebral media, al encontrar un patrón con más de 25 señales (patrón ducha) o con muy numerosas señales (patrón cortina) (fig. 9). La presencia de uno de los 2 patrones se asociaba con un riesgo elevado de padecer ACV (odds ratio [OR] = 3,5), particularmente en aquellos casos en los que el ACV era criptogénico (OR = 12). Este importante trabajo define con claridad la utilidad del DTC en el paciente con foramen oval como complemento de esta técnica a la ETE en la valoración del foramen oval y su importancia clínica.
Fig. 9. Diagnóstico del foramen oval permeable por medio del estudio del Doppler en la arteria cerebral media. superior: patrón sugerente de cortocircuito más que ligero. Medio: patrón en ducha. inferior: patrón en cortina.
Eco-Doppler de troncos supraaóticos
Cerca de un 30% de los pacientes con accidente isquémico cerebral presentan enfermedad corotídea. Clásicamente ha sido la angiografía la técnica de elección para establecer la gravedad y las implicaciones terapéuticas de la enfermedad carotídea. Recientemente, tras la publicación de los estudios ECST y NASCET83,84, sabemos que está indicado el tratamiento quirúrgico en lesiones superiores al 75-80%. La eco-Doppler de troncos supraaórticos no sólo permite valorar las características de localización de la placa de ateroma, sino evaluar la severidad de la lesión. El parámetro más utilizado es el cálculo de la velocidad sistólica máxima, que nos indicará una estenosis superior al 70% cuando la velocidad de flujo sea superior a 215 cm/s. Es importante recordar que cerca de la mitad de los pacientes con AIT presentan estenosis carotídeas menores del 50%. En estos casos es necesario valorar las características de la placa y definir las que, por su importantes alteraciones, tienen un riesgo elevado de generar un ictus arterial.
La monitorización con Doppler de la presencia de HITS se ha descrito en presencia de fibrilación auricular, prótesis cardíacas, estenosis intracaneales y durante la endarterectomía. En casos con enfermedad carotídea significativa, su existencia es más común en pacientes con estenosis carotídea sintomática y, por tanto, sería un importante marcador de placa inestable y podría predecir la posibilidad de embolia clínica.
PAUTAS DIAGNÓSTICAS ANTE UN PACIENTE CON ICTUS ISQUÉMICO
El primer paso básico ante un paciente con cuadro de ictus es definir el origen entre isquémico o hemorrágico del cuadro, ya que este primer paso diagnóstico orientará toda la toma de decisiones y el tratamiento subsiguiente. En la tabla 1 se indican los tests inmediatos que deben realizarse en el momento del ingreso en el hospital. Habitualmente, las técnicas de TC son las más estandarizadas para diferenciar el origen hemorrágico o isquémico del ictus, más aún si tenemos en cuenta que la clínica y la presentación se solapan en gran medida en ambos orígenes etiológicos (fig. 10).
Fig. 10. Decisiones clínicas basadas en técnicas de imagen en el paciente con sospecha de ACVA. ACVA: accidente cerebrovascular agudo; TC: tomografía computarizada; LCR: líquido cefalorraquídeo; rt-PA: activador tisular del plasminógeno.
Una vez establecido el tipo etiológico inicial y ante la sospecha de cardioembolia, no existe consenso general sobre el momento de realizar un ETT o ETE. A continuación exponemos nuestras recomendaciones (tabla 2).
Indicaciones para la realización de ETT
Se debe realizar ETT en todo paciente con sospecha o cribado de cardioembolia. Habitualmente, mediante electrocardiograma y exploración clínica podemos diagnosticar alrededor del 8-10% de los de origen cardioembólico. Con la llegada del ecocardiograma estándar esta cifra alcanza un 15-17%. Sin duda, el rendimiento de la prueba es escaso, pero duplica el número de diagnósticos clínicos. Hoy día, el ecocardiograma es una técnica básica sistemática integrada de tal manera en la clínica cardiológica que consideramos que no se justifica su exclusión sobre la base de un bajo rendimiento. Por otra parte, según nuestra experiencia, casi un 25% de los pacientes con enfermedad carotídea demostrada tiene a su vez otra causa embólica secundaria, por lo que el hallazgo positivo después del estudio de los troncos supraaórticos no excluye la práctica de una ETT.
Principales indicaciones de realización de ETT
Sin duda, el enfermo más común es el paciente joven con ictus. En estos casos, la búsqueda de FOP hace casi obligatoria la ETE, al igual que en todos los casos en que se sospecha la presencia de embolia paradójica. Asimismo, se debe hacer ETE a toda prótesis cardíaca con cuadro de ACV. Por último, toda ETT que ofrezca dudas diagnósticas, o ante una mala ventana con sospecha de cardioembolia, es preciso realizar una ETE
Indicaciones de probable realización de ETT
Los pacientes con ACV con una alta sospecha de arteriosclerosis aórtica en los que se busquen placas complicadas ateromatosas, así como en los casos con lesión mitral o fibrilación auricular embolígena, probablemente deberían realizarse una ETT.
CONCLUSIÓN
El ictus cerebrovascular y específicamente el ictus cardioembólico exigen, para una correcta valoración, la integración de distintas áreas y especialidades del hospital que justifican la creación funcional de las unidades de ictus específicamente dedicadas a esta afección.
La colaboración del área específica del laboratorio de ecocardiografía con los servicios de neurología es básica para la realización y el mantenimiento de protocolos asistenciales que permitan atender y diagnosticar correctamente al enfermo neurológico. Los notables avances de los últimos años nos han permitido conocer nuevas etiologías y su valor como origen de cardioembolia. No obstante, y a pesar de los notables avances, existen dudas diagnósticas en las distintas opciones terapéuticas que hacen que se deba seguir avanzando en este fascinante campo diagnóstico.
Sección patrocinada por el Laboratorio Dr. Esteve
Correspondencia: Dr. M.A. García Fernández.
Sección de Cardiología no Invasiva. Laboratorio de Ecocardiografía.
Hospital General Universitario Gregorio Marañón.
Dr. Esquerdo, 43. 28007 Madrid. España.
Correo electrónico: Magfeco@primustel.es