La ablación es uno de los pilares del tratamiento de las taquicardias ventriculares (TV)1,2. La presión es importante para determinar el tamaño y la eficacia potencial de las lesiones de ablación3,4. Los catéteres convencionales no proporcionan una información directa de la presión que ejercen contra el tejido, que se estima indirectamente mediante el voltaje de la señal y la sensación percibida por el operador. En el mapeo electroanatómico del sustrato de las TV, la ausencia de contacto entre el catéter y el endocardio puede generar electrocardiogramas de bajo voltaje que originen una delimitación errónea de las escaras reales y eventualmente la pérdida de canales involucrados en el mantenimiento de la TV. Una información directa de la fuerza aplicada en la punta del catéter podría mejorar la delimitación del tejido eléctricamente anormal en pacientes con sustrato para TV.
Los objetivos principales de este trabajo son comparar las áreas de escara obtenidas mediante un mapa de voltaje convencional con las obtenidas en un mapa que incorpora la información de la fuerza de contacto en pacientes con TV, y determinar si esta información permite mejorar el mapa convencional mediante la correción de los puntos adquiridos en áreas sin contacto.
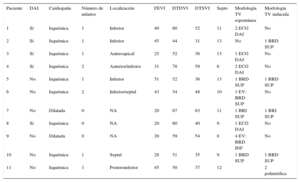
Para el estudio se incluyó a 11 pacientes (8 varones; media de edad, 64,9 [38-80] años) (tabla) con arritmias ventriculares debidas a miocardiopatía isquémica o miocardiopatía dilatada sometidos a ablación de TV por indicación clínica. El estudio fue aprobado por el Comité Ético del hospital e inscrito en el registro de ensayos clínicos clinicaltrials.gov con el identificador NCT01639365.
Características demográficas y clínicas
| Paciente | DAI | Cardiopatía | Número de infartos | Localización | FEVI | DTDVI | DTSVI | Septo | Morfología TV espontánea | Morfología TV inducida |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Sí | Isquémica | 1 | Inferior | 40 | 60 | 52 | 11 | 2 ECG DAI | No |
| 2 | Sí | Isquémica | 1 | Inferior | 45 | 44 | 31 | 13 | No | 1 BRD SUP |
| 3 | Sí | Isquémica | 1 | Anteroapical | 25 | 52 | 36 | 13 | 1 ECG DAI | No |
| 4 | Sí | Isquémica | 2 | Anterior/inferior | 31 | 78 | 59 | 6 | 2 ECG DAI | No |
| 5 | No | Isquémica | 1 | Inferior | 51 | 52 | 36 | 13 | 1 BRD SUP | 1 BRD SUP |
| 6 | No | Isquémica | 2 | Inferior/septal | 43 | 54 | 48 | 10 | 1 EV: BRD SUP | No |
| 7 | No | Dilatada | 0 | NA | 20 | 67 | 63 | 11 | 1 BRI SUP | 1 BRI SUP |
| 8 | Sí | Isquémica | 0 | NA | 20 | 60 | 40 | 9 | 1 ECG DAI | No |
| 9 | No | Dilatada | 0 | NA | 20 | 59 | 54 | 8 | 4 EV: BRD INF | No |
| 10 | No | Isquémica | 1 | Septal | 28 | 51 | 35 | 9 | 1 BRD SUP | 1 BRD SUP |
| 11 | No | Isquémica | 1 | Posteroinferior | 45 | 50 | 37 | 12 | 2 polimórfica |
BRD: bloqueo de rama derecha; BRI: bloqueo de rama izquierda; DAI: desfibrilador automático implantable; DTDVI: diámetro telediastólico del ventrículo izquierdo; DTSVI: diámetro telesistólico del ventrículo izquierdo; ECG: electrocardiograma; EV: extrasístole ventricular; FEVI: fracción eyección del ventrículo izquierdo; INF: eje frontal inferior; NA: no aplicable; SUP: eje frontal superior; TV: taquicardia ventricular.
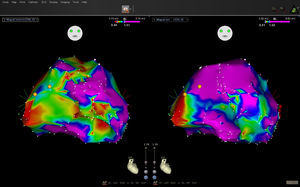
Se adquirió un mapa de voltaje del ventrículo izquierdo durante ritmo sinusal con sistema de navegación Carto® 3 y catéter Navistar Thermo Cool (Biosense-Webster; Diamond Bar, California, Estados Unidos). Se etiquetaron los puntos con potenciales fragmentados o tardíos y se ajustó el código de color del mapa de voltaje para localizar canales (mapa de control). La información de fuerza en cada punto captado fue adquirida por el sistema, pero el operador no dispuso de ella durante la adquisición del mapa de control. Una vez terminado este, se ofreció al operador la información de contacto y se procedió a una nueva captación de puntos para corregir las áreas previamente adquiridas con contacto inadecuado (mapa final). Se clasificó cada punto del mapa control sin contacto como escara (< 0,5 mV), de bajo voltaje (0,5–1,5 mV) o normal (> 1,5 mV). Se compararon el tamaño de las escaras, los potenciales anormales y los canales detectados en el mapa de control y el mapa final (figura).
Hemos observado que el área media no varió en general de manera significativa entre el mapa de control (10,08 ± 6,48 cm2) y el final (7,69 ± 9,21cm2), pero en 9 escaras el área fue claramente mayor en el mapa inicial; en 3, en el mapa final y en las 17 restantes, el tamaño estimado en ambos mapas fue similar. La diferencia de áreas en valor absoluto entre ambos mapas fue de 5,38 ± 7,32cm2. En 10 de las 29 escaras analizadas la información de contacto modificó la estimación del área en más de un 50%. Se detectaron en el mapa de control 8 canales de conducción en 6 pacientes. De ellos, 3 no los confirmó el mapa final. En 3 casos se definió un canal adicional. En 4 pacientes se detectaron zonas con potenciales de bajo voltaje compatibles con área anormal, que desaparecieron al remapear la zona en el mapa final. Las áreas sin contacto en los mapas de control con potenciales < 0,5, 0,5–1,5 y > 1,5 mV fueron 12,3, 18,5 y 8,6 cm2 respectivamente.
El principal hallazgo del estudio es la demostración de que el uso del catéter con sensor de fuerza permite definir con mayor exactitud el área real de las escaras y las zonas con potenciales reducidos. Nuestros datos confirman que un voltaje normal no implica la existencia de contacto, y que la falta de contacto puede también generar electrocardiogramas de voltaje reducido. La detección de canales también se modificó por la información de contacto. La delimitación de canales depende de la diferencia entre los voltajes registrados en una zona y las adyacentes. La evidencia de falta de contacto en algunas zonas indujo un mapeo más detallado, de los que se concluye que los valores del potencial eran más homogéneos y que se había asumido un falso canal en el mapa control. Se ha señalado que la mejora del contacto aumenta la sensibilidad de detección de potenciales tardíos5; sin embargo, en nuestra serie no observamos este efecto, quizá debido al reducido tamaño de la muestra. La elección del valor de 5 g como indicio de contacto se basó en la observación de que, con el catéter libre en el ventrículo durante la calibración del sistema, la fuerza ejercida por la sangre contra el sensor del catéter fue ≤ 5 g. Otros autores han considerado otros valores de corte5, pero son necesarios nuevos estudios para definir los valores más adecuados, tanto para el mapeo como para la aplicación de radiofrecuencia con esta tecnología.
Podemos concluir que el contacto inadecuado del catéter de mapeo con la pared ventricular puede causar una estimación incorrecta del tamaño de las escaras en el mapa electroanatómico, tanto por defecto como por exceso, y puede dificultar la interpretación de las áreas con potenciales reducidos, y que parece que el uso de un catéter de ablación con sensor de fuerza reduce estos errores sustancialmente.