Palabras clave
INTRODUCCIÓN
Las fugas perivalvulares (FPV) son frecuentes después de la cirugía. Si utilizamos la ecocardiografía transesofágica (ETE), se detecta hasta en un 17,6% de los casos tras sustitución valvular aórtica y en un 22,6% de las mitrales1,2. Habitualmente, se desarrollan como resultado de la rotura de alguna de las suturas, y es más prevalente en pacientes con enfermedad del anillo valvular debido a endocarditis infecciosa, calcio o cirugía previa.
Estas FPV suelen ser pequeñas y sin repercusión clínica importante, con tendencia a mejorar o desaparecer en el seguimiento, pero en ocasiones pueden presentar complicaciones graves: anemia hemolítica que requiere transfusiones sanguíneas repetidas o insuficiencia cardiaca congestiva.
La reintervención por FPV es rara (< 2%), pero es el tratamiento de elección para la gran mayoría de los pacientes3, aunque la mortalidad es elevada (tasas > 10%) y las recurrencias no son infrecuentes4,5.
En la actualidad está bien establecido el uso de los dispositivos Amplatzer en el tratamiento percutáneo de determinadas cardiopatías congénitas6-8. Recientemente se ha descrito su uso en el tratamiento de las FPV en casos aislados o series cortas9-11.
Presentamos nuestra experiencia inicial en el cierre percutáneo de las FPV con el uso de dispositivos Amplatzer.
MÉTODOS
Pacientes
Entre 2004 y 2006, se planteó realizar cierre percutáneo de FPV a 12 pacientes; todos ellos presentaban regurgitación severa. Tras ser evaluados junto con cirugía cardiaca, se indicó en 8 pacientes el cierre percutáneo porque presentaban insuficiencia cardiaca (clase funcional III-IV de la NYHA), anemia hemolítica severa que precisaba transfusiones sanguíneas repetidas o ambas indicaciones, junto con elevado riesgo quirúrgico o previsibles dificultades técnicas. Se excluyó a 4 por alguna de las siguientes características: varias fugas, bajo riesgo quirúrgico o situación basal paucisintomática.
Se realizó un estudio ecocardiográfico transtorácico y ETE para confirmar el diagnóstico y definir el tamaño, la localización y el número de fugas. Se consideró severa la regurgitación según los parámetros establecidos por la Sociedad Americana de Ecocardiografía, correlacionados con los grados de Seller por la angiografía12.
La anemia hemolítica fue definida por una concentración de hemoglobina < 10 g/dl en las últimas 2 semanas, con parámetros bioquímicos compatibles con hemolisis. Se consideró anemia severa cuando fue necesario realizar transfusiones sanguíneas.
Se calculó el EuroScore para predecir la mortalidad operatoria y valorar el riesgo quirúrgico.
Los pacientes fueron monitorizados durante 24 h tras el procedimiento, se realizó ecocardiograma de control antes del alta y se los siguió clínica y ecocardiográficamente a los 6 y a los 12 meses.
Técnica del procedimiento
Antes de la intervención, se administró profilaxis de endocarditis infecciosa (cefminox 2 g i.v.) y 5.000-10.000 UI de heparina sódica. Todos los procedimientos se llevaron a cabo con anestesia local y sólo en un caso se guió por ETE.
El procedimiento se realizó según la técnica previamente descrita13,14. Para el cierre de las FPV mitrales se realizó por vía anterógrada, a través de cateterismo transeptal, realizado con aguja de Brockenbrough y sistema de Mullins. Se avanzó a través de la funda de Mullins un catéter diagnóstico (tipo Judkins derecho o multipropósito) a la aurícula izquierda. A través del catéter, se pasó una guía hidrofílica Terumo para atravesar la FPV, se avanzó el catéter a través de la FPV y se cambió la guía hidrofílica por una de alto soporte de 260 cm. A continuación se avanzó el sistema de liberación Amplatzer y, una vez posicionado sobre la dehiscencia, se liberó el dispositivo Amplatzer oclusor de ductus (AGA Medical Corporation, Golden Valley, Estados Unidos), tras comprobar que no interfería en el correcto funcionamiento de la prótesis (fig. 1). El tamaño del dispositivo era al menos 2 mm mayor que las dimensiones estimadas por ecocardiografía y angiografía.
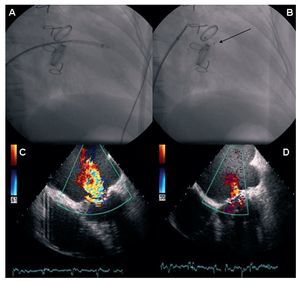
Fig. 1. Procedimiento de cierre de la fuga perivalvular mitral guiado con ETE por tener prótesis mecánica aórtica y mitral. A: avance de la funda transportadora a través de la dehiscencia. B: se libera el dispositivo. C y D: la ETE durante el procedimiento muestra la disminución del grado de regurgitación mitral.
El cierre de las FPV aórticas se realizó por vía retrógrada a través de la arteria humeral derecha, ya que la longitud del sistema de liberación Amplatzer 80 cm impediría el acceso femoral, salvo en personas de talla muy baja. A través de un catéter de diagnóstico (tipo Amplatz) se avanzó la guía hidrofílica hasta cruzar la FPV, y el resto del procedimiento fue se similar al anterior (fig. 2).
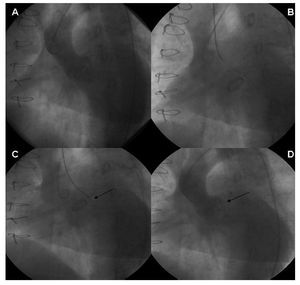
Fig. 2. Procedimiento de cierre de la fuga perivalvular aórtica. A: aortografía inicial. B: paso de guía hidrofílica. C: liberación del dispositivo. D: control angiográfico final que muestra disminución del grado de regurgitación.
RESULTADOS
Las FPV eran 4 aórticas y 4 mitrales. Las características clínicas basales están resumidas en la tabla 1.
La mortalidad media estimada preoperatoriamente con el EuroSCORE fue del 21,5% (intervalo, 5,48%-54,82%). La paciente con EuroSCORE del 5,48% estaba reoperada por FPV y tenía antecedentes de endocarditis infecciosa.
Implantación, complicaciones y resultados inmediatos
El cierre percutáneo de la FPV se llevó a cabo tras una mediana de 79 (7-264) meses desde la última sustitución valvular. En un caso de FPV mitral, se realizó simultáneamente una valvuloplastia de tricúspide.
La implantación del dispositivo fue posible en 7 (87,5%) pacientes, aunque en uno de los casos de FPV aórtica se consiguió en un segundo procedimiento (en el primer intento no se dispuso de un dispositivo de tamaño adecuado, ya que la FPV era más grande que la estimada por ecocardiografía). En un paciente con FPV aórtica no fue factible la implantación del dispositivo por dificultad de avance del sistema de liberación a través de la FPV. No hubo ninguna complicación durante el procedimiento.
De los 3 pacientes con FPV aórtica con implantación del dispositivo, la disminución del grado de regurgitación fue evidente angiográfica y ecocardiográficamente en 2 pacientes. De los 4 pacientes con FPV mitral tratados, la regurgitación disminuyó en 2 y persistió la regurgitación perivalvular severa en los demás.
En el seguimiento a medio plazo (tabla 1), presentaron mejoría clínica los pacientes en que se había conseguido reducir el grado de regurgitación (4 de 7 pacientes). Un paciente con disfunción ventricular severa requirió implante de desfibrilador por taquicardia ventricular sostenida.
De los 3 pacientes sin mejoría del grado de regurgitación, 1 fue intervenido 1 mes después sin complicaciones y 2 fallecieron de causa no cardiaca (neumonía a los 30 días y hemorragia digestiva a los 14 meses).
DISCUSIÓN
La incidencia de FPV sintomática en la que nos planteamos la reintervención es baja. La reoperación es el tratamiento de elección para la gran mayoría de los pacientes, y muchas series quirúrgicas publicadas refieren mortalidades < 10%, resultados superiores a los del tratamiento médico15. Sin embargo, estos resultados podrían estar infravalorados porque algunos pacientes de muy alto riesgo quirúrgico no se lleguen a plantear siquiera la reintervención, cuando el tratamiento percutáneo con dispositivos Amplatzer podría ser una opción terapéutica.
En nuestra serie, todos los pacientes se encontraban muy sintomáticos y el riesgo operatorio era alto, con un EuroSORE medio del 21,5%. Conseguimos implantar el dispositivo en el 87,5% y una mejoría clínica asociada a la disminución de la regurgitación periprotésica en el 57% de los casos, que se mantuvo (GF I o II) tras 12 meses de seguimiento. No hubo mortalidad ni complicaciones graves durante el procedimiento (embolización del dispositivo, interferencia con la prótesis), lo que refleja que la técnica puede ser segura. En el seguimiento no se presentó anemia hemolítica en ningún caso. Posiblemente, la regurgitación que persisitió en algunos pacientes se debiera al sellado incompleto de la dehiscencia, motivado por selección inadecuada del tamaño del dispositivo, dehiscencias múltiples y, fundamentalmente, el uso del dispositivo Amplatzer circular, que está diseñado para el cierre de determinadas cardiopatías congénitas pero no para FPV, que pueden tener morfología en semiluna.
Las mejorías clínica y angiográfica de los mitrales y los aórticos fueron similares a pesar de un fallo de implantación aórtico. Aunque hay diferencias técnicas en el abordaje, de mayor complejidad para las FPV mitrales, que pueden condicionar el resultado, éste también va a depender de la morfología de la FPV.
En la literatura están descritos casos aislados y series con escaso número, en su mayoría FPV mitrales, siempre con anestesia general y guiados con ETE, con resultados similares a los nuestros. Shapira et al9, con 11 casos (8 mitrales), obtuvieron una tasa de implantación del 90,9% y una reducción del grado de regurgitación del 60%. Pate et al10, con 10 pacientes (9 mitrales), obtuvieron tasa de implantes del 70% y éxito angiográfico en el 60%, aunque 1 paciente requirió cirugía urgente.
Limitaciones
Las principales limitaciones son que se trata de una serie corta, monocéntrica y con resultados dependientes del operador, ya que es una técnica compleja.
Además, el dispositivo de Amplatzer no ésta específicamente diseñado para el tratamiento de las FPV, lo cual puede justificar algunos fracasos y dificultades de la técnica.
En conclusión, los resultados parecen indicar que el tratamiento percutáneo de las FPV, tanto mitrales como aórticas, es técnicamente factible y seguro, y puede ser una alternativa terapéutica en pacientes con alto riesgo quirúrgico.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. A.J. Muñoz-García.
Campus de Teatinos, s/n. 29010 Málaga. España.
Correo electrónico: ajmunozgarcia@secardiologia.es
Recibido el 19 de febrero de 2008.
Aceptado para su publicación el 15 de julio de 2008.