La razón entre el desplazamiento sistólico del plano del anillo tricuspídeo y la presión arterial pulmonar sistólica (TAPSE/PAPS) es una medida no invasiva del acoplamiento entre el ventrículo derecho y la circulación pulmonar con implicaciones pronósticas en pacientes con insuficiencia cardiaca (IC) o hipertensión pulmonar. El objetivo es evaluar el valor pronóstico del cociente TAPSE/PAPS en pacientes con amiloidosis cardiaca.
MétodosA partir de la base de datos del registro de amiloidosis cardiaca de Galicia (estudio AMIGAL), un registro observacional prospectivo de pacientes con amiloidosis cardiaca inscritos en 7 hospitales de la Comunidad Autónoma de Galicia entre el 1 de enero de 2018 y el 31 de octubre de 2022, se seleccionó a los que tenían calculado el cociente TAPSE/PAPS mediante ecocardiografía. Se evaluaron la supervivencia y la supervivencia libre de ingresos por IC mediante 5 modelos de regresión de Cox multivariable. La mediana de seguimiento fue de 680 días.
ResultadosSe estudió a 233 pacientes con amiloidosis cardiaca, que 209 (89,7%) de ellos era del tipo transtirretina. La razón TAPSE/PAPS basal se correlacionó significativamente con los desenlaces clínicos. Dependiendo del modelo multivariable, la hazard ratio estimada por un incremento de 0,1 mm/mmHg del cociente TAPSE/PAPS osciló entre 0,76 y 0,84 para muerte por cualquier causa y entre 0,79 y 0,86 para muerte por cualquier causa u hospitalización por IC. La adición del cociente TAPSE/PAPS al modelo predictivo del Centro Nacional de Amiloidosis del Reino Unido resultó en un incremento del estadístico C de Harrell de 0,662 a 0,705 para muerte por cualquier causa y de 0,668 a 0,707 para muerte por cualquier causa u hospitalización por IC.
ConclusionesUna razón TAPSE/PAPS reducida es un marcador pronóstico adverso independiente en pacientes con amiloidosis cardiaca.
Palabras clave
La amiloidosis cardiaca es un grupo de enfermedades infiltrativas causadas por el depósito de fibrillas de amiloide en el miocardio. Estas fibrillas están compuestas con mayor frecuencia por cadenas ligeras de inmunoglobulina monoclonal (tipo AL) o transtirretina mal plegada (tipo ATTR) en uno de sus subtipos: hereditaria por mutaciones en TTR o en su forma natural o wild-type1,2.
El fenotipo clínico más frecuente de la amiloidosis cardiaca es la insuficiencia cardiaca (IC) con fracción de eyección del ventrículo izquierdo (FEVI) conservada, que puede evolucionar a miocardiopatía restrictiva grave3,4. La hipertensión pulmonar puede aparecer como consecuencia de la transmisión retrógrada de presiones de llenado del ventrículo izquierdo elevadas a la circulación pulmonar, lo que afecta negativamente al pronóstico5,6. En esta situación clínica, la eficacia de la adaptación del ventrículo derecho al aumento de la poscarga es un conocido factor decisivo en la gravedad de los síntomas y la evolución a largo plazo7,8.
El cateterismo cardiaco invasivo sigue siendo el método de referencia para evaluar el acoplamiento del ventrículo derecho a la arteria pulmonar9. Sin embargo, también se puede evaluar de manera fiable mediante un método no invasivo, el cociente entre el desplazamiento sistólico del plano del anillo tricuspídeo (TAPSE) y la presión arterial pulmonar sistólica (PAPS), que se puede medir con ecocardiografía transtorácica10,11. Estudios previos han demostrado que un cociente TAPSE/PAPS reducido, que indica el desacoplamiento del ventrículo derecho de la arteria pulmonar, es un potente predictor independiente de resultados adversos en pacientes con hipertensión pulmonar primaria10,12 o IC con FEVIreducida o conservada11,13.
Las implicaciones pronósticas del cociente TAPSE/PAPS en pacientes con amiloidosis cardiaca aún no se han aclarado. Comprender el papel potencial de este valor podría proporcionar más información sobre la evolución natural de la enfermedad, así como un instrumento pronóstico no invasivo útil y viable que podría utilizarse junto con los sistemas de estadificación con biomarcadores validados14,15. Por ello, el objetivo de este estudio es describir la distribución del cociente TAPSE/PAPS y evaluar sus implicaciones pronósticas en una cohorte multicéntrica de pacientes con amiloidosis cardiaca.
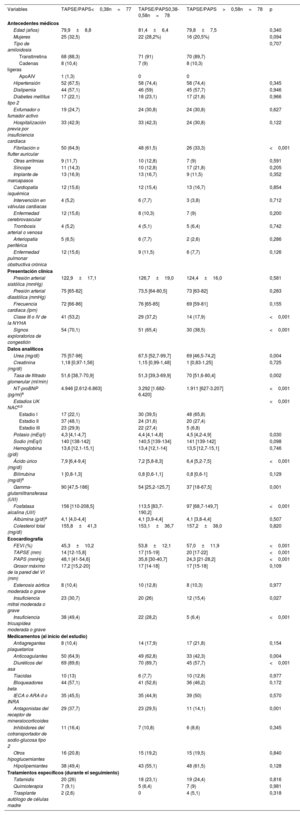
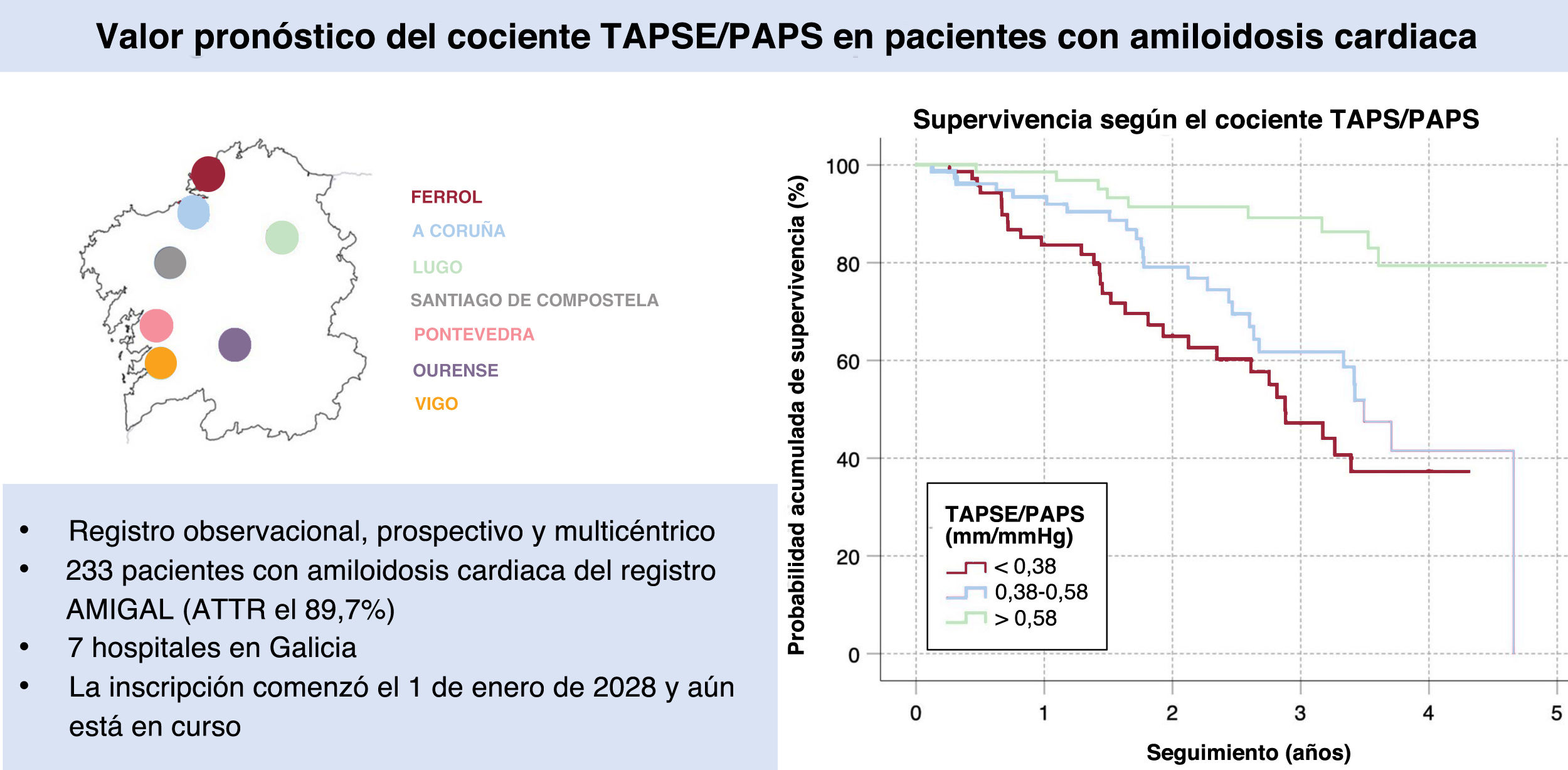
MÉTODOSDiseño del estudioLos datos clínicos utilizados para el presente estudio se extrajeron de la base de datos del registro observacional, prospectivo y multicéntrico AMIGAL, con pacientes consecutivos con miocardiopatía amiloide inscritos en 7 hospitales del sistema público sanitario de la Comunidad Autónoma de Galicia (figura 1). La inscripción de pacientes comenzó el 1 de enero de 2018 y aún está en curso. Para el presente análisis, se seleccionó a pacientes que habían sido incorporados al registro desde su inicio hasta el 31 de octubre de 2022.
Según el protocolo del estudio, descrito en otra parte16, el diagnóstico de amiloidosis cardiaca AL se establece mediante la detección de depósitos de cadenas ligeras en muestras de biopsias endomiocárdicas solas o de una biopsia no cardiaca, junto con hallazgos de imagen cardiaca claros que lo indiquen. La amiloidosis cardiaca ATTR se define por una captación cardiaca de grado ≥ 2 en la gammagrafía con ácido 3,3-difosfono-1,2-propanodicarboxílico en pacientes sin evidencia de gammapatía monoclonal en la inmunofijación en sangre y orina, y en el análisis de cadenas ligeras libres en suero. La confirmación histológica de los depósitos de transtirretina solo se requiere si existe gammapatía monoclonal. Se recomienda una prueba genética para descubrir variantes patógenas del gen de la transtirretina en pacientes con amiloidosis cardiaca ATTR. El diagnóstico de otros tipos de amiloidosis cardiaca distintos de AL y ATTR, como amiloidosis cardiaca apoAIV, requiere la demostración de un depósito anómalo de la proteína causal en muestras de biopsias endomiocárdicas mediante espectrofotometría de masas.
El protocolo del estudio fue aprobado por el Comité de Ética de Investigación Clínica de Galicia, y se obtuvo el consentimiento informado por escrito de todos los participantes antes de la inscripción. El proyecto se ajusta a los principios descritos en la Declaración de Helsinki.
EcocardiografíaCardiólogos colegiados llevaron a cabo las ecocardiografías transtorácicas durante el seguimiento clínico habitual y según la guía de práctica clínica17. Se recopilaron datos sobre los valores ecocardiográficos de los informes ecocardiográficos disponibles en la anamnesis de cada paciente.
La PAPS se calculó como la suma del gradiente sistólico máximo transtricuspídeo, medido mediante Doppler de flujo continuo en la proyección apical de 4 cámaras, más la presión venosa central, estimada en función del diámetro y la variación respiratoria de la vena cava inferior en la proyección subxifoidea.
La guía de práctica clínica específica sobre la estimación ecocardiográfica de la presión venosa central17 recomienda que se asigne un valor de 3mmHg en caso de que el diámetro de la vena cava inferior sea ≤ 21mm y se desplome más de un 50% con una inhalación y que se asigne un valor de 15mmHg en caso de que el diámetro de la vena cava inferior sea > 21mm y se desplome menos de un 50% con una inhalación. En los casos intermedios que no se ajusten a este sistema, la guía de práctica clínica recomienda que se asigne un valor de 8mmHg.
El TAPSE se midió mediante el modo M en la proyección apical de 4 cámaras.
Se excluyó del presente análisis a los pacientes incorporados al registro de quienes faltaban datos para el cálculo del cociente TAPSE/PAPS.
Seguimiento y resultados del estudioSe realizó el seguimiento de los pacientes desde el día de su inscripción en el registro hasta el 30 de noviembre de 2022 o hasta la fecha de fallecimiento o trasplante cardiaco, lo que ocurriera primero. Los principales resultados clínicos evaluados en este estudio fueron la supervivencia general y la supervivencia libre de hospitalización por IC. En la evaluación del objetivo combinado, la hospitalización por trasplante cardiaco se consideró equivalente a la hospitalización por IC.
Las causas de muerte se recopilaron a partir de los certificados de defunción o, cuando fue posible, de los informes de la autopsia. Para el análisis estadístico, las causas de muerte desconocidas se consideraron de origen cardiovascular.
Análisis estadísticoPara realizar comparaciones estadísticas, se clasificó a los pacientes en 3 grupos según los terciles del cociente TAPSE/PAPS basal. Las variables cualitativas se expresan en cifras absolutas y porcentajes, mientras que las continuas se expresan en media±desviación estándar o mediana [intervalo intercuartílico], según corresponda. La prueba de Kolmogorov-Smirnov se utilizó para evaluar la conformidad de las variables continuas con la distribución normal.
La comparación de las características basales, los parámetros ecocardiográficos y los datos analíticos en los terciles TAPSE/PAPS se realizó mediante la prueba de la χ2 para las tendencias lineales de las variables cualitativas y mediante el análisis de la varianza para las tendencias lineales en el caso de las continuas.
La supervivencia acumulada y la supervivencia acumulada libre de hospitalización por IC se resumen en las curvas de supervivencia de Kaplan-Meier y se compararon en los terciles del cociente TAPSE/PAPS mediante log-rank test.
Se utilizó el análisis multivariante de regresión de riesgos proporcionales de Cox para ajustar el efecto del sesgo de confusión en las asociaciones estadísticas observadas entre el cociente TAPSE/PAPS basal y el riesgo de mortalidad por cualquier causa y el objetivo combinado de mortalidad por cualquier causa u hospitalización por IC. Se rechazó el uso de modelos escalonados retrógrados para identificar posibles factores de confusión para evitar la posible pérdida de información causada por escasez de potencia estadística. En cambio, se diseñaron 5 modelos de regresión de Cox distintos en los que se introdujeron las variables clínicas, ecocardiográficas, analíticas, de tratamiento o de estadificación que se consideraron posibles factores de confusión, a partir del conocimiento previo y la distribución de estas variables entre las categorías del cociente TAPSE/PAPS. Por lo tanto, el objetivo principal con este análisis fue controlar el potencial sesgo de confusión mediante el cálculo de las hazard ratio estimadas ajustadas por distintas combinaciones de características clínicas relevantes.
Con este fin se diseñaron 5 modelos multivariantes que incluían distintas combinaciones de ajuste de las covariables basales que se distribuyeron asimétricamente entre terciles del cociente TAPSE/PAPS, por lo que se consideraron posibles factores de confusión. El modelo 1 (covariables clínicas) contenía edad, sexo, tipo de amiloidosis cardiaca (ATTR u otros tipos), fibrilación auricular, clase de la New York Heart Association (NYHA) y signos físicos de congestión. El modelo 2 (covariables analíticas) constaba de la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP), la tasa de filtrado glomerular, el ácido úrico, la urea, la gammaglutamiltransferasa, la fosfatasa alcalina y el potasio. El modelo 3 (variables ecocardiográficas) incluía grosor máximo de la pared del ventrículo izquierdo, FEVI, insuficiencia mitral moderada o grave e insuficiencia tricuspídea moderada o grave. El modelo 4 (variables de tratamiento) consistía en el uso de diuréticos del asa, bloqueadores beta, antagonistas del receptor de mineralocorticoides y anticoagulantes. El modelo 5 (estadios de la enfermedad) incluía los estadios de la amiloidosis cardiaca, definidos según el sistema de estadificación del United Kingdom National Amyloid Centre (UK NAC)15, un modelo de pronóstico validado que se basa en las concentraciones séricas de NT-proBNP y la tasa de filtrado glomerular.
Se calculó el estadístico C de Harrell para evaluar la capacidad predictiva del sistema de estadificación UK NAC15 en esta muestra, así como la capacidad predictiva gradual tras añadir el cociente TAPSE/PAPS a este modelo con biomarcadores. Además, se evaluó la asociación entre el cociente TAPSE/PAPS y los resultados del estudio estratificados por estadios del UK NAC. Las comparaciones de los estadísticos C de Harrell entre 2 modelos de regresión de Cox distintos se realizaron mediante el paquete Comparec-statistical de R.
Se utilizó un valor de p bilateral <0,05 para indicar la significación estadística. Los análisis se realizaron con SPSS 25 (IBM, Estados Unidos), STATA 14 (Statacorp, Estados Unidos) y R 4.3.2 (R Foundation, Austria).
RESULTADOSPacientesDesde el 1 de enero de 2018 hasta el 31 de octubre de 2022, se incorporó al registro a 315 pacientes con amiloidosis cardiaca. De ellos, se disponía de datos ecocardiográficos basales para el cálculo del cociente TAPSE/PAPS de 233 (74,0%), que conformaron la población evaluada en el presente análisis. En 72 de los 82 (87,8%) pacientes excluidos del estudio, la falta de datos se explica por una mínima o nula insuficiencia tricuspídea en la ecocardiografía basal, por lo que no se pudo calcular el gradiente transtricuspídeo para determinar la PAPS.
De la cohorte final del estudio, 209 pacientes (89,7%) presentaban miocardiopatía amiloide ATTR, 23 (9,9%) tenían miocardiopatía amiloide AL y 1 (0,4%) tenía miocardiopatía amiloide apoAIV. Entre los casos de ATTR, 176 (84,2%) fueron casos confirmados de la forma natural, 6 (2,9%) fueron casos confirmados de mutaciones y 27 (12,9%) fueron indeterminados, ya que estos pacientes no fueron genotipados.
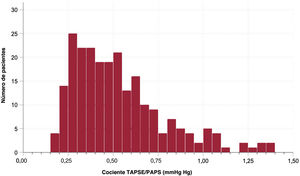
La figura 2 muestra la distribución del cociente TAPSE/PAPS basal de la población de estudio. La mediana de este parámetro fue 0,48 [0,33-0,65] mm/mmHg. Los terciles primero (más bajo), segundo (intermedio) y tercero (más alto) del cociente TAPSE/PAPS fueron <0,38, 0,38-0,58 y >0,58mm/mmHg respectivamente.
Características clínicas basalesLas características clínicas, analíticas y ecocardiográficas basales de los pacientes se muestran en la tabla 1 y se clasifican según los terciles del cociente TAPSE/PAPS.
Características basales de los pacientes del estudio según los terciles del cociente TAPSE/PAPS
| Variables | TAPSE/PAPS<0,38n=77 | TAPSE/PAPS0,38-0,58n=78 | TAPSE/PAPS>0,58n=78 | p |
|---|---|---|---|---|
| Antecedentes médicos | ||||
| Edad (años) | 79,9±8,8 | 81,4±6,4 | 79,8±7,5 | 0,340 |
| Mujeres | 25 (32,5) | 22 (28,2%) | 16 (20,5%) | 0,094 |
| Tipo de amiloidosis | 0,707 | |||
| Transtirretina | 68 (88,3) | 71 (91) | 70 (89,7) | |
| Cadenas ligeras | 8 (10,4) | 7 (9) | 8 (10,3) | |
| ApoAIV | 1 (1,3) | 0 | 0 | |
| Hipertensión | 52 (67,5) | 58 (74,4) | 58 (74,4) | 0,345 |
| Dislipemia | 44 (57,1) | 46 (59) | 45 (57,7) | 0,946 |
| Diabetes mellitus tipo 2 | 17 (22,1) | 18 (23,1) | 17 (21,8) | 0,966 |
| Exfumador o fumador activo | 19 (24,7) | 24 (30,8) | 24 (30,8) | 0,627 |
| Hospitalización previa por insuficiencia cardiaca | 33 (42,9) | 33 (42,3) | 24 (30,8) | 0,122 |
| Fibrilación o flutter auricular | 50 (64,9) | 48 (61,5) | 26 (33,3) | <0,001 |
| Otras arritmias | 9 (11,7) | 10 (12,8) | 7 (9) | 0,591 |
| Síncope | 11 (14,3) | 10 (12,8) | 17 (21,8) | 0,205 |
| Implante de marcapasos | 13 (16,9) | 13 (16,7) | 9 (11,5) | 0,352 |
| Cardiopatía isquémica | 12 (15,6) | 12 (15,4) | 13 (16,7) | 0,854 |
| Intervención en válvulas cardiacas | 4 (5,2) | 6 (7,7) | 3 (3,8) | 0,712 |
| Enfermedad cerebrovascular | 12 (15,6) | 8 (10,3) | 7 (9) | 0,200 |
| Trombosis arterial o venosa | 4 (5,2) | 4 (5,1) | 5 (6,4) | 0,742 |
| Arteriopatía periférica | 5 (6,5) | 6 (7,7) | 2 (2,6) | 0,286 |
| Enfermedad pulmonar obstructiva crónica | 12 (15,6) | 9 (11,5) | 6 (7,7) | 0,126 |
| Presentación clínica | ||||
| Presión arterial sistólica (mmHg) | 122,9±17,1 | 126,7±19,0 | 124,4±16,0 | 0,581 |
| Presión arterial diastólica (mmHg) | 75 [65-82] | 73,5 [64-80,5] | 73 [63-82] | 0,283 |
| Frecuencia cardiaca (lpm) | 72 [66-86] | 76 [65-85] | 69 [59-81] | 0,155 |
| Clase III o IV de la NYHA | 41 (53,2) | 29 (37,2) | 14 (17,9) | <0,001 |
| Signos exploratorios de congestión | 54 (70,1) | 51 (65,4) | 30 (38,5) | <0,001 |
| Datos analíticos | ||||
| Urea (mg/dl) | 75 [57-98] | 67,5 [52,7-99,7] | 69 [46,5-74,2] | 0,004 |
| Creatinina (mg/dl) | 1,18 [0,97-1,56] | 1,15 [0,99-1,48] | 1 [0,83-1,25] | 0,725 |
| Tasa de filtrado glomerular (ml/min) | 51,6 [38,7-70,9] | 51,3 [39,3-69,9] | 70 [51,6-80,4] | 0,002 |
| NT-proBNP (pg/ml)a | 4.946 [2.612-6.863] | 3.292 [1.682-6.420] | 1.911 [627-3.207] | <0,001 |
| Estadios UK NACa,b | <0,001 | |||
| Estadio I | 17 (22,1) | 30 (39,5) | 48 (65,8) | |
| Estadio II | 37 (48,1) | 24 (31,6) | 20 (27,4) | |
| Estadio III | 23 (29,9) | 22 (27,4) | 5 (6,8) | |
| Potasio (mEq/l) | 4,3 [4,1-4,7] | 4,4 [4,1-4,8] | 4,5 [4,2-4,9] | 0,030 |
| Sodio (mEq/l) | 140 [138-142] | 140,5 [139-134] | 141 [139-142] | 0,098 |
| Hemoglobina (g/dl) | 13,6 [12,1-15,1] | 13,4 [12,1-14] | 13,5 [12,7-15,1] | 0,746 |
| Ácido úrico (mg/dl) | 7,9 [6,4-9,4] | 7,2 [5,8-8,3] | 6,4 [5,2-7,5] | <0,001 |
| Bilirrubina (mg/dl)a | 1 [0,8-1,3] | 0,8 [0,6-1,1] | 0,8 [0,6-1] | 0,129 |
| Gamma-glutamiltransferasa (UI/l) | 90 [47,5-186] | 54 [25,2-125,7] | 37 [18-67,5] | 0,001 |
| Fosfatasa alcalina (UI/l) | 156 [110-208,5] | 113,5 [83,7-190,2] | 97 [68,7-149,7] | <0,001 |
| Albúmina (g/dl)a | 4,1 [4,0-4,4] | 4,1 [3,9-4,4] | 4,1 [3,8-4,4] | 0,507 |
| Colesterol total (mg/dl) | 155,8±41,3 | 153,1±36,7 | 157,2±38,0 | 0,820 |
| Ecocardiografía | ||||
| FEVI (%) | 45,3±10,2 | 53,8±12,1 | 57,0±11,9 | <0,001 |
| TAPSE (mm) | 14 [12-15,8] | 17 [15-19] | 20 [17-22] | <0,001 |
| PAPS (mmHg) | 48,1 [41-54,6] | 35,8 [30-40,7] | 24,3 [21-28,2] | <0,001 |
| Grosor máximo de la pared del VI (mm) | 17,2 [15,2-20] | 17 [14-18] | 17 [15-18] | 0,109 |
| Estenosis aórtica moderada o grave | 8 (10,4) | 10 (12,8) | 8 (10,3) | 0,977 |
| Insuficiencia mitral moderada o grave | 23 (30,7) | 20 (26) | 12 (15,4) | 0,027 |
| Insuficiencia tricuspídea moderada o grave | 38 (49,4) | 22 (28,2) | 5 (6,4) | <0,001 |
| Medicamentos (al inicio del estudio) | ||||
| Antiagregantes plaquetarios | 8 (10,4) | 14 (17,9) | 17 (21,8) | 0,154 |
| Anticoagulantes | 50 (64,9) | 49 (62,8) | 33 (42,3) | 0,004 |
| Diuréticos del asa | 69 (89,6) | 70 (89,7) | 45 (57,7) | <0,001 |
| Tiacidas | 10 (13) | 6 (7,7) | 10 (12,8) | 0,977 |
| Bloqueadores beta | 44 (57,1) | 41 (52,6) | 36 (46,2) | 0,172 |
| IECA o ARA-II o INRA | 35 (45,5) | 35 (44,9) | 39 (50) | 0,570 |
| Antagonistas del receptor de mineralocorticoides | 29 (37,7) | 23 (29,5) | 11 (14,1) | 0,001 |
| Inhibidores del cotransportador de sodio-glucosa tipo 2 | 11 (16,4) | 7 (10,8) | 6 (8,6) | 0,345 |
| Otros hipoglucemiantes | 16 (20,8) | 15 (19,2) | 15 (19,5) | 0,840 |
| Hipolipemiantes | 38 (49,4) | 43 (55,1) | 48 (61,5) | 0,128 |
| Tratamientos específicos (durante el seguimiento) | ||||
| Tafamidis | 20 (26) | 18 (23,1) | 19 (24,4) | 0,816 |
| Quimioterapia | 7 (9,1) | 5 (6,4) | 7 (9) | 0,981 |
| Trasplante autólogo de células madre | 2 (2,6) | 0 | 4 (5,1) | 0,318 |
ARA-II: antagonistas del receptor de angiotensina II; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidores de la enzima de conversión de la angiotensina; INRA: inhibidores de la neprilisina y del receptor de la angiotensina; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; PAPS: presión arterial pulmonar sistólica; TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo; UK NAC: United Kingdom National Amyloidosis Centre; VI: ventrículo izquierdo.
Valores ausentes: NT-proBNP: 7 (3%); bilirrubina: 1 (0,4%); albúmina: 1 (0,4%); estadios del UK NAC: 7 (3%).
Estadio I: NT-proBNP ≤ 3.000 pg/ml y tasa de filtrado glomerular ≥ 45ml/min. Estadio III: NT-proBNP >3.000 pg/ml y tasa de filtrado glomerular <45ml/min. Estadio II: pacientes no clasificados como estadio I ni como estadio III15.
Las variables cualitativas se expresan en n (%). Se utilizó la prueba de Kolmogorov-Smirnov para evaluar la adecuación de las variables continuas a la distribución normal. La edad, la presión arterial sistólica, el colesterol sérico total y la FEVI son variables de distribución normal y se expresan como media ± desviación estándar. El resto de las variables continuas mostraron distribuciones no normales y se expresan como mediana [intervalo intercuartílico].
No hubo diferencias significativas entre los terciles del cociente TAPSE/PAPS en las características sociodemográficas. Sin embargo, un cociente TAPSE/PAPS menor se asoció con una mayor prevalencia de fibrilación auricular, clase III o IV de la NYHA y signos físicos de congestión.
El cociente TAPSE/PAPS tuvo asociación inversa con las concentraciones séricas de NT-proBNP, ácido úrico, fosfatasa alcalina y gammaglutamiltransferasa, también asociación directa con la tasa de filtrado glomerular. Los pacientes con un cociente TAPSE/PAPS en el tercil más alto se encontraban con mayor frecuencia en el estadio I del UK NAC.
En la ecocardiografía, los pacientes con menor cociente TAPSE/PAPS mostraron una mayor prevalencia de insuficiencia tricuspídea moderada o grave, así como menor FEVI.
La prescripción de anticoagulantes, diuréticos y antagonistas del receptor de mineralocorticoides al inicio del estudio fue considerablemente más frecuente entre los pacientes con menor cociente TAPSE/PAPS, sin diferencias entre los subgrupos del estudio respecto a la prescripción de otros fármacos.
La proporción de pacientes que recibieron tratamientos específicos modificadores de la enfermedad, como tafamidis (para la ATTR), quimioterapia o trasplante autólogo de células madre (para la AL), fue similar en los terciles del cociente TAPSE/PAPS basal.
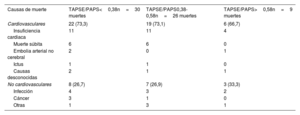
Asociación entre el cociente TAPSE/PAPS y los resultados clínicosSe realizó un seguimiento de los pacientes durante una mediana de 680 [371-1.234] días. Durante este tiempo, murieron 65 pacientes (27,9%) y a 7 (3,0%) se les realizó un trasplante cardiaco. Además, 68 (29,2%) requirieron al menos 1 ingreso hospitalario por IC durante el seguimiento. Las causas cardiovasculares representaron 47 de las 65 (72,3%) muertes registradas en el estudio. En la tabla 2 se detallan las causas específicas de muerte de la población de estudio según los terciles del cociente TAPSE/PAPS basal.
Causas de muerte en la población de estudio según los terciles del cociente TAPSE/PAPS
| Causas de muerte | TAPSE/PAPS<0,38n=30 muertes | TAPSE/PAPS0,38-0,58n=26 muertes | TAPSE/PAPS>0,58n=9 muertes |
|---|---|---|---|
| Cardiovasculares | 22 (73,3) | 19 (73,1) | 6 (66,7) |
| Insuficiencia cardiaca | 11 | 11 | 4 |
| Muerte súbita | 6 | 6 | 0 |
| Embolia arterial no cerebral | 2 | 0 | 1 |
| Ictus | 1 | 1 | 0 |
| Causas desconocidas | 2 | 1 | 1 |
| No cardiovasculares | 8 (26,7) | 7 (26,9) | 3 (33,3) |
| Infección | 4 | 3 | 2 |
| Cáncer | 3 | 1 | 0 |
| Otras | 1 | 3 | 1 |
PAPS: presión arterial pulmonar sistólica; TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo.
Los valores expresan n o n (%).
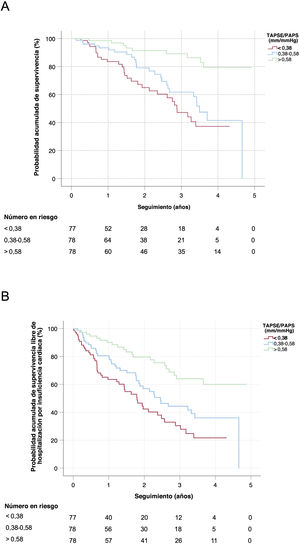
En la figura 3 se muestran las estimaciones de Kaplan-Meier de la probabilidad acumulada de supervivencia (A) y la probabilidad acumulada de supervivencia libre de hospitalización por IC (B) en la población de estudio, estratificadas según los terciles del cociente TAPSE/PAPS basal. En ambos casos, la prueba del orden logarítmico para tendencias lineales mostró una asociación estadísticamente significativa entre un cociente TAPSE/PAPS bajo y un mayor riesgo de resultado clínico adverso (p<0,001 en ambas comparaciones). Las medianas de supervivencia de los pacientes con un cociente TAPSE/PAPS basal dentro del primer cuartil (< 0,38mm/mmHg), el segundo (0,38-0,58mm/mmHg) y el tercero (> 0,58mm/mmHg) fueron de 2,8, 3,5 y 4,6 años respectivamente.
Estimaciones de Kaplan-Meier de la probabilidad acumulada general de supervivencia (A) y la probabilidad acumulada de supervivencia libre de hospitalización por insuficiencia cardiaca (B) en pacientes con amiloidosis cardiaca, estratificadas por terciles del cociente TAPSE/PAPS basal. PAPS: presión arterial pulmonar sistólica; TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo.
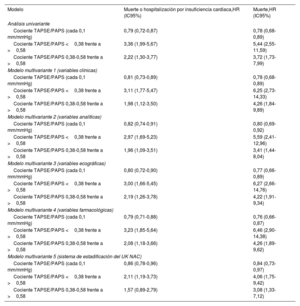
En la tabla 3 se resumen los resultados de los modelos de regresión de Cox univariante y multivariante construidos para evaluar la asociación entre el cociente TAPSE/PAPS basal y los resultados del estudio y, a continuación, para ajustar el potencial sesgo de confusión que podría afectarla. Los coeficientes univariante y multivariante individuales de todas las covariables analizadas se presentan en las tablas 1 y 2 del material adicional.
Asociación entre el valor basal del cociente TAPSE/PAPS y los resultados clínicos a largo plazo: análisis de regresión de Cox univariante y multivariante
| Modelo | Muerte o hospitalización por insuficiencia cardiaca,HR (IC95%) | Muerte,HR (IC95%) |
|---|---|---|
| Análisis univariante | ||
| Cociente TAPSE/PAPS (cada 0,1 mm/mmHg) | 0,79 (0,72-0,87) | 0,78 (0,68-0,89) |
| Cociente TAPSE/PAPS <0,38 frente a >0,58 | 3,36 (1,99-5,67) | 5,44 (2,55-11,59) |
| Cociente TAPSE/PAPS 0,38-0,58 frente a >0,58 | 2,22 (1,30-3,77) | 3,72 (1,73-7,99) |
| Modelo multivariante 1 (variables clínicas) | ||
| Cociente TAPSE/PAPS (cada 0,1 mm/mmHg) | 0,81 (0,73-0,89) | 0,78 (0,68-0,89) |
| Cociente TAPSE/PAPS <0,38 frente a >0,58 | 3,11 (1,77-5,47) | 6,25 (2,73-14,33) |
| Cociente TAPSE/PAPS 0,38-0,58 frente a >0,58 | 1,98 (1,12-3,50) | 4,26 (1,84-9,89) |
| Modelo multivariante 2 (variables analíticas) | ||
| Cociente TAPSE/PAPS (cada 0,1 mm/mmHg) | 0,82 (0,74-0,91) | 0,80 (0,69-0,92) |
| Cociente TAPSE/PAPS <0,38 frente a >0,58 | 2,97 (1,69-5,23) | 5,59 (2,41-12,96) |
| Cociente TAPSE/PAPS 0,38-0,58 frente a >0,58 | 1,96 (1,09-3,51) | 3,41 (1,44-8,04) |
| Modelo multivariante 3 (variables ecográficas) | ||
| Cociente TAPSE/PAPS (cada 0,1 mm/mmHg) | 0,80 (0,72-0,90) | 0,77 (0,66-0,89) |
| Cociente TAPSE/PAPS <0,38 frente a >0,58 | 3,00 (1,66-5,45) | 6,27 (2,66-14,76) |
| Cociente TAPSE/PAPS 0,38-0,58 frente a >0,58 | 2,19 (1,26-3,78) | 4,22 (1,91-9,34) |
| Modelo multivariante 4 (variables farmacológicas) | ||
| Cociente TAPSE/PAPS (cada 0,1 mm/mmHg) | 0,79 (0,71-0,88) | 0,76 (0,66-0,87) |
| Cociente TAPSE/PAPS <0,38 frente a >0,58 | 3,23 (1,85-5,64) | 6,46 (2,90-14,38) |
| Cociente TAPSE/PAPS 0,38-0,58 frente a >0,58 | 2,08 (1,18-3,66) | 4,26 (1,89-9,62) |
| Modelo multivariante 5 (sistema de estadificación del UK NAC) | ||
| Cociente TAPSE/PAPS (cada 0,1 mm/mmHg) | 0,86 (0,78-0,96) | 0,84 (0,73-0,97) |
| Cociente TAPSE/PAPS <0,38 frente a >0,58 | 2,11 (1,19-3,73) | 4,06 (1,75-9,42) |
| Cociente TAPSE/PAPS 0,38-0,58 frente a >0,58 | 1,57 (0,89-2,79) | 3,08 (1,33-7,12) |
HR: hazard ratio; IC95%: intervalo de confianza del 95%; PAPS: presión arterial pulmonar sistólica; TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo; UK NAC: United Kingdom National Amyloidosis Centre.
Covariables de ajuste incluidas en los modelos multivariante: modelo 1 (variables clínicas iniciales): edad, sexo, clase de la NYHA (I-IV), tipo de amiloidosis cardiaca (transtirretina u otra), fibrilación o flutter auricular, signos físicos de congestión; modelo 2 (variables analíticas iniciales): NT-proBNP: tasa de filtrado glomerular, ácido úrico, urea, gamma-glutamiltransferasa, fosfatasa alcalina, potasio; modelo 3 (variables ecocardiográficas basales): grosor máximo de la pared del ventrículo izquierdo, fracción de eyección del ventrículo izquierdo, insuficiencia mitral moderada o grave, insuficiencia tricuspídea moderada o grave; modelo 4 (variables farmacológicas basales): diuréticos del asa, antagonistas del receptor de mineralocorticoides, anticoagulantes, bloqueadores beta; modelo 5 (sistema de estadificación del UK NAC basal): estadios de amiloidosis cardiaca (I-III).
La regresión de Cox univariante mostró una asociación estadísticamente significativa entre el cociente TAPSE/PAPS basal y la mortalidad por cualquier causa (por cada 0,1mm/mmHg, HR=0,78; intervalo de confianza del 95% [IC95%], 0,68-0,89) y el objetivo combinado de muerte por cualquier causa u hospitalización por IC (por cada 0,1mm/mmHg, HR=0,79; IC95%, 0,72-0,87). La HR estimada de la muerte por cualquier causa fue de 5,44 (IC95%, 2,55-11,59) en los pacientes que mostraron un cociente TAPSE/PAPS basal en el primer tercil frente al tercero y de 3,72 (IC95%, 1,73-7,99) en los pacientes que mostraron un cociente TAPSE/PAPS basal en el segundo tercil frente al tercero. La HR estimada de la mortalidad por cualquier causa o la hospitalización por IC fue de 3,36 (IC95%, 1,99-5,67) en los pacientes que mostraron un cociente TAPSE/PAPS basal en el primer tercil frente al tercero y de 2,22 (IC95%, 1,30-3,77) en los pacientes con TAPSE/PAPS basal en el segundo tercil frente al tercil más alto.
La asociación entre el cociente TAPSE/PAPS basal y los resultados del estudio se mantuvo independiente y estadísticamente significativa en los 5 modelos de regresión de Cox multivariante ajustados construidos en este estudio (tabla 3). La HR ajustada estimada por aumento de 0,1mm/mmHg del TAPSE/PAPS basal varió de 0,76 a 0,84 en la mortalidad por cualquier causa y de 0,79 a 0,86 en el objetivo combinado de muerte por cualquier causa u hospitalización por IC. La HR ajustada estimada en pacientes con TAPSE/PAPS basal en el primer tercil frente al tercero varió de 4,06 a 6,46 en la mortalidad por cualquier causa y de 2,11 a 3,22 en el combinado de muerte por cualquier causa u hospitalización por IC. La HR ajustada estimada en pacientes con TAPSE/PAPS basal en el segundo tercil frente al tercero varió entre 3,08 y 4,26 en la mortalidad por cualquier causa y entre 1,57 y 2,19 en el combinado de muerte por cualquier causa u hospitalización por IC.
Cociente TAPSE/PAPS y estadios de amiloidosis cardiacaEn la muestra del estudio, los estadios más altos del UK NAC al inicio del estudio se asociaron con una supervivencia acumulada significativamente menor y una supervivencia acumulada libre de hospitalización por IC significativamente menor (figura 1 del material adicional). El aumento del riesgo de ambos resultados adversos fue similar en los pacientes en estadio III frente a aquellos en estadio I (muerte por cualquier causa u hospitalización por IC, HR=3,32; IC95%, 1,92-5,75; muerte por cualquier causa, HR=2,90; IC95%, 1,41-5,99) y en los pacientes en estadio II frente a aquellos en estadio I (muerte por cualquier causa u hospitalización por IC, HR=3,90; IC95%, 2,37-6,42; muerte por cualquier causa, HR=4,14; IC95%, 2,16-7,91), sin diferencias estadísticamente significativas entre los pacientes en estadio III y aquellos en estadio II (muerte por cualquier causa u hospitalización por IC, HR=0,85; IC95%, 0,54-1,35; muerte por cualquier causa, HR=0,70; IC95%, 0,39-1,27).
El modelo 5 de regresión de Cox multivariante incluyó los estadios iniciales del UK NAC junto con el cociente TAPSE/PAPS basal (tabla 3). Según este modelo, el TAPSE/PAPS basal se asoció independientemente con el objetivo combinado de muerte por cualquier causa u hospitalización por IC (por cada 0,1mm/mmHg, HR=0,86; IC95%, 0,78-0,96) y mortalidad por cualquier causa (por cada 0,1mm/Hg, HR=0,84; IC95%, 0,73-0,97). Sin embargo, si se había incluido TAPSE en el modelo multivariante en lugar del TAPSE/PAPS, las asociaciones ya no eran estadísticamente significativas, tanto con muerte por cualquier causa o hospitalización por IC (por cada aumento de 1mm de TAPSE, HR=0,96; IC95%, 0,91-1,02) como para mortalidad por cualquier causa (por cada aumento de 1mm de TAPSE, HR=0,95; IC95%, 0,89-1,02).
El sistema de estadificación UK NAC mostró una capacidad de predicción moderada tanto para el evento combinado de muerte por cualquier causa u hospitalización por IC (estadístico C de Harrell=0,668) como para la mortalidad por cualquier causa (estadístico C de Harrell=0,662). La adición del cociente TAPSE/PAPS al modelo de predicción en función de los estadios del UK NAC generó un aumento moderado de su capacidad de predicción, tanto para el evento combinado de muerte por cualquier causa u hospitalización por IC (estadístico C de Harrell=0,707; p de comparación=0,019) como para la mortalidad por cualquier causa (estadístico C de Harrell=0,705; p de comparación=0,065). La adición del TAPSE al modelo de predicción en función de los estadios del UK NAC en lugar del cociente TAPSE/PAPS provocó un aumento menor de la capacidad de predicción (muerte por cualquier causa u hospitalización por IC, estadístico C de Harrell=0,695; p de comparación=0,089; muerte por cualquier causa, estadístico C de Harrell=0,693; p de comparación=0,078).
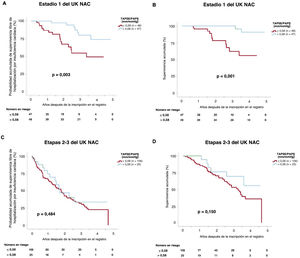
La figura 4 muestra las curvas de Kaplan-Meier de supervivencia acumulada y supervivencia acumulada libre de hospitalización por IC en pacientes con TAPSE/PAPS basal ≤ 0,58 (terciles primero y segundo) frente a >0,58 (primer tercil), clasificados según los estadios iniciales del UK NAC. En el subgrupo de pacientes en estadio I del UK NAC, la reducción del cociente TAPSE/PAPS basal (≤ 0,58) se asoció con una supervivencia libre de hospitalización por IC considerablemente menor (log-rank test, p=0,003) (figura 4A) y supervivencia general (log-rank test, p=0,001) (figura 4B). Sin embargo, en el subgrupo de pacientes en estadio II o III del UK NAC no se observaron diferencias estadísticamente significativas respecto a ninguno de los resultados adversos según el cociente TAPSE/PAPS basal (muerte por cualquier causa u hospitalización por IC: log-rank test, p=0,484; figura 4C; mortalidad por cualquier causa: log-rank test, p=0,150; figura 4D).
Estimaciones de Kaplan-Meier de la supervivencia acumulada libre de hospitalización por insuficiencia cardiaca (A y C) y la supervivencia acumulada (B y D) según los estadios del United Kingdom National Amyloidosis Centre. PAPS: presión arterial pulmonar sistólica; TAPSE: desplazamiento sistólico del plano del anillo tricuspídeo; UK NAC: United Kingdom National Amyloidosis Centre.
En el subgrupo específico de pacientes con amiloidosis cardiaca ATTR, los estadísticos C de Harrell estimados del sistema de estadificación UK NAC fueron 0,652 para el criterio de valoración combinado de mortalidad por cualquier causa u hospitalización por IC y 0,640 para mortalidad por cualquier causa, y aumentaron respectivamente a 0,692 (p de comparación=0,030) y 0,686 (p de comparación=0,063) cuando se añadió el TAPSE/PAPS basal al modelo de predicción.
DISCUSIÓNEn este estudio se presentan los resultados de un subanálisis de un registro multicéntrico de pacientes con miocardiopatía amiloide que ofrece evidencia adicional de que el cociente TAPSE/PAPS, una medición ecocardiográfica no invasiva del acoplamiento del ventrículo derecho a la arteria pulmonar, es un fuerte marcador pronóstico independiente en esta población.
En este estudio, la existencia de un cociente TAPSE/PAPS muy reducido al inicio del estudio (< 0,38mm/mmHg) se asoció con un aumento de ∼4 a ∼6 veces del riesgo de muerte en pacientes con amiloidosis cardiaca, dependiendo del modelo multivariante considerado para ajustar el sesgo de confusión residual. En particular, incluso una reducción leve de este índice (< 0,58mm/mmHg) se asoció con un aumento de la mortalidad de ∼3 a ∼4 veces. El deterioro del acoplamiento del ventrículo derecho a la arteria pulmonar se asoció con una cardiopatía más avanzada, una mayor prevalencia de fibrilación auricular, una peor clase de la NYHA, signos más frecuentes de congestión, una FEVI más baja, unas mayores concentraciones séricas de biomarcadores cardiacos, una peor función renal y una mayor incidencia de hospitalización por IC.
La disfunción del ventrículo derecho es uno de los principales factores determinantes del pronóstico en pacientes con IC y FEVI tanto reducida como conservada7,18,19. Entre los diversos valores propuestos como valores alternativos de la contractilidad del ventrículo derecho, la evaluación del acoplamiento del ventrículo derecho a la arteria pulmonar ha recibido una atención creciente en los últimos años, ya que describe mejor la unidad cardiopulmonar completa al abordar la extrema sensibilidad de la estructura del ventrículo derecho a la sobrecarga de presión. La medida más precisa del acoplamiento del ventrículo derecho a la arteria pulmonar es la relación entre la elasticidad del ventrículo derecho y la arteria pulmonar, un valor que se puede obtener mediante cateterismo cardiaco invasivo20; un punto de corte de 1,5 a 2 representa un buen equilibrio entre el trabajo mecánico y el consumo de oxígeno21. En pacientes con hipertensión pulmonar, el aumento progresivo de la resistencia vascular desencadena un remodelado inadaptativo del ventrículo derecho caracterizado por hipertrofia excéntrica y deterioro de las funciones sistólica y diastólica, lo que origina una disminución progresiva de la relación de elasticidad del ventrículo derecho a la arteria pulmonar hasta valores <0,8, que definen la existencia de desacoplamiento del ventrículo derecho de la arteria pulmonar22,23.
Guazzi et al.11 validaron por primera vez el cociente TAPSE/PAPS como un marcador no invasivo del acoplamiento del ventrículo derecho a la arteria pulmonar en un estudio prospectivo de 2 centros en pacientes con IC y FEVI conservada. Estos autores encontraron una buena correlación entre el TAPSE/PAPS medido mediante ecocardiografía transtorácica y la relación de elasticidad del ventrículo derecho a la arteria pulmonar determinada de forma invasiva. En este estudio anterior11, se identificó un punto de corte de TAPSE/PAPS <0,36mm/mmHg como un predictor independiente de resultados negativos. En otro estudio que abordó un espectro más amplio de pacientes con IC independientemente de la FEVI, este grupo italiano encontró que la relación TAPSE/PAPS fue un determinante más preciso de resultados clínicos adversos que TAPSE o PAPS solos13. Estudios posteriores han confirmado el papel predictivo del cociente TAPSE/PAPS en pacientes con IC24, cardiopatía valvular25,26 e hipertensión pulmonar primaria10.
Durante los últimos años, ha habido un gran interés por ofrecer medios útiles para evaluar el pronóstico de los pacientes con un diagnóstico de amiloidosis cardiaca y para evaluar la progresión de la enfermedad. El sistema de estadificación NAC basado en NT-proBNP y la tasa de filtrado glomerular se emplea ampliamente y ofrece una buena capacidad de discriminación15. También se ha demostrado que los valores de imagen son predictores independientes de la mortalidad; en especial, un artículo publicado por Knight et al.27 mostró una fuerte asociación entre el TAPSE y el pronóstico tanto en pacientes con AL como en aquellos con ATTR. Además, un trabajo reciente del mismo grupo encontró que la progresión de la insuficiencia mitral es el único predictor ecocardiográfico de mortalidad durante el seguimiento28.
La justificación para evaluar el valor pronóstico potencial del cociente TAPSE/PAPS en pacientes con amiloidosis cardiaca es que esta enfermedad es un conocido modelo de miocardiopatía restrictiva, cuya evolución habitual implica un cuadro clínico de IC y FEVI normal o ligeramente reducida, un aumento progresivo de la presión arterial pulmonar y la resistencia vascular y la posterior disfunción del ventrículo derecho. Por lo tanto, estos resultados tienen sentido biológico y concuerdan con estudios previos, ya que respaldan el uso del cociente TAPSE/PAPS como marcador alternativo del acoplamiento del ventrículo derecho a la arteria pulmonar con valor pronóstico en pacientes con amiloidosis cardiaca. Cabe destacar que la evaluación ecocardiográfica del cociente TAPSE/PAPS tiene la ventaja de no ser invasiva y que es rentable y fácil de llevar a cabo y de supervisar a lo largo del tiempo. Este estudio indica que el valor pronóstico del cociente TAPSE/PAPS se suma al del modelo UK NAC de pronóstico basado en biomarcadores y podría ser superior a la suma del TAPSE solo.
Cabe destacar que, en este estudio, incluso las reducciones leves del cociente TAPSE/PAPS se asociaron con un deterioro considerable de los resultados cardiovasculares de los pacientes con amiloidosis cardiaca. A juicio de los autores, esto podría explicarse por el hecho de que la amiloidosis cardiaca es una enfermedad infiltrativa en que la contractilidad del ventrículo derecho puede verse afectada directamente por el depósito de fibrillas de amiloide en el espacio extracelular del miocardio del ventrículo derecho. Los datos del estudio indican que el valor pronóstico del cociente TAPSE/PAPS es especialmente útil en pacientes en estadio I del UK NAC, es decir, aquellos con enfermedad menos avanzada. Por lo tanto, la evaluación sistemática del cociente TAPSE/PAPS en pacientes con amiloidosis cardiaca podría ayudar a los médicos a la identificación precoz de quienes tienen mayor riesgo de progresión de la enfermedad, que podrían requerir un seguimiento más estrecho, así como de aquellos cuya enfermedad podría ser modificada por medicamentos específicos29,30 o trasplante cardiaco31. Otros autores han destacado previamente el importante papel de la función del ventrículo derecho en pacientes con amiloidosis cardiaca32.
Fortalezas y limitacionesLas principales fortalezas de este estudio son su naturaleza multicéntrica, así como la inclusión prospectiva de un número considerable de pacientes con un estrecho seguimiento clínico y la recopilación de información clínica integral. Sus principales limitaciones son la naturaleza observacional del estudio y la ausencia de supervisión externa, lo que puede haber motivado posibles sesgos de información, selección y confusión. Además, este análisis se basa en datos recopilados previamente de un registro general de pacientes con miocardiopatía amiloide, que no se diseñó específicamente a los efectos de este estudio. Para este análisis no se dispuso de algunas variables pronósticas de interés, como la troponina sérica. Diferentes técnicos llevaron a cabo localmente las pruebas ecocardiográficas durante el seguimiento clínico habitual, lo que puede haber causado cierta heterogeneidad en la medición de los valores funcionales. Por último, los datos del cateterismo cardiaco no estaban disponibles, por lo que no se pudo validar de manera invasiva estas conclusiones.
CONCLUSIONESEste estudio respalda el valor pronóstico del cociente TAPSE/PAPS como marcador pronóstico no invasivo y fácil de obtener en pacientes con amiloidosis cardiaca, que puede sumarse a los sistemas estándar de predicción con biomarcadores cardiacos. Los resultados ponen de relieve el importante papel del acoplamiento de la poscarga del ventrículo derecho a la pulmonar en esta población.
- -
El cociente TAPSE/PAPS es un indicador alternativo no invasivo, derivado de la ecocardiografía, del acoplamiento del ventrículo derecho a la arteria pulmonar.
- -
Un cociente TAPSE/PAPS reducido se ha asociado con un pronóstico adverso en pacientes con insuficiencia cardiaca independientemente de la FEVI y en pacientes con hipertensión pulmonar primaria.
- -
A partir de un registro multicéntrico prospectivo, este estudio respalda la utilidad pronóstica del cociente TAPSE/PAPS en pacientes con amiloidosis cardiaca.
Este estudio se financió mediante una beca de investigación pública de la Sociedad Gallega de Cardiología (SOGACAR) y una beca de investigación independiente de Pfizer (número de identificación 54963821).
CONSIDERACIONES ÉTICASEl protocolo del estudio fue aprobado por el Comité de Ética en Investigación Clínica de la Comunidad Autónoma de Galicia. Se obtuvo el consentimiento informado por escrito de todos los participantes en el estudio. Los posibles sesgos de sexo no se tuvieron en cuenta en la preparación de este artículo.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALNo se utilizó ninguna herramienta de inteligencia artificial en la preparación de este artículo.
CONTRIBUCIÓN DE LOS AUTORESM. Maccallini: diseño del estudio, conservación de datos, redacción del original, coordinación del estudio, selección de pacientes. G. Barge-Caballero: diseño del estudio, conservación de datos, redacción del original, obtención de fondos, coordinación del estudio, selección de pacientes. E. Barge-Caballero: diseño del estudio, conservación de datos, conceptualización, análisis estadístico, redacción del original, selección de pacientes. A. Bouzas-Mosquera: análisis estadístico, revisión y edición del original. M.G. Crespo-Leiro: supervisión, conservación de datos, selección de pacientes, obtención de fondos, visualización, revisión y edición del original. Los demás autores participaron en la selección de pacientes, la conservación de datos, la revisión y la edición del original.
CONFLICTO DE INTERESESSeis de los investigadores (G. Barge-Caballero, E. Barge-Caballero, I. Gómez-Otero, A. Varela-Román, A. Bouzas-Mosquera y M.G. Crespo-Leiro) son miembros del Centro de Investigación Biomédica en Red de Enfermedades Cardiovasculares (CIBERCV) del Instituto de Salud Carlos III (ISCIII), Ministerio de Ciencia, Innovación y Universidades, Gobierno de España. G. Barge-Caballero ha recibido becas de viaje, honorarios como conferenciante y una beca de investigación de Pfizer (no relacionada con el presente estudio). E. Barge-Caballero ha recibido honorarios como conferenciante de Pfizer. M. Crespo-Leiro ha recibido becas de viaje de Pfizer. R. Bilbao-Quesada ha recibido honorarios como asesor de Pfizer. Los demás autores no tienen nada que declarar.