La presencia de secuelas neurológicas graves tras una muerte súbita conlleva un consumo importante de recursos. La hipotermia terapéutica está indicada para prevención del daño neurológico grave (DNG)1 aunque hay controversia en torno a este tratamiento2,3 y la valoración pronóstica en este escenario. Dicha valoración tiene fundamentalmente dos objetivos: inicialmente, informar a los familiares sobre las posibilidades de recuperación; después, guiar la toma de decisiones diagnosticoterapéuticas, y se aconseja una valoración neurológica mediante múltiples variables a partir del tercer día. Por el contrario, la información sobre la predicción precoz del DNG ha recibido mucha menos atención.
El objetivo de este estudio es elaborar un modelo predictivo de DNG mediante datos disponibles al ingreso de pacientes consecutivos recuperados de muerte súbita de presumible origen cardiaco sometidos a hipotermia terapéutica.
Se recogió prospectivamente a pacientes ingresados en la unidad de cuidados intensivos cardiológicos de nuestro centro desde noviembre de 2009 hasta enero de 2014, y se registraron datos clínicos y analíticos y la evolución intrahospitalaria. Se realizó hipotermia mediante el dispositivo Arctic-Sun® (33°C 24 h y recalentamiento a 0,25°C/h). La evolución neurológica se valoró mediante la escala Cerebral Performance Category (CPC). Se consideró DNG a los pacientes con grado CPC 3-5 o los fallecidos durante la hipotermia. En casos sin recuperación del nivel de conciencia tras finalizar la hipotermia y retirar la sedación, se realizó electroencefalograma a las 72-96 h del ingreso, así como potenciales evocados para determinar la presencia de onda N20, indicadora de respuesta cortical.
Se elaboró un modelo predictivo de DNG mediante variables disponibles precozmente. Se incluyeron en el análisis las variables disponibles al ingreso que mostraron asociación estadística (p < 0,2) con la aparición de DNG. El modelo predictivo se obtuvo mediante regresión logística binaria y cálculo de curva ROC (PASW Statistics 19.0; Chicago, Illinois, Estados Unidos), priorizándose la sencillez de medida y reproducibilidad de sus variables componentes, así como los criterios estadísticos del menor Cp de Mallows, mayor área bajo la curva ROC (ABC) y máxima parsimoniosidad del modelo.
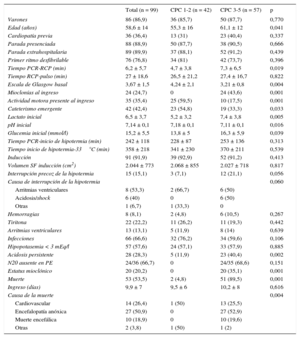
Del total de pacientes tratados (n = 100), se excluyó a 1 por no considerarlo indicado. Las características de los pacientes y su evolución intrahospitalaria se resumen en la tabla.
Características clínicas, manejo y evolución clínica en función de la evolución neurológica
| Total (n = 99) | CPC 1-2 (n = 42) | CPC 3-5 (n = 57) | p | |
|---|---|---|---|---|
| Varones | 86 (86,9) | 36 (85,7) | 50 (87,7) | 0,770 |
| Edad (años) | 58,6 ± 14 | 55,3 ± 16 | 61,1 ± 12 | 0,041 |
| Cardiopatía previa | 36 (36,4) | 13 (31) | 23 (40,4) | 0,337 |
| Parada presenciada | 88 (88,9) | 50 (87,7) | 38 (90,5) | 0,666 |
| Parada extrahospitalaria | 89 (89,9) | 37 (88,1) | 52 (91,2) | 0,439 |
| Primer ritmo desfibrilable | 76 (76,8) | 34 (81) | 42 (73,7) | 0,396 |
| Tiempo PCR-RCP (min) | 6,2 ± 5,7 | 4,7 ± 3,8 | 7,3 ± 6,5 | 0,019 |
| Tiempo RCP-pulso (min) | 27 ± 18,6 | 26,5 ± 21,2 | 27,4 ± 16,7 | 0,822 |
| Escala de Glasgow basal | 3,67 ± 1,5 | 4,24 ± 2,1 | 3,21 ± 0,8 | 0,004 |
| Mioclonías al ingreso | 24 (24,7) | 0 | 24 (43,6) | 0,001 |
| Actividad motora presente al ingreso | 35 (35,4) | 25 (59,5) | 10 (17,5) | 0,001 |
| Cateterismo emergente | 42 (42,4) | 23 (54,8) | 19 (33,3) | 0,033 |
| Lactato inicial | 6,5 ± 3,7 | 5,2 ± 3,2 | 7,4 ± 3,8 | 0,005 |
| pH inicial | 7,14 ± 0,1 | 7,18 ± 0,1 | 7,11 ± 0,1 | 0,016 |
| Glucemia inicial (mmol/l) | 15,2 ± 5,5 | 13,8 ± 5 | 16,3 ± 5,9 | 0,039 |
| Tiempo PCR-inicio de hipotermia (min) | 242 ± 118 | 228 ± 87 | 253 ± 136 | 0,313 |
| Tiempo inicio de hipotermia-33°C (min) | 358 ± 218 | 341 ± 230 | 370 ± 211 | 0,539 |
| Inducción | 91 (91,9) | 39 (92,9) | 52 (91,2) | 0,413 |
| Volumen SF inducción (cm2) | 2.044 ± 773 | 2.068 ± 855 | 2.027 ± 718 | 0,817 |
| Interrupción precoz de la hipotermia | 15 (15,1) | 3 (7,1) | 12 (21,1) | 0,056 |
| Causa de interrupción de la hipotermia | 0,060 | |||
| Arritmias ventriculares | 8 (53,3) | 2 (66,7) | 6 (50) | |
| Acidosis/shock | 6 (40) | 0 | 6 (50) | |
| Otras | 1 (6,7) | 1 (33,3) | 0 | |
| Hemorragias | 8 (8,1) | 2 (4,8) | 6 (10,5) | 0,267 |
| Tiritona | 22 (22,2) | 11 (26,2) | 11 (19,3) | 0,442 |
| Arritmias ventriculares | 13 (13,1) | 5 (11,9) | 8 (14) | 0,639 |
| Infecciones | 66 (66,6) | 32 (76,2) | 34 (59,6) | 0,106 |
| Hipopotasemia < 3 mEq/l | 57 (57,6) | 24 (57,1) | 33 (57,9) | 0,885 |
| Acidosis persistente | 28 (28,3) | 5 (11,9) | 23 (40,4) | 0,002 |
| N20 ausente en PE | 24/36 (66,7) | 0 | 24/35 (68,6) | 0,151 |
| Estatus mioclónico | 20 (20,2) | 0 | 20 (35,1) | 0,001 |
| Muerte | 53 (53,5) | 2 (4,8) | 51 (89,5) | 0,001 |
| Ingreso (días) | 9,9 ± 7 | 9,5 ± 6 | 10,2 ± 8 | 0,616 |
| Causa de la muerte | 0,004 | |||
| Cardiovascular | 14 (26,4) | 1 (50) | 13 (25,5) | |
| Encefalopatía anóxica | 27 (50,9) | 0 | 27 (52,9) | |
| Muerte encefálica | 10 (18,9) | 0 | 10 (19,6) | |
| Otras | 2 (3,8) | 1 (50) | 1 (2) |
CPC: escala Cerebral Performance Category; PCR: parada cardiorrespiratoria; PE: potenciales evocados; RCP: reanimación cardiopulmonar; SF: suero fisiológico.
Los valores expresan n (%), n/N (%) (N son los pacientes en que se realizó la exploración) o media ± desviación estándar.
Se consideró acidosis persistente la que se mantuvo 6 h o más a pesar de tratamiento. Se consideraron eventos hemorrágicos significativos los que motivaron inestabilidad hemodinámica o requirieron intervención, transfusión de hemoderivados o suspensión de tratamiento antitrombótico.
La incidencia de DNG fue de 57/99 (57,6%). La distribución por categorías de CPC al alta fue: CPC1, 34/99 (34,3%); CPC2, 8/99 (8,1%); CPC3, 5/99 (5,1%); CPC4, 38/99 (38,4%) y CPC5, 12/99 (12,1%); los 2 pacientes restantes (2,1%) fallecieron antes de alcanzar la normotermia.
Las variables al ingreso asociadas con DNG fueron: lactato inicial, acidosis metabólica, mioclonías; ausencia de actividad motora; tiempo hasta el inicio de la reanimación cardiopulmonar y edad. También se asociaron con DNG el estado mioclónico al finalizar la hipotermia, la acidosis metabólica persistente y la ausencia de respuesta cortical en potenciales evocados.
Los aspectos técnicos y las complicaciones relacionadas con el tratamiento no se correlacionaron con DNG.
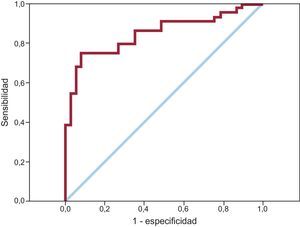
El modelo predictivo final, formado por 3 componentes (edad, lactato inicial y mioclonías al ingreso), mostró un ABC de 0,85 (intervalo de confianza del 95%, 0,76-0,94). La figura muestra la curva ROC del modelo predictivo.
En los pacientes sometidos a hipotermia terapéutica, la recuperación neurológica puede retrasarse por el efecto de la sedación o la hipotermia terapéutica en el cerebro, y actualmente se recomienda retrasar la valoración neurológica más allá de las 72 h y basándose en múltiples predictores, dado que ninguna variable descarta por completo una recuperación tardía.
Existe poca información sobre la valoración pronóstica precoz de pacientes con muerte súbita. Recientemente, Aschauer et al4 analizaron una serie de 1.932 pacientes con muerte súbita extrahospitalaria, y obtuvieron una puntuación de riesgo de muerte a 30 días con 4 variables con notable capacidad predictiva (ABC = 0,81). La principal diferencia con nuestra serie es la variable objetivo. A nuestro juicio, la mortalidad por cualquier causa (hemorragias, infecciones, etc.) y el DNG son objetivos con diferencias conceptuales significativas y consecuencias socioeconómicas diferentes. Por otro lado, algunas de las variables incluidas, a pesar de ser potentes predictores (cantidad de adrenalina administrada, minutos hasta la recuperación de circulación espontánea), en ocasiones son difíciles de medir con precisión, dado el escenario emergente del evento. En nuestra serie se priorizaron la sencillez, la objetividad y la reproducibildad de la medición de las variables, aun reconociendo la existencia de otros múltiples predictores de DNG, como reflejan otros trabajos. El modelo obtenido resultó parsimonioso, con únicamente 3 predictores y óptima capacidad predictiva.
A pesar de ello, la aplicabilidad práctica de estos hallazgos pasaría por elaborar una puntuación de riesgo ponderando la importancia de cada variable y establecer franjas de puntuaciones aplicables en otras series. Para ello se requeriría, en nuestra opinión, un mayor tamaño muestral y su validación externa en una muestra diferente. Otras limitaciones son las inherentes a un registro unicéntrico y la disponibilidad parcial de factores como enolasa neuronal, electroencefalograma o marcadores inflamatorios.
Es importante recalcar que esta aproximación pronóstica precoz no debe, en ningún caso, sustituir a una minuciosa valoración multidisciplinaria una vez eliminada la sedación, pues las decisiones respecto al mantenimiento del esfuerzo terapéutico deben ser escrupulosas y basarse en parámetros con especificidad cercana al 100%. El objetivo primordial de este trabajo es ilustrar una forma rápida y sencilla de realizar una valoración neurológica precoz en este escenario. Dada la secuencia habitual de actuaciones (inducción-mantenimiento-recalentamiento-retirada de sedación), la información en las primeras 72 h suele ser escasa, y nuestros hallazgos pueden complementar la valoración más tardía y mejorar la información a familiares, especialmente cuando la recuperación neurológica se presuma probable.