La válvula autoexpandible Portico es una nueva válvula de implante transcatéter que ha mostrado resultados prometedores en estudios preliminares; sin embargo, no existen estudios que comparen este dispositivo con sistemas previos de válvula aórtica transcatéter. El objetivo de este estudio es comparar los resultados hemodinámicos de la válvula autoexpandible Portico con los de la válvula expandible mediante balón SAPIEN XT en un estudio de casos apareados con análisis en un laboratorio central de ecocardiografía
MétodosSe emparejó a 22 pacientes tratados mediante implante transcatéter de la válvula Portico de 23mm con 40 pacientes tratados con la válvula SAPIEN XT de 23mm, según los siguientes parámetros: área y diámetro medio del anillo aórtico por tomografía computarizada multidetector, fracción de eyección del ventrículo izquierdo, área de superficie corporal e índice de masa corporal. El diámetro medio del anillo aórtico fue de 19,6±1,3mm por ecocardiografía transtorácica y de 21,4±1,2mm por tomografía computarizada, sin diferencias significativas entre los grupos. Se obtuvieron imágenes de ecocardiografía Doppler antes de la intervención y en el seguimiento realizado al cabo de 1 mes y se analizaron en un laboratorio central de ecocardiografía.
ResultadosNo se objetivaron diferencias significativas entre los grupos en el gradiente transaórtico medio residual (SAPIEN XT, 10,4±3,7mmHg; Portico, 9,8±1,1mmHg; p=0,49) ni en el área efectiva del orificio valvular (SAPIEN XT, 1,36±0,27cm2; Portico, 1,37±0,29cm2; p=0,54). La incidencia del desajuste protésico (área efectiva del orificio valvular < 0,65cm2/m2) fue similar en ambos grupos (el 13,5 frente al 10,0%; p=0,56). No se observaron diferencias entre los grupos en cuanto a la incidencia de fugas paravalvulares moderadas o graves (el 5,0 frente al 4,8%; p=0,90).
ConclusionesEl implante transcatéter de la válvula autoexpandible Portico produjo resultados hemodinámicos a corto plazo similares a los de la válvula expandible por balón SAPIEN XT en el tratamiento de pacientes con estenosis aórtica grave y anillo aórtico pequeño. Son necesarios estudios prospectivos con seguimiento a más largo plazo y en pacientes con anillo aórtico mayor.
Palabras clave
El implante percutáneo de válvula aórtica (TAVI) es una técnica bien establecida para el tratamiento de los pacientes con estenosis aórtica sintomática grave cuyo riesgo en una sustitución quirúrgica de la válvula aórtica se considere alto o prohibitivo1. Además, el TAVI se ha asociado a una mejora de los resultados hemodinámicos y clínicos en los pacientes con anillo aórtico pequeño, con baja incidencia de desajustes prótesis-paciente (DPP) y un aumento no significativo de insuficiencia aórtica (IA) importante, en comparación con la sustitución quirúrgica de la válvula aórtica en este grupo de pacientes2–4. Sin embargo, los datos sobre el tratamiento de los pacientes con anillo aórtico pequeño se han limitado en gran parte al uso de válvulas para implante percutáneo pequeñas (23mm) y expandibles con balón.
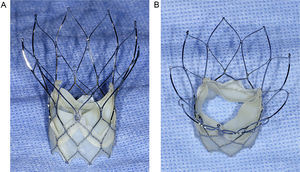
El sistema valvular Portico (St. Jude Medical; Minneapolis, Minnesota, Estados Unidos) es una válvula aórtica para implante percutáneo de segunda generación, que consta de un marco estructural autoexpandible de nitinol que contiene tres valvas de pericardio bovino y un manguito de sellado de pericardio porcino5 (figura 1). La recuperabilidad y recolocabilidad de la válvula Portico son dos importantes características favorables de este nuevo sistema valvular. La primera válvula Portico que se lanzó tenía un tamaño de 23mm, y los datos preliminares obtenidos en una cohorte de pacientes pequeña mostraron resultados clínicos y hemodinámicos satisfactorios en pacientes con anillo aórtico pequeño6. Sin embargo, es bien sabido que la menor cantidad de metal presente en el marco estructural del stent del sistema Portico, que facilita que se pueda volver a colocar una vaina que cubra la totalidad de una válvula colocada, conlleva la producción de menores fuerzas radiales que con otros sistemas percutáneos de válvula aórtica autoexpandibles7. Esto ha planteado cierta preocupación respecto al modo en que estos cambios pueden influir en la función de la válvula para implante percutáneo (tasa de fugas paravalvulares y área valvular residual). Además, la inserción inferior de las valvas de la válvula dentro del marco estructural de la estructura del stent, a nivel del anillo en vez de supraanular, puede influir también negativamente en la hemodinámica de la válvula. Así pues, sería importante comparar los resultados hemodinámicos de esta válvula con los de las válvulas de la generación anterior. El objetivo de este estudio es comparar en pacientes con anillo aórtico pequeño los resultados hemodinámicos a corto plazo de la válvula autoexpandible Portico de 23mm con los de la válvula expandible por balón SAPIEN XT (SXTV) de 23mm, mediante la evaluación realizada en una población de casos apareados en un laboratorio central de ecocardiografía.
MÉTODOSEl estudio se realizó en dos centros, en los que se trató con TAVI a 22 pacientes consecutivos con estenosis aórtica sintomática grave utilizando la válvula Portico autoexpandible de 23mm. Se emparejó a estos pacientes según sus características con 40 pacientes consecutivos a los que se había practicado anteriormente un TAVI con la válvula expandible por balón SXTV de 23mm. Los datos de estos pacientes se habían obtenido de forma prospectiva. Los criterios de emparejamiento (todos ellos previos al TAVI) fueron los siguientes: a) tamaño de la prótesis (23mm, emparejamiento exacto); b) área del anillo aórtico (con un margen de 50mm2) evaluado mediante tomografía computarizada multidetector (TCMD); c) diámetro medio del anillo aórtico evaluado mediante TCMD (con un margen de 0,5mm); d) fracción de eyección del ventrículo izquierdo (con un margen del 10%) determinada mediante ecocardiografía transtorácica; e) área de superficie corporal (con un margen de 0,4 m2), y f) índice de masa corporal (con un margen de 5 kg/m2). Se utilizó un número variable de pacientes de control (entre 1 y 4), con lo que la muestra final fue de 40 pacientes emparejados que habían sido tratados con TAVI utilizando la SXTV de 23mm. En la tabla 1 se presentan los valores de las variables de emparejamiento según el tipo de válvula.
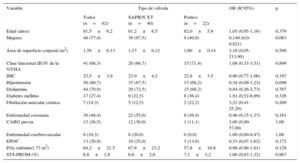
Variables de emparejamiento (en ambos grupos se utilizaron prótesis de 23mm)
| Variable | Tipo de válvula | OR (IC95%) | p | ||
|---|---|---|---|---|---|
| Todos (n=62) | SAPIEN XT (n=40) | Portico (n=22) | |||
| Diámetro medio de anillo aórtico (mm) | 21,4±1,2 | 21,7±1,1 | 20,9±1,2 | 0,57 (0,19-1,74) | 0,324 |
| Área de anillo aórtico (mm2) | 369,9±36,6 | 373,6±33,0 | 364,3±42,3 | 1,00 (0,97-1,04) | 0,934 |
| FEVI (%) | 56,9±11,9 | 58,1±10,9 | 54,8±13,7 | 0,95 (0,88-1,03) | 0,189 |
| Área de superficie corporal (m2) | 1,58±0,13 | 1,57±0,12 | 1,60±0,14 | 3,18 (0,05-213,20) | 0,589 |
| IMC | 23,5±3,9 | 23,9±4,2 | 22,8±3,5 | 0,90 (0,77-1,06) | 0,197 |
FEVI: fracción de eyección del ventrículo izquierdo; IC95%: intervalo de confianza del 95%; IMC: índice de masa corporal; OR: odds ratio.
Evaluado mediante tomografía computarizada.
Salvo otra indicación, los valores expresan media±desviación estándar o n (%).
Las exploraciones de TCMD se realizaron y se interpretaron según los criterios recomendados por Achenbach et al8. De forma resumida, el protocolo de adquisición de TCMD se sincronizó con el electrocardiograma (en sístole) mientras el paciente aguantaba la respiración, con un sistema de adquisición simultánea de 64 cortes y administración de un medio de contraste yodado. Se obtuvo una reconstrucción con una anchura de corte de 0,6mm en todo el volumen de imagen.
El tamaño de la prótesis se determinó a partir de las mediciones del anillo aórtico según un método descrito con anterioridad5,9. El objetivo era obtener un sobredimensionamiento del área de la prótesis en un 1-15% respecto al área del anillo aórtico en todos los pacientes. La intervención de TAVI se ha descrito detalladamente en publicaciones anteriores1. Las intervenciones se llevaron a cabo guiadas por fluoroscopia/angiografía y ecocardiografía transesofágica. Los datos de la intervención y de los eventos clínicos aparecidos en un periodo de 30 días se registraron de manera prospectiva y se definieron según los criterios del Valve Academic Research Consortium 2 (VARC-2)10. Todas las intervenciones de TAVI se llevaron a cabo dentro de un programa de uso clínico compasivo aprobado por la autoridad sanitaria Health Canada, y todos los pacientes firmaron un documento de consentimiento informado.
Se realizó a todos los pacientes una exploración completa mediante ecocardiografía transtorácica, siguiendo lo establecido en la guía de la American Society of Echocardiography11,12, antes de la intervención y a los 30 días del TAVI. Se evaluaron todas las ecocardiografías de manera centralizada en el laboratorio central de ecocardiografía del Quebec Heart and Lung Institute. Todas las imágenes se almacenaron en formato digital, y técnicos con experiencia realizaron los análisis offline, bajo la supervisión de un cardiólogo, empleando la plataforma Image Arena Plataform (TomTec Imaging Systems; Unterschleissheim, Alemania). Se realizaron las siguientes determinaciones a todos los pacientes: diámetro del anillo aórtico, diámetro del tracto de salida del ventrículo izquierdo (TSVI), volumen de eyección, fracción de eyección del ventrículo izquierdo evaluada con el método de biplano de Simpson, valor medio y máximo del gradiente transvalvular estimados con la fórmula de Bernoulli modificada, y área efectiva del orificio (AEO) valvular calculada con la ecuación de continuidad. El anillo aórtico se midió en una proyección de eje largo paraesternal, con zoom, desde el punto de bisagra de la cúspide aórtica anterior con el tabique ventricular hasta la unión de la cúspide aórtica posterior con la valva mitral anterior. Después del TAVI, se midió el diámetro del TSVI inmediatamente por debajo del margen apical del stent de la prótesis10,13,14. Se obtuvieron también registros Doppler del TSVI inmediatamente por debajo del margen del stent, con objeto de garantizar que las velocidades del flujo se registraran en el mismo lugar que el diámetro del TSVI14,15. Si la válvula implantada por vía percutánea tenía una posición baja en el TSVI, con el margen del stent por debajo del extremo apical de aquel y protruyendo en la cavidad del ventrículo izquierdo, las mediciones del diámetro del TSVI y la velocidad se realizaban dentro del stent, inmediatamente por debajo de las valvas de la válvula para implante transcatéter16. El índice de velocidad Doppler se calculó como el cociente de velocidad en el TSVI/velocidad transvalvular15,17. El AEO se indexó respecto al área de superficie corporal, y la presencia de un DPP se definió por un valor del AEO indexada ≤ 0,85cm2/m2. Se consideró18 que un DPP era moderado si el AEO indexada era de 0,65-0,85cm2/m2 y que era grave si era < 0,65cm2/m2.
Se registró la presencia o ausencia, el grado y el tipo (paravalvular o transvalvular) de IA en todos los pacientes. La gravedad de la IA se evaluó con un enfoque multiparamétrico y se clasificó según las recomendaciones del VARC-2. La gravedad de la IA se clasificó como sigue: ninguna o trazas, leve, moderada y grave. Si había una IA paravalvular, se determinaba también el número de chorros, la localización y la amplitud circunferencial. La amplitud circunferencial de los chorros paravalvulares se midió en proyecciones de eje corto paraesternales con Doppler color14,15.
Análisis estadísticoSe consideró variable de estratificación a cada grupo emparejado. Se aplicó una regresión logística condicional para detectar la asociación entre el tipo de válvula y las variables seleccionadas observadas en los estratos. Los resultados se consideraron significativos con valores de p<0,05.
Los análisis se llevaron a cabo con el paquete estadístico SAS, versión 9.3 (SAS Institute Inc.; Cary, North Carolina, Estados Unidos).
RESULTADOSNo se observó diferencia significativa alguna entre los grupos por lo que respecta a las características clínicas basales, pero hubo tendencia a mayor prevalencia de mujeres en el grupo de SXTV (tabla 2). En la tabla 3 se enumeran los principales eventos aparecidos durante la intervención y la hospitalización después del TAVI. No se identificaron diferencias significativas entre los grupos en cuanto a eventos periintervención, si bien en el grupo de Portico hubo mayor incidencia, no significativa, de hemorragias mayores que en el grupo de SXTV (el 14,3 frente al 5,0%; p=0,081). La incidencia de implante de marcapasos fue baja (< 10%) en los dos grupos. Dos pacientes del grupo de la válvula Portico necesitaron un segundo implante valvular. En un paciente se observó una IA grave después del despliegue de la primera válvula. En otro paciente se produjo una embolización de la válvula Portico hacia la aorta ascendente durante las maniobras de colocación del asa para el reposicionamiento de la válvula, y se implantó con éxito una segunda válvula. En un tercer paciente la válvula se desplazó hacia el TSVI al final del despliegue y se implantó en una posición ligeramente más ventricular de lo previsto; sin embargo, no se apreció una IA significativa ni hubo repercusiones hemodinámicas. De igual modo, 2 pacientes tratados con SXTV necesitaron una segunda válvula debido a una IA grave aparecida después del despliegue de la primera y que persistió tras la dilatación con balón. En un paciente del grupo de SXTV se produjo una perforación ventricular (relacionada con la guía) que requirió conversión a intervención quirúrgica abierta.
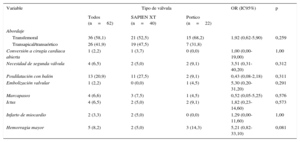
Características basales, en general y según el tipo de válvula percutánea
| Variable | Tipo de válvula | OR (IC95%) | p | ||
|---|---|---|---|---|---|
| Todos (n=62) | SAPIEN XT (n=40) | Portico (n=22) | |||
| Edad (años) | 81,5±6,2 | 81,2±6,5 | 82,0±5,9 | 1,05 (0,95-1,16) | 0,370 |
| Mujeres | 48 (77,4) | 39 (97,5) | 9 (40,9) | 0,149 (0,0-0,821) | 0,063 |
| Área de superficie corporal (m2) | 1,58±0,13 | 1,57±0,12 | 1,60±0,14 | 3,18 (0,05-213,90) | 0,589 |
| Clase funcional III-IV de la NYHA | 41 (68,3) | 26 (66,7) | 15 (71,4) | 1,08 (0,33-3,51) | 0,899 |
| IMC | 23,5±3,9 | 23,9±4,2 | 22,8±3,5 | 0,90 (0,77-1,06) | 0,197 |
| Hipertensión | 50 (80,7) | 35 (87,5) | 15 (68,2) | 0,34 (0,09-1,23) | 0,099 |
| Dislipemia | 44 (70,9) | 29 (72,5) | 15 (68,2) | 0,84 (0,26-2,73) | 0,767 |
| Diabetes mellitus | 17 (27,4) | 9 (22,5) | 8 (36,4) | 1,91 (0,52-6,99) | 0,326 |
| Fibrilación auricular crónica | 7 (14,3) | 5 (12,5) | 2 (22,2) | 3,21 (0,41-25,20) | 0,269 |
| Enfermedad coronaria | 30 (48,4) | 22 (55,0) | 8 (36,4) | 0,46 (0,15-1,37) | 0,163 |
| CABG previa | 13 (26,5) | 12 (30,0) | 1 (11,1) | 3,00 (0,00-57,00) | 1,00 |
| Enfermedad cerebrovascular | 8 (16,3) | 8 (20,0) | 0 (0,0) | 1,00 (0,00-8,47) | 1,00 |
| EPOC | 13 (20,9) | 10 (25,0) | 3 (13,6) | 0,33 (0,07-1,62) | 0,172 |
| FGe (ml/min/1,73 m2) | 64,2±21,5 | 67,8±23,2 | 57,8±16,8 | 0,98 (0,96-1,01) | 0,129 |
| STS-PROM (%) | 6,8±2,8 | 6,6±2,6 | 7,1±3,2 | 1,00 (0,83-1,22) | 0,967 |
CABG: cirugía de revascularización aortocoronaria; EPOC: enfermedad pulmonar obstructiva crónica; FGe: filtrado glomerular estimado; IC95%: intervalo de confianza del 95%; IMC: índice de masa corporal; NYHA: New York Heart Association; OR: odds ratio; STS-PROM: riesgo de muerte predicho de la Society of Thoracic Surgeons.
Salvo otra indicación, los datos expresan n (%) o media ± desviación estándar.
Complicaciones tras la intervención según el tipo de válvula percutánea
| Variable | Tipo de válvula | OR (IC95%) | p | ||
|---|---|---|---|---|---|
| Todos (n=62) | SAPIEN XT (n=40) | Portico (n=22) | |||
| Abordaje | |||||
| Transfemoral | 36 (58,1) | 21 (52,5) | 15 (68,2) | 1,92 (0,62-5,90) | 0,259 |
| Transapical/transaórtico | 26 (41,9) | 19 (47,5) | 7 (31,8) | ||
| Conversión a cirugía cardiaca abierta | 1 (2,2) | 1 (3,7) | 0 (0,0) | 1,00 (0,00-19,00) | 1,00 |
| Necesidad de segunda válvula | 4 (6,5) | 2 (5,0) | 2 (9,1) | 3,51 (0,31-40,20) | 0,312 |
| Posdilatación con balón | 13 (20,9) | 11 (27,5) | 2 (9,1) | 0,43 (0,08-2,18) | 0,311 |
| Embolización valvular | 1 (2,2) | 0 (0,0) | 1 (4,5) | 5,30 (0,20-31,20) | 0,291 |
| Marcapasos | 4 (6,6) | 3 (7,5) | 1 (4,5) | 0,52 (0,05-5,25) | 0,576 |
| Ictus | 4 (6,5) | 2 (5,0) | 2 (9,1) | 1,82 (0,23-14,60) | 0,573 |
| Infarto de miocardio | 2 (3,3) | 2 (5,0) | 0 (0,0) | 1,29 (0,00-11,60) | 1,00 |
| Hemorragia mayor | 5 (8,2) | 2 (5,0) | 3 (14,3) | 5,21 (0,82-33,10) | 0,081 |
IC95%: intervalo de confianza del 95%; OR: odds ratio.
Salvo otra indicación, los datos expresan n (%).
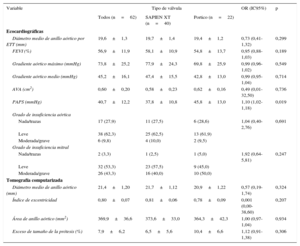
En la tabla 4 se enumeran las principales características observadas en la ecocardiografía y en la TCMD según el tipo de válvula utilizado. No se observaron diferencias entre los grupos en cuanto a la gravedad de la estenosis aórtica (p>0,70 para la media del gradiente transvalvular y el área de la válvula aórtica), y los diámetros del anillo aórtico (evaluado en la ecocardiografía transtorácica) también fueron similares entre los dos grupos (p=0,30). Aparte de las variables de TCMD con las que se realizó el emparejamiento (área del anillo aórtico y diámetro medio), los dos grupos también estaban bien igualados en cuanto al índice de excentricidad del anillo aórtico (p=0,21). Además, el grado de sobredimensionamiento de la válvula fue similar en los grupos de Portico y de SXTV (el 10,4±6,6 frente al 6,5±5,6%; p=0,31).
Datos de ecocardiografía y tomografía computarizada basales, generales y según el tipo de válvula
| Variable | Tipo de válvula | OR (IC95%) | p | ||
|---|---|---|---|---|---|
| Todos (n=62) | SAPIEN XT (n=40) | Portico (n=22) | |||
| Ecocardiográficas | |||||
| Diámetro medio de anillo aórtico por ETT (mm) | 19,6±1,3 | 19,7±1,4 | 19,4±1,2 | 0,73 (0,41-1,32) | 0,299 |
| FEVI (%) | 56,9±11,9 | 58,1±10,9 | 54,8±13,7 | 0,95 (0,88-1,03) | 0,189 |
| Gradiente aórtico máximo (mmHg) | 73,8±25,2 | 77,9±24,3 | 69,8±25,9 | 0,99 (0,96-1,02) | 0,549 |
| Gradiente aórtico medio (mmHg) | 45,2±16,1 | 47,4±15,5 | 42,8±13,0 | 0,99 (0,95-1,04) | 0,714 |
| AVA (cm2) | 0,60±0,20 | 0,58±0,23 | 0,62±0,16 | 0,49 (0,01-32,50) | 0,736 |
| PAPS (mmHg) | 40,7±12,2 | 37,8±10,8 | 45,8±13,0 | 1,10 (1,02-1,18) | 0,019 |
| Grado de insuficiencia aórtica | |||||
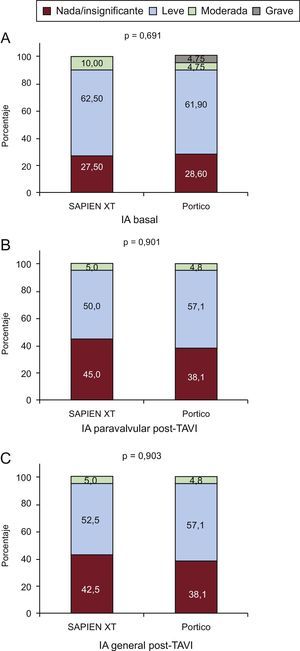
| Nada/trazas | 17 (27,9) | 11 (27,5) | 6 (28,6) | 1,04 (0,40-2,76) | 0,691 |
| Leve | 38 (62,3) | 25 (62,5) | 13 (61,9) | ||
| Moderada/grave | 6 (9,8) | 4 (10,0) | 2 (9,5) | ||
| Grado de insuficiencia mitral | |||||
| Nada/trazas | 2 (3,3) | 1 (2,5) | 1 (5,0) | 1,92 (0,64-5,81) | 0,247 |
| Leve | 32 (53,3) | 23 (57,5) | 9 (45,0) | ||
| Moderada/grave | 26 (43,3) | 16 (40,0) | 10 (50,0) | ||
| Tomografía computarizada | |||||
| Diámetro medio de anillo aórtico (mm) | 21,4±1,20 | 21,7±1,12 | 20,9±1,22 | 0,57 (0,19-1,74) | 0,324 |
| Índice de excentricidad | 0,80±0,07 | 0,81±0,06 | 0,78±0,09 | 0,001 (0,00-38,60) | 0,207 |
| Área de anillo aórtico (mm2) | 369,9±36,6 | 373,6±33,0 | 364,3±42,3 | 1,00 (0,97-1,04) | 0,934 |
| Exceso de tamaño de la prótesis (%) | 7,9±6,2 | 6,5±5,6 | 10,4±6,6 | 1,12 (0,91-1,38) | 0,306 |
AVA: área de válvula aórtica; ETT: ecocardiografía transtorácica; FEVI: fracción de eyección del ventrículo izquierdo; IC95%: intervalo de confianza del 95%; OR: odds ratio; PAPS: presión arterial pulmonar sistólica.
Salvo otra indicación, los datos expresan n (%) o media ± desviación estándar.
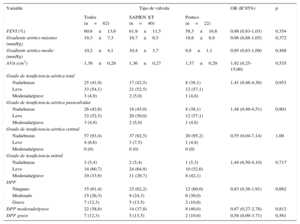
Los datos de la ecocardiografía después del TAVI, según el tipo de válvula, se presentan en la tabla 5. Las mediciones del diámetro y de la velocidad en el TSVI se realizaron antes de la colocación del stent en todos los pacientes, según las recomendaciones del VARC-2. La media global del gradiente transprotésico se redujo de 45,2±16,1 a 10,2±4,1mmHg (p<0,001), y la media del AEO aumentó de 0,60±0,2 a 1,36±0,28cm2 (p<0,001) después del TAVI. No hubo diferencia alguna entre los grupos por lo que respecta al gradiente medio transaórtico residual (p=0,49) y el AEO (p=0,54). No se observaron diferencias entre los grupos en cuanto a la presencia y la gravedad de fugas paravalvulares (p=0,90) o IA (p=0,95) (figuras 2 y 3).
Datos de ecocardiografía después del implante percutáneo de válvula aórtica según el tipo de válvula
| Variable | Tipo de válvula | OR (IC95%) | p | ||
|---|---|---|---|---|---|
| Todos (n=62) | SAPIEN XT (n=40) | Portico (n=22) | |||
| FEVI (%) | 60,6±13,6 | 61,9±11,5 | 58,3±16,6 | 0,98 (0,93-1,03) | 0,354 |
| Gradiente aórtico máximo (mmHg) | 19,3±7,3 | 19,7±6,5 | 18,6±8,9 | 0,96 (0,88-1,05) | 0,372 |
| Gradiente aórtico medio (mmHg) | 10,2±4,1 | 10,4±3,7 | 9,8±1,1 | 0,95 (0,83-1,09) | 0,488 |
| AVA (cm2) | 1,36±0,28 | 1,36±0,27 | 1,37±0,29 | 1,92 (0,25-15,00) | 0,535 |
| Grado de insuficiencia aórtica total | |||||
| Nada/trazas | 25 (41,0) | 17 (42,5) | 8 (38,1) | 1,41 (0,46-4,30) | 0,953 |
| Leve | 33 (54,1) | 21 (52,5) | 12 (57,1) | ||
| Moderada/grave | 3 (4,9) | 2 (5,0) | 1 (4,8) | ||
| Grado de insuficiencia aórtica paravalvular | |||||
| Nada/trazas | 26 (42,6) | 18 (45,0) | 8 (38,1) | 1,48 (0,49-4,51) | 0,901 |
| Leve | 32 (52,5) | 20 (50,0) | 12 (57,1) | ||
| Moderada/grave | 3 (4,9) | 2 (5,0) | 1 (4,8) | ||
| Grado de insuficiencia aórtica central | |||||
| Nada/trazas | 57 (93,4) | 37 (92,5) | 20 (95,2) | 0,55 (0,04-7,14) | 1,00 |
| Leve | 4 (6,6) | 3 (7,5) | 1 (4,8) | ||
| Moderada/grave | 0 (0) | 0 (0) | 0 (0) | ||
| Grado de insuficiencia mitral | |||||
| Nada/trazas | 3 (5,4) | 2 (5,4) | 1 (5,3) | 1,44 (0,50-4,10) | 0,717 |
| Leve | 34 (60,7) | 24 (64,9) | 10 (52,6) | ||
| Moderada/grave | 19 (33,9) | 11 (29,7) | 8 (42,1) | ||
| DPP | |||||
| Ninguno | 35 (61,4) | 23 (62,2) | 12 (60,0) | 0,83 (0,36-1,91) | 0,662 |
| Moderado | 15 (26,3) | 9 (24,3) | 6 (30,0) | ||
| Grave | 7 (12,3) | 5 (13,5) | 2 (10,0) | ||
| DPP moderado/grave | 22 (38,6) | 14 (37,8) | 8 (40,0) | 0,87 (0,27-2,78) | 0,812 |
| DPP grave | 7 (12,3) | 5 (13,5) | 2 (10,0) | 0,58 (0,09-3,71) | 0,561 |
AVA: área de válvula aórtica; DPP: desajuste prótesis-paciente; FEVI: fracción de eyección del ventrículo izquierdo; IC95%: intervalo de confianza del 95%; OR: odds ratio.
Salvo otra indicación, los datos expresan n (%) o media ± desviación estándar.
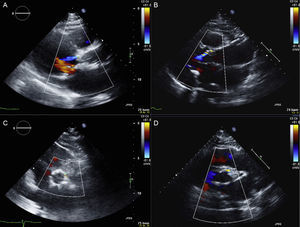
Imágenes de ecocardiografía tras la intervención en 2 pacientes sometidos a implante percutáneo de válvula aórtica empleando la válvula Portico (A y C) y la válvula SAPIEN XT (B y D). Fuga paravalvular leve tras implantar una válvula Portico (A: eje largo; C: eje corto) y una SAPIEN XT (B: eje largo; D: eje corto). Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Este primer informe, en el que se compara los resultados hemodinámicos de la nueva válvula autoexpandible Portico de 23mm con el de la válvula expandible por balón SXTV de 23mm en el tratamiento de pacientes con estenosis aórtica grave y anillo aórtico pequeño, resalta que los resultados hemodinámicos son similares con los dos sistemas valvulares, con un gradiente medio residual < 10mmHg y una tasa de incidencia de DPP grave < 15%. Además, la tasa de incidencia de fugas paravalvulares moderadas o graves fue de ∼5% en ambos grupos.
Algunos estudios previos —no todos— habían puesto de manifiesto mayores tasas de fugas paravalvulares precoces con el uso del sistema autoexpandible CoreValve19–22. Aunque las diferencias a largo plazo entre las válvulas son inciertas, esta mayor incidencia de fugas paravalvulares más tempranas se atribuyó en parte a que se alcanzaba menor fuerza radial que con el sistema autoexpandible por balón de Edwards23. Esto hizo que surgieran preocupaciones acerca del nuevo sistema transcatéter de válvula aórtica autoexpandible Portico, debido en gran parte a la menor cantidad de metal y el tamaño celular del marco estructural del stent, que causaban también menos fuerza radial, similar a la del sistema CoreValve7. Estas características de diseño se incorporaron con el objetivo de producir un sistema de válvula aórtica para implante transcatéter que fuera plenamente recuperable y reposicionable en caso de mala colocación o embolización de la válvula. El presente informe confirma que estas características de diseño no se tradujeron en mayor frecuencia o mayor gravedad de las fugas paravalvulares. El diseño con mayor área celular da lugar a un cociente de tejido respecto a marco estructural elevado en el segmento del manguito de la válvula, y se ha propuesto que esto es un posible mecanismo de reducción de la IA al permitir que el tejido de la válvula se conforme alrededor de los nódulos calcificados a la altura del anillo. Además, actualmente se acepta de manera general que la colocación adecuada del dispositivo es un factor clave por lo que respecta a la aparición de IA24. En este sentido, el carácter reposicionable y recuperable del sistema transcatéter de válvula aórtica Portico puede contribuir a mejorar la colocación final de la válvula.
La aparición de un DPP después del TAVI (y de la sustitución quirúrgica de válvula aórtica) sigue siendo un importante motivo de preocupación después del tratamiento de los pacientes con estenosis aórtica grave y anillo pequeño. En dos recientes subestudios del ensayo PARTNER2,3, se puso de manifiesto una tasa de DPP tras TAVI con válvula expandible por balón menor que la observada tras la sustitución quirúrgica de la válvula aórtica en esos pacientes. Además de la menor fuerza radial ejercida por la válvula Portico, que las valvas de la válvula se coloquen en una posición muy baja (a la altura del anillo en vez de supraanular) dentro del marco estructural del stent podría haberse traducido en un aumento del gradiente residual y en mayor frecuencia de DPP. El presente estudio observó una media de gradiente residual < 10mmHg y una frecuencia de DPP moderado o grave del 40% tras el implante de la válvula Portico en pacientes con anillo pequeño, lo cual es similar al resultado obtenido con el sistema expandible por balón de Edwards. Esta frecuencia es coherente también con la tasa de DPP descrita en estudios previos en pacientes con anillo pequeño3,4. La adaptabilidad y la función normal de la válvula del sistema Portico se han demostrado en estructuras circulares y no circulares en las pruebas realizadas (datos no publicados) y es probable que ello facilite que se mantengan bajos los gradientes residuales a pesar de las menores fuerzas radiales. Serán necesarios nuevos estudios para comparar este sistema de TAVI con otros con propiedades de función valvular supraanulares (el sistema Medtronic CoreValve).
St. Jude Medical detuvo temporalmente el programa de la válvula Portico en septiembre de 2014 tras detectar una movilidad reducida de las valvas en los exámenes de TCMD cuatridimensional en pacientes que participaban en un ensayo fundamental de registro en Estados Unidos (ClinicalTrials.gov: 02000115). Esta decisión se tomó a pesar de que los datos clínicos y ecocardiográficos preliminares no habían indicado ningún problema del sistema valvular. El presente estudio confirma que la hemodinámica inicial de la válvula con el sistema Portico es comparable a la que se da con los sistemas de TAVI contemporáneos. Es importante señalar que se observó ausencia de aumento del gradiente residual y que no hubo ningún caso de IA transvalvular significativa. Por desgracia, no se realizaron exploraciones de ecocardiografía transesofágica ni de TCMD con contraste en el seguimiento de la población en estudio, y no se puede aportar datos adicionales que permitan ampliar el conocimiento actual sobre el movimiento de las valvas.
Aunque este estudio no dispuso de la potencia estadística necesaria para detectar diferencias en los eventos clínicos, no se observaron diferencias significativas entre los dos grupos en cuanto a los eventos tempranos. No se registró ningún caso de trombosis protésica, lo cual concuerda con la baja incidencia anteriormente descrita de esta complicación25. Es de destacar que la tasa de implante de marcapasos permanentes fue baja en ambos grupos, en especial en el tratado con el sistema Portico (4,8%). Esta incidencia es muy inferior a la que indican los datos contemporáneos de otras válvulas aórticas transcatéter autoexpandibles26, lo que puede deberse en parte al diseño específico del sistema valvular Portico. En comparación con el sistema CoreValve, la válvula Portico no contiene una entrada acampanada y cuenta con valvas y un manguito de tejido de posición baja en el marco estructural de soporte, con lo que se reduce al mínimo la protrusión del dispositivo al TSVI. Además, se ha descrito que el implante valvular profundo es un factor independiente que predice la necesidad de implantar un marcapasos permanente después del TAVI con válvulas autoexpandibles26. Dada la posibilidad de volver a colocar una vaina que recubra la totalidad de la válvula Portico, esta puede reposicionarse para evitar un implante más bajo.
LimitacionesEn este análisis hay que tener en cuenta varias limitaciones, entre las que se encuentran el diseño no aleatorizado y el pequeño tamaño muestral. Esto se vio compensado en parte por el proceso de emparejamiento estricto utilizado entre los grupos, que incluyó el empleo de los datos de TCMD tridimensional y un análisis estandarizado uniforme realizado por un laboratorio central de ecocardiografía. Sin embargo, estos resultados tendrán que confirmarse en un ensayo más amplio, de diseño prospectivo y aleatorizado. Tal como es de prever al evaluar una nueva válvula cardiaca para implante percutáneo, los dos centros tenían menos experiencia con la válvula Portico que con el dispositivo SXTV. En el presente análisis solo se incluyó a los pacientes que sobrevivieron al periodo de hospitalización y, por consiguiente, puede haber habido un sesgo de selección «positiva» de los pacientes en ambos grupos. Además, en este estudio no se obtuvieron sistemáticamente datos sobre la carga de calcio a nivel del anillo de la válvula (factor este que puede influir en la incidencia de fugas paravalvulares), lo cual impidió el uso de esta variable en el proceso de emparejamiento. Estos datos hacen referencia a válvulas aórticas tricúspides y en el futuro serán necesarios estudios en la estenosis aórtica bicúspide27. Por último, estos datos solo se pueden aplicar a la válvula de 23mm y no pueden extrapolarse a anillos aórticos y tamaños valvulares mayores.
CONCLUSIONESEl sistema valvular Portico autoexpandible de 23mm produjo un resultado hemodinámico similar al del sistema expandible por balón SXTV. Mientras se esperan los resultados del ensayo prospectivo y aleatorizado fundamental con fines de registro en Estados Unidos, el presente informe indica que el sistema valvular Portico podría ser una alternativa válida para tratar a los pacientes con estenosis aórtica grave y anillo aórtico pequeño.
FINANCIACIÓNM. Del Trigo y O. Abdul-Jawad Altisent han contado con el apoyo de una subvención de investigación de la Fundación Alfonso Martín Escudero (España).
CONFLICTO DE INTERESESJ. Rodés-Cabau ha recibido subvenciones de investigación de Edwards Lifesciences y St. Jude Medical. J. Webb ha recibido pagos por asesoría de Edwards Lifesciences y St. Jude Medical. P. Pibarot ha recibido subvenciones de investigación de Edwards Lifesciences.