Analizar los resultados económicos y en salud de un programa dirigido a reducir las hemorragias mediante la optimización del uso de fármacos antitrombóticos en pacientes con síndrome coronario agudo.
MétodosEstudio analítico, observacional, de cohortes, retrospectivo con evaluación preintervención (PRE) y posintervención (POST). En la primera cohorte se analizaron las situaciones corregibles relacionadas con un aumento de hemorragias (PRE). Posteriormente, se implantó un paquete de intervenciones y, en tercer lugar, se analizó el impacto del paquete en la reducción de hemorragias en una segunda cohorte (POST). La eficiencia se analizó considerando los ahorros derivados de la prevención de hemorragias y los costes de la implantación de las intervenciones. El análisis de los resultados en salud se calculó por el porcentaje de hemorragias intrahospitalarias y la tasa de reingresos a los 30 días.
ResultadosSe incluyó a 677 pacientes (377 en PRE y 300 en POST). La intervención se asoció a una reducción en la probabilidad de desarrollar hemorragias de un 29,2% (31,6% en POST frente a 22,3% en PRE; OR = 0,62; IC95%, 0,44-0,88). La tasa de reingresos se redujo del 7,7% en PRE al 5% en POST (p = 0,20). El coste anual evitado se estimó en 95.113,6 euros, mientras que respecto al retorno de la inversión se calculó que, por cada euro invertido, se obtuvieron 10,1 euros de ahorro en el primer año y 36,3 euros en los siguientes.
ConclusionesUn programa multidisciplinario para reducir el riesgo de hemorragias en pacientes con síndrome coronario agudo es eficaz y económicamente atractivo.
Palabras clave
La hemorragia es una complicación frecuente observada en el tratamiento del síndrome coronario agudo (SCA) que puede tener una influencia decisiva en el pronóstico. Las hemorragias mayores se asocian a un aumento de 3 veces más del riesgo de accidente cerebrovascular, 4 veces más del riesgo de muerte y 5 veces más del riesgo de infarto de miocardio recurrente a los 30 días1–3. Sin embargo, las hemorragias no solo se relacionan con el pronóstico, sino que también suponen un aumento del gasto sanitario.
En este sentido, en los Estados Unidos de América se calculó que la aparición de hemorragias que requirieron transfusiones en pacientes con SCA aumentaban en 12.000 dólares el coste de cada episodio y, las hemorragias menores asociadas a una intervención coronaria percutánea, entre 1.327 y 7.238 dólares4. Asimismo, en un estudio publicado en España se calculó un coste medio de un episodio de hemorragia tras un SCA de aproximadamente 8.000 euros. Dicho coste oscilaba entre 1.400 euros (para una hemorragia letal) y 9.300 euros (para una hemorragia relacionada con una reducción de la hemoglobina > 3g/dl)5.
Las causas que contribuyen al aumento del coste son, entre otras, la prolongación de la estancia hospitalaria, la realización de pruebas adicionales y el ingreso en unidades de cuidados intensivos5,6.
En la prevención de las hemorragias contribuyen múltiples factores, pero un elemento clave es el uso adecuado de la terapia antitrombótica. Para ello, cabe considerar algunos aspectos como la individualización del tratamiento según las características del paciente y el empleo de fármacos con un perfil de seguridad más favorable7.
El objetivo del estudio es analizar los resultados económicos y en salud de un programa dirigido a la reducción de hemorragias mediante la optimización del empleo de fármacos antitrombóticos en pacientes con SCA.
MÉTODOSLos métodos de la intervención ya han sido publicados previamente8. Se trata de un estudio analítico, observacional, de cohortes, retrospectivo con evaluación preintervención (PRE) y posintervención (POST). Se incluyeron todos los pacientes adultos diagnosticados de SCA, ingresados en el servicio de cardiología de un hospital terciario de 1.400 camas y tratados con algún fármaco antitrombótico. Si un mismo paciente reingresaba durante la misma fase del estudio, no se incluyó de nuevo. Los fármacos considerados fueron: ácido acetilsalicílico, ticlopidina, clopidogrel, prasugrel, abciximab, tirofibán, eptifibatida, heparina no fraccionada, enoxaparina, bivalirudina, fondaparinux y tenecteplasa. El listado de los pacientes lo proporcionó el archivo del hospital. Se excluyó a los pacientes sometidos a cirugía de bypass y a aquellos en los que no estuviera disponible alguna de las fuentes de información.
Con el fin de evaluar el impacto de las medidas propuestas, se compararon 2 grupos de pacientes: los pertenecientes a la fase PRE (de enero a julio de 2010) y los de la fase POST (de septiembre de 2011 a febrero de 2012). En la fase PRE se realizó un análisis retrospectivo para evaluar la prevalencia de hemorragias intrahospitalarias e identificar los factores que pudieran haber contribuido a su aparición y que fuesen corregibles. Para el estudio de cada paciente se consultó la historia clínica, los datos analíticos (Modulab) y la relación de los fármacos prescritos en el programa de prescripción informatizada (Prescriplant). Dos farmacéuticas se encargaron de revisar dichos documentos y de registrar los datos en una base de datos Access. Posteriormente se analizaron los datos, y los resultados obtenidos se presentaron y se discutieron con el jefe de la unidad coronaria del hospital.
La segunda fase consistió en desarrollar acciones específicas dirigidas a reducir las hemorragias mediante la optimización de la terapia antitrombótica sobre la base de los resultados obtenidos en PRE. Para ello, cardiólogos, personal de enfermería y farmacéuticos diseñaron un paquete de intervenciones consistentes en 3 acciones específicas: a) reducir la incidencia de sobredosificación de fármacos antitrombóticos; b) aumentar el empleo de fármacos con un perfil de seguridad más favorable en cuanto al desarrollo de hemorragias (fondaparinux y bivalirudina), y c) reducir el porcentaje de combinaciones de antitrombóticos de mayor riesgo hemorrágico.
Estas intervenciones se describen con más detalle en el apartado de resultados. Todas las medidas de intervención propuestas se comunicaron al resto de profesionales en sesiones clínicas y pases de visita. Además, esta información quedó reflejada en el protocolo de tratamiento de la institución9.
Por último, en la fase POST se volvió a evaluar la prevalencia de hemorragias intrahospitalarias en una segunda cohorte de pacientes siguiendo la misma metodología utilizada en la fase PRE.
Cálculo del tamaño muestralTeniendo en cuenta que la tasa de hemorragia bruta encontrada en un estudio realizado en pacientes con SCA y en condiciones de práctica clínica habitual fue del 30%10, se calculó que era necesario incluir alrededor de 300 pacientes en cada grupo para que una disminución de esta tasa, en al menos un 30%, proporcionase un valor α = 5% y una potencia (1-β) = 80%.
Se fijó el valor del 30% teniendo en cuenta:
- •
La disminución de la hemorragia obtenida con fondaparinux y bivalirudina en los ensayos clínicos11,12.
- •
La extrapolación de dichos resultados a la práctica asistencial habitual.
- •
El empleo de otras medidas de intervención.
El análisis estadístico se realizó con el programa SPSS (versión 18) para Windows (SPSS, Chicago, Estados Unidos) y el programa EPIDAT V 3.1. Se consideró significación estadística un valor p < 0,05. Las variables cualitativas se expresaron con la distribución de frecuencias, mientras que las variables continuas se expresaron como media ± desviación estándar. Las variables numéricas con distribución no normal se presentaron como mediana [intervalo intercuartílico]. El análisis de normalidad se estudió con la prueba de Kolmogorov-Smirnov.
Para la búsqueda de diferencias entre ambos grupos se utilizó la prueba de la t de Student para variables normales. Se realizó la prueba de Levene para la igualdad de varianzas con el fin de ver la similitud entre varianzas. Para comparar las variables con distribución no normal se utilizó la prueba no paramétrica de la U de Mann-Whitney. Para estudiar la asociación entre variables categóricas se utilizó la prueba χ2 de Pearson o prueba exacta de Fisher y para las variables cualitativas con categorías con tendencia lineal se utilizó la prueba de asociación lineal. Para valorar el efecto de la intervención —la reducción de hemorragias— se utilizó la reducción del riesgo relativo, el riesgo relativo, la odds ratio (OR), el número necesario de pacientes que hay que tratar y los intervalos de confianza del 95% (IC95%).
Asimismo, se procedió a realizar un análisis multivariable mediante regresión logística para estudiar el impacto de la intervención controlando los posibles factores de confusión: edad > 75 años, sexo femenino, peso corporal < 60kg, diabetes mellitus, anemia crónica, insuficiencia renal crónica, antecedentes de hemorragia, intervención coronaria percutánea y vía de acceso al cateterismo2,13. De este modo, se obtuvo la OR ajustada. Para valorar la bondad de ajuste y su calibración se utilizó la prueba de Hosmer-Lemeshow y para el estudio de la discriminación, el área bajo la curva ROC (Receiver Operating Characteristic).
Análisis de la rentabilidadPara el cálculo de la rentabilidad del programa se estimaron los ahorros y los gastos derivados del programa.
Ahorros- •
Prevención de hemorragias: se utilizaron los datos del artículo español mencionado en el apartado introducción que incluye una población y un entorno similar al nuestro5. En dicho estudio se calculó el coste medio de un episodio de hemorragia en España: aproximadamente 1.400 euros para una hemorragia letal y 9.300 euros para una reducción de hemoglobina > 3g/dl. Con esta información, se contabilizaron las hemorragias que cumplían alguna de las 2 definiciones y se multiplicaron por el coste estimado para, así, calcular la diferencia de coste entre una cohorte y otra.
- •
Coste evitado de la no utilización de enoxaparina en los pacientes en los que se prescribió fondaparinux.
Adquisición de una balanza (Hill-Rom) acoplada a una grúa LIKO (modelo VIKING) para la medida del peso en los pacientes encamados y la introducción de fondaparinux y bivalirudina en la guía farmacoterapéutica.
Análisis de los resultados en saludPara el análisis de los resultados en salud se calculó la diferencia de hemorragias y de la tasa de reingresos a los 30 días entre ambas cohortes. Se consideró hemorragia cualquier episodio hemorrágico que cumpliese alguno de los criterios de la clasificación BARC (Bleeding Academic Research Consortium)14. El servicio de gestión del hospital proporcionó los reingresos. Se calcularon según la fecha de alta del episodio y no se contabilizaron los ingresos programados.
El estudio contó con la autorización del comité ético de investigación clínica. Al tratarse de un estudio de mejora asistencial, basado en evidencias científicas y organizativas, el hospital no consideró necesario obtener el consentimiento informado de los pacientes.
RESULTADOSEn el estudio se incluyó a 692 pacientes: 382 en PRE y 310 en POST. En total, 15 pacientes tuvieron que ser excluidos por no estar disponible la historia clínica en papel. Por tanto, el tamaño final de la muestra fue de 377 pacientes en fase PRE y 300 en POST.
Fase preintervenciónEn la fase PRE la mayoría de los pacientes eran varones (70,6%) y la media de edad fue de 67 años. El factor de riesgo de hemorragia más frecuente fue la realización de una intervención coronaria percutánea (79,3%), seguido de la elección de la vía femoral (51,2%) (tabla 1). Los factores de hemorragia corregibles identificados fueron:
- •
Presencia de sobredosificaciones con fármacos antitrombóticos: en la fase PRE, el porcentaje de pacientes sobredosificados con al menos un fármaco fue del 17,8% (tabla 2). Por este motivo, se revisó el protocolo institucional para definir (de manera detallada) la pauta habitual de los fármacos antitrombóticos sobre la base de las principales guías de práctica clínica y de las fichas técnicas15,16. Además, se detectó que el cálculo de las dosis de fármacos antitrombóticos (cuya dosificación depende del peso corporal) se realizaba con frecuencia mediante la estimación visual aproximada del peso. Sin embargo, se ha demostrado que este método es impreciso17 y por este motivo se aconsejó que, a falta de un método apropiado para la determinación del peso corporal, se preguntase directamente al paciente o a sus familiares. Además, para facilitar la medida de este parámetro, se adquirió una grúa acoplada a una balanza. Un 67,4% de los pacientes tenía un peso conocido en la fase PRE.
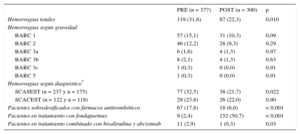
Tabla 2.Hemorragias totales y efectividad de las intervenciones en ambas cohortes de pacientes
PRE (n = 377) POST (n = 300) p Hemorragias totales 119 (31,6) 67 (22,3) 0,010 Hemorragias según gravedad BARC 1 57 (15,1) 31 (10,3) 0,09 BARC 2 46 (12,2) 28 (9,3) 0,29 BARC 3a 6 (1,6) 4 (1,3) 0,97 BARC 3b 8 (2,1) 4 (1,3) 0,63 BARC 3c 1 (0,3) 0 (0,0) 0,91 BARC 5 1 (0,3) 0 (0,0) 0,91 Hemorragias según diagnóstico* SCASEST (n = 237 y n = 175) 77 (32,5) 38 (21,7) 0,022 SCACEST (n = 122 y n = 118) 29 (23,8) 26 (22,0) 0,90 Pacientes sobredosificados con fármacos antitrombóticos 67 (17,8) 18 (6,0) < 0,001 Pacientes en tratamiento con fondaparinux 9 (2,4) 152 (50,7) < 0,001 Pacientes en tratamiento combinado con bivalirudina y abciximab 11 (2,9) 1 (0,3) 0,03 BARC: Bleeding Academic Research Consortium; POST: posintervención; PRE: preintervención; SCACEST: síndrome coronario agudo con elevación del ST; SCASEST: síndrome coronario agudo sin elevación del ST.
Los datos expresan n (%).
- •
Empleo de fármacos con un perfil de seguridad más desfavorable en cuanto a la aparición de hemorragias y existencia de una alternativa de menor riesgo de hemorragia.
- –
Enoxaparina en pacientes con SCA sin elevación del segmento ST y alto riesgo de hemorragia según la escala CRUSADE. En la fase PRE, un 97,6% de los pacientes recibió tratamiento con enoxaparina. Sin embargo, el uso de fondaparinux en este subgrupo de pacientes ha demostrado tener un menor riesgo de hemorragias11. Solo un 2,4% de los pacientes se trató con fondaparinux en fase PRE.
- –
Heparina no fraccionada en combinación con abciximab. La alternativa de esta combinación (la bivalirudina) ha mostrado una disminución del riesgo de hemorragias sin disminuir la eficacia12. Un 17,0% de los pacientes recibió tratamiento con heparina no fraccionada y abciximab, y un 8,7% con bivalirudina en fase PRE.
- •
Empleo de combinaciones de antitrombóticos de mayor riesgo hemorrágico, como la combinación de abciximab y bivalirudina. En la fase PRE, 11 pacientes recibieron tratamiento con dicha combinación. Sin embargo, las guías de práctica clínica recomiendan su uso restringido y provisional debido a que el uso sistemático de bivalirudina más un inhibidor de la glucoproteína IIb/IIIa demostró un mayor riesgo de hemorragias, pero no una mayor eficacia en comparación con la bivalirudina en monoterapia12.
- –
Características basales de los pacientes y factores de riesgo de hemorragia en ambas cohortes de pacientes
| PRE (n = 377) | POST (n = 300) | p | |
|---|---|---|---|
| Edad (años) | 67,2 ± 13,8 | 67,6 ± 13,4 | 0,67 |
| Sexo | 0,79 | ||
| Varón | 266 (70,6) | 208 (69,3) | |
| Mujer | 111 (29,4) | 92 (30,7) | |
| Peso corporal (kg) | 75,4 ± 13,7 | 77,2 ± 15,0 | 0,15 |
| SCACEST | 122 (32,4) | 118 (39,3) | 0,07 |
| Hipertensión | 240 (63,7) | 208 (69,3) | 0,14 |
| Hipercolesterolemia | 212 (56,2) | 186 (62,0) | 0,15 |
| Diabetes mellitus | 110 (29,2) | 80 (26,7) | 0,53 |
| Fumador | 0,24 | ||
| No | 141 (37,4) | 129 (43,0) | |
| Exfumador | 105 (27,8) | 77 (25,7) | |
| Sí | 125 (33,2) | 92 (30,7) | |
| Desconocido | 6 (1,6) | 2 (0,7) | |
| Insuficiencia renal crónica | 33 (8,8) | 35 (11,7) | 0,26 |
| Antecedentes de hemorragia | 20 (5,3) | 9 (3,0) | 0,20 |
| Anemia crónica | 19 (5,0) | 12 (4,0) | 0,65 |
| Intervención coronaria percutánea | 299 (79,3) | 240 (80,0) | 0,90 |
| Vía femoral | 193 (51,2) | 131 (43,7) | 0,25 |
| Lugar de ingreso | < 0,001 | ||
| Unidad coronaria | 294 (78,0) | 189 (63,0) | |
| Unidad no intensiva de cardiología | 75 (19,9) | 111 (37,0) | |
| Otro | 8 (2,1) | 0 (0,0) |
| Tratamiento farmacológico prescrito desde el inicio del episodio isquémico | |||
|---|---|---|---|
| Antiagregantes plaquetarios | 377 (100) | 300 (100) | — |
| Ácido acetilsalicílico | 364 (96,6) | 294 (98,0) | 0,37 |
| Ticlopidina | 1 (0,3) | 0 (0,0) | 0,91 |
| Clopidogrel | 358 (95,0) | 297 (99,0) | 0,006 |
| Prasugrel | 0 (0,0) | 10 (3,3) | 0,001 |
| Inhibidores de la GPIIb/IIIa | |||
| Abciximab | 86 (22,8) | 73 (24,3) | 0,71 |
| Tirofibán | 12 (3,2) | 2 (0,7) | 0,04 |
| Eptifibatida | 1 (0,3) | 1 (0,3) | 0,58 |
| Anticoagulantes | 345 (91,5) | 286 (95,3) | 0,07 |
| Heparina no fraccionada | 264 (70,0) | 235 (78,3) | 0,019 |
| Enoxaparina | 231 (61,3) | 130 (43,3) | < 0,001 |
| Fondaparinux | 6 (1,6) | 85 (28,3) | < 0,001 |
| Bivalirudina | 33 (8,8) | 10 (3,3) | 0,007 |
| Fibrinolíticos: tenecteplasa* | 35 (28,2) | 22 (18,5) | 0,10 |
GPIIb/IIIa: glucoproteína IIb/IIIa; POST: posintervención; PRE: preintervención; SCACEST: síndrome coronario agudo con elevación del ST.
Los datos expresan n (%) o media ± desviación estándar.
Las características basales de los pacientes en fase POST fueron similares a las de la fase PRE, así como la presencia de factores de riesgo de hemorragia (tabla 1). En cuanto al grado de aceptación de las medidas de intervención propuestas, se comprobó que:
- •
El porcentaje de pacientes sobredosificados se redujo en un 66,3% en fase POST (17,8 frente a 6,0%; p < 0,001). El porcentaje de pacientes con peso conocido aumentó de un 67,4 a un 88,7% (p < 0,001) (tabla 2).
- •
En lo que se refiere al empleo de fármacos con un perfil de seguridad más favorable:
- –
El porcentaje de pacientes tratados con fondaparinux aumentó en la fase POST (2,4 frente a 50,7%; p < 0,001), mientras que el uso de enoxaparina disminuyó (97,6 frente a 49,3%; p < 0,001) (tabla 2).
- –
Solo un 3,3% de los pacientes recibieron tratamiento con bivalirudina (p = 0,007), mientras que el empleo en fase POST de la combinación de heparina no fraccionada y abciximab fue del 21,3% (p = 0,019).
- •
En relación con el empleo de combinaciones de fármacos de mayor riesgo hemorrágico, solo 1 paciente en fase POST (0,3%) se trató con la combinación de abciximab más bivalirudina (p = 0,03) (tabla 2).
El porcentaje global de hemorragias intrahospitalarias en fase POST se redujo en un 29,2% (31,6 en PRE frente a 22,3% en POST; OR = 0,62; IC95%, 0,44-0,88) (tabla 2). La OR ajustada fue de 0,58 (IC95%, 0,40-0,85). El resultado de la prueba de Hosmer-Lemeshow no fue estadísticamente significativo (p = 0,36) y el área bajo la curva fue de 0,66.
En cuanto al número necesario de pacientes que hay que tratar, en 11 pacientes fue necesario implantar las medidas de intervención para evitar un episodio hemorrágico (IC95%, 7-39). La tasa de reingresos fue del 7,7% en fase PRE y del 5% en POST (p = 0,20) (14 reingresos en PRE y 8 reingresos en POST fueron por causas cardiovasculares).
Análisis de la rentabilidadAhorros- •
Prevención de hemorragias. En la fase PRE (de enero a julio de 2011) se produjo 1 hemorragia mortal (1.400 euros) y 15 hemorragias asociadas con una reducción de hemoglobina > 3g/dl (15 × 9.300 euros = 139.500 euros). Coste total/mes: 20.128,57 euros. En la fase POST (de septiembre de 2011 a febrero de 2012) no se produjo ninguna hemorragia letal, pero sí ocurrieron 8 hemorragias asociadas con una reducción de hemoglobina > 3g/dl (8 × 9.300 euros = 74.400 euros). Coste total/mes: 12.400 euros.
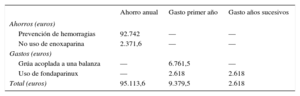
Por tanto, la diferencia de coste entre un periodo y otro fue de 92.742 euros anuales (tabla 3). Coincidió que todas las hemorragias BARC 3 se contabilizaron como hemorragias asociadas con una reducción de hemoglobina > 3g/dl.
Tabla 3.Análisis de la eficiencia del programa
Ahorro anual Gasto primer año Gasto años sucesivos Ahorros (euros) Prevención de hemorragias 92.742 — — No uso de enoxaparina 2.371,6 — — Gastos (euros) Grúa acoplada a una balanza — 6.761,5 — Uso de fondaparinux — 2.618 2.618 Total (euros) 95.113,6 9.379,5 2.618 - •
Coste evitado por la no utilización de enoxaparina. El uso de fondaparinux supuso una menor utilización de enoxaparina. Si se toma como referencia el coste de la enoxaparina de 60mg (coste unitario en precio de venta del laboratorio + IVA: 4,9 euros), y debido a que el peso medio de los pacientes de la fase POST en tratamiento con fondaparinux fue de 73,7kg, se evitaron 242 dosis de enoxaparina y se ahorraron, por tanto, 2.371,6 euros/anuales (tabla 3). Este dato se calculó teniendo en cuenta que alrededor de la mitad de los pacientes eran mayores de 75 años (0,75mg/kg/dosis) y que 6 pacientes tenían un filtrado glomerular < 30ml/min (1mg/kg/día).
Las inversiones económicas que tuvieron que realizarse consistieron en la compra de una grúa (precio total con IVA = 6.761,5 euros) y en la inclusión del fondaparinux en la guía farmacoterapéutica del hospital (coste unitario en precio de venta del laboratorio + IVA: 8,5 euros). En la fase POST se utilizaron 154 dosis de fondaparinux, lo que supuso un coste de 2.618 euros/anuales (tabla 3).
El coste de bivalirudina no se tuvo en cuenta porque su prescripción no aumentó en fase POST, sino que descendió.
Por tanto, el coste anual evitado se estimó en 95.113,6 euros. Si se calcula el retorno anual de la inversión, por cada euro invertido en el programa de intervención se obtienen 10,1 euros de ahorro en el primer año y 36,3 euros en los siguientes (tabla 3).
DISCUSIÓNEl programa multidisciplinar dirigido a la optimización del tratamiento antitrombótico ha demostrado reducir las hemorragias y ser coste-efectivo.
Las intervenciones fueron eficaces en cuanto a la reducción de las sobredosificaciones con fármacos antitrombóticos en la incorporación del uso de fondaparinux al arsenal terapéutico del SCA sin elevación del segmento ST y en la limitación del uso de bivalirudina junto con abciximab. Todos estos factores están asociados a un menor riesgo de hemorragias y, tras su implantación, se redujo significativamente la incidencia de hemorragias; así como la tasa de reingresos de manera numérica.
La única intervención que no consiguió implantarse fue la inclusión de la bivalirudina como alternativa a la combinación de heparina no fraccionada y abciximab, debido, posiblemente, al elevado coste del fármaco y a la falta de confianza que tenían los clínicos en ese momento acerca de los beneficios del fármaco; como consecuencia, tal vez, de las limitaciones encontradas en el ensayo ACUITY (Acute Catheterization and Urgent Intervention Triage strategY) en los SCA sin elevación del segmento ST18.
En cuanto al porcentaje de hemorragias, el riesgo de hemorragias encontrado en el presente estudio podría parecer elevado (31,8%). Sin embargo, la mayoría de estudios que evalúan las hemorragias en pacientes con SCA son ensayos clínicos, los cuales, por lo general, tienden a subestimar la gravedad real del problema. Desde la publicación en 2011 de la clasificación de hemorragias BARC, cada vez son más los trabajos que utilizan esta metodología para definir las hemorragias. En este sentido, en un estudio publicado en 2013 realizado en condiciones de práctica clínica, el porcentaje global de hemorragias fue similar al de nuestro estudio (30 frente a 31,8%). Sin embargo, hay que destacar que, en este caso, los autores no solo evaluaron las hemorragias intrahospitalarias, sino también las hemorragias a los 6 meses10. En estudios observacionales más recientes, como el de Alexopoulos et al.19, se obtuvo un porcentaje total de hemorragias aún mayor (alrededor del 49%) posiblemente debido a la inclusión de pacientes únicamente sometidos a una intervención coronaria percutánea y tratados también con prasugrel y ticagrelor.
En cuanto a la reducción de hemorragias según el tipo de SCA, la disminución fue mayor en el caso de SCA sin elevación del segmento ST. Podría haber 2 explicaciones: a) el uso de fondaparinux en los pacientes con SCA sin elevación del segmento ST en fase POST, y b) el mayor empleo de combinaciones de antitrombóticos en los pacientes con SCA con elevación del segmento ST, independientemente del periodo de estudio (alrededor de un 30% recibió tratamiento con 5 o más fármacos frente al 15% de los diagnosticados de SCA sin elevación del segmento ST).
En nuestra opinión, por su sencilla puesta en práctica y por no ir asociadas a una elevada inversión económica, las medidas propuestas son accesibles a la mayoría de servicios:
- •
El replanteamiento de los protocolos no ha supuesto una inversión económica directa.
- •
La introducción de fondaparinux para el tratamiento de pacientes de alto riesgo de hemorragia no ha implicado un mayor gasto.
- •
En la mayoría de unidades de hospitalización hay balanzas disponibles para la medida del peso corporal. Sin embargo, lo que suele faltar son directrices educativas enfocadas a concienciar al personal sobre la importancia de no estimar el peso corporal de una manera visual.
La originalidad mayor de este trabajo se basa en el hecho de haber replanteado el tratamiento habitual de los fármacos antitrombóticos desde los aspectos más básicos. Es decir, evaluar el protocolo de tratamiento punto por punto con el objetivo de detectar prácticas asistenciales muy integradas en la rutina de trabajo, pero que podrían suponer un aumento del riesgo hemorrágico de una manera silente.
A pesar de la existencia de numerosos estudios que señalan la importancia de la estratificación del riesgo hemorrágico, a la hora de decidir el tratamiento terapéutico de los pacientes con SCA20,21 no hemos encontrado experiencias que demuestren el impacto de un paquete de medidas para la reducción de hemorragias en pacientes con SCA. El concepto de paquete de medidas o care bundle consiste en aplicar un grupo de medidas (usualmente entre 3 y 5) basadas en la evidencia que, si se realizan conjuntamente, producen un resultado sinérgico. Un ejemplo de ello es la conocida Surviving sepsis campaign, con el objetivo de reducir la mortalidad en los pacientes con sepsis22.
LimitacionesLas limitaciones de los estudios retrospectivos son las específicas de este tipo de diseño. La causa más importante del sesgo es la dificultad a la hora de validar la información extraída de las historias clínicas. Sin embargo, la fiabilidad del estudio aumenta cuando se comparan 2 grupos de pacientes; ya que la magnitud del sesgo es similar en ambos. Otro aspecto relacionado con las limitaciones de los estudios retrospectivos ha sido la imposibilidad de registrar el riesgo isquémico y hemorrágico a posteriori lo que, sin duda, hubiera sido una información muy útil23. Debe aclararse, sin embargo, que la evaluación de las puntuaciones GRACE y CRUSADE está considerada en los Protocolos del Servicio de Cardiología para la indicación del tratamiento antiagregante en pacientes con SCA9. En segundo lugar, el cálculo del ahorro se estimó mediante una extrapolación parcial de los datos publicados por Soldevila et al.5 y no mediante el empleo de datos propios de nuestro hospital. La evaluación se realizó de esta manera porque la finalidad del trabajo fue obtener una rentabilidad aproximada y no una evaluación farmacoeconómica exhaustiva. Además, consideramos apropiado emplear los datos del mencionado trabajo al haber sido realizado en unas condiciones semejantes (estrategias de reperfusión utilizadas, tratamiento antitrombótico empleado, estudio nacional). En tercer lugar, el empleo actual mucho más frecuente de prasugrel y ticagrelor tal vez podría suponer que la tasa de hemorragias fuera superior a la registrada en el estudio. Incluso si se produjera esta eventualidad, la eficacia de la intervención en la reducción de hemorragias no tendría por qué disminuir. Por último, en cuanto a los eventos poco prevalentes, como los reingresos, fue difícil poder demostrar una diferencia estadística; ya que hubiera sido necesario un tamaño muestral muy elevado en cada grupo.
CONCLUSIONESEl presente programa multidisciplinar dirigido a la reducción de hemorragias en pacientes con SCA es eficaz y económicamente atractivo.
FINANCIACIÓNCNIC está financiado por el ministerio de Economía y Competitividad (MINECO) y la Fundación ProCNIC y es un Centro de Excelencia Severo Ochoa (MINECO SEV-2015-0505).
CONFLICTO DE INTERESESH. Bueno recibe financiación del Instituto de Salud Carlos III (PIE16/00021) y de Astra-Zeneca, BMS, Janssen y Novartis por proyectos de investigación y ha recibido pagos por asesoría, conferencias o ayudas a asistencia a congresos de Abbott, Astra-Zeneca, Bayer, BMS-Pfizer, Ferrer, MEDSCAPE-the heart.og, Novartis y Servier.
- –
La hemorragia es una complicación frecuente en los pacientes con SCA.
- –
Las hemorragias no solo se relacionan con el pronóstico, sino que también suponen un aumento del gasto sanitario.
- –
El uso adecuado del tratamiento antitrombótico es un elemento clave para su prevención.
- –
Aún existe margen para mejorar el uso de los antitrombóticos en pacientes con SCA.
- –
La optimización del tratamiento de los SCA a través de una intervención multidisciplinaria de mejora ha supuesto una reducción significativa de la tasa de hemorragias y, de manera numérica, la de los reingresos a los 30 días.
- –
El coste evitado estimado para esta intervención de mejora no resulta despreciable.
- –
Las medidas propuestas por esta intervención son accesibles a la mayoría de servicios por su sencilla puesta en práctica y por no ir asociadas a una elevada inversión económica.
Este proyecto ha sido posible gracias a la subvención concedida por el Ministerio de Sanidad, Política Social e Igualdad (Orden SAS/2377/2010) y ha supuesto un esfuerzo colaborativo para la unidad coronaria, el laboratorio de hemodinámica, el servicio de farmacia, el servicio de archivo y Alfonso Cuadrado.