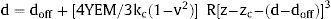Se ha estudiado la localización anatómica, las propiedades biomecánicas y el fenotipo molecular del colágeno miocárdico tisular en 40 pacientes con estenosis aórtica grave, fracción de eyección conservada y síntomas de insuficiencia cardiaca.
MétodosSe obtuvieron 2 biopsias transmurales de la pared libre del ventrículo izquierdo. La fracción del volumen de colágeno (FVC) se cuantificó mediante rojo picrosirio y la rigidez, mediante el módulo elástico de Young (YEM) evaluado con microscopia de fuerza atómica en regiones misiales y no misiales. Las FVC de tipos I y III se cuantificaron mediante microscopia confocal en áreas con determinación del YEM.
ResultadosComparados con sujetos de control, la FVC misial y no misial y el cociente FVC no misial:misial (p < 0,05) estaban incrementados en los pacientes. El cociente entre la velocidad pico de la onda E mitral y la velocidad E del anillo lateral mitral de los pacientes se correlacionaba con la FVC no misial (r = 0,330; p = 0,046) y con el cociente FVC no misial:misial (r = 0,419; p = 0,012). El cociente FVCI:FVCIII y el YEM aumentaban (p ≤ 0,001) en regiones no misiales respecto de las misiales, con correlación entre ellos (r = 0,895; p < 0,001).
ConclusionesEn la estenosis aórtica grave con fracción de eyección conservada y síntomas de insuficiencia cardiaca, la disfunción diastólica se asocia con un depósito no misial de colágeno aumentado, predominantemente de tipo I y con mayor rigidez. Las características del colágeno tisular pueden contribuir a la disfunción diastólica en estos pacientes.
Palabras clave
La estenosis de válvula aórtica (EA) es una enfermedad frecuente, en la que la falta de apertura completa de la válvula aórtica conlleva una carga de presión anormalmente alta en el ventrículo izquierdo (VI), lo cual conduce, a su vez, a hipertrofia miocardiocitaria y fibrosis del miocardio1. Se ha descrito que la fibrosis miocárdica se asocia a aumento de la rigidez del VI, aumento de la presión telediastólica del VI y deterioro del llenado diastólico (una disfunción diastólica)2–5. La fibrosis miocárdica progresiva, que contribuye al agravamiento de la disfunción diastólica, puede facilitar en última instancia la aparición de signos y síntomas de insuficiencia cardiaca (IC) en los pacientes con EA y fracción de eyección conservada (FEc)2,3,6.
En un estudio pionero, Villari et al.7 demostraron que un aumento de la cantidad de colágeno tisular en sí no modifica la función diastólica del VI de los pacientes con EA, lo que indica que las consecuencias de la fibrosis miocárdica en la función del VI no dependen simplemente de la cantidad de colágeno, sino también de su calidad. La hipótesis del presente trabajo era que, en los pacientes con EA grave, FEc y síntomas de IC, un depósito excesivo de colágeno en el miocardio, junto con las alteraciones de la localización anatómica, las propiedades biomécanicas y el fenotipo molecular de estos depósitos, pueden asociarse con disfunción diastólica. Para verificar esta hipótesis, se analizó la localización misial (asociada con grupos de miocardiocitos y rodeando e interconectando distintos miocardiocitos) o no misial (intersticial y perivascular intensa de los depósitos de colágeno), la rigidez del tejido descelularizado y la abundancia relativa de fibras de colágeno de tipos I y III en relación con la rigidez del miocardio de los pacientes con EA grave, FEc y síntomas de IC sometidos a reemplazo quirúrgico de válvula aórtica. Se analizó, además, la asociación de estas características con las presiones de llenado del VI.
MÉTODOSPoblación del estudioTodos los participantes dieron su consentimiento informado por escrito para participar en el estudio, y el protocolo del estudio fue aprobado por el comité de ética de investigación del centro. El estudio se atuvo a los principios de la Declaración de Helsinki.
Se incluyó a 40 pacientes con EA grave, en estadio D18, para los que se había programado reemplazo quirúrgico de la válvula aórtica. Todos los pacientes tenían un diagnóstico clínico previo de IC crónica basado en la presencia de como mínimo 1 criterio mayor de Framingham y 2 menores9. No se incluyó a los pacientes con angina o síncope pero sin signos de IC previa. Todos los pacientes habían tenido como mínimo 1 hospitalización previa por disnea de clase IV secundaria a IC. Todos los pacientes se encontraban en clases funcionales II-IV de la New York Heart Association y tenían una fracción de eyección del VI ≥ 55%. Se excluyó a los pacientes con una enfermedad coronaria significativa (estenosis ≥ 70% en alguna arteria coronaria epicárdica o ≥ 50% en el tronco coronario izquierdo), antecedentes de síndrome coronario agudo o de intervención de revascularización o enfermedad renal crónica en estadio 4-5. Se obtuvieron de cada paciente 2 biopsias transmurales de la pared libre del VI entre la arteria coronaria descendente izquierda y la circunfleja, mediante una aguja tru-cut durante la intervención de reemplazo de la válvula aórtica.
Se obtuvieron muestras cardiacas de 10 participantes emparejados por edad y sexo que habían fallecido por enfermedades no relacionadas con causas cardiovasculares, y se procesaron para el estudio histomorfológico, para utilizarlas como controles. Ninguno tenía antecedentes previos de enfermedad cardiovascular y la evaluación de los informes de autopsia determinó la ausencia de lesiones cardiacas macroscópicas y microscópicas.
Estudio ecocardiográficoMenos de 1 semana antes de la operación, 2 operadores experimentados llevaron a cabo estudios ecocardiográficos estándares de todos los pacientes con un ecógrafo digital iE33 (Philips). Se obtuvieron imágenes en la espiración, para tener en cuenta las ligeras variaciones del flujo sanguíneo durante la respiración. Las determinaciones se basaron en la media obtenida en 3 ciclos cardiacos (5 en caso de fibrilación auricular). No se observó valvulopatía mitral significativa ni insuficiencia aórtica en los pacientes. Treinta y cinco pacientes estaban en ritmo sinusal y 5, en fibrilación auricular. No se suspendió la medicación antes del estudio ecográfico. Las dimensiones del VI y la aurícula izquierda se midieron según las recomendaciones de la American Society of Echocardiography10. Se calculó la masa del VI con la fórmula de Devereux, y se indexó según el área de superficie corporal (índice de masa del VI). La hipertrofia ventricular izquierda se definió como un índice de masa del VI > 115 g/m2 en los varones y > 95 g/m2 en las mujeres10. Aplicando esta definición, todos los pacientes presentaban hipertrofia del VI. La fracción de eyección del VI se midió con el método de Simpson. La función diastólica se evaluó mediante el análisis de las velocidades máximas de flujo transmitral temprano (E) y tardío (A) en la diástole, el flujo venoso pulmonar, la velocidad de propagación del flujo mitral y los índices Doppler tisulares en la parte septal y lateral del anillo mitral. Se calculó el cociente E:e’, donde e’ es la velocidad diastólica inicial máxima del promedio de desplazamiento septal y lateral del anillo mitral. Se determinó la ausencia o presencia de presiones de llenado del VI elevadas según los valores del cociente E:e’ fueran ≤ 15 o > 15 respectivamente11. Se determinó en todos los pacientes los valores medio y máximo de gradiente de presión transvalvular, así como el área de la válvula aórtica.
Biopsia miocárdicaSe obtuvieron de cada paciente 2 biopsias transmurales de la pared libre del VI entre la arteria descendente izquierda y la circunfleja, mediante una aguja tru-cut durante la intervención de reemplazo de la válvula aórtica, antes de que se iniciara la circulación extracorpórea. Una de las muestras se fijó de inmediato en formaldehído al 4% y se incluyó en parafina. De los últimos 20 pacientes, se congeló otra muestra a una temperatura de corte óptima para las posteriores determinaciones mediante microscopia de fuerza atómica. No se produjeron complicaciones durante ni después de la biopsia.
Determinaciones bioquímicasSe determinó la fracción aminoterminal del propéptido natriurético cerebral en muestras de plasma mediante ELISA (Roche Diagnostics).
Estudio histomorfológicoSe determinó la fracción del volumen miocárdico ocupada por colágeno (FVC) con una morfometría cuantitativa realizada con un sistema de análisis automático de imágenes, en cortes teñidos con rojo picrosirio específico para el colágeno (rojo Sirius F3BA en ácido pícrico acuoso). Se excluyó del análisis el endocardio. Se definieron 2 localizaciones del depósito de colágeno: misial (bandas delgadas asociadas con grupos de células o perimisio y colágeno que rodean e interconectan células individuales o endomisio), y no misial (franjas grandes localizadas en los espacios intersticiales y perivasculares) (figura 1). Las determinaciones de la FVC de 2 pacientes se desecharon a causa de artefactos de imagen causados por una morfología anormal del tejido miocárdico procesado (grosor excesivo del endocardio y tejido subendocárdico anormalmente bajo) causantes de una tinción de rojo picrosirio aberrante (con porcentajes de FVC superiores al 50%). En los restantes 38 pacientes con determinaciones de la FVC válidas, se midieron la FVC total y no misial y se calculó la FVC misial restando la FVC no misial de la FVC total12. Se calculó el cociente FVC no misial:FVC misial de cada paciente.
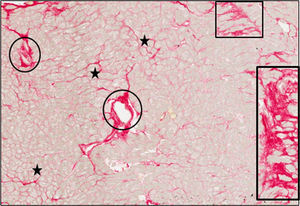
Tejido endomiocárdico procedente del paciente 1, que sufría EA grave con FEc y síntomas de IC. Los cortes se tiñeron con rojo picrosirio y las fibras de colágeno se identifican por el color rojo. Mientras que el colágeno misial se identifica como bandas delgadas alrededor de los miocardiocitos o grupos de miocardiocitos (estrellas), el colágeno no misial se identifica como franjas grandes de localización difusa en todo el intersticio (rectángulos) y alrededor de los vasos intramiocárdicos (óvalos). Aumentos, × 40. EA: estenosis de la válvula aórtica; FEc: fracción de eyección conservada; IC: insuficiencia cardiaca. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
El análisis biomecánico se realizó en muestras miocárdicas de 20 pacientes de las mismas regiones misiales y no misiales utilizadas para la determinación de la FVC. Estos 20 pacientes corresponden a los últimos incorporados al estudio, una vez ampliamente comprobado el método de microscopia de fuerza atómica. Los cortes (de 14 μm) se aplicaron a cubreobjetos con carga positiva y se sometieron a un proceso de descelularización durante 10 min en dodecilsulfato de sodio al 1%, y se lavaron con solución salina tamponada con fosfato de Dulbecco. Esta incubación basta para descelularizar por completo los cortes de miocardio. Todas las determinaciones micromecánicas se realizaron con un microscopio de fuerza atómica NanoWizard III Atomic Force Microscopy (JPK; Berlín, Alemania) acoplado a un microscopio óptico invertido Zeiss Axio Observer (Zeiss; Oberkochen, Alemania). Las mediciones se realizaron con soportes volados sin punta, con una constante de elasticidad nominal (k) de 0,03 N/m (MLCT, Bruker; Mannheim, Alemania) y acoplado a microesferas de polistireno de 10 μm de diámetro. La constante de elasticidad real se calibró mediante calibrado térmico. A partir de la aproximación entre la punta y la muestra, se obtuvo una curva de fuerza frente a indentación que se ajustó luego al modelo de Hertz para puntas esféricas para un indentación de 500 nm13. Se realizaron 200 curvas de fuerza-penetración por muestra de paciente. Se obtuvo el módulo elástico de Young (YEM) efectivo, la deflexión del punto de contacto (doff) y la altura del punto de contacto (zc) a partir de la siguiente ecuación:
donde d es la deflexión del soporte volado, z es la altura del soporte, ν es el cociente de Poisson (0,5), kc es la constante de elasticidad del soporte volado y R, el radio de la punta (5 μm).En cada uno de estos pacientes, se calculó la media de YEM de las 2 regiones no misiales evaluadas y se determinó el cociente YEM no misial:YEM misial.
Estudio inmunohistoquímicoLa fracción de volumen del miocardio ocupada por las fibras de colágeno tipos I (FVCI) y III (FVCIII) se determinó mediante inmunofluorescencia y microscopia confocal en muestras de tejido obtenidas de 5 pacientes, específicamente en las 2 regiones misiales y 1 región no misial en las que se había determinado anteriormente el YEM. Se seleccionó a estos 5 pacientes de manera consecutiva, y se excluyeron solo los casos cuyas muestras de tejido parecían inapropiadas en la evaluación macroscópica.
Los cortes se tiñeron con anticuerpos monoclonales anticolágeno tipo I y tipo III (Abcam) (figura 2) y se cuantificó la fluorescencia. Se calculó el cociente FVCI:FVCIII con objeto de valorar los cambios relativos entre los 2 tipos de fibras de colágeno.
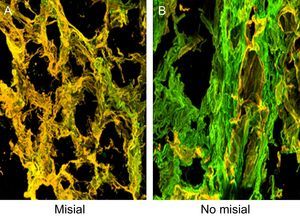
Tejido endomiocárdico procedente del paciente 1, que sufría EA grave con FEc y síntomas de IC. Los cortes se tiñeron con anticuerpos monoclonales específicos dirigidos contra los colágenos de tipo I y III, y las fibras se identificaron en la microscopia confocal en verde y amarillo respectivamente. A: la región misial de la red de colágeno. B: la región no misial de la red de colágeno. Aumentos, × 60. EA: estenosis de la válvula aórtica; FEc: fracción de eyección conservada; IC: insuficiencia cardiaca.
Los valores se expresan en forma de media ± desviación estándar, mediana [intervalo intercuartílico] o número de participantes (%). Se evaluó la distribución normal de todas las variables continuas mediante la prueba de Shapiro-Wilk. Las diferencias entre los grupos se evaluaron con la prueba de la t de Student para datos no emparejados. Las variables con distribución no paramétrica se examinaron tras una transformación logarítmica. Para los datos con distribución no normal, se utilizó una prueba no paramétrica (prueba de la U de Mann-Whitney). Las correlaciones se estimaron con el coeficiente de correlación de Pearson y análisis de regresión univariable. Los cocientes de FVC no misial:misial y de YEM no misial:misial se multiplicaron para obtener una variable compuesta que reflejara tanto las propiedades anatómicas como las biomecánicas de la matriz de colágeno en las regiones no misiales respecto a las regiones misiales. La influencia de los factores de confusión en las correlaciones de interés, teniendo en cuenta las que se asociaban con el cociente E:e’ en el análisis de regresión univariable (presión arterial sistólica, glucosa en ayunas y área valvular indexada), así como el índice de masa del VI, la edad y el sexo, se excluyó mediante análisis de regresión lineal múltiple (con un mínimo de 10 participantes por cada variable en los modelos finales). No se consideraron otros ajustes adicionales, dado el bajo número de pacientes. La significación estadística se estableció en un valor bilateral de p = 0,05. Los análisis se llevaron a cabo con el programa STATA (versión 12.1).
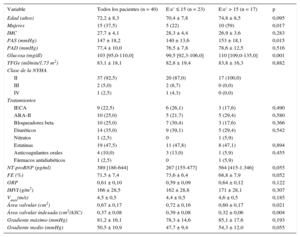
RESULTADOSEn la tabla 1 se muestran las características clínicas, bioquímicas y ecocardiográficas del total y de los pacientes clasificados según la ausencia o presencia de presiones de llenado del VI elevadas diagnosticadas en función de los valores del cociente E:e’ ≤ 15 o > 15 respectivamente. Tal como se indica en la tabla 1, los pacientes con cociente E:e’ > 15 presentaban mayor prevalencia de mujeres, aumentos de la presión arterial sistólica y la glucosa en ayunas y unos valores del área valvular bruta o indexada inferiores que los de los pacientes con cociente E:e’ ≤ 15.
Parámetros clínicos, bioquímicos y cardiacos de los pacientes con estenosis grave de válvula aórtica, fracción de eyección conservada y síntomas de insuficiencia cardiaca clasificados según el valor del cociente E:e’
| Variable | Todos los pacientes (n = 40) | E:e’ ≤ 15 (n = 23) | E:e’ > 15 (n = 17) | p |
|---|---|---|---|---|
| Edad (años) | 72,2 ± 8,3 | 70,4 ± 7,8 | 74,8 ± 8,5 | 0,095 |
| Mujeres | 15 (37,5) | 5 (22) | 10 (59) | 0,017 |
| IMC | 27,7 ± 4,1 | 28,3 ± 4,4 | 26,9 ± 3,6 | 0,283 |
| PAS (mmHg) | 147 ± 18,2 | 140 ± 13,6 | 153 ± 18,1 | 0,015 |
| PAD (mmHg) | 77,4 ± 10,0 | 76,5 ± 7,8 | 78,6 ± 12,5 | 0,516 |
| Glucosa (mg/dl) | 103 [95,0-110,0] | 99,5 [92,3-106,0] | 110 [109,0-135,0] | 0,001 |
| TFGe (ml/min/1,73 m2) | 83,1 ± 18,1 | 82,8 ± 19,4 | 83,8 ± 16,3 | 0,882 |
| Clase de la NYHA | ||||
| II | 37 (92,5) | 20 (87,0) | 17 (100,0) | |
| III | 2 (5,0) | 2 (8,7) | 0 (0,0) | |
| IV | 1 (2,5) | 1 (4,3) | 0 (0,0) | |
| Tratamientos | ||||
| IECA | 9 (22,5) | 6 (26,1) | 3 (17,6) | 0,490 |
| ARA-II | 10 (25,0) | 5 (21,7) | 5 (29,4) | 0,580 |
| Bloqueadores beta | 10 (25,0) | 7 (30,4) | 3 (17,6) | 0,366 |
| Diuréticos | 14 (35,0) | 9 (39,1) | 5 (29,4) | 0,542 |
| Nitratos | 1 (2,5) | 0 | 1 (5,9) | |
| Estatinas | 19 (47,5) | 11 (47,8) | 8 (47,1) | 0,894 |
| Anticoagulantes orales | 4 (10,0) | 3 (13,0) | 1 (5,9) | 0,455 |
| Fármacos antidiabéticos | 1 (2,5) | 0 | 1 (5,9) | |
| NT-proBNP (pg/ml) | 389 [186-644] | 267 [155-477] | 564 [415-1.346] | 0,055 |
| FE (%) | 71,5 ± 7,4 | 73,6 ± 6,4 | 68,8 ± 7,9 | 0,052 |
| GRP | 0,61 ± 0,10 | 0,59 ± 0,09 | 0,64 ± 0,12 | 0,122 |
| IMVI (g/m2) | 166 ± 28,5 | 162 ± 28,8 | 171 ± 28,1 | 0,307 |
| Vmáx(m/s) | 4,5 ± 0,5 | 4,4 ± 0,5 | 4,6 ± 0,5 | 0,185 |
| Área valvular (cm2) | 0,67 ± 0,17 | 0,72 ± 0,16 | 0,60 ± 0,17 | 0,021 |
| Área valvular indexada (cm2/ASC) | 0,37 ± 0,08 | 0,39 ± 0,08 | 0,32 ± 0,06 | 0,004 |
| Gradiente máximo (mmHg) | 81,2 ± 16,1 | 78,3 ± 14,6 | 85,1 ± 17,6 | 0,193 |
| Gradiente medio (mmHg) | 50,5 ± 10,9 | 47,7 ± 9,4 | 54,3 ± 12,0 | 0,055 |
ARA-II: antagonistas del receptor de la angiotensina II; ASC: área de superficie corporal; FE: fracción de eyección; GRP: grosor relativo de la pared; IECA: inhibidores de la enzima de conversión de la angiotensina; IMC: índice de masa corporal; IMVI: índice de masa ventricular izquierda; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; NYHA: New York Heart Association; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TFGe: tasa de filtrado glomerular estimada; Vmáx: velocidad de flujo máxima registrada en la válvula aórtica.
E:e’ es el cociente entre la velocidad de flujo transmitral inicial máximo en diástole y la velocidad inicial en el anillo mitral en diástole.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
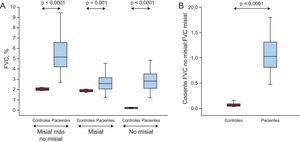
Como se muestra en la figura 3A, se observaron aumentos de los valores de la FVC total y de la FVC misial y no misial de los pacientes en comparación con los participantes de control, con incrementos de 3, 2 y 38 veces respectivamente. En consonancia con esta observación, el cociente FVC no misial:misial mostró un aumento significativo en los pacientes en comparación con los controles (figura 3B). Este cociente fue ligeramente superior en los pacientes con E:e’ > 15 (1,3 ± 0,6) en comparación con aquellos con E:e’ ≤ 15 (1,0 ± 0,3), pero esta diferencia no alcanzó significación estadística (p = 0,10).
A: distribución del volumen de tejido miocárdico ocupado por fibras de colágeno (FVC) en la región misial más la región no misial, en la región misial sola y en la región no misial sola, de los controles (n = 10) y los pacientes con EA grave con FEc y síntomas de IC (n = 38). B: distribución del cociente FVC no misial:misial de los controles y los pacientes; los recuadros indican los valores de los centiles 5 y 95 (líneas verticales), 25 y 75 (recuadros) y 50 (recta horizontal).
EA: estenosis de la válvula aórtica; FEc: fracción de eyección conservada; FVC: fracción de volumen de colágeno; IC: insuficiencia cardiaca.
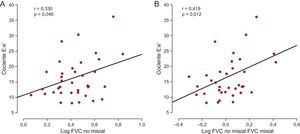
Mientras que la FVC no misial mostró correlación directa con el cociente E:e’ (figura 4A) en todos los pacientes, no ocurrió así con la FVC misial. El cociente FVC no misial:misial mostró una correlación inversa (r = –0,343; p = 0,04) con el valor de e’ y correlación directa con el cociente E:e’ (figura 4B) en todos los pacientes. Es de destacar que la asociación entre el cociente FVC no misial:misial y el cociente E:e’ era independiente de la edad y el sexo, la glucemia, la presión arterial sistólica y el área valvular indexada (tabla 2). Además, esta asociación no estaba influida por el índice de masa del VI (tabla 2).
A: correlación directa (y = 1,89× + 10,60) entre el volumen de tejido miocárdico ocupado por fibras de colágeno (FVC) en la región no misial y el cociente entre la velocidad máxima de flujo transmitral inicial en diástole y la velocidad inicial en el anillo mitral en diástole (cociente E:e’) de los pacientes con EA grave, FEc y síntomas de IC (n = 38). B: correlación directa (y = 6,08× + 9,37) entre el cociente FVC no misial:misial y el cociente E:e’ de los pacientes (n = 38). EA: estenosis de la válvula aórtica; FEc: fracción de eyección conservada; FVC: fracción de volumen de colágeno; IC: insuficiencia cardiaca.
Características del cociente E:e’ ajustado en relación con el cociente fracción de volumen de colágeno no misial:misial
| Variable | Covariables | Estimación | IC95% | p | R2 |
|---|---|---|---|---|---|
| Modelo 1 | Edad y sexo | 3,570 | 0,127-7,267 | 0,048 | 0,333 |
| Modelo 2 | Glucosa, PAS y área valvular indexada | 3,804 | 0,117-7,491 | 0,043 | 0,341 |
| Modelo 3 | IMVI | 4,683 | 1,042-8,323 | 0,013 | 0,270 |
FVC: fracción de volumen de colágeno; IC95%: intervalo de confianza del 95%; IMVI: índice de masa ventricular izquierda; PAS: presión arterial sistólica.
Las estimaciones se calcularon en 38 pacientes. Las estimaciones corresponden a la magnitud del efecto asociada con un aumento del cociente FVC no misial:misial al doble. E:e’ es el cociente entre la velocidad de flujo transmitral inicial máximo en diástole y la velocidad inicial en el anillo mitral en diástole.
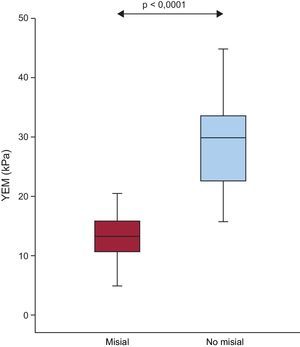
Como se indica en la figura 5, el valor del YEM fue significativamente superior en la región no misial que en la misial de los pacientes. Además, se observó un aumento de los valores del cociente YEM no misial:misial en los pacientes con E:e’ > 15 respecto a los pacientes con E:e’ ≤ 15 (2,8 ± 1,6 frente a 1,8 ± 0,4; p = 0,05).
Distribución del YEM en las regiones misial y no misial de los pacientes con EA grave, FEc y síntomas de IC (n = 20). Los recuadros indican los valores de los centiles 5 y 95 (líneas verticales), 25 y 75 (recuadros) y 50 (recta horizontal). EA: estenosis de la válvula aórtica; FEc: fracción de eyección conservada; FVC: fracción de volumen de colágeno; IC: insuficiencia cardiaca; YEM: módulo elástico de Young.
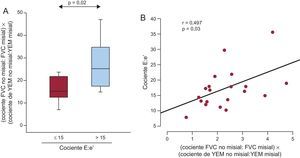
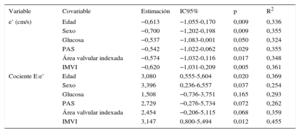
El producto del cociente FVC no misial:misial por el cociente YEM no misial:misial aumentó significativamente en los pacientes con E:e’ > 15 mmHg en comparación con los que tenían E:e’ ≤ 15 (figura 6A). El producto mencionado tenía correlación inversa con el valor de e’ (r = –0,578; p = 0,008) y directa con el cociente E:e’ (figura 6B) en todos los pacientes. Es interesante que las asociaciones del producto con e’ fueran independientes de la edad, el sexo, la glucosa, la presión arterial sistólica, el área valvular indexada y el índice de masa del VI (tabla 3). Además, las asociaciones del producto con el cociente E:e’ fueron independientes de la edad, el sexo y el índice de masa del VI (tabla 3).
A: distribución del producto del cociente FVC no misial:misial por el cociente de YEM no misial:misial de los pacientes con EA grave, FEc y síntomas de IC (n = 20) clasificados según el valor umbral ≤ 15 (n = 8) o > 15 (n = 12) del cociente entre la velocidad máxima inicial de flujo trasmitral en diástole y la velocidad inicial en el anillo mitral en diástole (cociente E:e’). B: correlación directa (y = 3,09× + 10,44) entre el producto del cociente FVC no misial:misial por el cociente YEM no misial:misial y el cociente E:e’ de los pacientes (n = 20). EA: estenosis de la válvula aórtica; FEc: fracción de eyección conservada; FVC: fracción de volumen de colágeno; IC: insuficiencia cardiaca; YEM: módulo elástico de Young.
Características de e’ y el cociente E:e’ ajustados en relación con el producto del cociente fracción de volumen de colágeno no misial:misial por el cociente de módulo elástico de Young no misial:misial
| Variable | Covariable | Estimación | IC95% | p | R2 |
|---|---|---|---|---|---|
| e’ (cm/s) | Edad | −0,613 | −1,055-0,170 | 0,009 | 0,336 |
| Sexo | −0,700 | −1,202-0,198 | 0,009 | 0,355 | |
| Glucosa | −0,537 | −1,083-0,001 | 0,050 | 0,324 | |
| PAS | −0,542 | −1,022-0,062 | 0,029 | 0,355 | |
| Área valvular indexada | −0,574 | −1,032-0,116 | 0,017 | 0,348 | |
| IMVI | −0,620 | −1,031-0,209 | 0,005 | 0,361 | |
| Cociente E:e’ | Edad | 3,080 | 0,555-5,604 | 0,020 | 0,369 |
| Sexo | 3,396 | 0,236-6,557 | 0,037 | 0,254 | |
| Glucosa | 1,508 | −0,736-3,751 | 0,165 | 0,293 | |
| PAS | 2,729 | −0,276-5,734 | 0,072 | 0,262 | |
| Área valvular indexada | 2,454 | −0,206-5,115 | 0,068 | 0,359 | |
| IMVI | 3,147 | 0,800-5,494 | 0,012 | 0,455 |
IC95%: intervalo de confianza del 95%; IMVI: índice de masa ventricular izquierda; PAS: presión arterial sistólica.
Las estimaciones se calcularon en 20 pacientes.
e’ es la velocidad inicial en el anillo mitral en diástole; E:e’, el cociente entre la velocidad de flujo transmitral inicial máximo en diástole y la velocidad inicial en el anillo mitral en diástole.
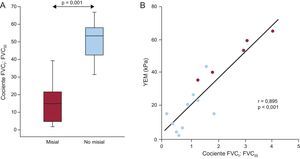
Por último, la FVCI aumentó 1,8 veces y la FVCIII se redujo a un tercio en la región no misial respecto a la misial de los pacientes. En consecuencia, el cociente FVCI:FVCIII fue significativamente superior en la región no misial que en la misial (figura 7A). Tiene interés que se observara una intensa correlación directa entre el cociente FVCI:FVCIII y el YEM (figura 7B) de los pacientes.
A: distribución del cociente entre el volumen de tejido miocárdico ocupado por fibras de colágeno de tipo I y el ocupado por las de tipo III (cociente FVCI:FVCIII) en las regiones misial y no misial del miocardio de 5 pacientes con EA grave, FEc y síntomas de IC. Los recuadros indican los valores de los centiles 5 y 95 (líneas verticales), 25 y 75 (recuadros) y 50 (recta horizontal). B: correlación directa (y = 16,93× + 3,50) entre el cociente FVCI:FVCIII y el YEM determinado en 2 regiones misiales (círculos azules) y 1 no misial (círculos rojos) de 5 pacientes. EA: estenosis de válvula aórtica; FEc: fracción de eyección conservada; FVCI: fracción de volumen de colágeno tipo I; FVCIII: fracción de volumen de colágeno tipo III; IC: insuficiencia cardiaca; YEM: módulo elástico de Young. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Los principales resultados de este estudio son los siguientes: primero, aunque se observó un aumento del depósito de fibras tanto en las regiones misiales como en las no misiales de la red de colágeno miocárdico en los pacientes con EA grave, FEc y síntomas de IC, el incremento fue mucho más pronunciado en la región no misial que en la misial; segundo, el depósito de colágeno no misial, pero no el de misial, se asoció con unas presiones de llenado del VI elevadas en la EA grave con FEc y síntomas de IC; tercero, en comparación con la misial, la región no misial de estos pacientes se caracterizaba por un aumento de la rigidez y el depósito predominante de fibras de colágeno de tipo I frente a las de tipo III. Estas observaciones apuntan a que las alteraciones en la localización anatómica, la composición fenotípica y las propiedades biomecánicas del colágeno tisular pueden contribuir a que se produzca la disfunción diastólica del VI en los pacientes con EA grave y FEc complicada con síntomas de IC.
Componentes de la red de colágeno y disfunción diastólica del ventrículo izquierdoLa red de colágeno del miocardio se divide en un componente misial y otro no misial, que cumplen diversas funciones14. Concretamente, el componente no misial es la matriz de colágeno que se encuentra entre el endotelio del miocardio y el epicardio, y forma una matriz compleja de fibras de colágeno. La evidencia existente indica que el aumento de la red de colágeno no misial se asocia con alteraciones de la función diastólica15,16. En consonancia con esta posibilidad, se observó que, en los pacientes con EA grave, FEc y síntomas de IC, un exceso de colágeno no misial se asociaba con un aumento de las presiones de llenado del VI según lo indicado por el aumento del cociente E:e’. Es interesante que esta asociación no estuviera influida por la hipertrofia del VI, lo cual indica la importancia de la acumulación de colágeno no misial para las propiedades de elasticidad del VI con sobrecarga de presión17, un concepto ya propuesto anteriormente en estudios experimentales18–20.
Otra cuestión que se plantea es si las propiedades biomecánicas de la red de colágeno del miocardio y, por lo tanto, la matriz extracelular del miocardio se afectan por la diferente expresión de los fenotipos de fibras de colágeno. Un estudio realizado ex vivo en tejido de aurícula derecha humano demostró que, en comparación con las fibras de colágeno de tipo III, las de tipo I tenían un YEM significativamente superior21. Teniendo en cuenta las consecuencias funcionales de esta observación, se podría plantear la hipótesis de que un aumento relativo del colágeno de tipo I podría conferir más rigidez y peor función diastólica a la red de colágeno del miocardio. En consonancia, se observó que había una asociación entre el predominio de fibras de colágeno de tipo I, frente a las de tipo III, y el aumento de rigidez de la región no misial de la red de colágeno de los pacientes con EA grave, FEc y síntomas de IC. Esta observación podría aportar un vínculo para el mecanismo de acción de la asociación antes comentada entre el depósito de colágeno no misial y la disfunción diastólica del VI.
Consecuencias clínicas¿Cuáles son las consecuencias clínicas de las observaciones descritas? El seguimiento a largo plazo de pacientes con EA grave tras un reemplazo de la válvula aórtica indica que la sustitución valvular puede no proporcionar una reversión completa de los cambios inadaptados que se producen en la matriz extracelular miocárdica secundarios al estado de sobrecarga de presión. De hecho, las anomalías residuales de la matriz extracelular, como la fibrosis miocárdica, probablemente sean la causa de las anomalías persistentes de la función diastólica del VI y el aumento de la morbilidad y la mortalidad después del reemplazo de la válvula aórtica1. En consecuencia, se necesitan tratamientos novedosos que vayan más allá de la sustitución de la válvula aórtica de los pacientes con EA, es decir, aquellos con FEc y síntomas de IC. El desarrollo de nuevos tratamientos requiere la identificación de los mecanismos moleculares que conducen a la aparición de la disfunción diastólica en estos pacientes. En el presente estudio se identifica un mecanismo de este tipo como posible diana: la acumulación excesiva de colágeno de tipo I en las regiones no misiales de la red de colágeno del miocardio que da lugar a un aumento de la rigidez de la matriz extracelular. Además, se podría usar los biomarcadores circulantes o las exploraciones de imagen que reflejan estos cambios del colágeno tisular del miocardio para mejorar los criterios diagnósticos y también para la evaluación del pronóstico en la EA grave con FEc y síntomas de IC. A este respecto, es posible que, tal como se ha observado en los pacientes con cardiopatía hipertensiva e IC con FEc22, los cambios en la concentración sérica del inhibidor tisular de las metaloproteinasas de matriz 1 puedan ser útiles para detectar la más temprana aparición de disfunción diastólica del VI producida por el colágeno, así como para el seguimiento de la eficacia del reemplazo de la válvula aórtica para reparar el remodelado miocárdico en la EA grave con FEc y síntomas de IC.
LimitacionesEste estudio tiene ciertas limitaciones. En primer lugar, el estudio contó con un número de pacientes relativamente bajo. Concretamente, la evaluación de los fenotipos del colágeno se realizó en un pequeño número de muestras de biopsia consecutivas, y no seleccionadas aleatoriamente. Sin embargo, dada la naturaleza de los objetivos de la investigación, tuvo la potencia estadística suficiente. Es importante tener en cuenta que no se observaron diferencias en la comparación de las características basales de los 40 pacientes iniciales, los 20 con determinación del YEM y los 5 con cuantificación de la FVCI y la FVCIII (datos no presentados). Segundo, además de por los cambios observados en el cociente entre los tipos de colágeno, la calidad del colágeno puede afectarse también por modificaciones postraslacionales de las moléculas de colágeno, en especial un aumento de los enlaces cruzados23. De hecho, se ha descrito que un exceso de enlaces cruzados del colágeno se asocia con un aumento de la rigidez miocárdica en los pacientes hipertensos con IC y FEc24,25. Lamentablemente, el pequeño número de biopsias obtenidas en este estudio no permitió realizar una evaluación del colágeno con y sin enlaces cruzados. Tercero, la rigidez del miocardio también está determinada por la proteína sarcomérica titina, que regula la tensión pasiva de los miocardiocitos26. Tal como se ha demostrado recientemente, el estado de fosforilación de la titina se asocia con un aumento de la rigidez miocárdica dependiente de la titina en los pacientes con IC y FEc hipertensos25 y en los diabéticos con estenosis aórtica27. Así pues, aunque la rigidez se evaluó en tejido descelularizado, serán necesarios nuevos estudios en tejido intacto para determinar la rigidez miocárdica dependiente de miocardiocitos en los pacientes con EA e IC con FEc. Cuarto, dado que son de carácter descriptivo, las asociaciones observadas entre los parámetros que valoran la FVC y el YEM y el cociente E:e’ no establecen una relación causal. Y quinto, la estimación de las presiones de llenado altas evaluando el cociente E:e’ plantea algunas limitaciones, en especial en casos de IC descompensada, disfunción grave del VI, ventrículos grandes, anomalías de la conducción o insuficiencia mitral importante. Sin embargo, en la población de este estudio no se daba ninguna de estas situaciones.
CONCLUSIONESEste estudio indica que la acumulación no misial de fibras de colágeno, es decir, fibras de tipo I, se asocia con un aumento de la rigidez de la matriz extracelular y de las presiones de llenado del VI en la EA grave con FEc y síntomas de IC. Aun siendo de naturaleza descriptiva, estos hallazgos indican que un aumento de la rigidez pasiva causado por los cambios fenotípicos y biomecánicos de la red de colágeno no misial puede contribuir a que se produzcan disfunción diastólica y disnea en la EA grave con FEc.
FINANCIACIÓNMinisterio de Economía y Competitividad, Madrid (España) (Instituto de Salud Carlos III, subvenciones RD12/0042/0009 y PI15/01909, y CIBER-CV CB16/11/00483), y Programa FP7 de la Comisión Europea, Bruselas (Bélgica) (proyecto MEDIA, subvención HEALTH-2010-261409, y proyecto FIBRO-TARGETS, subvención FP7-HEALTH-2013-602904). A.E.A. disfruta de una beca Juan de la Cierva (Ministerio de Economía y Competitividad). Ministerio de Economía y Competitividad, «Retos de la sociedad», subvenciones TEC 2013-48552-C2-2-R. Gobierno Vasco (PI 2015-044), Consejería de Educación, Política Lingüística y Cultura.
CONFLICTO DE INTERESESNinguno.
- –
La fibrosis miocárdica no solo contribuye a producir el deterioro progresivo de la función diastólica del VI que puede facilitar la aparición de IC en los pacientes con EA grave y FEc, sino que también puede influir negativamente en la evolución clínica tras el reemplazo de la válvula aórtica de estos pacientes.
- –
En este contexto, no se sabe qué características de la fibrosis miocárdica tienen influencia en la función diastólica del VI.
- –
El presente estudio demuestra específicamente («o por primera vez») que un depósito excesivo de fibras de colágeno de tipo I en la región no misial de la red de colágeno del miocardio es el principal factor causal del aumento de rigidez de la matriz extracelular evaluada mediante microscopia de fuerza atómica, y se asocia con disfunción diastólica del VI en la EA grave con FEc y síntomas de IC.
- –
La identificación de estos cambios con biomarcadores apropiados y la acción dirigida a ellos mediante tratamientos específicos son nuevos instrumentos para afrontar los retos médicos que plantea la IC en la EA grave con FEc.
Los autores agradecen a Sonia Martínez y María J. González su inestimable ayuda técnica.