Palabras clave
INTRODUCCIÓN
Los avances en la terapia de reperfusión, incluida la trombólisis y la revascularización, han mejorado radicalmente el pronóstico inicial y a largo plazo del infarto agudo de miocardio (IAM)1. Sin embargo, menos del 50% de estos pacientes logra una adecuada reperfusión epicárdica y microvascular antes de que se produzca un daño irreversible en los miocitos de la zona infartada. Una gran proporción de estos pacientes pueden desarrollar insuficiencia cardíaca debido al remodelado ventricular, proceso caracterizado por una expansión mecánica de la pared infartada, seguida de una progresiva dilatación y disfunción ventricular2. Dado que la principal causa de este proceso es el daño irreversible de los cardiomiocitos y de los componentes microvasculares de la pared infartada3, el desarrollo de tratamientos dirigidos a la regeneración de tejido miocárdico necrosado y, probablemente, de la microcirculación, se puede considerar como un auténtico reto para el futuro tratamiento de estos pacientes. El fundamento para este enfoque incluye evidencias recientes que demuestran la extraordinaria capacidad de las células madre adultas para producir células diferenciadas a partir de tejidos no emparentados embriológicamente4 y convincentes datos que confirman que el corazón tiene una capacidad regenerativa intrínseca5. En realidad, se ha demostrado que la existencia de células madre cardíacas hace posible la regeneración de miocitos y vasos después de un miocardio envejecido o dañado6-8 e indica que la repoblación de cardiomiocitos por células madre extracardíacas puede ocurrir en humanos9,10. Por lo tanto, la hipótesis de que la capacidad natural de los corazones de los mamíferos para regenerar el miocardio infartado puede ser reforzada por estimulación de células madre endógenas o por la liberación local de células madre extracardíacas ha generado varias investigaciones en animales que proponen que la terapia de células madre podría prevenir el remodelado ventricular postinfarto7. En particular, las células procedentes de médula ósea implantadas en el miocardio infartado indujeron miogénesis y angiogénesis, y mejoraron la función cardíaca y la supervivencia en ratones11-13 y cerdos14. Además, recientes estudios clínicos en fase I en un reducido número de pacientes también observaron que el trasplante intracoronario de células madre beneficia la función ventricular en humanos15-24. Por contra, recientes experimentos, que muestran una mejora funcional de la función ventricular después de la inyección directa de células madre en la pared infartada, no demuestran una transdiferenciación en cardiomiocitos22,23. De forma similar, la capacidad de las células madre extracardíacas para transdiferenciarse en cardiomiocitos en corazones infartados, trasplantados de pacientes no emparejados en sexo, también ha sido cuestionada recientemente24. Además, también ha sido cuestionada la seguridad en la fase aguda y a largo plazo del trasplante intracoronario de células madre en humanos25-29.
MECANISMOS DE ACCIÓN DE LAS CÉLULAS MADRE
La capacidad de las células mononucleares de medula ósea de transdiferenciarse en cardiomiocitos es una cuestión fundamental todavía no resuelta. Sin embargo, mientras algunos estudios experimentales5,11-14 y clínicos15-23 apoyan esta teoría, otros niegan esta posibilidad24,25. Junto con la observación de que las células madre, cardíacas y endógenas pueden dividirse y regenerar el miocardio infartado5, otras evidencias muestran que las células madre extracardíacas de origen hematológico pueden anidar en el corazón9,30-32. En este sentido, Orlic et al11 observaron que las células madre hematopoyéticas pueden incrementar la eficiencia de la capacidad de regeneración intrínseca del corazón y mostraron que, en un ratón con infarto agudo de miocardio, tanto la liberación local de células madre de médula ósea como la movilización con factor estimulante de colonias de granulocitos (G-CSF)12 daban lugar a la colonización del tejido infartado por células madre hematopoyéticas que proliferaban, se transdiferenciaban en cardiomiocitos y vasos, y se asociaban con una clara mejoría en términos de tamaño del infarto, mejoría de función ventricular y supervivencia. Tomita et al14 reprodujeron resultados similares en un modelo de infarto de miocardio en el cerdo, donde las células de médula ósea de origen estromal formaban islas de tejido cardíaco, inducían angiogénesis, prevenían el remodelado y mejoraban la función contráctil. Finalmente, Mangi et al13 demostraron que la inyección directa de células madre de médula ósea de origen mesenquimal, genéticamente modificadas para expresar el gen Akt1, reparaban el miocardio infartado de la rata, prevenían el remodelado y normalizaban la función cardíaca. En contraste con lo anterior, algunos estudios recientes no han demostrado transdiferenciación de células madre hematopoyéticas en cardiomiocitos después del daño miocárdico. En varones trasplantados que recibían un corazón de mujer y desarrollaban un infarto de miocardio después del trasplante, Höcht-Zeisberg et al26 encontraron una invasión de células madre extracardíacas que regeneraban células endoteliales, pero que no se transdiferenciaban en cardiomiocitos. En concordancia con estos hallazgos, Murry et al25 han objetivado recientemente que células madre hematopoyéticas genéticamente modificadas no adquirían un fenotipo cardíaco después de que fueran trasplantadas en corazones dañados de ratón. De forma muy llamativa, Balsam et al24 observaron que, después de producir un infarto de miocardio extenso en ratones, células madre de médula ósea, autólogas, adultas e inyectadas en el tejido necrótico adoptaban el fenotipo de células hematopoyéticas adultas, pero no se transformaban en células cardíacas. A pesar de esto, los animales trasplantados con células madre presentaban una mejor función ventricular que los controles.
FORMAS DE ADMINISTRACIÓN
Las rutas potenciales de liberación de células madre en el corazón son varias: inyección intramiocárdica directa durante la cirugía cardíaca abierta, inyección intramiocárdica con catéteres de forma percutánea guiados por fluoroscopia o con técnicas de cartografía electromecánica, administración intracoronaria de las células, movilización de las células de la médula ósea usando agentes farmacológicos que son capaces de estimular la proliferación de estas células en la propia médula ósea y su posterior liberación al torrente sanguíneo33. Otras vías hipotéticas en investigación serían la simple administración intravenosa periférica o de forma directa en el sistema venoso coronario a través del seno coronario. Todas estas vías de administración tienen sus ventajas y sus inconvenientes, pero todavía estamos lejos de saber cuál es la más ventajosa y adecuada. Quizá todas ellas tengan aplicaciones determinadas según la situación clínica del paciente. Por ejemplo, en un paciente con enfermedad severa y difusa de 3 vasos no revascularizables difícilmente podremos usar la vía intracoronaria o el abordaje quirúrgico. En este caso podrían plantearse los sistemas percutáneos de inyección directa en el endocardio o incluso un acceso retrógrado a través del seno coronario. En un paciente con infarto agudo de miocardio, la vía intracoronaria sería la más adecuada, o bien la movilización de células madre con fármacos. Sin embargo, lejos de buscar una competencia entre las diferentes formas de administración de las células madre, lo más sensato es complementarlas y usar la más adecuada según las características del paciente y la situación clínica que queramos resolver.
Otro tema en plena fase de investigación es cuál es el momento más adecuado para realizar el trasplante de células madre. Esto tiene una gran importancia en los pacientes con infarto agudo de miocardio. Los datos de experimentación animal indican que el mayor beneficio se obtiene después de la fase inflamatoria del infarto agudo de miocardio y antes de comenzar la fase de necrosis34. En los humanos se han utilizado ventanas que van de los 4 a los 15 días postinfarto de miocardio.
SEGUIMIENTO DE LOS PACIENTES QUE RECIBEN TERAPIA CELULAR
El seguimiento de los pacientes que reciben terapia celular tiene una enorme importancia por 2 motivos: para valorar la seguridad y la eficacia de la técnica. En relación con la seguridad, tiene una gran trascendencia conocer el daño miocárdico secundario a la técnica empleada.
Los siguientes parámetros pueden usarse para valorar la eficacia: función ventricular global y regional, viabilidad, tamaño del infarto, grosor de la pared infartada, reserva contráctil, perfusión y reserva coronaria. Las funciones global y regional pueden calcularse con angiografía, ecocardiografía y resonancia cardíaca. Quizá esta última técnica sea la de elección para seguir a estos pacientes, al tratarse de un procedimiento no invasivo, con una alta resolución temporal y espacial y, además, con una alta reproducibilidad. Además, es más precisa que la angiografía y la ecocardiografía para valorar el remodelado, porque no realiza asunciones en relación con la geometría ventricular, que es crucial en los ventrículos distorsionados después de un infarto de miocardio. Cuando se está valorando la función regional se debe calcular el wall motion score index35.
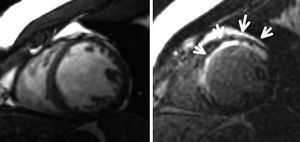
La viabilidad es otro parámetro de gran importancia en estos pacientes. Puede calcularse con ecocardiografía de estrés con dobutamina a dosis bajas, técnicas de medicina nuclear o mediante resonancia cardíaca con realce tardío con gadolinio (fig. 1). Varias investigaciones han demostrado que el grosor de la pared infartada, calculado por resonancia cardíaca o ecocardiograma, se correlaciona bien con la viabilidad. La reserva contráctil se define como la potencialidad del miocardio para incrementar su contractilidad después de la administración de inotrópicos y se puede determinar monitorizando la respuesta del ventrículo con ecocardiografía o resonancia magnética con administración de dobutamina a dosis bajas (desde 5 a 10-20 µg/kg/ min). La tomografía de emisión de positrones y las técnicas de medicina nuclear permiten una estimación muy precisa de la perfusión miocárdica. La ecocardiografía de estrés con dobutamina quizá no sea la técnica ideal para detectar la viabilidad. La sensibilidad varía del 70 al 85% y la especificidad del 80 al 90%36. Sin embargo, estos valores se determinaron antes de que la técnica del segundo armónico estuviese disponible, la cual ha demostrado mejorar sustancialmente la precisión de esta técnica37. Además, cuando se compara con el resto de las técnicas de imagen, incluida la tomografía de emisión de positrones, la ecocardiografía de estrés con dobutamina tiene los valores más elevados de valor predictivo positivo y negativo38. Por tanto, en ausencia de información directa de la necropsia, la ecocardiografía de estrés con dobutamina es una muy buena herramienta para valorar la viabilidad.
Fig. 1. Ejemplo de resonancia cardíaca con realce tardío con gadolinio. Plano transversal del ventrículo izquierdo. En la imagen de la izquierda se observa una imagen basal. En la imagen de la derecha se observa captación de gadolinio en la cara anterior del ventrículo izquierdo que indica ausencia de viabilidad.
Para demostrar algún beneficio del trasplante de células madre, debe compararse un estudio basal y uno posterior de seguimiento. Este estudio de seguimiento debe realizarse al menos 3 meses después del evento agudo para evitar la presencia del miocardio contundido, que puede dar lugar a resultados confusos.
SEGURIDAD
En relación con la seguridad a corto y largo plazo de la terapia celular, existe el inconveniente de acelerar estudios clínicos aleatorizados, destinados a valorar la eficacia de este tratamiento en pacientes con infarto reciente39,40. En primer lugar, atendiendo a la consideración del elevado efecto deletéreo de la disfunción microvascular persistente en el remodelado postinfarto del ventrículo y en el pronóstico clínico, los potenciales efectos de la infusión intracoronaria en la producción o el agravamiento del fenómeno de no-reflujo por oclusión de embolias microvasculares requiere un análisis cauteloso. Después de la infusión de células de médula ósea mesenquimales en la arteria circunfleja de perros sin infarto, Vulliet et al27 observaron cambios electrocardiográficos isquémicos severos seguidos de un incremento de los marcadores de daño miocárdico y una evidencia anatómica de áreas de microinfartos con acumulación de las células infundidas. Igualmente, Kang et al29 han informado recientemente de un incremento ligero de marcadores de daño miocárdico después del trasplante intracoronario de células de médula ósea. Al contrario, al igual que en estudios previos15,16, no hemos observado ni daño miocárdico ni disfunción microvascular después de repetidas oclusiones transitorias e infusión lenta y simultánea de células mononucleares de médula ósea en arterias coronarias de áreas infartadas no viables. Secundariamente, aunque la circulación de células madre hematopoyéticas parece contribuir a la integridad funcional y estructural del endotelio vascular41 y pueden beneficiar la reendotelización después de un daño arterial espontáneo o provocado42,43, algunos datos, recientemente publicados, apoyan que la liberación intravascular de células de médula ósea o la movilización de la médula ósea pueden inducir una progresión de lesiones coronarias de novo o reestenóticas28,29,44. Particularmente, Kang et al29 han publicado recientemente una inesperada alta tasa de reestenosis intra-stent a los 6 meses en pacientes con infarto reciente que recibieron G-CSF para la movilización de la médula ósea durante 4 días, seguido de tratamiento con stent de la arteria relacionada con el infarto sola o asociada con infusión intracoronaria de células de médula ósea. Por el contrario, según nuestra experiencia, la infusión intracoronaria de células de médula ósea no produjo más reestenosis ni más progresión de lesiones ateroscleróticas de las esperadas.
CONCLUSIONES
La terapia de regeneración miocárdica con células madre se ha convertido en una nueva esperanza para combatir la insuficiencia cardíaca y otras enfermedades cardiovasculares. Todavía nos encontramos en los albores de este nuevo concepto de tratamiento, pero el conocimiento de la existencia de una regeneración natural en el miocardio humano ha abi erto nuevas expectativas y nuevas vías de investigación. Todavía es temprano para poder establecer como indicación la terapia con células madre, debido a las muchas incógnitas que quedan por resolver y a los interrogantes suscitados en temas de seguridad de las diferentes técnicas de aplicación. Pero, sin duda, estamos ante uno de los retos más importantes de la investigación cardiovascular en este siglo.
Correspondencia: Dr. F. Fernández-Avilés.
ICICOR. Hospital Clínico Universitario.
Ramón y Cajal, 3.
47005 Valladolid. España.
Correo electrónico: faviles@secardiologia.es