La terapia de reperfusión ha supuesto un notable descenso de la morbimortalidad hospitalaria y a largo plazo de los pacientes con infarto agudo de miocardio. En los últimos años, se ha demostrado que la angioplastia es más eficaz que la fibrinolisis siempre que se realice en un intervalo de tiempo adecuado. Sin embargo, la angioplastia primaria no es el tratamiento mayoritariamente utilizado debido a que requiere una infraestructura adecuada y una organización muy eficiente. Para incrementar el uso de la angioplastia primaria y homogeneizar el tratamiento de los pacientes con infarto agudo de miocardio hemos revisado las principales barreras del circuito de la angioplastia primaria. Se describen diferentes estrategias que permiten acortar el tiempo puerta-balón y distintos programas de carácter nacional, regional y local que han facilitado el acceso a la angioplastia primaria y han mejorado los tiempos de reperfusión.
Palabras clave
El advenimiento en los últimos años de la terapia de reperfusión farmacológica (fibrinolisis) o mecánica (angioplastia primaria) ha comportado un descenso significativo de la morbimortalidad hospitalaria y a largo plazo de los pacientes con infarto agudo de miocardio con elevación del ST (IAMCEST)1,2. En consecuencia, las guías de práctica clínica3,4 consideran la terapia de reperfusión como indicación de clase IA en los pacientes que presentan sintomatología típica de menos de 12h de evolución y ECG con elevación persistente del ST o aparición de novo de bloqueo de rama izquierda.
Aunque el beneficio de la fibrinolisis está ampliamente probado1, en los últimos años varios estudios han demostrado la superioridad de la angioplastia primaria (ACPP) que se evidencia en una disminución significativa de la mortalidad, la tasa de reinfarto y la incidencia de ictus hemorrágico2,5–7. Sin embargo, dicho beneficio puede ser cuestionable en los casos en que sea preciso transferir a los pacientes hasta los centros con disponibilidad para realizar ACPP, dado el tiempo de retraso que puede comportar el traslado8. De hecho, hay una clara correlación en el intervalo de tiempo entre el inicio del dolor-balón y la mortalidad9,10. Por esta razón, la ACPP es la terapia de reperfusión considerada de elección siempre y cuando se realice en el intervalo de tiempo adecuado y por un equipo experimentado3,4.
A pesar de ello, la ACPP todavía no es el tratamiento que mayoritariamente reciben los pacientes con IAMCEST. En España, el registro MASCARA11 muestra que sólo el 38,6% de los pacientes con IAMCEST tratados con reperfusión recibieron ACPP. Porcentajes similares podemos observar en registros europeos, como el Euro Heart Survey12, o de ámbito pluricontinental, como el GRACE13, con una gran variabilidad entre países. En Estados Unidos, según datos del National Registry of Myocardial Infarction14, un 43,2% de los pacientes reperfundidos fueron tratados con ACPP.
La limitación más importante para la realización de la ACPP es la necesidad de una infraestructura adecuada con una organización eficiente. Está claro que no es posible implantar programas nacionales o comunitarios de ACPP si no se convence previamente a las autoridades sanitarias de su necesidad. Sin embargo, en el ámbito local es más factible esta coordinación puesto que es menor el número de agentes implicados en el proceso, lo que permite su aplicación de forma más inmediata. A continuación, revisaremos las condiciones exigibles para que la ACPP sea realmente eficaz, así como las principales medidas que se pueden tomar para conseguir su expansión como terapia de primera elección que permita mayor equidad y menor variabilidad en la asistencia de los pacientes con IAMCEST.
ANGIOPLASTIA PRIMARIA. REQUISITOS DE TIEMPOEl tiempo máximo de retraso de la ACPP con respecto a la fibrinolisis a partir del cual aquélla pierde su beneficio en cuanto a reducción de mortalidad se ha establecido en 60–120 min15–19, aunque puede variar en función de la localización del infarto, el tiempo desde el inicio del dolor y la edad del paciente17. Este intervalo puede ser tan corto como < 1h para un paciente de menos de 65 años con un IAMCEST anterior de menos de 2h de evolución y tan prolongado como 3h en un paciente mayor de 65 años con un infarto de localización no anterior con más de 2h de evolución17. Es muy importante señalar que este retraso se refiere a la diferencia teórica de tiempo que hay entre el primer contacto médico (PCM) y el inflado del balón, menos el tiempo desde este PCM hasta el tratamiento fibrinolítico3. Es decir, la diferencia «puertabalón» – «puerta-aguja», donde «puerta» es el momento en que el paciente es asistido por el PCM, que es el primer profesional capaz de administrar tratamiento de reperfusión. Actualmente, se recomienda que este tiempo sea de 90min para pacientes cuya duración de los síntomas sea inferior a 2h y de 120min para el resto3. Por cada 10min adicionales de retraso de la ACPP respecto a la fibrinolisis el beneficio absoluto de la ACPP en cuanto a supervivencia decrece un 0,24%16.
Es evidente que el intervalo de tiempo «puertaaguja» está menos condicionado por el circuito que sigue el paciente hasta que recibe el tratamiento fibrinolítico que el intervalo «puerta-balón» (PB). A partir del PCM, el tiempo hasta que se realiza la ACPP depende de la distancia hasta el centro de intervencionismo coronario percutáneo (IPC), si hay o no traslado interhospitalario previo, la capacidad de admisión del hospital con IPC, la disponibilidad de la sala de hemodinámica en ese momento, la experiencia del cardiólogo intervencionista y la celeridad en la respuesta del equipo de ACPP, que puede variar en función de la hora del día o del día de la semana en que se realiza la ACPP20.
Algunos de estos factores que intervienen en el circuito, como la disponibilidad permanente de cama en la unidad coronaria y de sala de hemodinámica (que condicionan la capacidad de admisión), así como el tiempo empleado en movilizar al equipo de ACPP primaria, están exclusivamente ligados al centro de ACPP, por lo que la optimización en el uso de los recursos mencionados y el acortamiento en los tiempos de respuesta dependen únicamente de la organización interna de los propios centros. El resto de los factores que acortan el tiempo están subordinados a circunstancias geográficas (distancia hasta el centro de IPC) y si hay medios de transporte adecuados. El tiempo que los servicios de emergencias (SEMM) emplean en el traslado de estos pacientes es decisivo; éste es el principal obstáculo para que la ACPP se lleve a cabo on time. Conocer el tiempo aproximado de traslado hasta el centro con IPC es esencial para decidir si la ACPP es la terapia de reperfusión indicada.
IDENTIFICACIÓN DE BARRERAS Y ESTRATEGIAS PARA MEJORAR LOS TIEMPOSEn el proceso temporal PCM-balón pueden producirse diferentes escenarios con los consiguientes circuitos también diferenciados. Es necesario revisar cada escenario y su circuito con el fin de identificar los puntos (barreras) donde una intervención asequible puede reducir este intervalo de tiempo.
El primer escenario es el de los pacientes que acuden por sus propios medios directamente a los centros con IPC. En este caso, la implementación de estrategias para acortar el tiempo PB es fundamentalmente dependiente del centro receptor que debe identificar los puntos mejorables tras examinar todo el proceso asistencial de la ACPP, que se inicia en el momento en que el paciente llega al hospital y termina con el inflado del balón.
El segundo escenario se produce cuando los pacientes llegan a estos centros directamente también mediante los servicios de emergencia (SEMM) extrahospitalarios, en cuyo caso las barreras a identificar y, por lo tanto, las posibles medidas a tomar afectan igualmente a la parte extrahospitalaria del circuito. Bradley et al21 realizaron en Estados Unidos un estudio para identificar qué estrategias implementadas por los distintos hospitales con IPC se asociaban a un tiempo PB más corto. Esos autores contabilizaron hasta un total de 28 estrategias distintas utilizadas con la intención de reducir el tiempo PB en 365 hospitales receptores directos de pacientes para ser tratados con ACPP (sin traslados interhospitalarios). Solamente las siguientes seis estrategias mostraron ser efectivas: la activación del equipo de ACPP por parte del médico de urgencias (sin la necesidad de contactar con el cardiólogo); la activación directa del equipo de ACPP por parte del mismo médico de urgencias tras recibir aviso y ECG transmitido por los paramédicos del SEMM mientras el paciente está de camino al hospital; la aplicación de un teléfono único para alertar al equipo; la llegada de éste tras el aviso en un tiempo < 30min; la presencia de un cardiólogo en el hospital y el feedback de los datos entre todos los participantes en el proceso. El estudio demostró que los hospitales que aplicaban hasta cuatro de alguna de estas seis estrategias tenían un tiempo PB 30min más corto que los hospitales que no aplicaban ninguna (mediana, 79 frente a 110min, respectivamente).
Otras estrategias, como la aplicación de protocolos de actuación, la creación de equipos multidisciplinarios guiados por un coordinador y el registro de datos, asimismo, son herramientas útiles que permiten evaluar el sistema e identificar los errores21–23. A raíz de estos estudios, el American College of Cardiology, en colaboración con otras entidades, ha impulsado desde 2006 un programa de mejora de calidad llamado D2B (Door to Baloon Alliance), abierto a otros países, que proporciona herramientas para facilitar la aplicación de estas seis estrategias en todos los hospitales que realizan ACPP en pacientes con IAMCEST no transferidos, con el objetivo de conseguir un tiempo puerta-balón ≤ 90min en al menos el 75% de los casos24. Asimismo, la American Heart Association ha impulsado el programa Mision Lifeline, en que publica una serie de recomendaciones aplicables en los distintos escenarios para extender el tratamiento con ACPP y facilitar su aplicación on time25.
Algunas de las medidas propuestas fácilmente pueden ser aplicables en nuestro país y otras no tanto, dadas las disparidades existentes entre los sistemas de salud estadounidense y español. Las diferencias más significativas las encontramos en la organización del sistema del SEMM, que en España depende de entidades públicas desligadas de los hospitales y con funcionamiento autónomo. Ésta es la principal fuente de dificultades en general y también en nuestro país. En la tabla 1 proponemos algunas intervenciones cuya aplicación debería ser factible en nuestro medio. De todas ellas, las más costosas de implementar son la coordinación entre los servicios (por razones administrativas y por el elevado número de personas implicadas), la creación de un registro continuo y fiable de los tiempos empleados en cada etapa del circuito desde la llegada al centro hasta el inflado del balón y el traslado directo del paciente por el SEMM a la sala de hemodinámica sin pasar por el área de urgencias, dado el importante ahorro de tiempo que supone26, aunque haya que asumir un cierto número de falsos positivos (probablemente bajo si ha existido formación en este sentido). En nuestras circunstancias, la forma más inmediata y fácil de disponer de un teléfono de llamada único para recibir aviso de llegada del paciente y, a su vez, movilizar al equipo de ACPP es habilitar un teléfono móvil para el cardiólogo de guardia, cuyo número debe ser conocido por todos los estamentos implicados en el circuito.
Angioplastia primaria, estrategias para reducir el tiempo puerta-balón
| Coordinación: servicios de emergencias extrahospitalarios/urgencias/ unidad coronaria |
| Disponibilidad de ECG prehospitalario |
| Programas de mejora interna de calidad (IQIP): registro de tiempos |
| Protocolos y algoritmos sencillos: checklist para pacientes con dolor y ascenso del ST |
| Circuitos intrahospitalarios rápidos: fast-track al laboratorio de hemodinámica |
| Fácil localización del cardiólogo «aceptador» que avisa al equipo de hemodinámica |
| Formación del personal en diagnóstico rápido de IAMCEST y de conocimiento del circuito |
El tercer escenario se produce cuando los pacientes acuden o son trasladados por los SEMM a hospitales sin IPC más o menos alejados de los centros de IPC operativos las 24h de los 7 días de la semana todo el año (24/7). Este escenario supone el máximo reto para que la ACPP sea asequible para la mayoría de la población que vive apartada de los grandes núcleos urbanos donde suelen estar ubicados los centros de IPC 24/7. El tratamiento con ACPP en este caso implica el posterior traslado de los pacientes con el consiguiente retraso con respecto a la posible administración de la fibrinolisis, sea por el médico del SEMM o el del hospital sin IPC (tiempo PB más largo que en caso de ser asistido directamente en un hospital con IPC). La ACPP podría carecer de beneficio o incluso ser perjudicial con respecto a la fibrinolisis cuando este retraso supera los 90–120min siguientes al PCM. Este escenario es el más frecuente en la mayoría de los países, incluido el nuestro, y es también el que despierta mayores reticencias para considerar la ACPP como terapia de reperfusión de primera elección, por lo que conviene revisar la evidencia existente en este sentido.
El estudio PRAGUE-227 comparó ambas estrategias asignadas de forma aleatoria a 850 pacientes con IAMCEST de menos de 12h de evolución. Los pacientes recibían tratamiento fibrinolítico con estreptoquinasa in situ en 42 hospitales sin IPC o bien ACPP tras traslado interhospitalario hasta uno de los 7 centros con IPC distribuidos por todo el país. Las distancias oscilaron en 5–120km y el traslado se realizó con una media de 48min. Un criterio importante de inclusión fue conocer antes de la aleatorización que el traslado podía iniciarse en menos de 30min. Aunque no se apreció ninguna diferencia de mortalidad a 30 días (end point primario) entre ambas estrategias en los pacientes aleatorizados en las primeras 3h de evolución (10 fibrinolisis; 6,8% ACPP; p = 0,12); el estudio finalizó de forma precoz debido a un exceso de mortalidad en el brazo de tratamiento con fibrinolisis en los pacientes que consultaron pasadas las primeras 3h desde el inicio del dolor (el 15,3 frente al 6%; p < 0,02). En conjunto, sí hubo beneficio a favor de la ACPP en el objetivo secundario de muerte/reinfarto/AVC (el 15,2% para los tratados con fibrinolisis y el 8,4% para los transferidos; p < 0,003).
El estudio DANAMI-228 se realizó en 1.572 pacientes con IAMCEST con los mismos criterios de inclusión que el PRAGUE-2. Se aleatorizó a los pacientes a ACPP o fibrinolisis con alteplasa tanto si acudían a uno de los 5 hospitales con IPC o a uno de los 24 sin IPC (en este caso el tratamiento con ACPP incluía el traslado hasta el centro de IPC). El end point primario fue la combinación de reinfarto, ictus o muerte a los 30 días que en el grupo de pacientes atendidos en hospitales sin IPC fue del 14,2% en los tratados con fibrinolisis in situ frente al 8,5% en aquellos trasladados para ACPP (p = 0,002). Las distancias interhospitalarias fueron de 3 a 150km (mediana, 50km), con un tiempo de retraso hasta la salida del primer centro sin IPC de 50min y un tiempo de transporte de 32min. Cabe destacar que el 50% de los pacientes incluidos en el estudio estaban en las primeras 2h de evolución. El beneficio de la ACPP se produjo casi de forma exclusiva por una reducción del 75% en el riesgo relativo de reinfarto, sin que hubiera diferencias significativas en la mortalidad ni en la tasa de ictus. Ambos estudios han demostrado el beneficio de la ACPP sobre la fibrinolisis, a pesar de los retardos inherentes al traslado del paciente, aunque hay que resaltar que esto fue posible porque fueron capaces de conseguir tiempos PB muy reducidos (PRAGUE-2, 94min; DANAMI-2 < 120min).
Asimismo, un metaanálisis29 que incluyó los 5 principales estudios que han comparado el tratamiento fibrinolítico on site con la ACPP que requiere traslado interhospitalario, concluyó que el tratamiento con ACPP conlleva una reducción significativa de la mortalidad (el 6,8 frente al 9,6%; riesgo relativo = 0,65; intervalo de confianza del 95%, 0,51-0,92; p = 0,001). También hubo una reducción de otros eventos mayores (reinfarto o accidente cerebrovascular), de forma que, tratando a 14 pacientes con ACPP, se evita un evento mayor con respecto a la fibrinolisis on site29. No obstante, en la vida real el traslado interhospitalario suele ser más prolongado, como muestra el National Registry of Myocardial Infarction30, en el que la mediana de tiempo PB en los pacientes transferidos en Estados Unidos es de 180min y sólo en un 4% de estos pacientes se consiguen tiempos PB ≤ 90min, en gran parte debido a que las distancias entre los centros suelen ser mucho más largas en Estados Unidos que en Europa.
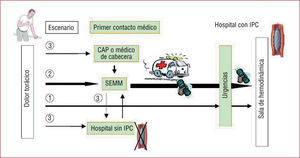
Es posible, por lo tanto, generalizar la práctica de ACPP como tratamiento de primera elección, aunque para ello es preciso una reorganización interna de los centros con IPC y una excelente coordinación de los diferentes servicios implicados (urgencias de los diferentes centros, cardiología, unidades de IPC, SEMM). Evitar el paso previo por el centro sin IPC en los casos asistidos inicialmente por los SEMM reduciría el número actual de traslados interhospitalarios que habitualmente convierten una distancia corta en kilómetros y tiempo en el equivalente real de otra mucho mayor. El traslado por el SEMM directamente a la sala de hemodinámica del hospital con IPC de referencia, sin detenerse antes en el hospital sin IPC más cercano, acorta hasta 80min el intervalo PCM-balón26. Un resumen de las estrategias utilizables en los distintos escenarios se expone en la figura 1.
1 cuando el paciente acude directamente al hospital con IPC. 2 cuando es trasladado directamente por los servicios de emergencias (SEMM) y 3 cuando el paciente acude a un centro sin intervencionismo coronario percutáneo (IPC) o es trasladado allí por los servicios de emergencias y luego debe ser transferido a un centro con IPC. La flecha gruesa indica el circuito preferente que elude el centro sin IPC y transporta directamente al paciente a la sala de hemodinámica con alerta previa en ruta.
Según los datos citados previamente, en los últimos años se han desarrollado nuevas estrategias en la atención de los pacientes con IAMCEST que se han traducido en la creación de diversos sistemas o programas de carácter nacional, regional o local que han permitido acceder a este tratamiento a un mayor número de pacientes. Su implementación depende, en gran medida, del modelo sanitario en que se enmarcan, que condiciona mayor o menor facilidad tanto para la coordinación de los diferentes agentes implicados como para disponer de los recursos imprescindibles para ello. A continuación revisaremos algunos de los programas o redes de ACPP y los resultados conseguidos.
Programas de angioplastia primaria en EuropaEn Europa es donde más se ha extendido la implantación de programas o redes nacionales de ACPP debido a que las circunstancias son más favorables (proximidad entre centros, disponibilidad de ambulancias medicalizadas, existencia de sistemas de salud públicos). La principal diferencia entre programa y red estriba en el ámbito territorial de aplicación y el grado de reconocimiento por parte de las autoridades sanitarias, así como su implicación en la implantación.
Países como Dinamarca y la República Checa han aprovechado la infraestructura creada para realizar los estudios DANAMI-2 y PRAGUE-2 para constituir sus respectivos programas nacionales de atención al IAMCEST que incluye la realización de ACPP en prácticamente todos los casos. En Chequia, la instalación de alguna unidad más de hemodinámica, cuya ubicación geográfica se ha establecido en función del análisis de las iocronas del PRAGUE-2, hace que hoy en día todos los checos se encuentren a menos de 100km de un centro con IPC 24/7. La implantación de los respectivos programas nacionales de ACPP convierte a ambos países en modelos de referencia para la creación de programas nacionales de ACPP. En España algunas comunidades autónomas cuentan desde hace algún tiempo con programas de ACPP que más adelante comentaremos.
Existen redes regionales, como la de Emilia-Romagna, en Italia, con distancias centro sin IPCcentro IPC de 12–57km, que permiten conseguir un tiempo PB de 112 (86–147) min para los pacientes con traslado interhospitalario y 71 (46–104) min para aquellos tratados con ACPP on site, sin diferencia de mortalidad hospitalaria ni al año entre ambos grupos de tratamiento31. También hay redes en España, aunque la mayoría sin reconocimiento institucional específico.
Programas de angioplastia primaria en Estados Unidos y CanadáEn Estados Unidos, donde las distancias interhospitalarias son grandes y no existe un sistema único de atención sanitaria, se han creado diferentes programas de ámbito regional con la intención de optimizar el tratamiento de reperfusión para pacientes alejados del centro de IPC teniendo en cuenta el tiempo de evolución del IAMCEST, la distancia hasta el centro de IPC y las posibilidades de traslado en un tiempo razonable32–34. Como veremos, todos los programas locales o comunitarios encaminados a la realización de ACPP, tanto in situ como antes del traslado interhospitalario, han adoptado alguna o varias de las recomendaciones antes mencionadas. Asimismo, en función de las iocronas y el tiempo previsto para que el servicio encargado del transporte interhospitalario emplee en el traslado, se administra tratamiento fibrinolítico en los casos en que presumiblemente no se alcanzará el tiempo puerta-balón idóneo.
El Mayo Clinic STEMI protocol32 se inició en Minnesota en 2004 para extender el tratamiento con ACPP a los pacientes que acudían a 28 hospitales sin IPC que se encuentran dentro del área de influencia del St. Marys Hospital (Rochester), que dispone de IPC 24/7. La distancia máxima hasta el St. Marys es de 150 millas, con un tiempo calculado de traslado < 90 (mediana, 57) min. El programa incluyó a 597 pacientes y fue consensuado previamente por todos los centros. Los pacientes atendidos en los centros sin IPC recibían tenecteplasa si llevaban menos de 3h de evolución, y luego se los transfería al St. Marys para angioplastia de rescate o coronariografía en las 24–48h siguientes. A aquellos con más de 3h directamente se los transfería para ACPP. El protocolo implantado en el propio St. Marys incluía la realización e interpretación del ECG por un médico de urgencias en menos de 10min desde la llegada al hospital; la activación del equipo de ACPP con llamada única sin supervisión por parte del cardiólogo; laboratorio de hemodinámica operativo en menos de 30min y recogida de datos con distribución a la plantilla de todos los centros participantes 24–48h más tarde. En los casos transferidos se realizaba una única llamada entre el primer médico asistente y el cardiólogo del St. Marys que, a su vez, activaba el sistema de transporte y el equipo de ACPP. Un centro operativo elegía el sistema más rápido de transporte (terrestre o aéreo) y en todos los casos se eludió el paso por el servicio de urgencias del Hospital St. Marys. La mediana de tiempo PB de los pacientes tratados en St. Marys se redujo de 90 a 71min después de implantar el protocolo. Asimismo, la tasa de pacientes tratados con tiempo ≤ 90min pasó del 50 al 75%. Sin embargo, sólo un 12% de los transferidos para ACPP tuvieron tiempos PB por debajo de 90 (mediana, 116) min. Se trató con ACTP de rescate al 36,6% de los pacientes que recibieron fibrinolisis.
El Stat Heart Program33 se inició en enero de 2005 y fue diseñado para acercar la ACPP a la población rural. Incluyó 6 hospitales comarcales sin capacidad de IPC situados a 28–88 millas de distancia de los 2 hospitales de referencia con capacidad de IPC situados en Springfield (Illinois). Se transfería siempre para ACPP a los pacientes con riesgo hemorrágico alto, así como a aquellos con riesgo bajo si el tiempo previsto de llegada del transporte al centro emisor (ambulancia terrestre o helicóptero) era inferior a 20min. Si se preveía una demora mayor se administraba fibrinolisis, y luego se los trasladaba al centro de IPC. El médico del hospital emisor realizaba una sola llamada a una operadora central que alertaba al cardiólogo, la unidad coronaria, el equipo de ACPP y la unidad de admisión de pacientes. El equipo de ACPP estaba disponible 20min después de ser activado y se trasladaba al paciente directamente a la sala de hemodinámica. El programa incluyó a 230 pacientes y se realizó ACPP en el 88% de los casos. El 65% de los traslados se realizaron con transporte aéreo. La mediana de tiempo puerta del hospital emisor-balón fue de 117min (percentil 75, 136min) con un 12% de los pacientes tratados en 90min o menos y un 58%, en 120min o menos. Dos tercios del tiempo transcurrido entre la llegada y la salida del paciente desde el hospital emisor (mediana, 46min) corresponden a la espera del transporte y «carga» del paciente.
El MHI program34 se inició en Minneapolis en 2003 con el Minneapolis Heart Institute como hospital con IPC referente de 30 hospitales comunitarios localizados en Minnesota y Wisconsin. Durante la primera fase, el programa abarcó los hospitales con distancias inferiores a 60 millas con respecto al centro de IPC (zona 1). En una segunda fase, se añadió al protocolo la angioplastia facilitada con mitad de dosis de tenecteplasa para los hospitales alejados entre 60 y 210 millas (zona 2). Como en el Stat Heart Program, si el tiempo de traslado previsto era excesivo, se administraba tratamiento con tenecteplasa y posteriormente se transfería al paciente. En total, se incluyó a 1.345 pacientes, de los que se transfirió a 1.048 desde centros sin IPC. Se realizó un entrenamiento previo al personal implicado que, además, disponían de checklist, indicaciones para el traslado y formato detallado del protocolo de tratamiento. El médico de urgencias del hospital emisor era quien activaba el sistema mediante una sola llamada telefónica. Se trasladaba (vía terrestre o aérea) a los pacientes directamente a la sala de hemodinámica. Se creó una base de datos compartida entre los hospitales y se estableció un plan de mejora en cada centro. La mediana de tiempo PB para los pacientes de la zona 1 fue de 95 (percentil 75, 116) min y para los de la zona 2, de 120 (percentil 75, 145) min. El 79% de los pacientes de la zona 1 y el 49% de la zona 2 obtuvieron tiempos puerta-balón < 120min.
El Citywide Ottawa Protocol35 se implantó en mayo de 2005 en el área metropolitana de Ottawa, cuyas autoridades sanitarias modificaron el circuito asistencial establecido hasta entonces con el objetivo de adoptar la ACPP como tratamiento de elección en los pacientes con IAMCEST. El proyecto requirió la elaboración de nuevos protocolos para todos los centros, para los médicos que fueran el PCM y, sobre todo, para las ambulancias. El centro sin IPC más alejado estaba a 17 millas y el resto a 7 millas o menos del único hospital con IPC. El PCM (del centro sin IPC) avisaba a la ambulancia para el traslado y los paramédicos de la propia ambulancia alertaban en ruta de su llegada al centro de IPC que movilizaba al equipo de ACPP. El PCM (hospital sin IPC) administraba tenecteplasa si la ambulancia para el transporte no llegaba 15min después de su llamada (el 2% de los casos).
Simultáneamente se comparó si había diferencias en tiempo PB entre los pacientes transferidos directamente al hospital con IPC por paramédicos del SEMM especialmente entrenados en la lectura del ECG y que avisaban en ruta de su llegada y aquellos que se llevaban primero a los otros centros de emergencia sin IPC y que luego precisaban de un traslado interhospitalario. El 93,6% de los 344 pacientes asistidos recibieron ACPP. El tiempo puerta (centro IPC)-balón fue < 90min en el 79,7% y ≤ 120min en el 95,9% de los pacientes trasladados directamente por los paramédicos, mientras que en aquellos que tuvieron un traslado interhospitalario (paciente o SEMM-centro sin IPC-centro IPC) estas cifras fueron del 11,9 y el 44,9% (medianas PB, 69 frente a 123min; p < 0,001). El tiempo inicio de síntomas-balón también fue menor en los pacientes directamente trasladados por los SEMM al centro de IPC (medianas, 158 frente a 230min; p < 0,001), con un ahorro de 30min en el tiempo ECGllegada al centro IPC. Un 40% de los pacientes fueron trasladados directamente al centro de IPC y tratados con ACPP en el tiempo adecuado. Antes del cambio de modelo asistencial, probablemente se hubiera tratado a estos pacientes con fibrinolisis o con una ACPP tardía. La mortalidad hospitalaria fue del 5 frente al 10% en los 2 años previos a la implantación del protocolo.
Programas de angioplastia primaria en EspañaEn España, los dos programas de ACPP más conocidos son el APRIMUR36 en la Comunidad Autónoma de Murcia, que fue pionero en nuestro país, y el PROGALIAM en la Comunidad Autónoma de Galicia. Existen otros de los que no disponemos de datos.
APRIMUR36 se inició en abril de 2000 en la Comunidad de Murcia, que tiene 1.115.068 habitantes. En la capital, ubicada en el centro de la región, se encuentran el único hospital con IPC 24/7 y otros 2 centros. La comunicación terrestre con los otros 6 centros regionales se realiza en un tiempo ≤ 1h. La implantación del programa se inició en fases progresivas. Primero se asentó en el Hospital Virgen de la Arrixaca (IPC) y en una segunda y una tercera fase se implantó en los otros 2 centros de la capital. La cuarta fase debería abarcar al resto de los hospitales de la comunidad.
Se creó un registro prospectivo de todos los pacientes con IAMCEST remitidos al laboratorio de hemodinámica donde se recogen las características clínicas basales, los datos del procedimiento, la evolución hospitalaria y los acontecimientos durante el primer año. Se realizaron acuerdos con las unidades de intensivos de los centros, así como con la gerencia del Servicio 061. El médico de urgencias alerta al equipo de ACCP en horario laboral o al cardiólogo de guardia durante el resto del día que, a su vez, activa al equipo de angioplastia. Los pacientes retornan al hospital de origen tras el procedimiento si la situación clínica lo permite. En 20 meses se realizaron 355 ACPP (el 87% entre los 3 hospitales de la ciudad de Murcia). Se trató con ACPP al 92% de los pacientes del centro con IPC, así como al 85% de los pacientes del Hospital Morales Meseguer, situado a 10km del primero. Los retrasos desde la activación del equipo de ACPP hasta el inicio del procedimiento fueron de 25min de mediana para el centro de IPC y de 35 y 45min para los otros 2 hospitales sin IPC. El 45% de los pacientes atendidos directamente en el Hospital Virgen de la Arrixaca tuvieron la arteria abierta en menos de 1h desde su llegada al centro37. El mayor retraso se debió al tiempo empleado en hacer el diagnóstico y llamar al equipo ACPP (20min) que tardó 19min (mediana) en llegar al centro en horario no laboral. Sólo se tardó 12min más en realizar la ACPP a los pacientes del Hospital Morales Meseguer38.
En Galicia, el Programa Gallego de Atención al Infarto Agudo de Miocardio (PROGALIAM) se ha desarrollado mediante el consenso entre las unidades de cardiología intervencionista, los servicios de cardiología, los responsables del transporte sanitario urgente y el Servicio Gallego de Salud (SERGAS). Todo esto ha propiciado una red en la que participan los diferentes profesionales implicados en el manejo del IAM, que parte de la idea de que el mejor tratamiento que hay en la actualidad para esta enfermedad es la angioplastia primaria. Desde el SERGAS y las unidades de cardiología se busca con este programa disminuir la mortalidad y la morbilidad, mejorar la expectativa de calidad de vida del paciente con infarto y promover la equidad en el acceso a las prestaciones del sistema sanitario para disminuir la variabilidad en el uso de recursos y tecnologías diagnósticas y terapéuticas.
Para esto, hay que explicar la distribución poblacional y de los medios en esta comunidad autónoma; la población total es de 2.728.772 habitantes, que se distribuyen de forma heterogénea entre la franja de la costa y el interior; la primera es la que acapara la mayor parte de la población y la que dispone de mayor número de centros hospitalarios. Los medios se distribuyen, en cuanto a tratamiento intervencionista, en 3 hospitales terciarios con dos salas cada uno y con personal localizado las 24h durante todo el año; en cuanto a transporte urgente, éste se realiza a través de la Fundación Pública Urgencias Sanitarias de Galicia-061, que dispone de 10 unidades de soporte vital avanzado, operativas las 24h. Las bases están situadas en A Coruña (A Coruña y área norte), Santiago de Compostela, Ferrol, Lugo, Ourense, Pontevedra, Vigo, Mos (área sur) y Sanxenxo (en la época estival). Cada una de las UVI móviles tiene un radio de acción centrado en el casco urbano y en los municipios colindantes comprendido en una isocronía de 20min. Se dispone, además, de dos aeronaves con base en Santiago de Compostela y Ourense, dependientes de SOS Galicia, medicalizadas por personal sanitario del 061. En caso de necesidad, se puede disponer de otros dos helicópteros medicalizables pertenecientes a la Consellería de Pesca, con bases en Celeiro y Vigo. Todos ellos son aeronaves de asistencia y transporte sanitario capaces de prestar soporte vital avanzado in situ en los lugares donde se produce la urgencia, sobre todo en zonas rurales de difícil acceso. Su equipamiento incluye el mismo material sanitario que las ambulancias medicalizadas. Además, se cuenta con 99 ambulancias asistenciales distribuidas por todo el territorio, equipadas con desfibriladores semiautomáticos y, en cuanto a personal, con un técnico sanitario. Todos estos medios de transporte están coordinados desde una central única en Santiago de Compostela.
Con estos medios se han diseñado unas líneas de tiempo y traslado hasta los centros intervencionistas de manera que desde el primer contacto sanitario se puede garantizar, teóricamente, al 90% de la población de Galicia con IAMCEST, que puede estar en menos de 90min en los hopitales donde se les realizará la ICP primaria y sólo un 5,2% de la población (la franja más interior) está a más de 120min. El protocolo de actuación es variable en función del tipo de asistencia, si la atención es extrahospitalaria, el 061 es el que, en función del tiempo de traslado a la sala de hemodinámica y la duración de los síntomas del IAM, decide si realiza fibrinolisis o no y se pone en contacto directamente con el cardiólogo intervencionista para solicitar la ICP. En la urgencia hospitalaria la decisión es del cardiólogo o intensivista y éste es quien se pone en contacto con el hemodinamista y, luego, con el transporte sanitario.
Muy importante dentro de este esquema de funcionamiento es el sistema de retornos; al distribuirse toda la actividad intervencionista en 3 centros, la sobrecarga asistencial en cuanto a la disponibilidad de camas ha propiciado que se traslade a los pacientes con estabilidad clínica y hemodinámica a su hospital de referencia, si éste dispone de unidad de vigilancia intensiva, tras finalizar el procedimiento.
Durante 2007 se trató en los centros intervencionistas gallegos a 964 pacientes con IAMCEST, de los que 877 fueron ICP primarias; no hay datos del número total de pacientes con IAMCEST en Galicia en ese año, pero el hecho de que esta comunidad sea la segunda en ICP, con 322 por millón de habitantes, hace pensar que el programa tiene una aplicación adecuada.
Uno de los objetivos de este programa es el control y la explotación de los datos para localizar los puntos débiles y mejorar el sistema. Todavía no se ha cumplido con este punto y sólo hay comunicaciones de los resultados de cada centro intervencionista que, al tener unas áreas de distribución poblacional diferentes, es complicado su análisis, pero sí se sabe que los mejores tiempos puerta-balón están en los centros intervencionistas que reciben directamente al paciente, y el siguiente mejor tiempo es el de los pacientes que recoge el 061 inicialmente, lo que fortalece la idea de que, a menor número de intermediarios, mejores resultados.
Redes locales en EspañaDesde que en 1994 se publicaron los datos de los primeros 33 pacientes tratados mediante angioplastia primaria39, se han creado diferentes redes locales, fundamentalmente, gracias al voluntarismo de los agentes participantes y con poco soporte institucional en la mayoría de los casos. En general, funcionan razonablemente bien en cuanto afecta a la operatividad de los centros, pero el rendimiento es escaso en cuanto a la rapidez en la movilización de recursos por parte de los SEMM, lo que castiga especialmente los traslados interhospitalarios incluso para distancias muy cortas. Revisaremos aquellas con datos publicados, como la red local del Hospital Puerta de Hierro de Madrid40, o de las que tenemos constancia personal, como nuestra propia experiencia.
El Hospital Puerta de Hierro de Madrid tiene una población de referencia de 635.495 habitantes, en general, concentrada en núcleos urbanos cercanos y bien conectados por vía terrestre. Recogen todos los datos clínicos y angiográficos en una base de datos. Hay un protocolo escrito y un grupo de trabajo multidisciplinario que realiza reuniones mensuales en las que se discuten los resultados obtenidos con el fin de reducir el tiempo PB a 60min o menos. El SEMM preavisa al cardiólogo de guardia que alerta al equipo de ACPP que, a su llegada, avisa al servicio de urgencias para que el paciente pase directamente a la sala. El 84,7% de IAMCEST se trató con IPC (361 ACPP y 28 de rescate en 34 meses) con una mediana de tiempo puerta-guía de 79 (53–104) min, que fue 30 (60–90) min menor cuando los SEMM dieron la alerta previa. La reducción del tiempo fue especialmente relevante en los casos atendidos fuera del horario laboral. Aunque no se menciona el tiempo PCM-balón, presumiblemente éste fuera largo en los casos trasladados, dado que la mediana de tiempo inicio dolorguía fue de 235 (percentiles 25–75, 170–335) min.
El Hospital Universitari Germans Trias i Pujol es el centro de referencia con IPC 24/7 de la región sanitaria del Barcelonés Norte y Maresme (Cataluña). Abarca una población de 770.000 habitantes, principalmente distribuida en 4 núcleos urbanos, que son Badalona, Santa Coloma de Gramenet, Mataró y Calella, que disponen de hospital comarcal y se encuentran excelentemente comunicados con nuestro centro por autopista a una distancia de 2, 7, 20 y 45km, respectivamente. La situación del hospital y la distribución de la población más cercana a los centros sin IPC nos convierte obligatoriamente en un centro receptor de ACPP previo traslado interhospitalario. Hay una base de SEMM con ambulancia dotada con personal de enfermería en Badalona y otras medicalizadas en Calella, Mataró y nuestro centro (equipada con miembros de la plantilla de la Unidad de Cuidados Intensivos del propio hospital).
En el año 2000 se realizó la primera ACPP y en febrero de 2007 nos convertimos en centro de IPC 24/7 dadas las demandas poblacionales que tenían que ser solventadas en centros de Barcelona con el consiguiente retraso. La experiencia 2000–2007 sirvió para identificar las principales barreras, que eran la tardanza en el diagnóstico y las dificultades logísticas en los traslados interhospitalarios, por lo que implementamos diversas medidas de mejora. Se realizaron reuniones con los servicios de urgencias de todos los hospitales y los médicos del SEMM de nuestro centro donde se presentó el protocolo de ACPP 24/7. En dichas reuniones, además de sesiones de formación en el diagnóstico del IAMCEST, se difundió la logística a emplear. Se mejoró la base de datos de ACPP existente que utiliza un checklist (fig. 2) en el que los médicos (PCM y cardiólogo intervencionista) que atienden al paciente recogen los intervalos de tiempo y los datos clínicos más relevantes. Dicha base (disponible en la web de la sección de hemodinámica de la SEC) está configurada de forma que permite el análisis inmediato de los datos y es de libre acceso.
Se asignó un teléfono móvil al cardiólogo de guardia cuyo número se difundió en las áreas de urgencias de todos los centros y al personal del SEMM de nuestro hospital. Se precisa una única llamada para solicitar ACPP al cardiólogo de guardia que, sin más, activa al equipo ACPP y garantiza cama libre en la unidad coronaria gracias al drenaje preferente de los enfermos a camas de hospitalización convencional o semicríticos. Se estableció un acuerdo para el retorno de los pacientes no complicados al Hospital de Mataró, que es el único que dispone de unidad de cuidados intensivos. Los pacientes son trasladados directamente a la sala de hemodinámica en caso de proceder de otro centro, y siempre que son atendidos por el SEMM de nuestro hospital. No hay ningún criterio de exclusión para aceptar un paciente candidato a ACPP.
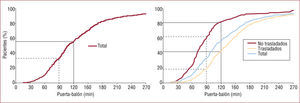
Desde febrero de 2007 hasta abril de 2009 se han realizado 445 ACPP; se trató con ACPP al 92% de los pacientes de nuestro centro que tenían criterios de tratamiento de reperfusión. La mortalidad hospitalaria ha sido del 4,7% y hemos tenido un 5% de falsos positivos. La figura 3 muestra los intervalos de tiempo recogidos para todos los pacientes, y se diferencian también los trasladados de los propios. Puede observarse que el tiempo invertido entre el inicio del procedimiento y la dilatación de la arteria es de 20min, el mismo tiempo que el equipo ACPP tarda en acudir cuando es alertado fuera del horario laboral. Las medianas de tiempo PB son aceptables para el conjunto de pacientes y para los que acuden directamente a nuestro centro (107 y 80min, respectivamente), pero mejorables en los trasladados (131min). Lo mismo sucede con el porcentaje de pacientes con un tiempo PB ≤ 90 y 120min (fig. 4). Hay una diferencia de 56min (p < 0,0001) en el tiempo PB que penaliza a los trasladados y que mayoritariamente corresponde al tiempo de traslado que es el más inaceptable dadas las cortas distancias a recorrer. Nuestros datos muestran que los mejores tiempos PB se consiguen con los pacientes asistidos por el SEMM y trasladados directamente a la sala de hemodinámica.
En Cataluña, el programa CODI IAM, incluido dentro del Plan de Enfermedades Cardiovasculares dependiente de la Dirección General de Planificación Sanitaria de la Consejería de Sanidad, establece prioridades de tratamiento y traslado hospitalario para los pacientes con IAMCEST. La Sociedad Catalana de Cardiología ha impulsado, dentro de dicho plan, la inmediata puesta en marcha, inicialmente en el área metropolitana de Barcelona, de un proyecto coordinado por CatSalut para conseguir que la ACPP sea el tratamiento de elección en estos pacientes. Este proyecto incluye la sectorización de los hospitales con IPC 24/7, la coordinación con los centros de su sector, la implantación de una norma de retorno obligado de los pacientes a su hospital local, la modificación de la normativa interna de funcionamiento por parte del SEMM para facilitar la logística de los traslados y la creación de un registro de pacientes con IAMCEST con especial atención a los casos subsidiarios de tratamiento de reperfusión.
CONCLUSIONESActualmente, la mediana de tiempo PB en muchos centros es superior a los 90–120min recomendados, especialmente en los pacientes que precisan traslado interhospitalario. En los centros de IPC, la identificación de las barreras que alargan este intervalo de tiempo y la consiguiente aplicación de las medidas correctoras permitiría alcanzar, sin gran dificultad, el objetivo propuesto de tratar con ACPP al menos al 75% de los pacientes. El sistema de llamada única para la activación del equipo ACPP por parte del médico de urgencias o del SEMM en ruta hacia el centro y el traslado directo del paciente a la sala de hemodinámica sin el paso previo por centros sin IPC, probablemente, son las medidas que más tiempo ahorran. Favorecer la equidad y disminuir la variabilidad en el tratamiento de los pacientes son una obligación para los sistemas públicos de salud, por lo que éstos deben implementar programas u organizar redes preferentes de atención para que la ACPP pueda ser extensible a la mayoría de los pacientes que no se ubican en las inmediaciones del centro de IPC. La coordinación entre centros, así como la mayor eficacia de los SEMM para establecer tiempos más cortos y fiables de traslado interhospitalario, es esencial para conseguir que la ACPP también sea el tratamiento de primera elección para los pacientes que acuden inicialmente a su centro más cercano que carece de IPC.