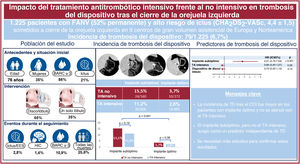
El tratamiento antitrombótico (TA) óptimo tras el cierre de la orejuela izquierda (COI) es objeto de debate. Se evaluó el impacto de los TA intensivo y no intensivo en la incidencia de trombosis relacionada con el dispositivo (TD) según el implante fuera óptimo o subóptimo.
MétodosEl estudio incluyó a pacientes que se sometieron a un COI exitoso en 9 centros. Se clasificó a los pacientes según el implante del dispositivo fuera óptimo (implante proximal sin fuga peridispositivo ≥3mm) o subóptimo (implante distal y/o fuga ≥3mm) y el TA, intensivo (doble antiagregación plaquetaria, anticoagulación o una combinación de ambas) o no intensivo (sin TA o antiagregación plaquetaria simple) tras el implante. El objetivo primario fue la incidencia de TD entre las semanas 6 y 12 tras el procedimiento.
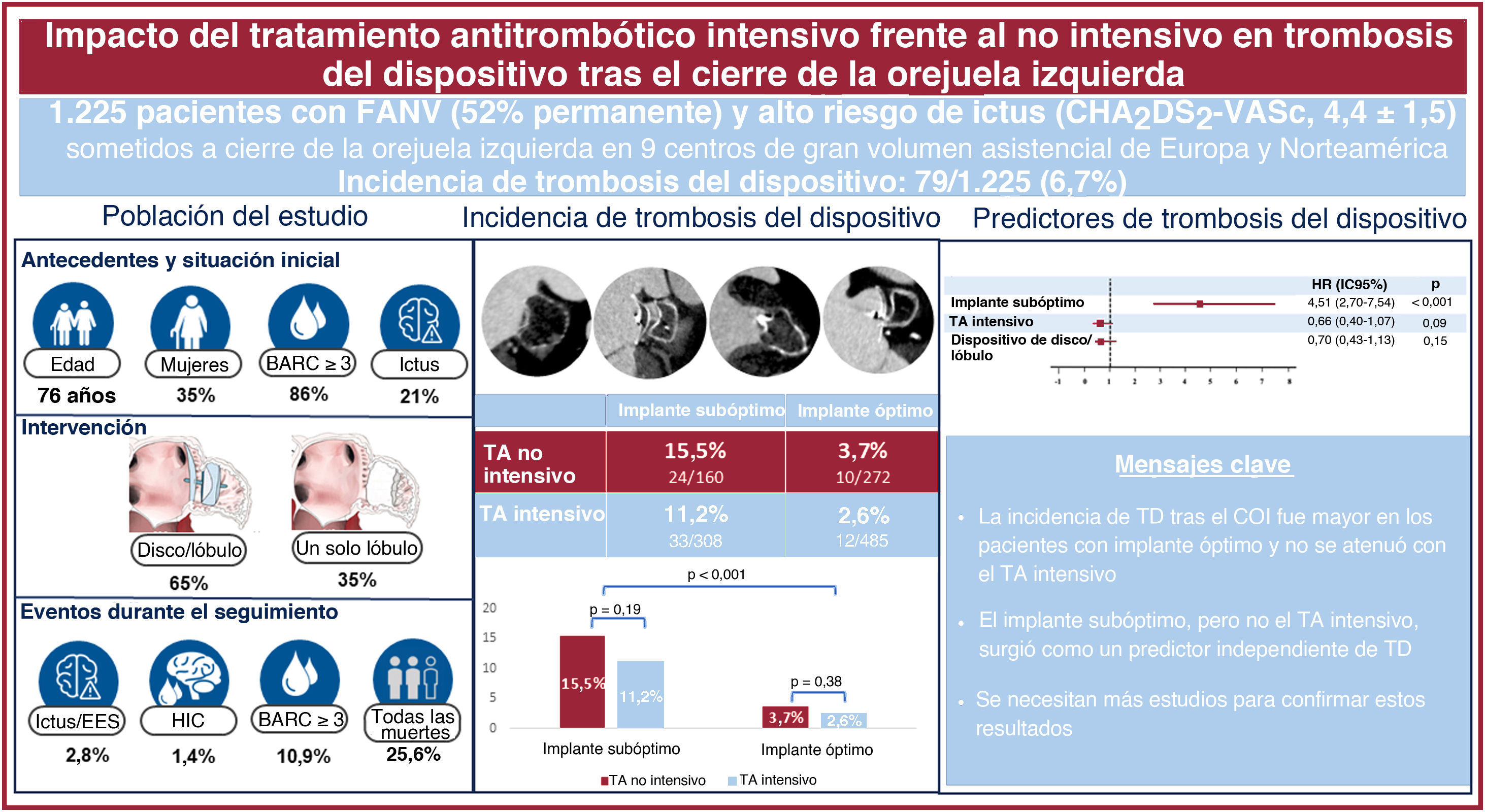
ResultadosUn total de 1.225 pacientes se sometieron a COI. Se lograron implantes óptimo y subóptimo del dispositivo en 757 (61,8%) y 468 (38,2%) de ellos. Tras un seguimiento de 20 meses, los pacientes con implante óptimo y TA intensivo o no intensivo presentaron una incidencia de TD del 2,6 y el 3,7% (p=0,38). En aquellos con un implante subóptimo, la incidencia de TD aumentó al 11,2% con TA intensivo y el 15,5% con TA no intensivo (p=0,19). En el análisis multivariable, el implante subóptimo (HR=4,51; IC95%, 2,70-7,54; p <0,001), pero no el TA intensivo (HR=0,66; IC95%, 0,40-1,07; p=0,09), se identificó como un predictor independiente de TD.
ConclusionesLa incidencia de TD tras el COI fue mayor en pacientes con implante subóptimo del dispositivo. En el grupo de implante óptimo, la incidencia de TD fue baja y similar entre TA no intensivo y TA intensivo. Se requieren ensayos clínicos grandes y aleatorizados para confirmar estos resultados.
Palabras clave
Cada vez más pruebas respaldan el cierre de la orejuela izquierda (COI) de pacientes con fibrilación auricular no valvular seleccionados1,2. La adopción de la intervención se ha propagado a un ritmo notable, lo que refleja la acuciante necesidad no cubierta de una estrategia eficaz de prevención del ictus en pacientes para quienes la anticoagulación oral (ACO) a largo plazo es inadmisible3. Las recientes mejoras de la planificación y la técnica de la intervención han optimizado la intervención de COI y han reducido las complicaciones4,5. La trombosis del dispositivo (TD) es una de las principales preocupaciones restantes relacionadas con el COI, ya que se ha vinculado con cifras más altas de ictus y eventos isquémicos6,7. El tratamiento antitrombótico (TA) tras el implante tiene como objetivo atenuar el riesgo de TD durante el proceso de cierre de la superficie auricular del dispositivo8,9. El tipo y la intensidad del TA después del COI se han propuesto arbitrariamente como un régimen temporal de ACO de entre 6 y 12 semanas10 o doble antiagregación plaquetaria durante 12 semanas seguida de antiagregación plaquetaria simple durante 1 año11. Sin embargo, la hemorragia no quirúrgica asociada con el TA intensivo, sobre todo la doble antiagregación plaquetaria, tras el cierre de la orejuela izquierda (COI) no es infrecuente y se ha relacionado con un mayor riesgo de mortalidad12, lo que podría reducir el beneficio de la intervención. Más recientemente, se han publicado protocolos menos intensivos con antiagregación plaquetaria simple o incluso sin TA para pacientes seleccionados con hemorragias de alto riesgo intervenidos mediante COI, con una incidencia de eventos adversos isquémicos aceptable13,14.
Recientemente se ha demostrado que la profundidad del implante del dispositivo de COI es un factor independiente del riesgo de TD15. Las grandes áreas proximales no cubiertas y la cresta pulmonar (CP) no cubierta observadas con un implante profundo se han considerado equivalentes a una nueva orejuela, lo que aumenta el riesgo de TD tras el implante. Además, la fuga peridispositivo (FPD) puede provocar turbulencias en el flujo sanguíneo adyacente al dispositivo y sangre estancada en una neocavidad residual, que es un reconocido factor predisponente a la TD16. Por consiguiente, un implante de dispositivo óptimo por lo que respecta a reducir el riesgo de TD tras la intervención podría ser uno con un implante proximal y sin FPD importante. En cambio, un implante de dispositivo subóptimo puede derivar de una colocación más profunda del dispositivo o la existencia de FPD considerable15. Aunque varios estudios han destacado el impacto negativo de los implantes distales y FPD significativa, ninguno ha evaluado estos factores en combinación. Además, el papel del TA intensivo después de los implantes de COI óptimos o subóptimos continúa siendo confuso. Por lo tanto, el objetivo del presente estudio es evaluar la incidencia de TD en pacientes que recibieron TA intensivo o no intensivo tras el implante de un dispositivo de COI óptimo o subóptimo.
MÉTODOSCohorte del estudioLa cohorte del estudio ya está descrita en detalle15. En resumen, las características basales, las características de las intervenciones, el TA tras el implante y los resultados de los pacientes sometidos con éxito a COI en 9 centros de Europa y Norteamérica se recopilaron en una base de datos específica. La selección del dispositivo, el tipo de imágenes antes y después de la intervención y el TA posterior a esta se dejaron a criterio del cirujano. Las intervenciones de COI se realizaron de conformidad con las recomendaciones actuales de los expertos17. El seguimiento (imágenes) del objetivo principal (TD) se llevó a cabo en el 96,7% de los pacientes. No se excluyó a los pacientes sin seguimiento por imágenes cardiacas para evaluar la cifra de eventos adversos en función del tipo de implante (óptimo frente a subóptimo) y TA (intensivo frente a no intensivo). El estudio se realizó conforme al comité de ética de cada centro participante y todos los pacientes dieron el consentimiento informado por escrito para la intervención. El estudio se ajustó a los principios rectores de la Declaración de Helsinki.
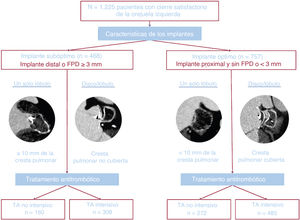
En el presente estudio, primero se clasificó a los pacientes en 2 grupos (implante óptimo y subóptimo) según el resultado de la intervención. Se definió implante óptimo como un implante proximal en ausencia de FPD importante (≥3mm). Los implantes proximales se definieron como cobertura de CP por dispositivos de disco/lóbulo y profundidad <10mm de dispositivos de un solo lóbulo. En cambio, se definió implante subóptimo como un implante distal (sin cobertura de CP por dispositivos de disco/lóbulo y profundidad del implante ≥10mm de dispositivos de 1 solo lóbulo) o FPD importante (>3mm). Estas definiciones se basaron en estudios previos que asocian estos valores de corte con una mayor incidencia de TD y se han detallado en otra parte15,16,18–22. Se formó a todos los centros para que clasificaran a los pacientes según la cobertura de la CP y las mediciones de la FPD, y obtuvieran todas las mediciones descritas anteriormente. En caso de duda, los pacientes se reclasificaban tras el consenso alcanzado por 2 médicos expertos. También se clasificó a los pacientes en 2 grupos según la naturaleza del TA (intensivo o no intensivo) tras el implante. Esta clasificación se ciñe al consenso actual de COI17,23, que recomienda TA intensivo con antiagregación plaquetaria doble o ACO (antagonistas de la vitamina K, ACO de acción directa o heparina de bajo peso molecular) después de OOI. El TA intensivo se definió como cualquier otro TA después de la intervención que incluyera antiagregación plaquetaria doble o cualquier ACO (antagonistas de la vitamina K, ACO de acción directa o heparina de bajo peso molecular). El TA no intensivo se definió como antiagregación plaquetaria simple o la ausencia de cualquier TA (ya sea un antiagregante plaquetario o ACO) tras el implante del dispositivo. La incidencia de TD y los resultados clínicos se describen en 4 grupos de pacientes: con implante óptimo o subóptimo y con TA intensivo o no intensivo.
Objetivos y resultadosLas definiciones de los datos y resultados del estudio se han descrito previamente de manera pormenorizada8. La primera prueba de seguimiento por imágenes (ecocardiografía transesofágica [ETE] o tomografía computarizada [TC], a criterio de cada centro) se realizó entre la 6.a y la 12.a semana tras la intervención. La TD se diagnosticó en ETE o TC y se definió como un trombo adherido al lado de la aurícula izquierda del dispositivo, independientemente de sus consecuencias clínicas7. También se publicaron eventos adversos de la intervención, eventos adversos mayores (como muerte, ictus, embolia sistémica y hemorragia mayor) y FPD, según el documento del Consenso de Múnich18. Dado que el riesgo hemorrágico estimado variaba según los pacientes, el TA después del COI se decidió según el riesgo individualizado de cada paciente, valorado por el médico responsable. Los eventos hemorrágicos mayores se definieron como de tipo 3 o superior según la escala del Bleeding Academic Research Consortium (BARC)19.
El resultado principal del estudio fue la aparición de TD. Los objetivos del estudio incluyeron: a) comparación de las cifras de TD en función del implante del dispositivo, definido como óptimo o subóptimo, y b) comparación de las cifras de TD según la naturaleza del TA tras el implante en los 2 grupos. Los análisis adicionales incluyeron resultados clínicos entre los grupos de implante de dispositivo óptimo o subóptimo y TA posoperatorio intensivo o no intensivo.
Análisis estadísticosLas variables cualitativas se expresan en frecuencias (porcentajes) y las diferencias se evaluaron mediante la prueba de la χ2 (o la prueba de Fisher cuando fue necesario). Las variables continuas se expresan en media ± desviación estándar o mediana [intervalo intercuartílico]. Se aplicó la prueba de Kolmogorov-Smirnov para comprobar la normalidad de la distribución. Las variables continuas se compararon mediante la prueba de la t de Student o la prueba de la U de Mann-Whitney, según correspondiera. Los predictores de TD se determinaron con un análisis de regresión de Cox con un enfoque de selección de variables preespecificado según la teoría. Se obtuvieron hazard ratios (HR) con sus intervalos de confianza del 95% (IC95%). Las variables preespecificadas con valores de p <0,10 en el análisis univariante se incluyeron en el modelo multivariante. Entre las variables preespecificadas se encontraban edad, sexo femenino, ictus isquémico previo, fibrilación auricular permanente, insuficiencia renal crónica, implante subóptimo, FPD, derrame pericárdico iatrogénico, TA intensivo, dispositivo de disco/lóbulo y puntuación CHADS-VASc ≥37,24. Se construyeron curvas de supervivencia con todos los datos de seguimiento disponibles de las variables de tiempo hasta el evento utilizando el método de Kaplan-Meier. En todos los análisis se utilizó un valor bilateral de p <0,05 como criterio de significación estadística. Se consideró que el seguimiento finalizaba la fecha del último seguimiento. Los análisis se realizaron con el software STATA (V 14.0, StataCorp LP, Estados Unidos).
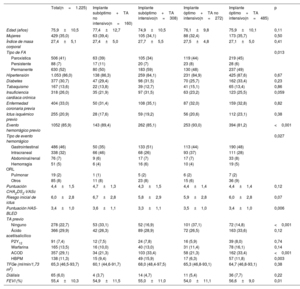
RESULTADOSEn el estudio se incluyó a 1.225 pacientes (el 35,0% mujeres) sometidos con éxito a cierre percutáneo de la orejuela izquierda (tabla 1 y figura 1). Entre ellos, el resultado de la intervención fue óptimo en 757 pacientes (61,8%) y subóptimo en 468 (38,2%) (figura 2). El TA en la población del estudio se describe en la . Las características basales de los 2 grupos se resumen en la . La proporción de pacientes con fibrilación auricular no valvular permanente fue menor en el grupo de implante óptimo (el 48 frente al 56%; p=0,01). Las características basales y clínicas de los 2 grupos en función del TA posterior al implante se resumen en la tabla 1. Los pacientes con TA no intensivo tenían antecedentes de hemorragia grave más frecuentes en los grupos de implante óptimo (el 93,0 frente al 81,2% de aquellos con TA intensivo) y subóptimo (el 89,4 frente al 85,1%). En relación con los pacientes con TA intensivo, la proporción de pacientes sin TA intensivo fue mayor entre quienes ya habían tenían un evento de hemorragia intracraneal y menor entre aquellos con un evento de hemorragia gastrointestinal previo (p=0,027).
Características demográficas y clínicas basales según el implante óptimo o subóptimo y la intensidad del tratamiento antitrombótico después del implante del dispositivo
| Total(n=1.225) | Implante subóptimo+TA no intensivo(n=160) | Implante subóptimo+TA intensivo(n=308) | Implante óptimo+TA no intensivo(n=272) | Implante óptimo+TA intensivo(n=485) | p | |
|---|---|---|---|---|---|---|
| Edad (años) | 75,9±10,5 | 77,4±12,7 | 74,9±10,5 | 76,1±9,8 | 75,9±10,1 | 0,11 |
| Mujeres | 429 (35,0) | 63 (39,4) | 105 (34,1) | 88 (32,4) | 173 (35,7) | 0,50 |
| Índice de masa corporal | 27,4±5,1 | 27,4±5,0 | 27,7±5,5 | 27,5±4,8 | 27,1±5,0 | 0,41 |
| Tipo de FA | 0,013 | |||||
| Paroxística | 506 (41) | 63 (39) | 105 (34) | 119 (44) | 219 (45) | |
| Persistente | 88 (7) | 17 (11) | 20 (7) | 23 (8) | 28 (6) | |
| Permanente | 630 (52) | 80 (50) | 183 (59) | 130 (48) | 237 (49) | |
| Hipertensión | 1.053 (86,0) | 138 (86,3) | 259 (84,1) | 231 (84,9) | 425 (87,6) | 0,67 |
| Diabetes | 377 (30,7) | 47 (29,4) | 98 (31,5) | 70 (25,7) | 162 (33,4) | 0,23 |
| Tabaquismo | 167 (13,6) | 22 (13,8) | 39 (12,7) | 41 (15,1) | 65 (13,4) | 0,86 |
| Insuficiencia cardiaca crónica | 318 (26,0) | 35 (21,9) | 97 (31,5) | 63 (23,2) | 123 (25,5) | 0,059 |
| Enfermedad coronaria previa | 404 (33,0) | 50 (31,4) | 108 (35,1) | 87 (32,0) | 159 (32,8) | 0,82 |
| Ictus isquémico previo | 255 (20,9) | 28 (17,6) | 59 (19,2) | 56 (20,6) | 112 (23,1) | 0,38 |
| Evento hemorrágico previo | 1052 (85,9) | 143 (89,4) | 262 (85,1) | 253 (93,0) | 394 (81,2) | <0,001 |
| Tipo de evento hemorrágico | 0,027 | |||||
| Gastrointestinal | 486 (46) | 50 (35) | 133 (51) | 113 (44) | 190 (48) | |
| Intracraneal | 338 (32) | 66 (46) | 68 (26) | 93 (37) | 111 (28) | |
| Abdominal/renal | 76 (7) | 9 (6) | 17 (7) | 17 (7) | 33 (8) | |
| Hemorragia ORL | 51 (5) | 6 (4) | 16 (6) | 10 (4) | 19 (5) | |
| Pulmonar | 19 (2) | 1 (1) | 5 (2) | 6 (2) | 7 (2) | |
| Otros | 85 (8) | 11 (8) | 23 (8) | 15 (6) | 36 (9) | |
| Puntuación CHA2DS2-VASc | 4,4±1,5 | 4,7±1,3 | 4,3±1,5 | 4,4±1,4 | 4,4±1,4 | 0,12 |
| Riesgo inicial de ictus | 6,0±2,8 | 6,7±2,8 | 5,8±2,9 | 5,9±2,8 | 6,0±2,8 | 0,07 |
| Puntuación HAS-BLED | 3,4±1,0 | 3,6±1,1 | 3,3±1,1 | 3,5±1,0 | 3,4±1,0 | 0,006 |
| TA previo | ||||||
| Ninguno | 278 (22,7) | 53 (33,1) | 52 (16,9) | 101 (37,1) | 72 (14,8) | <0,001 |
| Ácido acetilsalicílico | 366 (29,9) | 42 (26,3) | 89 (28,9) | 72 (26,5) | 163 (33,6) | 0,12 |
| P2Y12 | 91 (7,4) | 12 (7,5) | 24 (7,8) | 16 (5,9) | 39 (8,0) | 0,74 |
| Warfarina | 165 (13,5) | 16 (10,0) | 40 (13,0) | 31 (11,4) | 78 (16,1) | 0,14 |
| ACOD | 357 (29,1) | 34 (21,3) | 103 (33,4) | 58 (21,3) | 162 (33,4) | <0,001 |
| HBPM | 138 (11,3) | 15 (9,4) | 49 (15,9) | 17 (6,3) | 57 (11,8) | 0,003 |
| TFGe (ml/min/1,73 m2) | 65,3 (46,5-93,7) | 60,1 (44,6-91,7) | 68,0 (48,4-97,5) | 65,3 (46,8-93,1) | 64,7 (46,8-93,1) | 0,38 |
| Diálisis | 65 (6,0) | 4 (3,7) | 14 (4,7) | 11 (5,4) | 36 (7,7) | 0,22 |
| FEVI (%) | 55,4±10,3 | 54,9±11,5 | 55,0±11,0 | 54,0±11,1 | 56,6±9,0 | 0,01 |
ACOD: anticoagulantes orales de acción directa; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; HBPM: heparina de bajo peso molecular; ORL: otorrinolaringológica; puntuación CHADS-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 años, edad de 65 a 74 años, diabetes mellitus, ictus/accidente isquémico transitorio/tromboembolia, vasculopatía, sexo femenino; TA: tratamiento antitrombótico; TFGe: tasa de filtrado glomerular estimada.
Los valores expresan n (%) o media±desviación estándar.
Figura central. Aparición y predictores de trombosis del dispositivo después del cierre de la orejuela izquierda en pacientes con un implante subóptimo u óptimo que reciben TA no intensivo o intensivo. Panel izquierdo: principales características basales y de las intervenciones, y resultados de la población del estudio. Panel central: aparición de trombosis del dispositivo en pacientes con un implante óptimo o subóptimo y TA intensivo o no intensivo. Panel derecho: predictores de trombosis del dispositivo en la población del estudio. Análisis preliminar en pacientes con implante óptimo, que no muestra el impacto de la intensidad del TA o el tipo de dispositivo. BARC: Bleeding Academic Research Consortium; COI: cierre de la orejuela izquierda; EES: eventos embólicos sistémicos; HIC: hemorragia intracraneal; TA: tratamiento antitrombótico; TD: trombosis del dispositivo.
Esquema del estudio. Se estratificó a 1.225 pacientes con COI satisfactorio por características del implante en el grupo de implante subóptimo del dispositivo de COI (implante distal o fuga peridispositivo moderada o importante) o grupo de implante óptimo del dispositivo de COI (implante proximal o fuga peridispositivo menos que moderada) y tratamiento antitrombótico no intensivo (ácido acetilsalicílico o nada) o intensivo (distinto del ya mencionado) en el momento del alta. COI: cierre de la orejuela izquierda; FPD: fuga peridispositivo; TA: tratamiento antitrombótico.
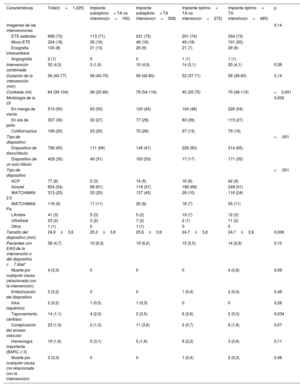
La tabla 2 muestra las características de las intervenciones en los 4 grupos predefinidos. En relación con los dispositivos de un solo lóbulo, los dispositivos de disco/lóbulo se asociaron más a menudo con un implante óptimo (el 17 frente al 83%) y TA intensivo o no intensivo (el 35 frente al 65%; p<0,001), lo que se debió principalmente a cifras más altas de implantes profundos de dispositivos de un solo lóbulo. Los resultados de las intervenciones fueron similares entre los grupos, pero se observó una mayor tasa de taponamiento en pacientes con TA no intensivo. La tasa de eventos adversos graves relacionados con la intervención fue del 4,7%. Se observaron 4 muertes relacionadas con la intervención en el grupo de implante óptimo y TA intensivo (frente a ninguna en los otros grupos; p=0,09). Se publicaron 3 embolizaciones del dispositivo en el grupo de implante óptimo (frente a ninguna en el grupo de implante subóptimo; p=0,49). La tasa general de hemorragia importante (BARC ≥3) notificada alcanzó el 1,6%, con un aumento leve, pero no estadístico, en los pacientes de ambos grupos con TA no intensivo.
Características y resultados de las intervenciones
| Características | Total(n=1.225) | Implante subóptimo+ TA no intensivo(n=160) | Implante subóptimo+ TA intensivo(n=308) | Implante óptimo+ TA no intensivo(n=272) | Implante óptimo+ TA intensivo(n=485) | p |
|---|---|---|---|---|---|---|
| Imágenes de las intervenciones | 0,14 | |||||
| ETE estándar | 899 (73) | 113 (71) | 231 (75) | 201 (74) | 354 (73) | |
| Micro-ETE | 224 (18) | 26 (16) | 48 (16) | 49 (18) | 101 (20) | |
| Ecografía intracardiaca | 100 (8) | 21 (13) | 29 (9) | 21 (7) | 29 (6) | |
| Angiografía | 2 (1) | 0 | 0 | 1 (1) | 1 (1) | |
| Intervención combinada | 52 (4,3) | 3 (1,9) | 15 (4,9) | 14 (5,1) | 20 (4,1) | 0,38 |
| Duración de la intervención (min) | 56 (40-77) | 56 (40-75) | 59 (42-80) | 52 (37-71) | 58 (39-80) | 0,14 |
| Contraste (ml) | 64 (39-104) | 36 (20-80) | 78 (54-116) | 40 (20-75) | 70 (48-110) | <0,001 |
| Morfología de la OI | 0,002 | |||||
| En manga de viento | 513 (50) | 63 (53) | 120 (45) | 104 (48) | 226 (54) | |
| En ala de pollo | 307 (30) | 32 (27) | 77 (29) | 83 (39) | 115 (27) | |
| Coliflor/cactus | 199 (20) | 23 (20) | 70 (26) | 27 (13) | 79 (19) | |
| Tipo de dispositivo | <,001 | |||||
| Dispositivo de disco/lóbulo | 796 (65) | 111 (69) | 145 (47) | 226 (83) | 314 (65) | |
| Dispositivo de un solo lóbulo | 429 (35) | 49 (31) | 163 (53) | 17 (17) | 171 (35) | |
| Tipo de dispositivo | <,001 | |||||
| ACP | 77 (8) | 5 (3) | 14 (5) | 16 (6) | 42 (9) | |
| Amulet | 654 (54) | 98 (61) | 118 (37) | 189 (69) | 249 (51) | |
| WATCHMAN 2.5 | 313 (23) | 32 (20) | 137 (45) | 28 (10) | 116 (24) | |
| WATCHMAN Flx | 116 (9) | 17 (11) | 26 (8) | 18 (7) | 55 (11) | |
| LAmbre | 41 (3) | 5 (3) | 5 (2) | 19 (7) | 12 (3) | |
| UltraSeal | 23 (2) | 3 (2) | 7 (2) | 2 (1) | 11 (2) | |
| Otros | 1 (1) | 0 | 1 (1) | 0 | 0 | |
| Tamaño del dispositivo (mm) | 24,9±3,8 | 25,3±3,6 | 25,6±3,9 | 24,7±3,8 | 24,7±3,9 | 0,006 |
| Pacientes con EAG de la intervención o del dispositivo ≤7 días* | 58 (4,7) | 10 (6,3) | 19 (6,2) | 15 (5,5) | 14 (2,9) | 0,10 |
| Muerte por cualquier causa (relacionada con la intervención) | 4 (0,3) | 0 | 0 | 0 | 4 (0,8) | 0,09 |
| Embolización del dispositivo | 3 (0,2) | 0 | 0 | 1 (0,4) | 2 (0,4) | 0,49 |
| Ictus isquémico | 2 (0,2) | 1 (0,5) | 1 (0,3) | 0 | 0 | 0,28 |
| Taponamiento cardiaco | 14 (1,1) | 4 (2,0) | 2 (0,5) | 6 (2,6) | 2 (0,5) | 0,034 |
| Complicación del acceso vascular | 23 (1,9) | 2 (1,3) | 11 (3,6) | 2 (0,7) | 8 (1,6) | 0,07 |
| Hemorragia importante (BARC ≥ 3) | 19 (1,6) | 5 (3,1) | 5 (1,6) | 6 (2,2) | 3 (0,6) | 0,11 |
| Muerte por cualquier causa (no relacionada con la intervención) | 3 (0,3) | 0 | 0 | 1 (0,4) | 2 (0,3) | 0,48 |
BARC: Bleeding Academic Research Consortium; EAG: evento adverso grave; ETE: ecocardiografía transesofágica; OI: orejuela izquierda; TA: tratamiento antitrombótico.
Los valores expresan n (%) o media±desviación estándar.
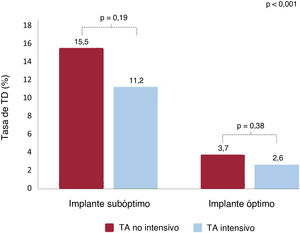
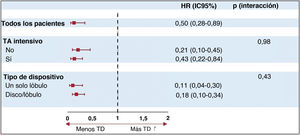
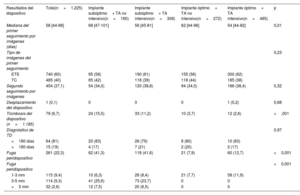
Como se muestra en la tabla 3, se detectó TD en 79 pacientes (6,7%). En general, el 81% de las TD se detectaron antes de 180 días después del COI y el 19%, más de 180 días después de la intervención. Los pacientes con un implante óptimo presentaron una tasa de TD más baja que aquellos con un implante de dispositivo subóptimo (22/757 [2,9%] frente a 57/468 [12,1%]; p<0,001). Además, respecto a los pacientes con TA no intensivo, la aparición de TD disminuyó ligeramente, aunque sin significación, con el TA intensivo en ambos grupos con implantes óptimo (el 2,6 frente al 3,7% en pacientes con TA no intensivo; p=0,38) y subóptimo (el 11,2 frente al 15,5%; p=0,19) (tabla 3, figura 1 y figura 3). Cabe destacar que la incidencia de TD fue mayor en los pacientes con implante de dispositivo subóptimo que en aquellos con implante óptimo, independientemente de la intensidad del TA. Esta asociación fue independiente del tipo de dispositivo implantado ().
Resultados del dispositivo en el seguimiento máximo
| Resultados del dispositivo | Total(n=1.225) | Implante subóptimo+ TA no intensivo(n=160) | Implante subóptimo+ TA intensivo(n=308) | Implante óptimo+ TA no intensivo(n=272) | Implante óptimo+ TA intensivo(n=485) | p |
|---|---|---|---|---|---|---|
| Mediana del primer seguimiento por imágenes (días) | 58 [44-88] | 68 [47-101] | 56 [45-81] | 62 [44-96] | 54 [44-82] | 0,01 |
| Tipo de imágenes del primer seguimiento | 0,23 | |||||
| ETE | 740 (60) | 95 (58) | 190 (61) | 155 (56) | 300 (62) | |
| TC | 485 (40) | 65 (42) | 118 (39) | 118 (44) | 185 (38) | |
| Segundo seguimiento por imágenes | 454 (37,1) | 54 (34,0) | 120 (38,8) | 94 (34,5) | 186 (38,4) | 0,32 |
| Desplazamiento del dispositivo | 1 (0,1) | 0 | 0 | 0 | 1 (0,2) | 0,68 |
| Trombosis del dispositivo (n=1.185) | 79 (6,7) | 24 (15,5) | 33 (11,2) | 10 (3,7) | 12 (2,6) | <,001 |
| Diagnóstico de TD | 0,97 | |||||
| <180 días | 64 (81) | 20 (83) | 26 (79) | 8 (80) | 10 (83) | |
| >180 días | 15 (19) | 4 (17) | 7 (21) | 2 (20) | 2 (17) | |
| Fuga peridispositivo | 261 (22,3) | 62 (41,3) | 118 (41,6) | 21 (7,9) | 60 (12,7) | <0,001 |
| Fuga peridispositivo | <0,001 | |||||
| 1-3 mm | 115 (9,4) | 10 (6,3) | 26 (8,4) | 21 (7,7) | 58 (11,9) | |
| 3-5 mm | 114 (9,3) | 41 (25,6) | 73 (23,7) | 0 | 0 | |
| >5 mm | 32 (2,6) | 12 (7,5) | 20 (6,5) | 0 | 0 |
ETE: ecocardiografía transesofágica; TA: tratamiento antitrombótico; TC: tomografía computarizada; TD: trombosis del dispositivo.
Los valores expresan n (%) o mediana [intervalo intercuartílico].
Tasas de trombosis del dispositivo según las características del implante y el tratamiento antitrombótico en el momento del alta. La proporción de pacientes con TD no fue significativamente diferente con TA intensivo o no intensivo después de un implante de dispositivo subóptimo (el 11,2 frente al 15,5%; p=0,19) u óptimo (el 2,6 frente al 3,7%; p=0,38). TA: tratamiento antitrombótico; TD: trombosis del dispositivo.
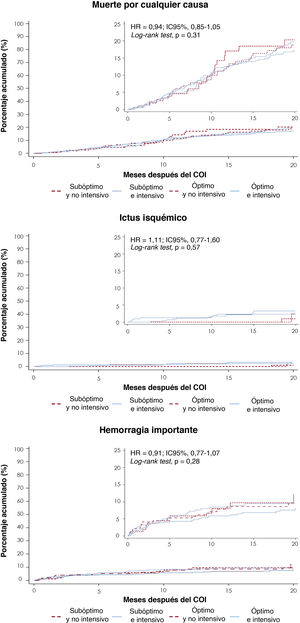
Se observaron 4 ictus a los 3 meses en el grupo de implante subóptimo y TA intensivo (frente a ninguno en los otros grupos; p=0,014). A los 12 meses de seguimiento, los resultados clínicos —como ictus, embolia sistémica, hemorragia importante y mortalidad por cualquier causa— no difirieron entre los grupos (). No hubo diferencias entre los grupos respecto a la incidencia acumulada de muerte por cualquier causa, ictus isquémico y hemorragia importante (figura 4).
Resultados clínicos del seguimiento. Resultados clínicos estratificados por características del implante y TA en el momento del alta. A: muerte por cualquier causa. B: ictus isquémico. C: eventos hemorrágicos importantes. HR: hazard ratio; IC95%: intervalo de confianza del 95%; COI: cierre de la orejuela izquierda; TA: tratamiento antitrombótico.
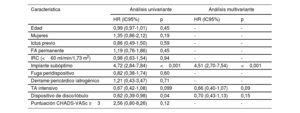
La tabla 4 y la figura 1 muestran los predictores de TD independientes. Después del análisis multivariante, el implante subóptimo se identificó como el único predictor de TD independiente. Es importante destacar que el tipo de dispositivo y el TA intensivo no surgieron como predictores de TD independientes. El implante óptimo se asoció de forma significativa con una TD menor, sin interacción del TA o el tipo de dispositivo, como se muestra en la figura 1 y la figura 5.
Predictores de trombosis del dispositivo
| Característica | Análisis univariante | Análisis multivariante | ||
|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | |
| Edad | 0,99 (0,97-1,01) | 0,45 | - | - |
| Mujeres | 1,35 (0,86-2,12) | 0,19 | - | - |
| Ictus previo | 0,86 (0,49-1,50) | 0,59 | - | - |
| FA permanente | 1,19 (0,76-1,86) | 0,45 | - | - |
| IRC (<60 ml/min/1,73 m2) | 0,98 (0,63-1,54) | 0,94 | - | - |
| Implante subóptimo | 4,72 (2,84-7,84) | <0,001 | 4,51 (2,70-7,54) | <0,001 |
| Fuga peridispositivo | 0,82 (0,38-1,74) | 0,60 | - | - |
| Derrame pericárdico iatrogénico | 1,21 (0,43-3,47) | 0,71 | - | - |
| TA intensivo | 0,67 (0,42-1,08) | 0,099 | 0,66 (0,40-1,07) | 0,09 |
| Dispositivo de disco/lóbulo | 0,62 (0,39-0,98) | 0,04 | 0,70 (0,43-1,13) | 0,15 |
| Puntuación CHADS-VASc ≥3 | 2,56 (0,80-8,26) | 0,12 | - | - |
FA: fibrilación auricular; HR: hazard ratio; IC95%: intervalo de confianza del 95%; IRC: insuficiencia renal crónica; OR: odds ratio; TA: tratamiento antitrombótico.
Variables identificadas tras la regresión logística univariante con p <0,10 se incluyeron en el modelo final de regresión logística multivariante. Los datos del análisis multivariante se expresan en OR con los correspondientes IC95%.
Las principales conclusiones del presente estudio que evalúa el impacto del TA intensivo frente al no intensivo en pacientes con implantes óptimos y subóptimos después de COI percutáneo fueron: a) los implantes subóptimos se asociaron con una mayor incidencia de TD después del COI, que no se atenuó con el TA intensivo; b) en pacientes con implantes óptimos, el TA intensivo podría no ser necesario, ya que la incidencia de TD fue baja y semejante en los grupos de TA intensivo y no intensivo, y c) el implante subóptimo del dispositivo, pero no el TA intensivo, surgió como un predictor de TD independiente.
La TD continúa siendo una de las principales preocupaciones después del COI, ya que se asocia con un aumento importante de los ictus isquémicos y las embolias sistémicas25. Teniendo en cuenta el aumento de la cantidad de intervenciones y de COI en pacientes con menos riesgo, predecir y prevenir la TD es de suma importancia. Los factores del riesgo de TD no son modificables en su mayoría y están relacionados con las características del paciente, como accidente isquémico transitorio previo e ictus, FA permanente, edad avanzada, insuficiencia cardiaca e insuficiencia renal19. A diferencia de estas situaciones, parece que la profundidad del implante del dispositivo es el único factor modificable asociado con tasas variables de TD15,16,18–22.
Aunque la justificación del TA después del COI es prevenir la TD facilitando la endotelización adecuada del dispositivo, la asociación entre el TA y la TD después del COI continúa siendo controvertida. Algunos estudios mostraron una intensa correlación entre el tipo de TA después de la intervención y la incidencia de TD26, mientras que otros no han encontrado una asociación importante7,19,22,27. Estos datos contradictorios se reflejan en la considerable heterogeneidad del TA tras el COI en la práctica actual y son el resultado de que falta evidencia que respalde una intensidad específica del TA tras el COI28.
Con datos de la cohorte más grande hasta la fecha, incluidos los oclusores de disco/lóbulo y de un solo lóbulo, se clasificó a los pacientes según el implante realizado en óptimo (implante proximal y ausencia de FPD significativa) o subóptimo (implante distal o existencia de FPD importante). Según la última evidencia, se seleccionaron diferentes valores de corte para definir los implantes distales: ≥1mm para dispositivos de disco/lóbulo y >10mm para dispositivos de un solo lóbulo15,22,24,27. Además, el valor de corte de una FPD importante se consideró principalmente >5mm, pero datos recientes indican que la FPD de 3-5mm puede estar asociada con una mayor tasa de eventos tromboembólicos después del COI28. Por consiguiente, la FPD >3mm se consideró importante en ambos dispositivos y entró en la definición de implante subóptimo.
Nuestro estudio refuerza la falta de beneficios adicionales del TA intensivo en la prevención de la TD, ya que tanto el TA intensivo como el no intensivo se asociaron con incidencias comparables de TD en pacientes con implantes subóptimos y óptimos. Dicho de otro modo, el presente estudio indica que, en pacientes con un implante óptimo del dispositivo, el tratamiento intensivo tras el COI podría no estar justificado y solo se traduciría en un potencial aumento del riesgo de hemorragia. Además, no parece que la intensidad del TA compensara los efectos nocivos de un implante distal. Esta conclusión es clínicamente relevante, ya que varios estudios ya habían publicado un mayor riesgo de TD después de implantes profundos15,19,22. Por lo tanto, en el momento del alta hospitalaria, los médicos se sintieron tentados a prescribir TA intensivo a pacientes con un implante subóptimo del dispositivo para reducir la aparición de TD.
La aparición de FPD y TD varía considerablemente entre los estudios publicados a causa de la variabilidad de las técnicas de imagen y la falta de imágenes estandarizadas de seguimiento tras el COI. Debido a una mayor resolución espacial, se ha demostrado que la TC es más sensible que la ETE en la detección de FPD24. Sin embargo, si bien la FPD detectada por ETE se ha asociado con eventos adversos, las fugas residuales identificadas por la coronariografía por tomografía computarizada (CTC) son más frecuentes, pero carecen de importancia pronóstica21. Estos hallazgos subrayan la necesidad de más investigación para caracterizar e identificar las FPD de alto riesgo utilizando la CTC.
Respecto a la TD, la ETE y la CTC, todas son idóneas para establecer el diagnóstico, aunque la CTC es más sensible para detectar el engrosamiento hipoatenuado (EHA), un hallazgo de imagen observado comúnmente en todos los dispositivos, percutáneos y quirúrgicos24. Aunque la existencia de TD se ha considerado en gran medida un hallazgo dicotómico en la bibliografía, el EHA ahora se reconoce cada vez más en la TC tras el COI. Que este hallazgo subclínico deba considerarse un precursor de la TD sigue pendiente.
En el presente estudio, el seguimiento inicial por imágenes se llevó a cabo con ETE (60%) o TC (40%), y la TD se definió según los criterios clásicos como un trombo adherido a la superficie de la aurícula izquierda del dispositivo. Esta definición excluye el EHA de bajo grado (grados 0 y 1). El primer estudio de imágenes de seguimiento se realizó entre las semanas 6 y 12 tras la intervención, tras una mediana de 58 [44-88] días, cuando la mayoría de los pacientes todavía recibían el TA prescrito al alta. Por ello, la mayoría de los equipos consideran que una exploración sin TD es requisito para la reducción escalonada del TA. Según lo propuesto por las recomendaciones de expertos17, se realizó un segundo estudio de seguimiento por imágenes del 37% de los pacientes entre los meses 6 y 12 tras la intervención inicial, y hay que destacar que la mayoría (81%) de las TD se diagnosticaron en la exploración inicial. Esto no concuerda con los informes anteriores que muestran una detección equilibrada entre los momentos tempranos y los tardíos.
Por ejemplo, en los ensayos PROTECT-AF y PREVAIL, el 51% de las TD detectadas durante la ETE programada se observaron en la exploración a 1 año, y el 62% de las detectadas en exploraciones no programadas se observaron más de 1 año después10. Curiosamente, en el ensayo AMULET IDE, la mayoría de las TD asociadas con el dispositivo AMULET (61%) ocurrieron en 45 o menos días, mientras que la mayoría de las TD asociadas con el dispositivo WATCHMAN (74%) se identificaron tras más de 45 días29. Esta diferencia ha generado preocupación sobre los posibles mecanismos específicos del dispositivo que subyacen al momento en que se forma la TD, aunque nuestros datos coincidieron respecto a ambos dispositivos. Independientemente de nuestras conclusiones, la naturaleza y la duración del TA óptimo continúan siendo una cuestión abierta y difícil.
LimitacionesLa primera limitación de este estudio es su diseño observacional, que conlleva el riesgo de sesgo inherente de algunas variables analizadas; por lo tanto, nuestros resultados deben considerarse generadores de hipótesis. En especial, la intensidad del TA se dejó a criterio del médico, lo que implica varios sesgos de selección. Por ejemplo, los pacientes considerados en mayor riesgo de hemorragia tenían más probabilidades de recibir TA no intensivo, mientras que a aquellos con un balance de riesgos a favor de los eventos isquémicos probablemente se les recetó un TA más intensivo durante más tiempo. Se necesitan más estudios para confirmar nuestras conclusiones. En segundo lugar, los resultados clínicos y de las imágenes son comunicados por el centro, sin validación independiente ni implicación de un laboratorio centralizado. En tercer lugar, se utilizó ETE y TC para el seguimiento por imágenes, aunque estas 2 técnicas tienen capacidades diferentes para detectar FPD o TD. Además, no existe ninguna definición estandarizada de TD con ETE, y menos aún con TC. En cuarto lugar, aunque se siguió por imágenes a todos los pacientes entre las semanas 6 y 12 después de la intervención, solo al 37% se le repitió la exploración programada. En quinto lugar, aunque los valores de corte seleccionados tienen importancia clínica, son arbitrarios y requieren más exploración y validación externa para su uso en la práctica clínica. En sexto lugar, el estudio no se diseñó para identificar factores asociados con objetivos distintos de la TD (p. ej., ictus isquémico). Por último, en este estudio no participó ningún comité independiente de validación y los datos se basaron en informes clínicos de cada centro.
CONCLUSIONESLa aparición de TD después del COI fue mayor en pacientes con implantes subóptimos y no se vio atenuada con el TA intensivo. En comparación con el TA no intensivo, el TA intensivo no se asoció con una menor incidencia de TD después de un implante óptimo o subóptimo. Los implantes subóptimos, pero no el TA intensivo, surgieron como un predictor de TD independiente. Se necesitan más estudios para confirmar estos resultados.
FINANCIACIÓNEste estudio no recibió financiación.
CONSIDERACIONES ÉTICASEl estudio se realizó de conformidad con el comité de ética institucional de cada centro participante y todos los pacientes dieron el consentimiento informado por escrito para las intervenciones. El estudio se ajustó a los principios rectores de la Declaración de Helsinki. De acuerdo con las directrices de SAGER, la información se desglosó en la tabla 1 sin diferencias entre grupos.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIALLos autores declaran que no han utilizado ningún tipo de inteligencia artificial generativa para la elaboración de este manuscrito.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores contribuyeron de manera importante a la obra presentada. Aportaciones sustanciales a la concepción o el diseño de la obra o a la obtención, el análisis o la interpretación de datos: P. Garot, P. Cepas-Guillén y X. Freixa. Redacción del artículo o revisión crítica en busca de contenido intelectual importante: E. Flores-Umanzor, N. Leduc, V. Bajoras, N. Perrin, A. McInerney, A. Lafond, J. Farjat-Pasos, X. Millán, G. O’Hara, S. Zandjebil, R. Ibrahim, P. Salinas, O. de Backer, J.E. Nielsen-Kudsk, I. Cruz-González, D. Arzamendi, L. Sanchis, L. Nombela-Franco, A. Aminian y J. Rodés-Cabau. Todos los autores aprobaron la versión final que se publicará. Todos los autores aceptan ser responsables de todos los aspectos de la obra y dan fe de la precisión e integridad de esta.
CONFLICTO DE INTERESESP. Garot informa que recibe honorarios como ponente/asesor/proctor de Abbott, Biosensors, Boston Scientific, Edwards Lifesciences, General Electric HealthCare y Terumo. Es director médico y accionista del Cardiovascular European Research Center de Massy, Francia. O. de Backer recibió becas de investigación institucionales y honorarios de asesoría de Abbott y Boston Scientific. R. Ibrahim informa que recibe honorarios como ponente/asesor/proctor de Abbott, Boston Scientific, Edwards Lifesciences y Medtronic. L. Sanchis es proctor de Abbott Medical y es editora asociada de Revista Española de Cardiología. Se ha seguido el procedimiento editorial de la Revista para garantizar un tratamiento imparcial del original. A. Aminian es proctor y asesor de Abbott y Boston Scientific. J.E. Nielsen-Kudsk es proctor y asesor de Abbott y Boston Scientific. X. Freixa es proctor de Abbott y Boston Scientific. Los demás autores informan que no existen potenciales conflictos de intereses en relación con el contenido de este artículo.
- –
En la selección del tratamiento antitrombótico para prevenir la tromboembolia en pacientes con fibrilación auricular después del cierre de la orejuela izquierda (COI), debe tenerse en cuenta varios factores clínicos y operatorios. Después del COI, se prescriben diferentes tratamientos antitrombóticos, como los inhibidores orales de la trombina y el factor Xa de acción directa (anticoagulantes orales de acción directa) o la antiagregación plaquetaria simple o doble, para atenuar el riesgo de TD y los eventos tromboembólicos asociados. Los anticoagulantes orales de acción directa y la doble antiagregación plaquetaria después del COI están aprobados actualmente para uso clínico en Estados Unidos y Europa, pero no existe ninguna estrategia validada, ya que estos tratamientos no se han comparado en un ensayo clínico aleatorizado.
- –
El implante óptimo del dispositivo se asocia con menos riesgo de TD, independientemente de la intensidad del TA o el tipo de dispositivo. El TA intensivo (anticoagulantes orales de acción directa o antiagregación plaquetaria doble) no logra atenuar la aparición de TD después del implante óptimo y subóptimo del dispositivo de COI. Es necesario investigar más para determinar el tratamiento antitrombótico óptimo y su duración después del COI. Es posible que se recomiende el TA no intensivo, dado su impacto clínico, para pacientes con implantes óptimos.