Palabras clave
INTRODUCCIÓN
Se ha demostrado que los stents liberadores de fármaco (SLF) disminuyen la incidencia de reestenosis y la ulterior necesidad de nuevos procedimientos de revascularización en comparación con los stents convencionales (SC)1,2. Por otro lado, los SLF presentan mayor riesgo de trombosis del stent (TS) que los SC, especialmente a partir del primer año (TS muy tardía)3-8.
Sin embargo, parece que la incidencia de TS de los SLF se ha subestimado en los metaanálisis de ensayos clínicos, pues se realizaron en pacientes muy seleccionados. En el mundo real, en el que son frecuentes los pacientes con condiciones médicas complejas (infarto de miocardio, insuficiencia renal, disfunción ventricular) o con lesiones complejas (lesiones bifurcadas, reestenosis, injertos quirúrgicos, vasos pequeños), la incidencia de TS de los SLF en buena lógica debería ser mayor9. Este exceso de riesgo de TS podría limitar los beneficios clínicos de los SLF asociados con la reducción de la reestenosis.
En este contexto, pretendimos comparar el riesgo de TS de los SLF frente a los SC y sus posibles consecuencias clínicas en nuestro medio de práctica clínica habitual, y evaluar específicamente el efecto de la TS muy tardía en la relación riesgo-beneficio tras el implante de un SLF.
MÉTODOS
Diseño del estudio
Realizamos un análisis retrospectivo de la evolución clínica de dos cohortes, compuestas por todos los pacientes consecutivamente tratados con al menos un SLP y con al menos un SC en nuestra Unidad de Hemodinámica en 2003 y 2004. Se descartó a los pacientes que recibieron ambos tipos de dispositivos. Durante ese tiempo, los SLP eran los únicos SLF disponibles en nuestro hospital, así que no incluimos a pacientes tratados con stents liberadores de sirolimus u otros SLF. Ambas cohortes de pacientes se obtuvieron de la base de datos informatizada de nuestro laboratorio. Nuestra Unidad de Hemodinámica dispone de una base de datos en la que se registran las características clínicas de los pacientes sometidos a un estudio hemodinámico.
Los procedimientos de revascularización se realizaron de acuerdo con las guías actuales de práctica clínica sobre intervencionismo coronario percutáneo (ICP)10. La decisión de implantar un SLP fue tomada por el operador principal según las características clínicas individuales de cada paciente. Administramos una dosis de carga de 300 mg de clopidogrel a todos los pacientes que no estaban tomando dicha medicación. Los inhibidores de la glucoproteína IIb/IIIa fueron indicados por el operador principal.
Tras el intervencionismo, se indicó doble antiagregación con aspirina y clopidogrel durante 6 meses a los pacientes tratados con SLP y durante 1 mes a los que recibieron SC, para después continuar en ambos casos con monoterapia con aspirina o clopidogrel indefinidamente. Esto contrasta con la recomendación actual sobre la duración de la terapia dual antiplaquetaria de 12 meses para los SLF y de 1 mes para los SC11. El hospital suministraba los envases necesarios de clopidogrel para garantizar el cumplimiento de la doble antiagregación prescrita al alta.
El objetivo principal del estudio fue la TS. La muerte de causa cardiovascular, infarto de miocardio no fatal, reestenosis clínica y revascularización de lesión tratada fueron objetivos secundarios.
A partir de las historias clínicas y la base de datos informatizada de nuestro hospital, recogimos las características basales de la población. Revisamos la evolución clínica de los pacientes tras el implante para recoger los principales eventos clínicos y examinar su relación con la TS, empleando para ello el contacto telefónico, la historia clínica y la base de datos informatizada de nuestro hospital y la red informática de los hospitales de nuestra comunidad autónoma (programa Ianus), en la que se almacena la información sobre los pacientes obtenida en los diferentes centros de atención primaria y especializada de nuestra red sanitaria.
La TS se definió de acuerdo con los criterios vigentes del Academic Research Consortium12 y consideramos las TS probables y demostradas, tanto precoces como tardías y muy tardías. La trombosis probable incluyó las muertes súbitas de causa no conocida en los 30 días siguientes al ICP y el infarto agudo de miocardio (IAM) en el territorio teórico de un stent previamente implantado sin que pudiera confirmarse la presencia de un trombo. Se consideró trombosis demostrada la oclusión del stent por un trombo confirmada mediante coronariografía o necropsia. La TS se clasificó en precoz (las que ocurrieron en los primeros 30 días tras el implante), tardía (entre los 30 y los 365 días) y muy tardía (más allá del primer año).
El IAM se definió como un valor de troponina cardiaca mayor que el percentil 99 de los valores de referencia y al menos uno de los siguientes: síntomas compatibles con isquemia, ondas Q en el electrocardiograma, cambios electrocardiográficos que indicaran isquemia (alteraciones del ST-T o bloqueo de rama izquierda del haz de His de novo) y evidencia por imagen de pérdida de miocardio viable o de alteración de la contractilidad segmentaria13.
La reestenosis clínica se definió como todo estrechamiento de la luz vascular de un stent (incluidos los 5 mm proximales y los 5 mm distales a dicha endoprótesis) descubierto tras la documentación clínica de isquemia miocárdica. En nuestro centro no se realiza sistemáticamente una coronariografía de control tras el implante de un stent.
Análisis estadístico
Las variables continuas se presentan como media ± desviación estándar; las variables categóricas, como frecuencia absoluta (%). Utilizamos el test de la χ2 o el test exacto de Fisher para evaluar la relación entre dos variables categóricas. Para comparar dos medias empleamos la prueba de la t de Student o la de Mann-Whitney en función de la normalidad de la variable.
La incidencia a largo plazo de los principales objetivos del estudio se estimó mediante el método de Kaplan-Meier. El log-rank test se utilizó para comparar la evolución cronológica de los eventos entre las dos cohortes de pacientes.
Para compensar la naturaleza no aleatorizada del estudio, realizamos un análisis ajustado mediante índice de propensión (propensity score)14, que es la probabilidad condicional de cada individuo de recibir un tratamiento acorde con sus características clínicas. En nuestro caso, para calcular la probabilidad de recibir un SLF para cada paciente, se construyó un modelo de regresión logística en el que el implante de un SLF constituyó la variable dependiente y en el que se utilizaron como variables independientes las características recogidas en la tabla 1: edad, diabetes mellitus, cirugía coronaria previa, función renal, indicación clínica, localización de la lesión, angioplastia primaria, RIS, lesiones bifurcadas y diámetro y longitud del stent. El ajuste del modelo se valoró mediante el estadístico C, que fue de 0,8 (intervalo de confianza [IC] del 95%, 0,76-0,82).
El riesgo ajustado de cado uno de los objetivos del estudio se estimó mediante el método de regresión de Cox, ajustando por el propensity score, al introducirlo como covariable en cada uno de los modelos estimados. Para proporcionar una descripción por separado del riesgo precoz y tardío de eventos clínicos, realizamos un landmark analysis, estableciendo como límite temporal predeterminado 12 meses15.
Para el análisis estadístico empleamos el programa SPSS (Statistical Package for Social Sciences) versión 17.0 para Windows. Se consideró un resultado estadísticamente significativo si p < 0,05.
RESULTADOS
Características basales
Las cohortes en estudio estuvieron compuestas por 1.268 pacientes tratados con SC y 430 pacientes tratados con SLP. El seguimiento fue completo para 1.674 pacientes (422 pacientes en el grupo de SLP y 1.252 pacientes en la cohorte de SC), lo cual supone el 98% del total de pacientes. Sólo 24 pacientes se perdieron para el seguimiento, si bien no presentaron ningún evento clínico dentro de nuestro sistema sanitario y todos figuraban vivos de acuerdo con datos oficiales al finalizar el estudio.
Las características basales de ambas cohortes se comparan en la tabla 1. En comparación con los pacientes que recibieron SC, los tratados con SLP eran más jóvenes y con mayor frecuencia diabéticos. En el grupo de los SLP, el antecedente de una revascularización previa, percutánea o quirúrgica, fue más frecuente. La enfermedad multivaso, la enfermedad de la arteria coronaria descendente anterior y del tronco coronario izquierdo, el tratamiento de una RIS o las lesiones bifurcadas fueron más frecuentes en el grupo de SLP. El diámetro promedio del stent fue sensiblemente menor en los pacientes tratados con SLP y la longitud cubierta por stent fue significativamente mayor. La angioplastia primaria fue más frecuente en la cohorte de SC. Este grupo presentaba además peor función ventricular izquierda que la cohorte de SLP.
Trombosis del stent
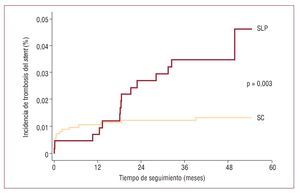
Tras una mediana de seguimiento de 46,1 [intervalo intercuartílico, 13] meses, la incidencia de TS probable o definitiva fue mayor entre los SLP que entre los SC (el 3,5 frente al 1,3%; p = 0,003). No hubo diferencias para la incidencia de TS precoz (el 0,5 frente al 0,8%; p = 0,574) ni tardía (el 0,23 frente al 0,32%; p = 0,769). Sin embargo, la TS muy tardía fue mucho más frecuente en el grupo de SLP que en la cohorte de SC (el 2,8 frente al 0,24%; p < 0,001) (fig. 1; tablas 2 y 3).
Fig. 1. Incidencia de trombosis del stent con los stents liberadores de paclitaxel (SLP) y los stents convencionales (SC).
Tras el ajuste estadístico por el propensity score, los SLP presentaban mayor riesgo de TS que los SC (hazard ratio [HR] = 3; IC del 95%, 1,2-7,1; p = 0,014). No detectamos diferencias en el riesgo ajustado de TS durante el primer año tras el ICP índice (HR = 0,8; IC del 95%, 0,2-3,4; p = 0,767), si bien los SLP se asociaron con un exceso de riesgo de TS muy tardía en comparación con los SC (HR = 12,8; IC del 95%, 3-55,1; p = 0,001) (tabla 4).
Las TS se presentaron como IAM en todos los casos salvo en 2 (2 TS probables que fueron muertes súbitas en los primeros 30 días tras el ICP, un caso en cada grupo).
Muerte cardiovascular
No detectamos diferencias significativas en la mortalidad cardiovascular entre los grupos de SLP y SC en el seguimiento (el 5,3 frente al 7,3%; p = 0,26) durante el primer año de seguimiento (el 2,6 frente al 2,7%; p = 0,868) ni después (el 2,8 frente al 4,6%; p = 0,186) (tabla 3).
Tampoco hubo diferencias significativas en el riesgo de muerte por causa cardiovascular ajustado por el propensity score entre los SC y los SLP (HR = 0,7; IC del 95%, 0,4-1,2; p = 0,195) al año (HR = 1,1; IC del 95%, 0,5-2,4; p = 0,876) ni después (HR = 0,6; IC del 95%, 0,3-1,2; p = 0,122) (tabla 4).
Infarto agudo de miocardio no fatal
La incidencia de IAM fue mayor en el grupo de SLP que en los SC, sin llegar a ser estadísticamente significativa (el 7,4 frente al 4,2%; p = 0,277). Dicho evento fue más frecuente en el grupo de SLP a partir del primer año, aunque sin alcanzar la significación estadística (el 5,6 frente al 1,8%; p = 0,175). En los primeros 12 meses no hubo diferencias entre uno y otro grupo (el 2,4 frente al 1,9%; p = 0,513) (tabla 3).
No encontramos diferencias significativas en el riesgo ajustado de IAM no fatal entre SLP y SC (HR = 0,7; IC del 95%, 0,4-1,3; p = 0,215). Esta ausencia de diferencias se mantuvo en los primeros 12 meses (HR = 0,6; IC del 95%, 0,3-1,3; p = 0,16). Después los SLP se asociaron con un incremento límite del riesgo de IAM frente a los SC (HR = 2,6; IC del 95%, 0,9-7,7; p = 0,089) (tabla 4).
Reestenosis del stent
La RIS fue menos frecuente en los SLP (incidencia acumulada del 2,8% en los SLP y del 5,4% en los SC; p = 0,025). Durante el primer año, hubo una tendencia estadísticamente límite (el 2,1 frente al 4,1%; p = 0,05); después no hubo diferencias entre ambos grupos (el 0,7 frente al 1,3%; p = 0,291) (tabla 3).
Los SLP redujeron el riesgo ajustado de RIS en comparación con los SC (HR = 0,3; IC del 95%, 0,2-0,7; p = 0,001), sobre todo en los primeros 12 meses (HR = 0,32; IC del 95%, 0,2-0,7; p = 0,003), pues esta diferencia no alcanzó la significación estadística después (HR = 0,4; IC del 95%, 0,1-1,6; p = 0,206) (tabla 4).
Revascularización de la lesión tratada
No detectamos diferencias estadísticas en la incidencia de revascularización de la lesión tratada (RLT) entre SLP y SC (el 5,1 frente al 6,5%; p = 0,282). En el primer año, la incidencia de RLT fue menor en los SLP que en los SC (el 2,3 frente al 5%; p = 0,017); a partir de dicho límite, hubo una tendencia estadísticamente borderline hacia una mayor incidencia de RLT en el grupo de los SLP que en el de SC (el 2,8 fente al 1,5%; p = 0,084) (tabla 3).
No hubo diferencias en el riesgo ajustado de RLT entre ambos dispositivos (HR = 0,8; IC del 95%, 0,5-1,3; p = 0,355). Sin embargo, el riesgo de RLT durante el primer año se redujo de forma importante con los SLP respecto a los SC (HR = 0,33; IC del 95%, 0,2-0,7; p = 0,002). Después los SLP presentaron un exceso de RLT en comparación con los SC (HR = 1,8; IC del 95%, 1-3,2; p = 0,05) (tabla 4).
DISCUSIÓN
La trombosis tardía es la principal preocupación actual sobre los SLP16,17. El principal hallazgo de este estudio radica en que un exceso de riesgo de TS de los SLP respecto a los SC, en términos absolutos mayor en un escenario real que en el ámbito experimental, podría limitar los beneficios clínicos derivados de la reducción del riesgo de reestenosis que producen los SLF.
En nuestro estudio, los SLP se han asociado con un exceso de riesgo de TS frente a los SC, a expensas de la TS muy tardía. La incidencia de TS en los SLP en esta serie (3,5%) resulta superior a la comunicada por diferentes metaanálisis3-8. Esto probablemente se deba a la mayor complejidad de los pacientes de nuestra muestra. De hecho, este factor ha sido señalado como un serio inconveniente de los metaanálisis para cuantificar la incidencia de la TS tardía de los SLF9. Si bien otros estudios observacionales han comunicado cifras variables pero sensiblemente inferiores a la que presentamos (en general, < 1%)18,19, dichos registros disponen de periodos de seguimiento cortos (< 2 años). Dado que constantemente ocurren TS tardías de los SLF20,21, la duración de nuestro seguimiento parece explicar la diferencia entre nuestro estudio y los registros previos. Así, la incidencia acumulada a 1 año en el grupo de SLP (0,5%) resulta similar a la publicada por estudios previos. Además, la mayor parte de las TS de los SLP fue muy tardía (12 [80%] de 15 casos); estos eventos no serían contabilizados por estudios con seguimientos más cortos. Por otro lado, la incidencia de TS de los SLP de nuestro registro es compatible con la publicada por otros análisis más recientes22, con periodos de seguimiento similares.
Nuestro estudio apoya la existencia de una relación riesgo-beneficio diferente en el tiempo, de forma precoz y tardía tras el implante de un SLP en comparación con un SC.
El uso de SLP no redujo de forma significativa la necesidad de nuevos procedimientos de revascularización en comparación con los SC. Sin embargo, durante el primer año de seguimiento, los SLP redujeron de forma marcada la necesidad de RLT, al disminuir el riesgo de RIS. En cambio, a partir de entonces, el uso de SLP se asoció con un riesgo de TS 13 veces mayor, exceso que se tradujo en un incremento del riesgo de RLT frente a los SC. De forma similar, no hubo diferencias en la tasa de revascularización del vaso tratado (RVT) a 3 años entre los SLF y los SC en el estudio BASKET LATE (tasa de RVT del 14,7% para los SLF frente a una tasa del 17,5% para los BMS; p = 0,29), hecho que los autores ponen en relación con la TS23. En estudios aleatorizados, los SLF redujeron la necesidad de nuevos procedimientos de revascularización en comparación con los SC1,2. Esos estudios subestiman la incidencia de TS tardía y muy tardía al excluir sistemáticamente a los pacientes complejos; esto puede haber sobrestimado el beneficio de los SLF al minimizar el impacto de la TS tardía. Otros estudios observacionales han mostrado igualmente una disminución de la necesidad de nuevas revascularizaciones de los SLF frente a los SC, pero también tienden a subestimar la magnitud de la TS de los SLF al disponer de seguimientos más cortos24-26.
El papel de la RIS en la ausencia de diferencias estadísticamente significativas para la RLT entre los SLP y los SC merece reflexión. En nuestro estudio, el riesgo de RIS fue marcadamente disminuido por los SLP; en este sentido, existe un gran cuerpo de evidencia en la actualidad. No obstante, llama la atención la baja tasa de RIS tras el implante de un SC (5,8%) y la escasa diferencia, en valor absoluto, en cuanto a la necesidad de RLT entre SC y SLP (1,4%). Ambas tasas resultan inferiores a las comunicadas por otros estudios, si bien en el registro SCAAR se obtuvieron cifras similares15. Al haber empleado un criterio clínico para la definición de RIS, es muy probable que hayamos subestimado su incidencia. Esto podría haber contribuido en parte a que los beneficios de los SLF sean menores en comparación con otros estudios realizados en poblaciones en las que se anticipa un mayor riesgo de reestenosis.
Nuestro estudio no dispone de la potencia estadística para detectar diferencias significativas entre ambos dispositivos en cuanto a la RLT por su modesto tamaño muestral. No obstante, si tenemos en cuenta que la evolución futura de la TS muy tardía no se conoce bien y que a día de hoy no se puede descartar que siga presentándose de forma extraordinariamente tardía (varios años después del implante), se requieren nuevos estudios con seguimientos más largos para valorar su posible impacto clínico y su trascendencia en la comparación clínica entre SC y SLP.
No detectamos diferencias en el riesgo ajustado de IAM no fatal entre SLP y SC. Durante el primer año, los SLP mostraron una tendencia a disminuir el riesgo de IAM frente a los SC, que parece en relación con la reducción de la RIS; a partir de entonces, dicha tendencia se invirtió, de modo que hubo tendencia hacia un incremento del riesgo de IAM para los SLP, estadísticamente límite y claramente relacionada con el exceso de riesgo de TS muy tardía que presentan estos dispositivos.
Este fenómeno de crossover tardío ha sido comunicado con anterioridad por otros autores. En el estudio BASKET LATE23, los SLF no aumentaron el riesgo de muerte o IAM a 3 años en comparación con los SC. Sin embargo, las tasas de muerte e IAM fueron mayores en los SLF que en los SC a partir de los 6 meses, de forma paralela al exceso de TS. En el registro SCAAR15 el riesgo ajustado de IAM a los 6 meses fue igualmente menor en los SLF. A partir de entonces, hubo una tendencia no significativa hacia un incremento del riesgo de IAM con este tipo de stents. En el análisis landmark, las curvas para el IAM se separaban con el tiempo, en especial a partir de los primeros 12 meses. En el estudio de Ontario26, la tasa de IAM a 2 años fue similar en los grupos de SLF y SC. No obstante, dicha tasa fue el 0,4% menor en los SLF que en los SC durante los primeros 6 meses. A partir de los 15 meses, hubo un fenómeno de crossover, de modo que la tasa fue un 0,5% superior en los SLF que en los SC. Los datos del seguimiento para estos dos últimos estudios se obtuvieron de bases de datos administrativas, de modo que no se pudo cuantificar la incidencia de TS y valorar la probable relación entre la TS muy tardía y un exceso de riesgo de eventos tras el primer año con el uso de SLF. Desde nuestra perspectiva, la TS muy tardía de los SLF es una explicación razonable para este fenómeno de crossover tardío, aunque no se puede excluir la existencia de sesgos de selección.
Limitaciones del estudio
Este estudio puede tener diferentes limitaciones. Se trata de un registro unicéntrico de seguimiento de cohortes y puede tener los sesgos inherentes a este tipo de estudios. El seguimiento de los pacientes no ha sido completo. Las pérdidas de seguimiento suelen concentrar un mayor número de eventos, que en caso de ser conocidos podrían modificar los resultados del estudio. Nuestros resultados deben ser interpretados con cautela, pues puede haber variables de confusión que contribuyan a las diferencias existentes tras el ajuste. Dado que sólo incluimos a pacientes con SLP, estos resultados pueden no ser aplicables a otros tipos de SLF. De hecho, el SLP parece entrañar mayor riesgo de TS que otros SLF27. Además, no se controló el cumplimiento de la doble antiagregación durante el seguimiento. Por último, estos hallazgos provienen de la práctica habitual de nuestra Unidad de Hemodinámica y podrían no reproducirse en otras unidades con una política de implante de SLF diferente.
CONCLUSIONES
En nuestro medio de práctica clínica, los SLP se asociaron a un mayor riesgo ajustado de TS que los SC, principalmente debido al exceso de riesgo de TS muy tardía. Nuestros hallazgos indican la existencia de una diferente relación riesgo-beneficio de forma precoz y tardía tras el implante de un SLP. Así, parece que hay un efecto beneficioso inicial, consistente en la reducción de la RIS y la necesidad de nuevas revascularizaciones, que se contrarresta por el exceso de riesgo de TS muy tardía. La TS muy tardía parece limitar los beneficios clínicos de los SLP frente a los SC en cuanto a nuevas revascularizaciones, relacionados con la disminución de la RIS. Los resultados deben ser interpretados con cautela por la naturaleza no aleatorizada del estudio, y es posible que factores de confusión contribuyan a las diferencias existentes tras el ajuste. Se requieren nuevos estudios, pues se desconoce la evolución futura de la TS muy tardía y sus consecuencias clínicas.
ABREVIATURAS
HR: hazard ratio.
IAM: infarto agudo de miocardio.
RIS: reestenosis del stent.
RLT: revascularización de la lesión tratada.
SC: stents convencionales.
SLF: stents liberadores de fármacos.
TS: trombosis del stent.
Full English text available from: www.revespcardiol.org
Correspondencia:
Dr. X. Flores Ríos.
Servicio de Cardiología. Complexo Hospitalario Universitario A Coruña.
As Xubias, s/n. 15006 A Coruña. España.
Correo electrónico: xacobeflores@yahoo.es
Recibido el 13 de septiembre de 2009.
Aceptado para su publicación el 16 de diciembre de 2009.