Palabras clave
INTRODUCCIÓN
En las últimas décadas el cambio en el espectro de etiologías de las lesiones valvulares ha convertido la afección no valvular en la primera causa de insuficiencia aórtica (IAo) en nuestro medio1. Se trata de válvulas con lesiones poco extensas en los velos y dilatación concomitante de aorta ascendente (AA), cuya regurgitación se explica gracias a un mejor conocimiento del papel de la raíz de aorta en la función valvular2. Se ha demostrado que las relaciones geométricas y el comportamiento dinámico de los componentes de la raíz aórtica aseguran la competencia valvular cuando los velos no tienen lesión estructural3. Los senos de Valsalva (SV), la unión sinotubular (UST) y las comisuras son estructuras muy especializadas y un verdadero aparato «supravalvular» aórtico4,5. Por este motivo, cuando en los aneurismas de la AA de larga evolución se producen cambios geométricos que distorsionan las inserciones de los velos, se modifican sus condiciones de apertura y cierre, haciéndolos incompetentes6. Basadas en esto, se han desarrollado técnicas quirúrgicas conservadoras en la cirugía del aneurisma aórtico y se ha despertado interés en la reparación de la IAo, que hoy se ofrece como una alternativa al reemplazo valvular por prótesis7,8. En la IAo, las decisiones sobre cirugía de conservación y/o reparación valvular se toman hasta ahora sobre la base de las lesiones anatómicas encontradas por el cirujano en quirófano, con el corazón parado y la aorta vacía de volumen. Sin embargo, el desarrollo de la ecocardiografía transesofágica intraoperatoria nos permite la visión en tiempo real de la raíz y de la válvula aórtica antes de la toracotomía9. Nuestro objetivo es analizar mediante ecocardiografía transesofágica (ETE) la anatomía funcional de la insuficiencia aórtica in vivo, describiendo lesiones y mecanismos, estudiar la exactitud diagnóstica de la ETE, comparada con la inspección directa del cirujano, y establecer su utilidad para identificar candidatos óptimos a técnicas de cirugía conservadora de válvula aórtica (CCVAo).
MÉTODOS
Población de estudio
Entre enero de 2002 y enero de 2005, se intervino en nuestro centro a 335 pacientes consecutivos con los diagnósticos de valvulopatía aórtica y/o dilatación de AA. Se incluyó en el estudio a 66 que cumplían los siguientes criterios: a) IAo aislada de grado ≥ 2 y con gradiente medio transvalvular aórtico medido por ecocardiografía Doppler < 25 mmHg; b) indicación de cirugía por criterio de severidad de la IAo o de las dimensiones de la aorta proximal; c) exploración quirúrgica con aortotomía y examen directo e independiente de las lesiones por un cirujano, y d) estudio ecocardiográfico transesofágico preoperatorio o intraoperatorio habitual disponible. Se excluyó a los pacientes a quienes se realizó cirugía urgente de IAo o con síndrome aórtico de presentación aguda. No se excluyó a ningún paciente por cuestión de edad, disfunción ventricular izquierda, causa de la IAo crónica o cirugía valvular mitral o coronaria concomitantes.
Anatomía quirúrgica de la insuficiencia aórtica
Las lesiones anatómicas se diagnosticaron de acuerdo con los criterios establecidos previamente para la observación directa y macroscópica10. La descripción de las lesiones y los mecanismos se transcribieron, sin alterar, de los informes redactados por el cirujano o por uno de los autores (PGG) tras información verbal ofrecida por el cirujano cuando realizaba la exploración quirúrgica.
En todos los casos se realizó una inspección sistemática de la raíz de aorta. Se obtuvieron del informe quirúrgico: forma anatómica de dilatación de la AA, número de cúspides, lesiones de los velos (calcificación, fusión comisural y engrosamiento que indicaran afección reumática, fenestraciones lineales y engrosamientos del borde libre de las comisuras, vegetaciones o perforaciones, ausencia de lesión estructural y prolapso), flap o disección y rotura de la pared de la aorta.
El cirujano clasificó el mecanismo de la regurgitación en cuatro grupos: a) funcional, si no hay lesión orgánica ni prolapso pero sí dilatación de los anillos aórticos funcionales (UST y/o anillo), como en los casos de aneurisma de AA o de raíz de aorta (RAo); b) movimiento restrictivo de velos con lesión estructural macroscópica, generalmente extensa; c) perforaciones, y d) prolapso, definido por las diferencias entre las longitudes del borde libre de cada uno de los velos, cuando una o dos de ellas exceden las restantes. El prolapso se subclasificó en absoluto (borde libre del velo por debajo de su inserción en la pared del SV) y relativo (borde libre del velo al mismo nivel que su inserción en la pared del SV, pero por debajo del nivel del borde libre de los restantes velos).
Aunque el cirujano conocía los estudios ecocardiográficos realizados, desconocía que el estudio comparativo se estaba llevando a cabo. La decisión de intentar CCVAo se tomó según las observaciones quirúrgicas y no según los hallazgos de la ecocardiografía. En los restantes casos o cuando el intento de cirugía funcional fracasó, se realizó sustitución valvular aórtica (con o sin sustitución combinada de AA con tubo supracoronario) o sustitución de AA por tubo valvulado con técnica de Bentall, según decisión del cirujano.
Ecocardiografía transesofágica
Se realizó a todos los pacientes una ETE preoperatoria o intraoperatoria con Doppler color. Las ETE se realizaron indistintamente con equipos Acuson Siemens-Sequoia C-256 (Mountain View, California, Estados Unidos), Image Point HX (Philips, Andover, Massachusetts) o EnVisor C (Philips, Andover, Massachusetts), con almacenamiento de imágenes en movimiento y estáticas en formato DICOM y equipados con sondas transesofágicas multiplanares de 5-7 MHz. Todos los estudios fueron registrados en disco magnetoóptico y en formato digital e informados por dos de los autores antes de la entrada del paciente en parada cardiocirculatoria. Cada parámetro fue medido 3 veces y el valor medio es el que se usó para el análisis estadístico.
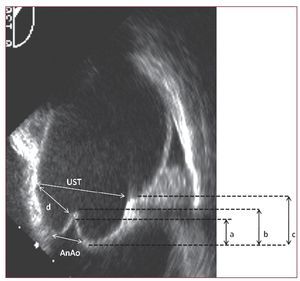
Se obtuvieron imágenes estándar de la válvula aórtica en eje corto desde proyección medioesofágica y de la AA y la válvula aórtica desde la proyección eje largo medioesofágica, rotando el ángulo hasta 120-145°. En ambas, se analizaron el número y la ausencia o presencia de lesión orgánica de las cúspides. Se consideró que había prolapso aórtico en presencia de velos valvulares de borde libre sinuoso o redundante, con apariencia normal en sístole y que en diástole presentaran eversión completa del velo o abombamiento diastólico en el tracto de salida ventricular. Se midieron las dimensiones de anillo, SV, UST y AA y la relación geométrica entre ellos, como el cociente UST: anillo (normal, < 1,2), la altura de los SV (normal, ratio altura/anillo < 1), la altura de tenting y la altura efectiva de los velos (fig. 1).
Fig. 1. Imagen de raíz de aorta desde proyección en eje largo medioesofágica. Identificamos las dimensiones de anillo y unión sinotubular (UST) y la relación geométrica entre ellos: relación UST:anillo, distancia anillo-UST o altura de los senos de Valsalva (c), la altura efectiva de cada velo (b) y la altura de tenting (a).
Análisis estadístico
Las variables cuantitativas se expresaron con media ± desviación típica y las categóricas, como porcentajes de frecuencias. Las comparaciones entre los grupos se realizaron mediante análisis de la varianza para distribuciones normales y Kruskal-Wallis para las no normales en las variables cuantitativas y mediante el test de la χ2 o el exacto de Fisher para las categóricas. Empleando la observación quirúrgica como referencia, se establecieron la sensibilidad, la especificidad, los valores predictivos positivo y negativo y la precisión o exactitud diagnóstica general de la ETE para el diagnóstico de los mecanismos básicos y de las lesiones de las cúspides o la distorsión de la geometría de la raíz y de la AA. Los valores diagnósticos se expresan en porcentajes, con intervalos de confianza (IC) del 95%, y sus valores kappa correspondientes.
Se evaluó la concordancia entre las decisiones sobre reparación o sustitución valvular basadas en la ETE y las basadas en las observaciones quirúrgicas mediante el coeficiente kappa de Cohen.
Retrospectivamente, se analizó la relación de las variables ecocardiográficas mecanismo, dirección del jet y relaciones geométricas (fig. 1) con el éxito de las técnicas de CCVAo y con el procedimiento de sustitución de AA. Se emplearon el test exacto de Fisher para variables categóricas y el test de la U de Mann-Whitney o el test de comparaciones múltiples de Scheffé para las cuantitativas. El análisis multivariable se realizó mediante regresión logística para las variables que alcanzaron un valor de p < 0,05 en el análisis univariable. Se utilizó el programa estadístico SPSS 12.0 para Windows.
RESULTADOS
La dilatación de aorta, asociada o no a enfermedad degenerativa de la válvula, es la primera causa de IAo aislada entre los pacientes enviados a cirugía en nuestro centro, referencia en el área en afecciones aórticas (53%). Hasta en el 40% de los casos de aneurisma arteriosclerótico de AA y en 7 de los 16 casos de anuloectasia aórtica encontramos degeneración fibroelástica de los velos asociada al aneurisma de aorta. Causas menos frecuentes son las lesiones valvulares propiamente dichas: la valvulopatía aórtica congénita (21,2%), la endocarditis infecciosa (4%) y la enfermedad reumática (4,5%). Sólo en 2 pacientes la etiología se consideró no aclarada (3%).
Observaciones quirúrgicas
Las observaciones quirúrgicas permitieron caracterizar a 35 pacientes, que agrupamos bajo el epígrafe de IAo de causa no valvular. Se caracterizan por IAo sin aparente lesión estructural macroscópica de los velos y/o dilatación de la aorta al nivel de los SV o de la AA con un diámetro > 2,1 cm/m2.
Se describieron tres formas anatómicas de dilatación de aorta: aneurisma de AA (tipo 1), cuando la dilatación de la aorta ocurría distal a la UST y la geometría de los SV estaba conservada (9 pacientes); aneurisma de raíz de aorta (tipo 2), cuando había dilatación de los senos con o sin dilatación de la AA, pero el anillo aórtico era < 25 mm (6 pacientes); anuloectasia aórtica (tipo 3), cuando también el anillo era > 25 mm (18 pacientes). Sólo en 2 pacientes con IAo no valvular la AA y la raíz eran normales, con dilatación del anillo y la UST como únicas distorsiones de la geometría.
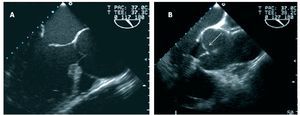
En nuestra serie, los mecanismos de la IAo de causa no valvular encontrados en cirugía son básicamente dos (fig. 2): funcional o tethering de velos macroscópicamente normales por dilatación de la UST (14 casos; 41,2%) y prolapso valvular (19 casos; 55,9%). Este último fue clasificado por el cirujano como absoluto en 6 de los 19 casos y relativo en 13 pacientes. El mecanismo se consideró una fenestración lineal del borde libre, paracomisural, sólo en 2 casos (2,9%) y calcificación poco extensa de los velos en 1 (< 1%).
Fig. 2. Imágenes ecocardiográficas en proyección en eje largo de aorta que ilustran los mecanismos básicos de la insuficiencia aórtica de causa no valvular. A: funcional, en que la dilatación de la unión sinotubular desplaza las comisuras hacia fuera, restringe el movimiento de los velos y evita que coapten en el centro en diástole. B: prolapso relativo y aneurisma de la raíz de aorta.
Valor diagnóstico de la ecocardiografía transesofágica
La tabla 1 resume los valores diagnósticos de la ETE en la clasificación de las lesiones específicas en el grupo total de 66 pacientes. La exactitud diagnóstica general de la ETE para clasificar la etiología (87%; IC del 95%, 78%-95%; kappa = 0,82) y para caracterizar las formas anatómicas de dilatación de aorta (> 88%; IC del 95%, 80%-96%; kappa = 0,83) es excelente. No obstante, en la descripción detallada de las lesiones anatómicas de los velos la exactitud diagnóstica, aunque buena, no es óptima (83%; IC del 95%, 73%-92%; kappa = 0,778). La descripción del mecanismo de la IAo alcanzó un índice de concordancia adecuado entre ambos grupos (kappa = 0,8), lo que en términos de precisión diagnóstica supone el 85% (IC del 95%, 77%-94%). El prolapso valvular fue la principal discrepancia en la valoración anatómica y funcional de la IAo en ETE (23/27). Otros falsos negativos en el diagnóstico fueron fenestraciones del borde libre que se presentaron en afecciones degenerativas (7/9). En ambos casos, el falso diagnóstico ecocardiográfico del mecanismo de la regurgitación había sido tethering de los velos valvulares por dilatación de AA.
Predicción de reparabilidad mediante ecocardiografía transoesofágica
Se realizó cirugía conservadora en 32 de los 66 pacientes y sustitución valvular aórtica en 34 casos. La ETE intraoperatoria predijo la aplicabilidad de la CCVAo, asociada o no a técnicas de reparación valvular, como procedimiento quirúrgico inicial en un elevado porcentaje de los casos (90%) y el éxito del procedimiento en el 80%. Asimismo, predijo correctamente la sustitución valvular en la mayor parte de los casos en que la inspección quirúrgica inicial descarta definitivamente intentar cirugía conservadora (25/34).
La clasificación anatómica y funcional de las lesiones realizada mediante ETE presentaba una asociación significativa con la aplicabilidad de la CCVAo (p < 0,001). La calidad del tejido de los velos fue el factor principal asociado con la decisión de reparar. Perforaciones (el 14 frente al 4%), vegetaciones (el 7,1% frente a 0) o lesiones postinflamatorias (el 9,5% frente a 0) y calcificaciones resultaron en sustitución valvular por prótesis en número significativamente mayor en los pacientes de nuestra serie (p < 0,05). Por el contrario, velos flexibles e IAo en pacientes con aneurisma de aorta resultaron casos adecuados para plantear la reparación (el 78 frente al 55%; p = 0,03).
La descripción del mecanismo mediante ETE fue el parámetro que, en nuestra serie, mejor permitió predecir la reparabilidad de la raíz de aorta (p < 0,0001). La CCVAo tiene éxito en el 73% de los casos de dilatación de los anillos funcionales (tethering), pero el 78% de los casos de prolapso, el 90% de los casos con velos engrosados o calcificados y hasta el 100% de los velos con perforaciones fueron tratados mediante sustitución valvular aórtica.
En la IAo no valvular, junto al mecanismo y la dirección del jet regurgitante (central, el 71% de éxito frente al 29% de fracaso; p = 0,001), la simetría o la ausencia de diferencias en la altura efectiva de los velos (diferencia b de éxito, 0 ± 0,1, frente a fracaso, 2,8 ± 0,6; p = 0,005) fue la variable que se relacionó independientemente con la posibilidad de éxito de la cirugía de remodelado sin reparación de los velos (tabla 2).
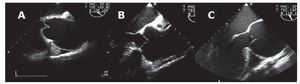
Finalmente, encontramos una asociación estadísticamente significativa entre las distintas formas anatomoclínicas del aneurisma y el procedimiento de sustitución de la AA (p = 0,004): en el tipo 1, tubo supracoronario, con o sin prótesis valvular (13/19); remodelado de la raíz en el tipo 2 (3/5), o reimplantación de la válvula nativa en un tubo protésico en posición subvalvular o tubo valvulado según técnica de Bentall en el tipo 3 o en síndrome de Marfan con cualquier forma anatómica de dilatación (19/24) (fig. 3).
Fig. 3. Imágenes de ecocardiografía transesofágica de las distintas formas anatomoclínicas de dilatación de aorta ascendente. A: dilatación supratubular. B: dilatación de raíz de aorta. C: anuloectasia aórtica.
DISCUSIÓN
El manejo quirúrgico de la IAo está cambiando a medida que las formas no valvulares asociadas a afecciones de AA se han convertido en las causas más frecuentes1. En gran medida, el éxito de estas técnicas depende de la anatomía funcional de la raíz y la válvula aórticas, lo que subraya la importancia del diagnóstico preoperatorio de las lesiones. Nuestro estudio demuestra que, como en el caso de la insuficiencia mitral, la ETE es de gran valor en la evaluación preoperatoria de los mecanismos y lesiones anatómicas de la IAo de causa valvular y no valvular y, particularmente, en la selección óptima de candidatos para técnicas de cirugía conservadora de la válvula aórtica.
Diagnóstico de las lesiones anatómicas
Cuando analizamos el valor diagnóstico de la ETE preoperatoria para cada una de las formas específicas de IAo, encontramos cifras óptimas de sensibilidad y especificidad (> 95%) para la descripción del aneurisma de AA y de las lesiones de causa valvular. Aún más, todos los casos de válvula bicúspide fueron correctamente diagnosticados con ETE, figura esta que coincide con la recientemente publicada por Alegret et al11. Sin embargo, en la IAo no valvular se encontraron discrepancias, principalmente en lo que respecta al diagnóstico del prolapso relativo y de las fenestraciones del borde libre. En estos casos la lesión valvular se diagnosticaba erróneamente como velos normales e insuficiencia funcional.
En el aneurisma de la raíz, la dilatación de los SV puede causar remodelado tisular de los velos. El remodelado pretende compensar la sobrecarga mecánica que sufre el velo cuando la aorta pierde su geometría y resulta en alargamiento y engrosamiento del borde libre12. Por ello, el prolapso relativo en este grupo es una lesión común. En muchos de estos pacientes, en quienes las exploraciones quirúrgica y ecocardiográfica se realizan, obviamente, en diferentes condiciones de llenado aórtico, la lesión del velo por estiramiento, muy sutil, puede pasar inadvertida para la ETE y diagnosticarse erróneamente la dilatación de AA como lesión única. En nuestra serie, aunque en ambos mecanismos la altura de tenting está aumentada, la simetría de la altura efectiva de los velos puede ayudar a diferenciar ambas entidades.
Identificar el prolapso es muy importante en el marco de la CCVAo: no corregir un prolapso preexistente es la primera causa del fracaso precoz de los procedimientos de reimplantación valvular o remodelado de la raíz13 y una altura efectiva de coaptación baja en válvulas reparadas identifica las que progresan a regurgitación y requieren reintervención14. Muy recientemente, Le Polain de Waroux et al15 y El Khoury et al16 describieron, en series de IAo muy similares a la nuestra, un tipo de lesiones que constituyen los principales errores diagnósticos de la ecocardiografía y que se caracterizan por un chorro regurgitante de dirección excéntrica. También la dirección central del jet, en nuestra serie, es un factor relacionado con éxito de la CCVAo. Por lo tanto, la presencia de un jet excéntrico en la IAo no valvular, aun en ausencia de aparente lesión estructural de los velos, obliga al cirujano a explorar cuidadosamente la anatomía y la longitud del borde libre de los velos para diagnosticar prolapsos o fenestraciones que pudieran pasar inadvertidos.
Diagnóstico de los mecanismos
Una de las principales aportaciones de la ecocardiografía en la enfermedad valvular es la posibilidad de obtener imágenes detalladas de la válvula y la raíz aórtica funcionando en condiciones fisiológicas de presión arterial. En la IAo, aún no existe un criterio unánimemente aceptado para la selección adecuada de los pacientes, y las decisiones sobre cirugía de conservación y/o reparación valvular se toman sobre la base de las lesiones anatómicas encontradas por el cirujano en quirófano, con el corazón parado y la aorta vacía de volumen. Sin embargo, no podemos despreciar el efecto que la presión arterial in vivo tiene en el comportamiento del velo o de la aorta con alteraciones de la elasticidad (como ocurre en afecciones degenerativas). El desarrollo de la ETE intraoperatoria nos ha permitido realizar, antes de la toracotomía, una aproximación sistemática a la interrelación estructura-función, es decir, a los mecanismos de la insuficiencia. Nuestros resultados ilustran la relación significativa entre el diagnóstico ecocardiográfico del mecanismo de la IAo y el éxito de estas técnicas quirúrgicas: los pacientes con IAo funcional por dilatación de la UST con tethering de los velos son los mejores candidatos para la CCVAo. Por lo tanto, como demuestran Le Polain et al15, en la reparación aórtica el papel de la ETE en el diagnóstico del mecanismo puede ser crucial para el cirujano a la hora de determinar la probabilidad de aplicar con éxito la CCVAo en el tratamiento quirúrgico del aneurisma de AA.
Diagnóstico de reparabilidad
En la cirugía del aneurisma aórtico, una alta probabilidad de éxito en la CCVAo es un incentivo para la aplicación precoz de las técnicas, antes de que las dimensiones extremas de la aorta17 y la IAo severa limiten los resultados18. A pesar del pequeño número de pacientes sometidos a técnicas conservadoras, la clasificación anatómica y funcional de las lesiones en nuestros pacientes presentaba una asociación significativa con la aplicabilidad de la CCVAo.
La calidad del tejido de los velos es el factor principal que garantiza la reparabilidad19. Además, en ausencia de lesiones extensas en los velos, la dirección del jet regurgitante se ha considerado el principal criterio ecocardiográfico que diferencia la IAo funcional de la valvular, tanto en las series ecocardiográficas15 como en las clasificaciones quirúrgicas16,20. No obstante, entre las series ecocardiográfica y quirúrgica del grupo belga15,16 y la clasificación funcional del grupo francés20 hay una discrepancia importante sobre el significado de la dirección del jet. Para Lansac et al20 el jet central es característico de la IAo que ocurre exclusivamente por dilatación de los anillos funcionales, mientras que los belgas también encuentran un jet central en la IAo secundaria a afección restrictiva de velos. Los parámetros de relación geométrica de los velos con respecto a los SV que proponemos permiten explicar estas observaciones tan diferentes. Sólo la diferente altura efectiva de los velos alcanzó significación estadística en el análisis multivariable. Por eso, ante un jet excéntrico en ausencia de lesión estructural de los velos, aunque observemos en la ETE disposición en tienda de campaña de los velos valvulares o tenting diastólico21, estamos obligados a asegurar su simetría para diagnosticar prolapsos que pudieran pasar inadvertidos.
Para tratar el aneurisma aórtico, se han desarrollado varias técnicas quirúrgicas de CCVAo (remodelado y reimplantación) cuyo objetivo es reparar la IAo corrigiendo las lesiones y preservando la dinámica de la raíz de aorta22. El presente estudio demuestra una relación estrecha entre la descripción ecocardiográfica de las diferentes formas anatomoclínicas de dilatación de AA y la elección del procedimiento de sustitución de aorta. No obstante, los pacientes con síndrome de Marfan23 o historia familiar de disección fueron tratados con reimplantación valvular fuera cual fuere la morfología del aneurisma. Por lo tanto, la elección de un procedimiento u otro depende, junto con la experiencia del cirujano, de la enfermedad subyacente y la forma anatómica del aneurisma.
CONCLUSIONES
La ETE intraoperatoria permite una descripción precisa de las lesiones de la válvula y la raíz de aorta y de los mecanismos de la incompetencia valvular en todas las formas de IAo, tiene una elevada tasa de acuerdo con las observaciones quirúrgicas, predice adecuadamente la aplicabilidad de las técnicas de cirugía conservadora de válvula aórtica y el procedimiento de sustitución de AA. La IAo no valvular funcional secundaria al aneurisma de aorta con velos sin lesión estructural es el mejor candidato para técnicas de conservación valvular aórtica con o sin reparación de velos.
ABREVIATURAS
AA: aorta ascendente.
CCVAo: cirugía conservadora de válvula aórtica
ETE: ecocardiografía transesofágica.
IAo: insuficiencia aórtica.
RAo: raíz de aorta.
SV: senos de Valsalva.
UST: unión sinotubular.
Full English text available from: www.revespcardiol.org
Véaseeditorialenpágs. 513-5
Correspondencia:
Dra. P. Gallego.
Servicio de Cardiología. Hospital Universitario Virgen Macarena.
Avda. Dr. Fedriani, 3. 41071 Sevilla. España.
Correo electrónico: pastoragallego@teleline.es
Recibido el 13 de abril de 2009.
Aceptado para su publicación el 25 de noviembre de 2009.