Palabras clave
INTRODUCCIÓN
La arteriosclerosis es una enfermedad sistémica y multifactorial en la que se hallan implicados diversos factores de riesgo1-6. Múltiples factores de crecimiento, citocinas y otras sustancias producidas por las células endoteliales, células musculares lisas (CML), monocitos/macrófagos y linfocitos T regulan la respuesta inflamatoria y la proliferación celular que se produce en las lesiones ateroscleróticas. El resultado de la interacción de estos factores es una respuesta fibroproliferativa que hace evolucionar las lesiones ateroscleróticas. Uno de los primeros elementos que resultan afectados en la génesis de las lesiones ateroscleróticas es el endotelio; de hecho, la disfunción endotelial es un denominador común durante el proceso aterogénico7-9. Además, el endotelio se ha revelado clave en el proceso de formación de nuevos vasos sanguíneos (neovascularización) que tiene lugar en placas ateroscleróticas avanzadas10,11.
La formación de nuevos vasos es activada por diferentes factores de crecimiento, como el factor de crecimiento endotelial de origen vascular (VEGF) y el factor de crecimiento de fibroblastos de tipo básico (bFGF), cuya expresión aumenta en respuesta a diferentes desencadenantes del proceso12-14. El VEGF es un factor angiogénico, mitógeno para las células endoteliales, que aumenta la permeabilidad vascular y modula la trombogenicidad15. En la pared vascular, y especialmente en las lesiones ateroscleróticas, los factores de crecimiento producidos por las CML, como el VEGF, pueden modular la función endotelial y la expresión de genes vinculados a la activación de la migración y proliferación de las células endoteliales durante la angiogénesis16. Además de estos factores, que son generados in situ por las células que interaccionan en las lesiones ateroscleróticas, la trombina retenida por la matriz extracelular, donde permanece funcionalmente activa17, parece desempeñar un papel importante en la regulación del proceso, ya que puede promover la activación de las células vasculares, tanto CML como células endoteliales.
Los estudios sobre angiogénesis se han realizado in vitro, en modelos experimentales, principalmente en animales transgénicos, y en arterias humanas procedentes de autopsias14,15, pero no conocemos estudios que analicen sistemáticamente el proceso de neovascularización en lesiones arteroscleróticas de arterias coronarias humanas obtenidas inmediatamente tras la extracción quirúrgica del corazón. El objetivo de este estudio fue cuantificar la presencia de neovasos en lesiones coronarias con distinto grado de lesión y estudiar los valores de expresión de factores de crecimiento potencialmente asociados a dicha neovascularización.
En este estudio realizado en arterias coronarias humanas se ha observado una formación significativa de neovasos sólo en lesiones avanzadas. En estas lesiones, la expresión de VEGF fue muy significativa y, desde el punto de vista cuantitativo, estaba principalmente asociada a CML. Con frecuencia se observó colocalización entre áreas con alto contenido de trombina/protrombina y CML en estado activado. Estas células podrían desempeñar un papel en el proceso de formación de neovasos maduros.
PACIENTES Y MÉTODO
Obtención y preparación de las muestras de tejido
Las arterias coronarias humanas se obtuvieron a partir de corazones extraídos en operaciones de trasplante cardíaco, concretamente de segmentos proximales de unos 2 cm de longitud, a partir del ostium de las coronarias derecha, circunfleja y descendente anterior. Las arterias se procesaron inmediatamente tras la extracción del corazón. Fueron fijadas en paraformaldehído, criopreservadas en sacarosa e incluidas en OCT (Miles Inc.). Finalmente, se conservaron a -80 °C hasta su análisis. Un grupo de muestras, después de la fijación con paraformaldehído, se incluyó en parafina mediante un procesador automático de tejidos (Shandon-Elliot).
A partir de las muestras congeladas o incluidas en parafina se generaron secciones seriadas consecutivas de 5 μm de grosor mediante crióstato (JUNGCM 3000, Leica) o micrótomo (Supercut, Reichert), respectivamente.
Para el análisis de VEGF, las arterias fueron subdivididas en fragmentos y se realizó una asignación aleatoria en tres grupos que se procesaron independientemente: mediante fijación con paraformaldehído, por congelación en nitrógeno líquido o mediante inclusión en parafina. En las muestras fijadas en paraformaldehído, la inmunotinción del VEGF no permitió diferenciar áreas celulares de áreas acelulares. Además, la inespecificidad de la tinción del VEGF enmascaró la tinción de los marcadores celulares, lo que no permitió identificar tipos celulares. La inmunotinción del VEGF en muestras congeladas directamente en nitrógeno líquido fue positiva en las túnicas media e íntima. Sin embargo, el bajo contraste entre las áreas de celularidad y las zonas ricas en matriz extracelular no permitió identificar claramente estructuras vasculares en la íntima. En la doble inmunotinción fue difícil observar colocalización de VEGF con las células. Por tanto, para analizar el VEGF se escogió el método de inclusión en parafina por su mayor especificidad.
Tinciones histopatológicas e inmunohistoquímicas
Se realizó una tinción con tricrómico de Masson18 para identificar las estructuras vasculares, y una tinción con Oil Red-O (ORO)19 para determinar el contenido lipídico. A partir de estas tinciones, las lesiones se clasificaron de acuerdo con el criterio de la American Heart Association (AHA)20,21.
Método de fosfatasa alcalina
Este método se aplicó según las técnicas convencionales22 para analizar la presencia de los siguientes marcadores: HAM56, protrombina, α-SM actina, y CD34 (tabla 1).
Método de avidina-biotina-peroxidasa
Este método se utilizó según las técnicas convencionales23 para la detección de VEGF y Ki67 (tabla 1). En el caso de doble inmunotinción con VEGF y un marcador celular, se utilizó el método avidina-biotina-peroxidasa (ABC Kit, Vector Labs.) para el VEGF, y el de fosfatasa alcalina (Vector Labs.) para el marcaje complementario.
Método de fluorescencia
También siguiendo técnicas convencionales24 se utilizó este método para el marcaje del factor von Willebrand (vWF) y α-SM actina (tabla 1).
Análisis de imagen
Las preparaciones se observaron mediante un microscopio binocular de luz transmitida y fluorescencia (Vanox AHBT3, Olympus). Para bajos aumentos se utilizó una lupa binocular (SCH10, Olympus). La captación de imágenes se realizó mediante una cámara digital (Sony 3CCD) y el análisis de imagen se llevó a cabo informáticamente mediante el programa Visilog 4.1.5 (Noesis).
Cálculos de áreas generales sobre las coronarias
La imagen de cuatro secciones de cada coronaria teñida mediante la tinción tricrómica de Masson se captó con lupa binocular (x25 aumentos). Mediante el programa Visilog se midió el área de la media (Am), de la íntima (Ai) y del lumen (Al). Se calculó el porcentaje de estenosis y el grado de intrusión (GI) según las fórmulas:
Los resultados de las áreas se expresaron en mm2 y el grado de estenosis e intrusión, en porcentajes25,26.
Cuantificación de las áreas de lípidos y macrófagos
Para la cuantificación del contenido de lípidos (tinción ORO) y de monocitos/macrófagos (tinción con el marcador HAM56) se procedió a la captación de cinco campos por sección con una magnificación de x200. A continuación se procedió a desarrollar un programa informático con una subrutina incorporada que permitió calcular el porcentaje del área de la íntima ocupada por el marcador estudiado mediante el cálculo de la relación (en porcentaje) entre el área teñida (área positiva) y el área total, multiplicado por 100.
Presencia de neovasos en las lesiones
De una sección elegida al azar entre las incubadas con la combinación de anticuerpos antifactor von Willebrand (vWF) y anti-α-actina de músculo liso (α-SM actina) se captaron a 200 aumentos las áreas teñidas con el factor von Willebrand. Se determinó el área ocupada por estos neovasos y se calcularon las relaciones entre la superficie ocupada por los neovasos y las diferentes áreas indicadas anteriormente.
La densidad de los neovasos (D) se calculó de acuerdo con la siguiente fórmula:
donde ANv es el área ocupada por los neovasos27.
Análisis estadísticos
Los resultados se expresaron como el valor medio ± EEM (error estándar de la media) y se analizaron con el programa estadístico StatviewTM (Abacus Concepts). La comparación entre dos grupos se realizó mediante la prueba de la U de Mann-Whitney, y la regresión, con el análisis no paramétrico de Spearman. Las diferencias se consideraron significativas cuando p < 0,05.
RESULTADOS
Características de los pacientes
Se analizaron las arterias coronarias de 20 pacientes de raza blanca (el 90% varones y el 10% mujeres) sometidos a trasplante, con edades comprendidas entre los 18 y los 63 años, seleccionados durante un período de 18 meses (desde octubre de 1999 a marzo de 2001). En la tabla 2 se muestra la distribución de factores de riesgo en estos pacientes, de acuerdo con la enfermedad subyacente: miocardiopatía dilatada (MD) o isquémica (MI). En la MI destacó la presencia de hiperlipemia (88%), hipertensión arterial (67%) y diabetes (11%), frente a la ausencia de dichos factores de riesgo en los pacientes con MD. Todos los pacientes con MI tenían antecedentes de infarto de miocardio antiguo.
Clasificación de las lesiones estudiadas
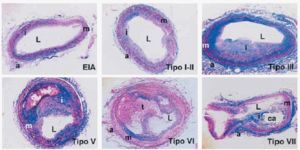
Se analizaron un total de 60 lesiones correspondientes a 60 coronarias. En la tabla 3 se muestra la distribución de las lesiones de acuerdo con los factores de riesgo. En general, se observó que las lesiones avanzadas correspondían a pacientes con MI (24 de 25 lesiones, tipos IV a VIII), mientras que las lesiones tempranas se observaron en pacientes con MD no isquémica (32 de 35 lesiones analizadas, tipos I-III). En la figura 1 se muestran ejemplos característicos correspondientes a dichas lesiones. Los estudios de correlación de Spearman mostraron que la gravedad de las lesiones, que conlleva un aumento del grado de estenosis, se correlacionó positivamente con la infiltración de monocitos/macrófagos (r = 0,536; p = 0,0001), alcanzando el máximo en la lesión tipo VI, para luego disminuir en los estadios finales (tipo VII y VIII), y con el contenido lipídico (r = 0,647; p = 0,0001).
Fig. 1. Tinción tricrómica de Masson de arterias coronarias en diferentes grados de lesión. EIA: engrosamiento de la íntima arterial; a: adventicia; c: core lipídico; ca: calcificación; i: íntima; L: lumen; m: media; t: trombo (x25).
Neovascularización en las lesiones ateroscleróticas humanas
En las lesiones tempranas (tipos I y II) no se detectaron neovasos. Éstos aparecen a partir de las lesiones intermedias (tipo III), y su número aumenta hasta la lesión tipo VI, para finalmente disminuir en las lesiones avanzadas (tipo VII y VIII). Los neovasos se encontraron no sólo alrededor del núcleo lipídico, sino también en la capa media y en la frontera entre la media y la íntima. Los estudios de doble inmunolocalización mostraron que las áreas que rodean a los neovasos son ricas en células inflamatorias, especialmente monocitos/macrófagos. Por lo general, son áreas donde aumenta el contenido de CML (marcador α-SM actina). En la figura 2 se muestra un ejemplo representativo de una lesión avanzada con un elevado contenido de neovasos. El resultado de la cuantificación de las áreas ocupadas por neovasos en los diferentes tipos de lesión se muestra en la tabla 4. Estudios de correlación de Spearman mostraron una correlación positiva entre el contenido de neovasos y el grado de estenosis (r = 0,740; p = 0,0001), de intrusión (r = 0,758; p = 0,0001), la infiltración de monocitos/macrófagos (r = 0,537; p = 0,0001), el contenido lipídico (r = 0,663; p = 0,0001) y la presencia de trombina/protrombina (r = 0,650; p = 0,0001).
Fig. 2. A: Lesión avanzada con un elevado contenido de neovasos. Inmunolocalización de α-SM actina (verde) y factor von Willebrand (rojo) (x100). B: Ampliación de la imagen indicada en A. Las flechas indican la posición de los neovasos. i: íntima; L: lumen; m: media.
Expresión del factor de crecimiento endotelial de origen vascular en las lesiones
El método de inclusión en parafina fue el más eficaz para analizar el VEGF. Éste se colocalizó con áreas celulares y definió áreas perivasculares en el endotelio vascular y en los neovasos de la íntima (fig. 3B y F). Los vasa vasorum de la adventicia también mostraron una tinción positiva para el VEGF. La tinción del VEGF se colocalizó principalmente con las CML de las capas media e íntima (fig. 3C, D y G), y también con las células endoteliales (fig. 3E) y los macrófagos (fig. 3H). Las áreas ricas en colágeno fueron negativas para el VEGF. Como se aprecia en la figura 3, estructuralmente, los neovasos maduros están formados por una monocapa de células endoteliales rodeada de musculatura lisa (positivo para α-SM actina).
Fig. 3. Inmunotinción de VEGF en secciones parafinadas. A: tinción tricrómica de Masson. B: localización inmunohistoquímica de VEGF. C y D: doble inmunotinción de VEGF (marrón) y α-SM actina (rojo). E: doble inmunotinción de VEGF (marrón) y CD34 (rojo, célula endotelial). F: inmunotinción de VEGF. G: doble inmunotinción de VEGF (marrón) y α-SM actina (rojo). H: doble inmunotinción de VEGF (marrón) y HAM56 (rojo, macrófago). En A, las letras indican la zona de las imágenes mostradas en C a H. Las flechas indican la posición de los neovasos. L: lumen. A y B (x100), C a H (x600).
Expresión de moléculas proangiogénicas: trombina
No se detectó trombina/protrombina en las arterias con engrosamiento intimal (EIA) (fig. 4C); en cambio, su presencia aumentó en la íntima a medida que evolucionó la lesión, alcanzando su nivel más alto en la lesión tipo VI (fig.4 D). En las lesiones de tipo II y III se encuentra asociada a la presencia de monocitos/macrófagos, CML y material lipídico. En las lesiones avanzadas, su distribución está relacionada con las CML, monocitos/macrófagos y matriz extracelular. Se observó una colocalización de zonas con un alto contenido de trombina/protrombina con CML en estado activado (positivo para Ki67) (fig. 5).
Fig. 4. Presencia de trombina/protrombina en lesiones avanzadas. A y B: tinción tricrómica de Masson. C y D: inmunolocalización de trombina/protrombina (azul) en secciones consecutivas a las mostradas en A y B. A y C: engrosamiento de la íntima arterial (EIA). B y D: lesión tipo VI. i: íntima; L: lumen; m: media. A y C (x100), B y D (x40).
Fig. 5. Inmunolocalización de trombina/protrombina (azul) (A) y Ki67 (negro) (B) en una lesión avanzada tipo VI. Ki67: marcador de proliferación; i: íntima; m: media (x200).
DISCUSIÓN
En este estudio nos planteamos analizar la presencia de neovasos y VEGF en relación con los marcadores de evolución de la lesión en arterias coronarias humanas.
Se incluyó a 20 pacientes, de los que 9 sufrían MI y 11 MD. Las lesiones avanzadas pertenecían mayoritariamente a pacientes con MI, y los factores de riesgo más prevalentes fueron la hiperlipemia y la hipertensión. Como la diabetes es una contraindicación relativa de trasplante cardíaco, sólo uno de los 20 pacientes incluidos en el estudio sufría dicha afección. Las lesiones tempranas correspondían principalmente a pacientes con MD que no presentaron estos factores de riesgo. La edad de los pacientes con MI fue significativamente mayor que la de los que padecían MD. De hecho, ningún paciente menor de 45 años presentó lesiones avanzadas ni evidencias de complicación trombótica en sus coronarias. Este estudio fue llevado a cabo en arterias procesadas inmediatamente después de la extracción quirúrgica del corazón. Esta aproximación puede aportar información más próxima a la situación in vivo que la obtenida del análisis de especímenes de autopsias, ya que el tiempo de obtención de las muestras en estos casos suele ser de varias horas post mortem. Por otra parte, la inmunorreactividad de las proteínas puede alterarse en las muestras procedentes de autopsias, y también puede producirse la liberación del contenido celular, lo que dificulta la localización de los marcadores celulares y de las proteínas de interés.
En las lesiones analizadas, la presencia de neovasos en la íntima se correlacionó con el porcentaje de estenosis, de intrusión, con el contenido de células inflamatorias, material lipídico y la presencia de trombina/protrombina. La presencia de lípidos aumentó gradualmente hasta la lesión tipo VI, y fueron las lesiones tipo VI las más ricas en neovasos. Resultados previos han relacionado la presencia de neovasos con complicaciones trombóticas28,29 y, precisamente, son las placas tipo VI las más asociadas a complicaciones trombóticas. Además, la colocalización de los neovasos con monocitos/macrófagos sugiere un papel importante de estas células, que producen factores angiogénicos que pueden estimular la formación de neovasos30.
Estudios in vitro e in vivo han mostrado que el VEGF es el factor angiogénico más importante14,15,31-33. Sin embargo, su análisis se realizó utilizando diferentes métodos de procesamiento/fijación, normalmente en arterias humanas procedentes de autopsias en las que el tiempo de extracción variaba de 3 a 16 h post mortem14,15. Los resultados de estos estudios son, en cierto modo, discrepantes; ya que en inmunohistoquímica, la obtención de las muestras y su procesamiento pueden afectar significativamente a los resultados34. Nosotros observamos que el método de inclusión en parafina fue el más específico para analizar el VEGF en las arterias coronarias humanas extraídas inmediatamente tras la extracción quirúrgica del corazón en el trasplante cardíaco. El principal tipo celular que expresó el VEGF en las lesiones fue el de las CML, de acuerdo con estudios anteriores llevados a cabo en diferentes arterias humanas12,14,32. En los neovasos presentes en la íntima, el VEGF se colocalizó con las CML y las células endoteliales. La expresión del VEGF se asoció con células vasculares, pero también con monocitos/macrófagos. Algunos autores han detectado VEGF en la matriz extracelular, en zonas próximas a las CML y en macrófagos33, o de forma generalizada32. Nosotros sólo detectamos expresión significativa de VEGF en la matriz extracelular en las muestras fijadas en paraformaldehído, un procedimiento con el que la tinción de VEGF fue poco específica.
Además de factores autocrinos generados por las células vasculares in situ, como el VEGF, otras moléculas de origen plasmático infiltradas en la pared, como la trombina, pueden potenciar el proceso angiogénico35,36. La trombina modula la actividad de las metaloproteinasas37,38 y posee actividad mitogénica para las células endoteliales39 y las CML40. Además, puede liberar factores de crecimiento «secuestrados» por los componentes de la matriz41 y, por tanto, también puede potenciar de forma indirecta la angiogénesis. En nuestro estudio, en lesiones avanzadas observamos colocalización de áreas con un alto contenido de trombina/protrombina con CML activadas (Ki67 positivas).
Aunque en numerosos estudios realizados en muestras procedentes de pacientes fallecidos como consecuencia de complicaciones agudas se observa neovascularización en la íntima de las lesiones ateroscleróticas, su papel fisiopatológico es controvertido. Nuestro estudio muestra que, en las lesiones ateroscleróticas de pacientes sometidos a trasplante cardíaco, el grado de neovascularización es bajo, incluso en las lesiones avanzadas de los pacientes con episodios previos de miocardiopatía isquémica. Esto podría deberse al riguroso control farmacológico de estos pacientes. Por tanto, una excesiva angiogénesis favorecería la rotura de las placas y el desarrollo de episodios agudos. Esta hipótesis está siendo evaluada en este momento en nuestro laboratorio.
Limitaciones del estudio
Debido a las características del estudio, basado en pacientes estabilizados en espera de recibir un trasplante cardíaco, debemos precisar que no se cuenta con información de pacientes en fase aguda y que también hay un déficit de información sobre diabéticos. Ambos grupos de pacientes son obviamente de interés y serán el foco de futuros trabajos.
CONCLUSIONES
Hemos detectado neovasos a partir de lesiones de tipo III, y su número fue máximo en las de tipo VI. Los neovasos se localizaron tanto en la íntima como en las zonas contiguas entre íntima y la media, en áreas ricas en material lipídico y células inflamatorias. Se encontraron neovasos casi exclusivamente en los pacientes con MI que presentaban lesiones avanzadas asociadas a una mayor incidencia de factores de riesgo, como la hipertensión y la hiperlipemia. En estas lesiones, la expresión de VEGF fue muy significativa y, desde el punto de vista cuantitativo, estaba vinculada principalmente a las CML.
AGRADECIMIENTO
Los autores agradecen la colaboración continuada del equipo de trasplante cardíaco de la División de Cardiología y Cirugía Cardíaca del Hospital de la Santa Creu i Sant Pau. Los autores agradecen el apoyo continuado de la Fundación de Investigación Cardiovascular-Catalana Occidente.
Este trabajo ha sido posible gracias a los fondos proporcionados inicialmente por la Marató-TV3 para Enfermedades Cardíacas de 1995, que permitió iniciar el banco de tejidos, por el Fondo de Investigaciones Sanitarias (FIS99/0907) y el Plan Nacional (SAF2000-0174), y gracias a una beca de la Fundación Española del Corazón 1999-2000 para formación posdoctoral de Josep O. Juan-Babot.
Correspondencia: Prof. Lina Badimon.
Centro Investigación Cardiovascular. Hospital de la Santa Creu i Sant Pau.
Avda. Sant Antoni M.a Claret, 167. 08025 Barcelona. España.
Correo electrónico: lbmucv@cvid.csic.es