Palabras clave
INTRODUCCIÓN
La toxicidad pulmonar por amiodarona (TPA) es una entidad de difícil diagnóstico debido a la inespecificidad de los síntomas, los hallazgos clínicos y los resultados de los tests de laboratorio1. En la actualidad no hay un proceso diagnóstico disponible que nos permita confirmar y evaluar la actividad de la TPA.
El Krebs von den Lungen-6 (KL-6)2, una glucoproteína expresada en los neumocitos alveolares tipo 2, ha sido relacionado como un marcador de actividad de enfermedad intersticial pulmonar; sin embargo, su papel como indicador precoz de TPA no ha sido documentado.
Presentamos el caso de 1 paciente que desarrolló TPA demostrada por biopsia pulmonar y cuya evolución clínica fue buena tras la suspensión del fármaco. Se determinaron los valores de KL-6 al comienzo de la clínica y tras la retirada de la amiodarona.
CASO CLÍNICO
Se trata de una mujer de 69 años, hipertensa, en tratamiento médico con indapamida, con fibrilación auricular paroxística de 3 años de evolución tratada con amiodarona en dosis de 200 mg/día, dosis acumulada de 219 G y anticoagulada con dicumarínicos.
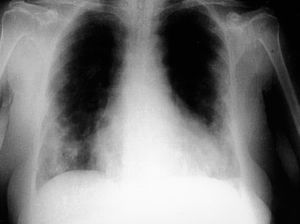
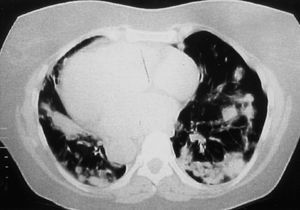
La paciente ingresó en el hospital tras presentar un cuadro de 2 meses de evolución de disnea progresiva hasta ser de moderado esfuerzo, acompañada de episodios de tos seca, sin dolor torácico, fiebre, cuadro constitucional ni otras alteraciones. En la exploración destacaba la presencia de crepitantes secos bibasales pulmonares y soplo sistólico en el foco mitral de intensidad II/VI. Los hallazgos radiológicos (figs. 1 y 2) mostraron un patrón intersticio-alveolar de predominio en los campos medios y bases, con la presencia de múltiples nódulos pulmonares, periféricos, de contornos mal definidos.
Fig. 1. Radiografía de tórax basal. Se observa una afección pulmonar bilateral de predominio en los campos medios y las bases, consistente en un patrón intersticio-alveolar con nodularidad mal definida.
Fig. 2. Tomografía computarizada de alta resolución pulmonar. Se observa un patrón de predominio alveolar con la presencia de múltiples nódulos pulmonares, periféricos, de contornos mal definidos, algunos de ellos con cavitación, acompañados de otras zonas de consolidación pulmonar con broncograma aéreo. Aunque menos evidente, se podía detectar algún área de fibrosis.
Se obtuvo una analítica completa y una gasometría arterial, y se realizó un estudio inmunológico e infeccioso, que fueron normales. Únicamente se detectó una alteración ligera de la función tiroidea (TSH, 6,6 U/ml, y T4 libre, 1,3). Los niveles de amiodarona fueron de 0,9 µg/ml y los de desetilamiodarona de 0,8 µg/ml. Las pruebas de función respiratoria mostraron una restricción moderada con una capacidad vital forzada del 66% y un índice de Tiffeneau del 97%. El test de difusión de monóxido de carbono estaba en el límite inferior de la normalidad (87%).
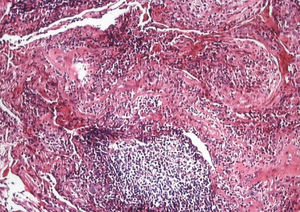
Se practicó una biopsia pulmonar (fig. 3), cuyos hallazgos revelaron la presencia de un parénquima pulmonar con signos de fibrosis septal de distribución irregular, sin distorsión arquitectural o remodelación, presencia de fenómenos de «neumonía organizada», abundantes folículos linfoides (en ocasiones con centro reactivo) y frecuentes macrófagos alveolares espumosos. Todo ello era compatible con una TPA.
Fig. 3. Biopsia pulmonar. Se observan fenómenos de neumonía organizada, folículos linfoides y macrófagos alveolares en el seno de una fibrosis septal.
La paciente experimentó una recuperación de sus lesiones pulmonares, tanto clínica como radiológica, tras la suspensión del fármaco y el inicio de tratamiento corticoideo y oxigenoterapia.
El KL-6 se determinó el primer día de su estancia hospitalaria, a los 7 días de su ingreso y a los 140 días tras la suspensión del fármaco, y sus niveles fueron, respectivamente, 695, 1,005 y 325 U/l. La técnica utilizada ha sido la descrita por Endoh et al2.
DISCUSIÓN
La TPA fue descrita por primera vez en 1980 por Rotmensch et al3. Los efectos tóxicos de la amiodarona en el pulmón4 incluyen daño alveolar difuso, neumonía organizada, bronquiolitis obliterante, broncoespasmo, daño alveolar difuso hemorrágico, neumonitis por hipersensibilidad, fallo cardíaco, infiltrados pulmonares con eosinofilia y enfermedad pulmonar intersticial. El mecanismo de acción puede ser directo mediante la liberación de radicales libres o de forma indirecta por hipersensibilidad5. El cuadro clínico es variable, pero lo más frecuente es la presencia de disnea, predominantemente de esfuerzo, y tos seca1. La alteración radiológica más frecuente es el patrón intersticial difuso6, aunque hay casos de masa solitaria pulmonar4 y con menos frecuencia afección pleural o infiltrados alveolares unilaterales4. En la bibliografía se describen algunos casos de TPA asociada a múltiples nódulos pulmonares que simulaban un proceso maligno7-9, probablemente por una respuesta inflamatoria a la acumulación de inclusiones fosfolipídicas en las células alveolares inducidas por el fármaco10.
Los hallazgos patológicos hallados con más frecuencia incluyen la bronquiolitis obliterante, la neumonitis intersticial, la fibrosis intersticial y una combinación de todas ellas6,11,12. La presencia de macrófagos vacuolados es frecuente pero no es patognomónica de TPA, ya que aparece en pacientes expuestos al fármaco que no desarrollan TPA.
Estudios inmunohistoquímicos demuestran que el KL-6 es fuertemente expresado en los neumocitos tipo 2 regenerados o activados tras una agresión intersticial, por lo que podría ser un buen marcador de actividad en enfermedades pulmonares intersticiales, tales como neumonía intersticial asociada a colagenopatías, neumonitis actínica y neumonitis por amiodarona2.
El diagnóstico de TPA es costoso y difícil en ocasiones, y se basa en las manifestaciones clínicas y los hallazgos radiológicos; es preciso utilizar técnicas invasivas para descartar otros procesos.
Hemos presentado el primer caso en España con TPA demostrada por los hallazgos histológicos y la evolución clínica favorable tras la suspensión del fármaco, donde se observa una elevación significativa del marcador KL-6. Aunque aún echamos en falta la realización de estudios prospectivos que ayuden a valorar su utilidad en la predicción de TPA, el KL-6 surge como una novedosa herramienta diagnóstica en una enfermedad que carece de un claro patrón de referencia para su diagnóstico.
Correspondencia: Dra. C. Moro Serrano.
Servicio de Cardiología. Hospital Ramón y Cajal.
Crta. Colmenar, km 9,100. 28034 Madrid. España.
Correo electrónico: cmoro.hrc@salud.madrid.org