Palabras clave
INTRODUCCIÓN
El implante de electrodos epicárdicos transitorios en cirugía cardiaca es una práctica común. Generalmente, los electrodos ventriculares se colocan en el ventrículo derecho (VD). No está comprobado que éste sea el mejor lugar para la estimulación. La estimulación en VD resuelve las complicaciones arrítmicas, pero no se produce una activación fisiológica del ventrículo izquierdo (VI), inicia una activación eléctrica y una contracción ventricular asincrónica.
Diferentes estudios han mostrado el posible efecto adverso de la estimulación en VD especialmente cuando se realiza durante largo tiempo, pues da lugar a un mayor número de hospitalizaciones y una disminución de la clase funcional del paciente, fundamentalmente en caso de disfunción ventricular1-5.
Las técnicas de imagen mediante Doppler tisular (DT) permiten analizar la sincronía mecánica6,7. El análisis de la deformación miocárdica (strain) utilizado en este trabajo presenta la ventaja de diferenciar la contracción miocárdica activa del desplazamiento pasivo miocárdico y se ha utilizado para demostrar la asincronía mecánica7-9.
La colocación de electrodos endocavitarios en VI utilizando como acceso el seno coronario puede ser muy dificultosa, ya que depende de la anatomía venosa, mientras que en la cirugía cardiaca se puede colocar electrodos en cualquier posición epicárdica y observar el efecto de la estimulación en cada uno de ellos.
Por ello hemos llevado a cabo este estudio en pacientes sometidos a cirugía cardiaca, para lo cual se implantaron electrodos transitorios en VD y en diferentes posiciones epicárdicas del VI. Los objetivos son, por una parte, analizar el efecto de la estimulación aguda en VD y en diferentes localizaciones del VI en la sincronía y, por otra, determinar si hay algún lugar en el que se pueda conseguir mayor eficacia cardiaca tras la estimulación.
MÉTODOS
Población del estudio
Se seleccionó a pacientes adultos consecutivos en espera de cirugía cardiaca electiva, en ritmo sinusal y que dieran su consentimiento firmado para la realización del estudio, que fue aprobado por el Comité Ético de nuestro hospital. Criterios de exclusión: fibrilación auricular, bloqueo completo de rama izquierda, estimulación con marcapasos y no cumplir los criterios de inclusión. Se estudió a 19 pacientes (4 mujeres, 21%) con una media de edad de 68 ± 10,62 años. La fracción de eyección (FE) media, estimada con ecocardiografía usando el método de Simpson10, fue del 57,6% ± 14,6%. Sólo 4 pacientes presentaron una FE < 50% (el 25, el 30, el 45 y el 45% respectivamente); 16 pacientes presentaban cardiopatía isquémica, 6 con infarto previo (4 anteroapicales y 2 inferobasales). Todos estaban en ritmo sinusal y en ningún caso la duración del QRS (parte del trazado del electrocardiograma que representa polarización ventricular) fue > 120 ms. Se sometió a revascularización a 16 pacientes, y a sustitución valvular aórtica a 3. En ningún caso aparecieron complicaciones posquirúrgicas graves.
Técnica quirúrgica
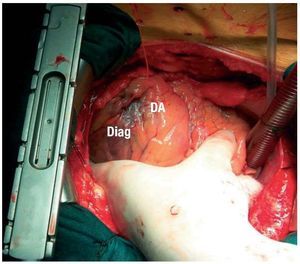
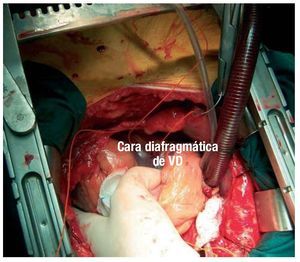
Se implantaron electrodos epicárdicos transitorios en tres posiciones del VI (anterior, inferior y lateral), así como un electrodo en la cara inferior del VD cerca del ápex (figs. 1 y 2). Se colocaron dos electrodos transitorios auriculares y dos electrodos en la piel que actuaran como indiferentes.
Fig. 1. Electrodo transitorio en cara anterior del ventrículo izquierdo, entre arteria descendente anterior (DA) y diagonal (Diag).
Fig. 2. Electrodo transitorio colocado en la cara diafragmática del ventrículo derecho (VD).
Se usaron dos generadores externos (5388 bicameral Medtronic, Medtronic Inc., Minneapolis, Minnesota, Estados Unidos). Los electrodos auriculares se conectaron al canal auricular del generador n.o 1 en bipolar. La estimulación de las diferentes zonas ventriculares se realizó en monopolar utilizando uno de los electrodos de la piel como positivo. La frecuencia de estimulación fue 10 lpm mayor que la frecuencia que presentaba el paciente y el intervalo auriculoventricular, 130 ms. Estos parámetros se mantuvieron fijos independientemente de la zona estimulada. La captura ventricular durante la estimulación se confirmó mediante el análisis de la morfología del QRS en el electrocardiograma (ECG) de superficie. Los electrodos se retiraron tras finalizar el estudio.
Estudio ecocardiográfico
El estudio ecocardiográfico se realizó entre el tercero y el quinto día tras la cirugía. Se utilizó un equipo Vivid 7 (General Electrics Medical systems, Horton, Noruega) con una sonda de 3,4 MHz. Se realizaron cinco estudios ecocardiográficos consecutivos: sin estimulación, con estimulación en VD y en las paredes anterior, lateral e inferior del VI.
Se obtuvieron imágenes utilizando proyecciones paraesternal es en los planos de eje largo y corto y apical en planos de dos, tres y cuatro cámaras. El registro de velocidad del flujo del tracto de salida del VI se obtuvo en el plano de cinco cámaras apical mediante Doppler pulsado. Se registraron cinco latidos consecutivos en cada plano durante el estudio basal y durante cada estimulación.
La asincronía se analizó sobre las imágenes bidimensionales obtenidas con DT. Los estudios se realizaron en los planos apicales de dos, tres y cuatro cámaras. Para conseguir la mayor tasa de imágenes por segundo (frame rate), se utilizó el sector más estrecho que permitiera un análisis adecuado de las paredes ventriculares excluyendo las aurículas. La tasa de imágenes obtenida fue siempre > 100 fps. Se registraron cinco latidos consecutivos en cada plano. Los registros se hicieron en apnea, con óptima señal de ECG y excluyendo las extrasístoles.
Análisis de los estudios ecocardiográficos
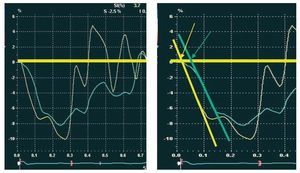
Las mediciones se realizaron en una estación de trabajo externa (Echopac, General Electrics, Horton, Noruega). Las diferentes mediciones en modo M, 2D, y la determinación de la FE se realizaron según las recomendaciones de la Sociedad Americana de Ecocardiografía utilizando el método de Simpson10. El gasto cardiaco (GC) se determinó mediante estudio de ecocardiografía Doppler11. Para obtener las curvas de strain (ε) se utilizó una región de interés de 10 x 30 mm, colocada en las regiones basal y medial de cada una de las seis paredes del VI (anterior, anterolateral, inferolateral, inferior, inferoseptal y anteroseptal) y en la pared lateral del VD. En cada segmento se determinó el tiempo desde el comienzo del complejo del QRS al punto donde la recta que sigue la dirección de la parte descendente fundamental de la curva en sístole superaba la velocidad cero. El tiempo en que esta recta atraviesa la línea de velocidad cero se utiliza para medir el comienzo del strain (fig. 3), de manera similar a lo publicado previamente en estudios con cardiorresonancia12. Se utilizó el tiempo promedio de cinco ciclos cardiacos. Para obtener los índices de sincronía, utilizamos el tiempo promedio de cada una de las caras ventriculares (promedio de los segmentos basal y medial).
Fig. 3. En cada segmento se midió sobre las curvas de strain el tiempo desde el comienzo del complejo QRS al punto donde la recta que sigue la dirección de la parte descendente fundamental de la curva en sístole supera la línea de velocidad cero (flechas). En amarillo, curva del segmento septal, y en verde, la del segmento lateral.
Parámetros de asincronía
Para estimar la asincronía mecánica interventricular, se utilizó la diferencia en el tiempo de comienzo del strain entre el VD y el VI (Tε DI): media del comienzo del tiempo de strain en las seis paredes del VI.
Para estimar la asincronía intraventricular, se utilizaron las siguientes medidas: desviación estándar (DE) del tiempo del comienzo del strain de las seis paredes del VI (Tε DE), y máxima diferencia entre el tiempo del comienzo del strain miocárdico de dos diferentes paredes del VI (Tε MD).
Análisis estadístico
Los datos cuantitativos se expresan como media ± DE. La correlación entre los diferentes parámetros cuantitativos se analizó utilizando el test de Spearman. Para el análisis de las diferencias entre grupos, se utilizaron el test de Friedman y el test de Wilcoxon para el análisis de las diferencias entre grupos apareados, utilizando la corrección de Bonferroni. El coeficiente de correlación intraclase (CCI) y el intervalo de confianza (IC) del 95% se utilizaron para evaluar el acuerdo en el observador y entre observadores en el análisis de Tε DE, Tε MD y del cálculo de la integral de la velocidad de flujo en el tracto de salida del VI. Para estimar la variabilidad del cálculo del GC, se analiza esta variable, dado que es la única que se modifica cuando se calcula el GC con los diferentes tipos de estimulación. La significación estadística se estableció en p < 0,05. Se utilizó el software SPSS (versión 11.0; SPSS Inc., Chicago, Illinois, Estados Unidos).
RESULTADOS
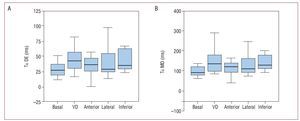
La media de los parámetros utilizados para medir la asincronía fue: Tε DI, 28,3 ± 56,9 ms; Tε DE, 36,6 ± 34,9 ms; Tε MD, 90,5 ± 87,4 ms. Hubo una buena correlación entre los últimos dos parámetros (r = 0,971; p < 0,0001).
Asimismo, Tε DE y Tε MD presentaron buena correlación con la FE (r = 0,62 y r = 0,6 respectivamente; p < 0,001) y con el antecedente de infarto previo. Los pacientes con infarto previo y baja FE tuvieron peores valores en los parámetros de asincronía. Los pacientes con infarto previo (n = 6) presentaron mayor asincronía, pero sin alcanzar la significación estadística: Tε DI, 13,9 ± 45,9 frente a 28,19 ± 24,8 ms; Tε DE, 23,7 ± 11,3 frente a 41,9 ± 25,2 ms (p = 0,06); Tε MD, 60 ± 25,9 frente a 100 ± 67,2 ms (p = 0,1).
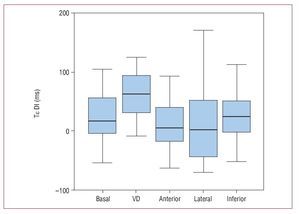
Todos los parámetros de asincronía aumentaron respecto de los valores basales cuando se estimuló el VD: Tε DI, 59,8 ± 40,5 frente a 28,23 ± 56,9 ms (p = 0,002); Tε DE, 53,2 ± 34,4 frente a 36,6 ± 34,9 ms (p = 0,007); Tε MD, 135,3 ± 82,9 frente a 90,5 ± 87,4 ms (p = 0,007) (tabla 1; figs. 4 y 5). Esta estimulación es la que más asincronía produjo (tabla 1). La estimulación en las caras anterior y lateral del VI produjo menos asincronía que la estimulación en VD. Asimismo, la estimulación en la región anterior del VI produjo menos diferencia respecto al estudio basal en los parámetros de asincronía analizados (tabla 1).
Fig. 4. Diagrama de barras que representa el valor de la diferencia en el tiempo en el comienzo del strain entre el ventrículo derecho y el izquierdo (Tε DI) en situación basal y tras cada tipo de estimulación. VD: ventrículo derecho.
Fig. 5. Diagramas de barras. A: valor de la desviación estándar en el tiempo de comienzo del strain en las seis caras del ventrículo izquierdo (Tε DE). B: máxima diferencia en el tiempo de comienzo del strain en las seis caras del ventrículo izquierdo (Tε MD), en situación basal y tras la estimulación en las diferentes regiones. VD: ventrículo derecho.
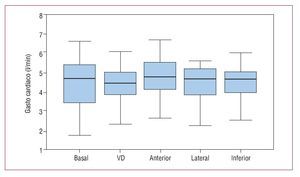
El GC obtenido en los diferentes estudios fue: basal, 4,4 ± 1,2; con estimulación en VD, 4,3 ± 1; con estimulación en la cara anterior del VI, 4,7 ± 1; en la cara lateral del VI, 4,5 ± 1,2; en la cara inferior, 4,4 ± 0,9 (test de Friedman, p = 0,0018). El GC tras la estimulación en la cara anterior del VI fue significativamente mayor que el obtenido tras la estimulación en VD (test de Wilcoxon, p = 0,001). El resto de las estimulaciones en otras zonas del VI no mostró diferencias significativas en el GC respecto a la estimulación en el VD (fig. 6).
Fig. 6. Diagrama de barras que representa el valor del gasto cardiaco en situación basal y tras la estimulación en las diferentes regiones. VD: ventrículo derecho.
El CCI entre observadores y en el observador fueron, para el Tε DE, 0,74 (0,48-0,88) y 0,89 (0,77-0,95) y para el Tε MD, 0,73 (0,46-0,87) y 0,87 (0,73-0,94) respectivamente. El CCI entre observadores y en el observador para la estimación de la integral de velocidad en el tracto de salida del VI fue 0,997 (0,992-0,999) y 0,998 (0,996-0,999).
DISCUSIÓN
Este es el primer estudio que analiza en detalle el efecto agudo en la asincronía mecánica y la eficacia de la función contráctil cardiaca tras la estimulación en diferentes localizaciones durante el postoperatorio inmediato de cirugía cardiaca. Nuestro estudio muestra que la estimulación en VD es una de las que produce más asincronía interventricular e intraventricular entre las diferentes localizaciones analizadas, mientras que la que se realiza en las caras anterior y lateral del VI es una estimulación más parecida a la basal. Por otra parte, aunque el GC obtenido con la estimulación en estas zonas del VI no es diferente del obtenido en condiciones basales, la estimulación en la cara anterior del VI proporciona unas cifras de GC significativamente superiores a las obtenidas cuando la zona estimulada es el VD.
Validez del método
La utilidad del estudio de la asincronía mecánica resulta controvertida, fundamentalmente tras la publicación del ensayo PROSPECT13. En él se muestra que los índices de asincronía mecánica no parecen fiables para predecir la respuesta tras la terapia de resincronización. Sin embargo, no se valoró la asincronía utilizando métodos basados en strain, por lo que sus resultados no son extrapolables a los estudios realizados con estos métodos. Además, estudios recientes basados en la técnica de strain han mostrado mayor utilidad en predecir el efecto de la terapia de resincronización14-16. Un reciente trabajo17 compara los métodos basados en la velocidad y en el strain obtenidos con DT para determinar qué parámetro es mejor predictor de respuesta tras terapia de resincronización. Ningún parámetro obtenido con las velocidades del DT indicó mejoría tras la terapia de resincronización, mientras que la DE del strain fue un buen predictor de la reducción del volumen tras la resincronización.
Hemos analizado parámetros de asincronía basados en strain de forma similar al estudio previo17, pero utilizamos un sector amplio, registrando simultáneamente segmentos opuestos. Así evitamos errores de medición secundarios a la variabilidad de la frecuencia cardiaca. Pero el frame rate obtenido es menor, y la alineación segmentaria puede no ser adecuada. Estos problemas son menores en nuestros pacientes, ya que son casos con corazones no dilatados, buena relación señal/ruido y una alineación más fácil. También medimos el tiempo del strain de manera diferente. A veces es difícil seleccionar el tiempo pico, bien porque puede haber múltiples picos, bien porque puede haber variabilidad entre picos. Para evitar este problema, en nuestro trabajo seleccionamos el punto donde la recta que muestra la deformación principal del segmento supera el valor cero de strain. De esta manera reflejamos el comportamiento principal de la curva de strain y homogeneizamos la medida al extrapolar la curva a un mismo momento, el valor cero de strain. Evita la dificultad de medición que supone la existencia de más de un pico de strain o cuando su comienzo no está claramente definido (fig. 3). Este método ha sido validado previamente en estudios con cardiorresonancia12, y el estudio de variabilidad obtiene buenos resultados en los CCI en las diferentes medidas utilizadas.
Efecto de la estimulación en la función cardiaca de pacientes con función ventricular disminuida y conservada
La asincronía que provoca la estimulación en VD da lugar a diferentes efectos deletéreos, sobre todo en pacientes con baja FE: disminución de la FE, aumento de los episodios de insuficiencia cardiaca y de la mortalidad18-20. Además, en pacientes con disfunción ventricular y trastorno de conducción, la estimulación biventricular o izquierda es más beneficiosa21-28.
La población de nuestro estudio no se caracteriza por una función ventricular disminuida. Un reciente estudio en pacientes con disfunción sinusal a los que se implantó un marcapasos bicameral, que presentaban tanto una conducción auriculoventricular como una FE normales, ha puesto de manifiesto que la estimulación en VD produce una disminución de la FE a largo plazo29. Además, Puggioni et al30, al comparar la estimulación en VI frente a la estimulación en VD en pacientes con fibrilación auricular y ablación del nodo auriculoventricular, pudieron comprobar que la estimulación en VI produjo un efecto hemodinámico agudo favorable, con un aumento en la FE y una disminución del grado de insuficiencia mitral. Este efecto fue similar en pacientes con FE normal y FE deprimida.
En la misma línea, nuestro estudio muestra que la estimulación en VD se asocia con un empeoramiento de los parámetros de asincronía interventricular e intraventricular y que la estimulación en VI produce menos asincronía interventricular e intraventricular que la estimulación en VD. Los lugares de estimulación que produjeron menos ansicronía fueron las paredes anterior y lateral del VI. Esta estimulación no se acompañó de un aumento en el gasto cardiaco, pero sí fue superior al observado cuando se estimuló el VD.
Estudios en el postoperatorio de cirugía cardiaca
Existen pocos estudios que analicen el efecto de diferentes tipos de estimulación en el postoperatorio de cirugía cardiaca y, además, con resultados contradictorios. Healy et al31 mostraron que la estimulación en modo DDD (marcapasos de doble percepción, doble estímulo y doble respuesta) aumenta el flujo coronario, el GC y el flujo del conducto coronario respecto a la estimulación en modo VVI (volumen ventricular izquierdo). La estimulación biventricular no rinde efecto añadido. Schmith et al32 tampoco encontraron mejoría en los parámetros de la función ventricular izquierda general o segmentaria en pacientes con insuficiencia cardiaca y trastorno de conducción cuando realizaron estimulación biventricular después de la cirugía. Bakhtiary et al33, por el contrario, observaron un aumento del GC con estimulación biventricular en aproximadamente el 59% de los pacientes que tenían función ventricular deprimida y QRS ancho. Flynn et al34 estudiaron a pacientes con disfunción ventricular. Analizaron con un catéter de termodilución el efecto de la estimulación en VD, cara anterior y cara posterior de VI y demostraron que la estimulación en la pared inferolateral del VI produce un aumento en el índice cardiaco y en la presión arterial media respecto a la estimulación en VD. Concluyeron que la estimulación en la cara inferolateral del VI ofrece un efecto beneficioso a los pacientes quirúrgicos.
Los estudios previamente mencionados se realizaron en pacientes con disfunción de VI y generalmente con trastornos de conducción. Sin embargo, el presente trabajo se realizó en pacientes con QRS normal y no seleccionados por una FE disminuida. En estos casos hemos observado que los cambios producidos en el GC cambiando el lugar de estimulación son pequeños. No obstante, hemos podido observar que hay tendencia a que el GC disminuya cuando la estimulación se realiza en VD, en contraste con la estimulación en la cara anterior del VI.
Limitaciones del estudio
Los pacientes estudiados no han sido seleccionados por su disfunción ventricular o bloqueo de rama. Por lo tanto, los resultados no pueden ser extrapolables a otros estudios en que se utiliza a pacientes con disfunción ventricular izquierda o bloqueo de rama. Dado que el número de pacientes estudiado es reducido, los resultados deberían confirmarse en estudios posteriores.
Si bien diferentes estudios como el ensayo PROSPECT13 no corroboran la validez de los métodos usuales de evaluación de la asincronía mecánica y, en general, les atribuyen una pobre reproducibilidad, nuestro método sí la muestra y, al utilizar al mismo paciente como control basal, se minimizan los errores de interpretación. Estos cambios, además, son más fáciles de analizar que la comparación entre dos grupos de pacientes. El análisis del strain radial y circunferencial habría aportado mayor información al trabajo y habría aumentado su validez. Lamentablemente, el estudio se hizo con Doppler tisular, lo que imposibilita el análisis radial y circunferencial.
En este estudio no analizamos como parámetros de función ventricular la FE o los volúmenes ventriculares. Para realizar de forma fiable y reproducible estas determinaciones, es necesaria una buena calidad de imagen, lo que no siempre es fácil de obtener en el postoperatorio de cirugía cardiaca. Por ello preferimos analizar los cambios en el GC, que sólo dependen de los cambios en la señal Doppler en el tracto de salida del VI, menos influidos por la calidad de imagen.
CONCLUSIONES
La estimulación en VD produjo una significativa asincronía interventricular e intraventricular en pacientes en el postoperatorio inmediato de cirugía cardiaca. En estos pacientes, los lugares de estimulación que menos asincronía produjeron fueron las paredes lateral y anterior del VI.
Aunque no hubo cambios significativos entre el GC de los pacientes sin estimulación frente al estimulado, pudimos observar una diferencia significativa en el GC obtenido tras la estimulación en VD frente al obtenido tras la estimulación en la pared anterior de VI.
A la luz de nuestros resultados, pensamos que, debido a la facilidad de colocación de los electrodos en cualquier parte del epicardio tras la cirugía, la colocación habitual debería cambiar. Si el paciente no tiene disfunción ventricular, se debería colocarlos en aurícula y en cara anterior o lateral de VI para estimulación en modo DDD.
AGRADECIMIENTOS
Nuestro agradecimiento a los miembros del Departamento de Bioestadística, en especial Alfonso Muriel y Víctor Abraira.
ABREVIATURAS
ε: strain, deformación miocárdica.
Tε DE: desviación estándar en el tiempo de comienzo del strain en las seis caras del ventrículo izquierdo.
Tε DI: diferencia en el tiempo en el comienzo del strain entre el ventrículo derecho y el izquierdo.
Tε MD: máxima diferencia en el tiempo de comienzo del strain en las seis caras del ventrículo izquierdo.
Full English text available from: www.revespcardiol.org
Correspondencia: Dr. J.L. Moya Mur.
Hospital Ramón y Cajal.
Ctra. Colmenar, Km 9,300. 28034 Madrid. España.
Correo electrónico: jmoya.hrc@salud.madrid.org
Recibido el 22 de abril de 2009.
Aceptado para su publicación el 12 de marzo de 2010.