La búsqueda de tratamientos eficaces contra la pandemia actual por COVID-19 ha supuesto un desafïo enorme para la comunidad científica. De hecho, no existe todavía un tratamiento claramente efectivo, además de las medidas de soporte, contra el SARS-CoV-2. Los esfuerzos se han centrado en recuperar fármacos antivirales empleados previamente contra otras infecciónes viricas y en el uso de antiinflamatorios, dado el estado hiperinflamatorio que pueden sufrir los pacientes con COVID-19 y que se asocia con un peor pronóstico de la enfermedad. Sin embargo, estos fármacos, usados en ocasiones de manera compasiva, pueden causar efectos secundarios graves o interacciones farmacológicas que se debe conocer. El objetivo de este artículo es revisar el estado actual del conocimiento sobre los tratamientos farmacológicos más usados contra la COVID-19 en nuestro medio, prestando una especial atención a los efectos secundarios y las interacciones farmacológicas relacionadas con el sistema cardiovascular.
Palabras clave
En diciembre de 2019 se detectaron en China los primeros casos de una neumonía que podia desarrollar rápidamente un síndrome de disnea aguda (SDRA) grave, cuyo agente causante se identificó como un nuevo coronavirus, el coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2)1. Desde entonces, la rápida propagación de la enfermedad coronavírica de 2019 (COVID-19) ha llevado a la situación actual de pandemia global (declarada por la Organizacion Mundial de la Salud el 11 de marzo de 2020), que ha supuesto un enorme desafïo sanitario, científico y socioeconomico.
La COVID-19 presenta un amplio espectro de manifestaciones clí-nicas, desde una forma asintomática o con discretos síntomas consti-tucionales (tos, cefalea, febricula...) hasta el desarrollo de una neu-monía viral. está ultima, en su forma más grave, puede complicarse con insuficiencia respiratoria y SDRA, relacionados con la propia infección vírica y con una intensa actividad proinflamatoria, que puede conducir a fallo multiorgánico y muerte2,3. Ante la emergencia sanitaria que estamos viviendo, la comunidad médica se ha visto obli-gada a considerar y utilizar fármacos ya existentes, en especial aque-llos con experiencias previas en el contexto de otras epidemias recientes por coronavirus, como el coronavirus del síndrome respiratorio agudo grave (SARS-CoV) y el coronavirus del síndrome respiratorio de Oriente Medio (MERS-CoV)4,5. Además del uso de medidas de soporte, fundamentales en estos pacientes, se han empleado diferen-tes tratamientos farmacológicos que, desde un punto de vista didáctico, pueden clasificarse Según tengan una acción antiviral o antiinflamatoria.
Cabe recordar que la forma grave de la COVID-19 se asocia con un aumento de manifestaciones cardiovasculares potencialmente graves (arritmias, daño miocárdico, síndrome coronario agudo, insuficiencia cardiaca...) y que la presencia previa de enfermedad cardiovascular, entre otras comorbilidades, aumenta el riesgo de muerte de los pacientes infectados6-9. Por otro lado, los pacientes con enfermedad cardiovascular se ven expuestos Además a potenciales efectos adver-sos e interacciones farmacológicas del tratamiento específicamente utilizado contra la COVID-1910, lo que puede tener graves consecuencias. El objetivo de este artículo es revisar la evidencia existente sobre los tratamientos farmacológicos con un papel más destacado en el tratamiento de la COVID-19 en nuestro medio, ya sea por su actividad antivírica o por su efecto antiinflamatorio, con un especial interés en los efectos secundarios y las interacciones farmacológicas en el ambito de las enfermedades cardiovasculares (tabla 1).
Farmacos utilizados contra la COVID-19 y sus efectos adversos e interacciones farmacológicas cardiovasculares
| Farmaco | Mecanismo de accion | Efectos secundarios CV | Interacciones con fármacos CV |
|---|---|---|---|
| Antivirales | |||
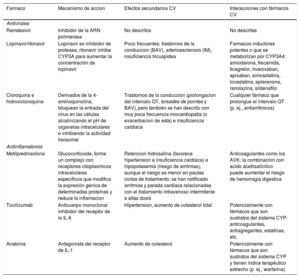
| Remdesivir | Inhibidor de la ARN polimerasa | No descritos | No descritas |
| Lopinavir/ritonavir | Lopinavir es inhibidor de proteasa; ritonavir inhibe CYP3A para aumentar la concentración de lopinavir | Poco frecuentes: trastornos de la conduccion (BAV), arterioesclerosis (IM), insuficiencia tricuspídea | Farmacos inductores potentes o que se metabolizan por CYP3A4: amiodarona, flecainida, ticagrelor, rivaroxaban, apixaban, simvastatina, lovastatina, eplerenona, ranolazina, sildenafilo |
| Cloroquina e hidroxicloroquina | Derivados de la 4-aminoquinolina, bloquean la entrada del virus en las células alcalinizando el pH de organelas intracelulares e inhibiendo la actividad lisosomal | Trastornos de la conduccion (prolongacion del intervalo QT, torsades de pointes y BAV), pero también se han descrito con muy poca frecuencia miocardiopatía (o exacerbacion de esta) e insuficiencia cardiaca | Cualquier fármaco que prolongue el intervalo QT (p. ej., antiarrítmicos) |
| Antiinflamatorios | |||
| Metilprednisolona | Glucocorticoide, forma un complejo con receptores citoplasmicos intracelulares específicos que modifica la expresión génica de determinadas proteínas y reduce la inflamacion | Retencion hidrosalina (favorece hipertension e insuficiencia cardiaca) e hipopotasemia (riesgo de arritmias), aunque el riesgo es menor en pautas cortas de tratamiento; se han notificado arritmias y parada cardiaca relacionadas con el tratamiento intravenoso intermitente a altas dosis | Anticoagulantes como los AVK; la combinacion con acido acetilsalicilico puede aumentar el riesgo de hemorragia digestiva |
| Tocilizumab | Anticuerpo monoclonal inhibidor del receptor de la IL-6 | Hipertension, aumento de colesterol total | Potencialmente con fármacos que son sustratos del sistema CYP: anticoagulantes, antiagregantes, estatinas, etc. |
| Anakinra | Antagonista del receptor de IL-1 | Aumento de colesterol | Potencialmente con fármacos que son sustratos del sistema CYP y tienen índice terapéutico estrecho (p. ej., warfarina) |
ARN: acido ribonucleico; AVK: antagonistas de la vitamina K; BAV: bloqueo auriculoventricular; CYP: citocromo P450; IL: interleucina.
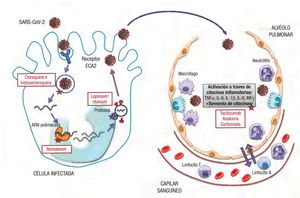
El tratamiento de los pacientes afectos de COVID-19, fundamentalmente los casos graves, ha supuesto un desafío enorme. Tal como se ha mencionado, no existe evidencia procedente de ensayos clínicos controlados para recomendar un tratamiento específico para el SARS-CoV-2. De hecho, dado que el desarrollo de un antiviral específico y potente puede tardar años (un tiempo del que evidentemente no se dispone), se ha intentado recuperar y evaluar fármacos que han mostrado cierta actividad antiviral contra otros coronavirus4,5. Estos agentes han sido o están siendo evaluados en numerosos ensayos clí-nicos en el contexto de la pandemia de COVID-19, aunque a algunos de ellos se les ha dado en la practica clínica un uso compasivo. Se resumen en este apartado las características de los principales fármacos antivirales utilizados durante la pandemia (figura 1). Debido a la poca extension del artículo, no se comentan otros tratamientos que se han propuesto durante la pandemia (p. ej., interferones), aunque no haya evidencia clínica disponible en el contexto de COVID-19.
El remdesivir es un analogo de nucleotido que actua inhibiendo la acción de la ARN polimerasa y el proceso de multiplicacion de diver-sos virus11. Se lo ha considerado el tratamiento antiviral más promete-dor contra el SARS-CoV-2 por la eficacia mostrada en estudios in vitro y modelos animales contra coronavirus patógenos como el SARS-CoV y el MERS-CoV12, sí bien su desarrollo clínico previo se situa fundamentalmente en el tratamiento de la infección por el virus del Ébola, donde mostro una eficacia clínica discreta13.
En lo que respecta a la pandemia actual, Además de su evaluacion en ensayos clínicos, se aprobo inicialmente en algunos países el uso compasivo del remdesivir en formas graves de COVID-19 (infusion de 200 mg el primer día, seguida de 100 mg/24 h en los siguientes 2-10 días de tratamiento). En un ensayo clínico multicéntrico realizado en China en pacientes con enfermedad grave (n = 237) comparando el remdesivir con placebo (en proporción 2:1), no se observaron dife-rencias en mortalidad entre grupos y el unico dato esperanzador fue una tendencia numérica (no estadísticamente significativa) hacia una reducción con el remdesivir del tiempo hasta la mejoríasíi se iniciaba en los primeros 10 días tras el inicio de los síntomas14. más reciente-mente, el informe preliminar de un ensayo clínico realizado en pacientes con COVID-19 y afección del tracto respiratorio inferior tampoco mostro diferencias significativas en cuanto a mortalidad, perosíi una reducción del tiempo hasta la recuperacion con el remdesivir frente a placebo (mediana, 11 frente a 15 días; p < 0,001)15. Finalmente, otro ensayo clínico en pacientes que no requerían venti-lacion mecánica mostro resultados similares con un tratamiento con remdesivir durante 5 o 10 días, aunque sin compararlos con un grupo a placebo16. Actualmente siguen en marcha diversos estudios clínicos que aportaran más datos sobre la eficacia del remdesivir contra el SARS-CoV-2.
En general, remdesivir es un fármaco relativamente bien tolerado, aunque entre los efectos adversos descritos se encuentran nauseas, vomitos, diarreas, elevación de enzimas hepaticas, empeoramiento del aclaramiento renal e hipotensión durante la infusion15,17. Este ultimo punto insta a tener precaucion a la hora de administrar el far-maco a pacientes que requieren terapia vasopresora por su estado hemodinamico. Pese a que el remdesivir es un profarmaco que se transforma en su metabolito activo principalmente por la isoforma del citocromo P450 (CYP) 3A4, hasta el momento no se han descrito interacciones significativas con fármacos utilizados para enfermeda-des cardiovasculares18.
Inhibidores de proteasas víricas: lopinavir/ritonavirAlgunos inhibidores de la proteasa del virus de la inmunodeficien-cia humana 1 (VIH-1) como, por ejemplo, el darunavir/cobicistat, se postularon inicialmente como tratamientos para la COVID-19, sí bien el lopinavir/ritonavir ha sido el que sin duda ha tenido un papel más destacado. El lopinavir inhibe la multiplicacion viral y suele combi-narse con ritonavir para aumentar su vida medía (inhibiendo su metabolizacion en el sistema CYP) y, en consecuencia, su eficacia. La justificacion para el uso de está combinacion contra la COVID-19 deriva de la actividad demostrada previamente in vitro y en modelos animales contra el SARS-CoV y el MERS-CoV19,20.
A pesar de la poca evidencia sobre la eficacia potencial de está combinacion contra la infección por SARS-CoV-2, el lopinavir/ritona-vir se ha estado utilizando solo o en combinacion con otros fármacos durante la pandemia, con una dosis propuesta de 400/100 mg/12 h vía oral, individualizando la duracion del tratamiento hasta un maximo de 14 días. Los datos clínicos más relevantes publicados hasta ahora provienen de un ensayo clínico en el que se aleatorizo a los pacientes (n = 199) hospitalizados por COVID-19 a recibir el lopinavir/ritonavir anadido a la terapia estandar o no recibirlo. No se observaron diferencias significativas en el tiempo hasta la mejoría clínica, la mortalidad a los 28 días o el aclaramiento viral, aunque se observó un menor tiempo de estancia en unidades de cuidados inten-sivos, un menor tiempo de hospitalización (1 día de diferencia) y un porcentaje mayor de pacientes con mejoría clínica a los 14 días en el grupo que recibio el farmaco21. A la espera de nuevos resultados de otros estudios que están en marcha, a día de hoy la utilidad del lopinavir/ritonavir en pacientes con COVID-19 parece bastante limitada.
Entre las reacciones adversas frecuentes que pueden darse con el lopinavir/ritonavir, destacan las alteraciones gastrointestinales (nauseas, vomitos o diarreas) y la hepatotoxicidad, con aumento de las transaminasas18, y se han descrito también, Según ficha técnica pero poco frecuentes, trastornos de la conduccion (bloqueo auriculoventri-cular), arterioesclerosis (infarto de miocardio) e insuficiencia tricus-pídea. Un problema notable de está combinacion es el gran número de interacciones farmacológicas en las que puede estar involucrada, debido a que el ritonavir es un potente inhibidor del CYP3A y la gluco-proteína P. En lo que se refiere a la interacción en CYP3A, se puede producir una reducción en la acción de los fármacos que precisan una bioactivación en el citocromo o un aumento en la concentración del farmacosíi no se degrada, lo que podría generar un aumento de su efecto o su toxicidad. Entre los tratamientos cardiovasculares de uso frecuente con gran riesgo de interacción con el ritonavir, no sería recomendable el uso conjunto (en otros casos podría ser necesario un ajuste de dosis o una monitorización estricta) de: antiarrítmicos (amiodarona, dronedarona, flecainida), anticoagulantes orales (riva-roxabán, apixabán), antiagregantes inhibidores del receptor plaqueta-rio P2Y12 (ticagrelor), antagonistas del calcio (lercanidipino), antiangi-nosos (ivabradina, ranolazina), diuréticos (eplerenona), estatinas (lovastatina, simvastatina) e inhibidores de la fosfodiesterasa (silde-nafilo).
Es de destacar que se ha especulado mucho sobre la interacción entre el lopinavir/ritonavir y los antiagregantes inhibidores del receptor P2Y12, especialmente con el clopidogrel (reduce la formación de su metabolito activo y su eficacia antiagregante) y el ticagrelor (aumenta su concentración y su potencia antiagregante), y se ha llegado a pro-poner el uso prioritario del prasugrel (con un efecto menos afectado por la interaccion), aunque este aspecto podría matizarse. En este caso particular, lo razonable es individualizar la necesidad de uso del fármaco antiviral, dados los datos controvertidos sobre su beneficio, sí ello conlleva cambiar la estrategia antiagregante habitual (basada en el balance entre los riesgos isquémico y hemorrágico); unicamentesíi se considera imprescindible emplear el antiviral, sí sería recomen-dable utilizar el prasugrel durante el tiempo que se administren con-comitantemente ambos tratamientos22. La monitorización con prue-bas de función plaquetaria puede ayudar a conseguir la inhibición plaquetaria deseada en casos seleccionados.
Cloroquina e hidroxicloroquinaAmbos compuestos, cloroquina e hidroxicloroquina, son derivados de la 4-aminoquinolina y se han usado ampliamente en la profilaxis y el tratamiento de la malaria, así como en algunas enfermedades reu-máticas como la artritis reumatoide y el lupus eritematoso sistémico, buscando un efecto antiinflamatorio y modulador de la respuesta inmunitaria. Su mecanismo de acción antiviral no se conoce totalmente, pero se ha postulado que pueden bloquear la entrada del virus en las células alcalinizando el pH de organelas intracelulares e inhi-biendo la actividad lisosomal23. Ambos fármacos han mostrado capa-cidad de inhibir la multiplicacion in vitro de diferentes virus a ARN, como SARS-CoV y MERS-CoV23, con una mayor potencia de la hidroxicloroquina para inhibir el SARS-CoV-224. Pese a que no hay evidencia firme de la eficacia clínica de estos compuestos en pacientes con infecciónes virales por SARS-CoV o MERS-CoV, la hidroxicloroquina (con menor toxicidad que la cloroquina) se ha usado ampliamente durante la pandemia por COVID-19 para el tratamiento de la infección (generalmente dosis de carga de 400 mg/12 h el primer día, seguida de 400-600 mg/24 h durante 4 días) e incluso para la profilaxis de poblaciones en riesgo.
Desde un punto de visto clínico, la utilidad de la hidroxicloroquina en la COVID-19 es extraordinariamente controvertida y ha generado un intenso debate científico, y la escasa evidencia disponible generalmente viene de estudios observacionales o no aleatorizados. En un estudio no aleatorizado con una muestra pequena (n = 36) de pacientes con COVID-19, se observó un aclaramiento viral más rápido en los sujetos que recibieron hidroxicloroquina (especialmente en los casos en que se anadio también azitromicina) frente a los sujetos de control que no recibieron el fármaco25. Sin embargo, estudios observacionales posteriores a mayor escala no han mostrado beneficio alguno con el uso de la hidroxicloroquina en pacientes con formas más graves de la COVID-1921,6,27 y resulta especialmente interesante por su tamaño (n = 1.376) la investigación de Geleris et al.26 en pacientes hospitalizados por COVID-19, en la que la administración de hidroxicloroquina no se asocio con una reducción del evento combinado de muerte o intuba-cion, aunque tiene la limitacion de que los pacientes que recibieron el fármaco tenían una afección basal más grave. Por último, en el momento de redactar este documento hay una importante controver-sia sobre la seguridad de la cloroquina o la hidroxicloroquina en pacientes con COVID-19 (lo que incluye la retractacion de algun ar-tículo publicado en una revista de alto impacto). En resumen, los datos disponibles actualmente no permiten pronunciarse claramente a favor o en contra del uso sistemático de la hidroxicloroquina en los pacientes con COVID-19.
Tanto la cloroquina como la hidroxicloroquina son fármacos generalmente bien tolerados, aunque pueden causar efectos adver-sos muy graves, entre los que se encuentran la hipoglucemia grave, la retinopatía, la miopatía, las alteraciones hemáticas (anemia, leu-cocitopenia y trombocitopenia), trastornos neuropsiquiátricos y diversas alteraciones cardiovasculares (principalmente trastornos de la conduccion, pero también se han notificado con muy poca fre-cuencia casos de miocardiopatía e insuficiencia cardiaca). Sin embargo, cabe mencionar que la mayoría de estas complicaciones se han descrito en tratamientos cronicos o a largo plazo28. En el con-texto de la COVID-19, el tratamiento con hidroxicloroquina estaría limitado a unos pocos días, por lo que lo esencial es una monitoriza-cion estricta del electrocardiograma por el riesgo que conlleva el fármaco (toxicidad dependiente de la dosis) de que se produzcan prolongación del intervalo QT, torsade des pointes y bloqueo auricu-loventricular18. Por ejemplo, sí el intervalo QTc es > 500 ms o se incrementa en más de 60 ms, sería recomendable suspender la administración de hidroxicloroquina. Es fundamental, por lo tanto, evitar la combinacion de la hidroxicloroquina con cualquier fármaco que prolongue el intervalo QT (antiarrítmicos, antipsicoticos, anti-depresivos, etc.), incluida la azitromicina (en algun momento se indico que podrían tener un efecto sinérgico contra el SARS-CoV-2), y tener precaucion al administrar otros fármacos que pueden alargar el intervalo PR, como los bloqueadores beta, para no aumentar el riesgo de bloqueo auriculoventricular avanzado.
Tratamientos con efecto antiinflamatorioLa letalidad de la COVID-19 está determinada en gran medida por la gravedad de la afección respiratoria, que se relaciona con una acti-vidad proinflamatoria muy marcada que, a su vez, contribuye de manera relevante a la coagulopatía asociada con está enfermedad y, por ende, a las frecuentes y graves complicaciones trombóticas obser-vadas en estos pacientes22. Este estado de hiperinflamación debido a la «tormenta de citocinas» es, por lo tanto, un factor clave de mal pro-nostico en la evolución de la enfermedad, lo que justifica el abordaje con fármacos antiinflamatorios en está situación (figura 1). Igual que en el apartado anterior, no se entra a valorar otros tratamientos en investigación de los que aun no hay datos clínicos disponibles (p. ej., los inhibidores selectivos de las cinasas asociadas con Janus, JAK1 y JAK2, el ruxolitinib y el baricitinib).
GlucocorticoidesEl uso de glucocorticoides se ha planteado por su potente efecto antiinflamatorio para disminuir el daño pulmonar y el ulterior SDRA producido por la excesiva respuesta inflamatoria que induce el SARS-CoV-2. Sin embargo, no existe un consenso claro sobre el posi-ble beneficio de su uso en distintas neumonías víricas producidas por coronavirus (SARS-CoV y MERS-CoV) y virus Influenza, ya que se ha senalado que pueden retrasar el aclaramiento del virussíi no se utili-zan en el momento adecuado (con evidencia de estado inflamatorio exacerbado) e incluso empeorar el curso de la enfermedad29-31. En el contexto que nos ocupa, no se ha recomendado el uso sistemático de glucocorticoides, sino que se ha centrado su utilizacion en casos de pacientes graves, sobre todo con daño alveolar difuso y SDRA, en un intento de mejorar su evolución disminuyendo la gran respuesta inflamatoria, y se ha postulado también el supuesto beneficio poten-cial de mejorar las secuelas pulmonares tras el SDRA (p. ej., la evolucion a fibrosis pulmonar). Los fármacos de este grupo más usados han sido la metilprednisolona a dosis altas (1-2 mg/kg/24 h) y la dexame-tasona durante pocos días, y es razonable evitar tratamientos prolon-gados para minimizar los efectos secundarios y las infecciónes opor-tunistas.
Entre las experiencias publicadas hasta ahora sobre el tratamiento con glucocorticoides para la COVID-19, destacan un estudio observa-cional retrospectivo que mostro un posible beneficio de la metilpred-nisolona en pacientes con neumonía por COVID-19 y SDRA en cuanto a reducción de mortalidad32, y un estudio con un diseno cuasi-experi-mental (antes y después de la intervencion) en el que el tratamiento precoz con metilprednisolona se asocio con una menor frecuencia de eventos adversos (combinado de necesidad de unidad de cuidados intensivos, necesidad de ventilación mecánica o muerte) en pacientes (n = 213) ingresados por COVID-19 moderada o grave33. sí bien otros estudios destacan el delicado equilibrio o incluso el desequilibrio entre beneficio y efectos adversos en este contexto29, en el momento de redactarse este documento se han hecho publicos los resultados preliminares del ensayo clínico aleatorizado RECOVERY, que ha mos-trado una reducción de la mortalidad con la dexametasona en pacien-tes hospitalizados por COVID-19 que requerían asistencia respiratoria (NCT04381936).
Es bien sabido que el tratamiento con glucocorticoides genera múltiples efectos secundarios que se relacionan con la potencia del fármaco empleado, la dosis y la duracion del tratamiento. Un repaso exhaustivo de estos efectos adversos se escapa del objetivo de este artículo, por lo que se comentaran unicamente los que afectan al sis-tema cardiovascular. Debido a su mecanismo de accion, puede produ-cirse retencion de agua y sodio, con el consiguiente riesgo de hiper-tension e insuficiencia cardiaca, e hipopotasemia, lo que puede favorecer la aparición de determinadas arritmias, aunque el riesgo de estos efectos adversos es menor en tandas cortas de tratamiento. Aunque quiza infrecuentes, se han descrito también arritmias y parada cardiaca en pacientes en tratamiento intermitente con pulsos intravenosos de altas dosis del farmaco.
En lo que respecta a las interacciones farmacologicas, cabe des-tacar la posibilidad de una disminución de la concentración plas-matica de dicumarínicos (mecanismo no conocido), por lo que se debe monitorizar la coagulación y ajustar la dosissíi fuera necesa-rio34. Asimismo, debe considerarse la posible interacción entre la metilprednisolona y el acido acetilsalicílico (puede disminuir la concentración sanguínea cuando se administra conjuntamente con el glucocorticoide), teniendo en cuenta Además que el uso con-junto de ambos fármacos puede aumentar el riesgo de ulcera gastrica o hemorragia intestinal. Es relevante mencionar que los inhi-bidores del CYP3A (p. ej., ritonavir, cobicistat o diltiazem) pueden ocasionar un aumento de las concentraciones plasmáticas de metilprednisolona y, por lo tanto, que aumente el riesgo de toxici-dad o efectos adversos.
Inhibidores de la interleucina 6: tocilizumabDentro de la sofisticada respuesta inflamatoria, la interleucina 6 (IL-6) participa en diversos procesos como la activación de los linfoci-tos T y la induccion de secrecion de inmunoglobulinas y proteínas de fase aguda. Se ha senalado la utilidad de los inhibidores de la IL-6 para el tratamiento de los casos graves de COVID-19 con la intencion de frenar la llamada «tormenta de citocinas» asociada con la infección, principalmente con el tocilizumab, mientras que otros inhibidores de la IL-6 (como el sarilumab) han tenido menos predicamento. El tocili-zumab es un anticuerpo monoclonal humanizado que se une al receptor de la IL-6 (tanto en su forma soluble como unida a membrana) y actua inhibiendo la senalizacion mediada por estos recepto-res. Se emplea en el tratamiento de la artritis reumatoide y la artritis idiopatica juvenil, así como en el tratamiento del síndrome de libera-cion de citocinas inducido por la terapia de células T con receptor de antígeno quimérico (CART)5,18. La posología propuesta para el tratamiento de la COVID-19 es una dosis unica de 600 mg (400 mg en caso de pacientes con peso < 75 kg), similar a la utilizada en el síndrome de liberación de citocinas asociado con la terapia CART, con la posibili-dad de una segunda infusion a las 12 h en los pacientes que sufran un repunte de los parámetros analíticos inflamatorios tras una mejoría inicial.
En el momento de está redaccion, se están realizando diversos ensayos clínicos sobre el uso de tocilizumab en la infección por SARS-CoV-2, solo se dispone de los resultados de algunas experiencias observacionales con resultados esperanzadores en pequenas series de pacientes. Una experiencia preliminar (sin grupo de control o de referencia) realizada en China mostro una mejoría relativamente rápida en parámetros clínicos y analíticos tras iniciar el tocilizumab en pacientes con formas graves de COVID-19 (n = 20), Además de una buena tolerancia al farmaco35. más relevantes son los hallazgos de un estudio con diseno antes-después de la intervencion en sujetos con neumonía por COVID-19 e insuficiencia respiratoria, en el que el grupo que recibio tocilizumab (n = 63), comparado con el de control, presento una mejoría en la evolución clínica y una mayor superviven-cia (el 3,2 frente al 47,8%; hazard ratio = 0,035; intervalo de confianza del 95%, 0,004-0,347; p = 0,004), aunque hay que ser cautos, dados el diseno y el pequeño tamaño del estudio36.
No se recomienda la administración de tocilizumab a pacientes con sepsis o una infección activa distinta de SARS-CoV-2; Además, debe vigilarse especialmente la posibilidad de reactivación de ciertas infecciónes, como una hepatitis B crónica o una tuberculosis. Entre los efectos adversos, los más frecuentes fueron infecciónes en el tracto respiratorio superior, nasofaringitis, cefalea, hipertension y elevación de transaminasas; destaca la posible aparición de trastornos hemati-cos (neutropenia y trombocitopenia), el aumento de parámetros lipí-dicos (aunque no suele haber incremento del índice aterogénico) y la hepatotoxicidad, por lo que debe administrarse con precaucion a pacientes con enfermedad hepatica. En cuanto a las interacciones medicamentosas, cabe mencionar que la inflamación cronica, estimu-lada por citocinas como la IL-6, disminuye la expresión de las enzimas CYP, por lo que una inhibición potente de la senalizacion mediada por IL-6 puede revertir dicho efecto y aumentar la expresión de las men-cionadas enzimas, con lo que podrían aumentarse las concentracio-nes plasmáticas de fármacos que son sustratos del sistema CYP (anticoagulantes, antiagregantes, estatinas...). Dada la larga semivida de eliminacion del tocilizumab, este efecto puede ser significativo hasta 1-2 semanas tras la administración de una sola dosis del farmaco. Por lo tanto, sería recomendable monitorizar la acción de fármacos con indices terapéuticos estrechos, como s el caso de la warfarina, porsíi fuera necesario un ajuste de dosis5,34.
Antagonistas del receptor de la interleucina 1: anakinraLa IL-1 es otra citocina que interviene en diversos procesos de la respuesta inflamatoria. El anakinra es un antagonista del receptor de está IL-1 (inhibe la actividad inflamatoria de IL-1a y IL-1 ß), utilizado en diferentes trastornos como la artritis reumatoide, la fiebre medite-rranea familiar o la enfermedad de Still. También se han obtenido buenos resultados en pacientes con sepsis y una respuesta inflamato-ria desmesurada (síndrome de activación macrofagica)37. Por todo ello, se ha pensado que podría tener un papel para reducir la inflama-cion producida por SARS-CoV-2.
La experiencia con el uso de anakinra en pacientes con COVID-19 es escasa. En un pequeño estudio observacional monocéntrico reali-zado en pacientes con SDRA por COVID-19, el uso de dosis altas de anakinra (5 mg/kg/12 h endovenosa hasta la mejoría clínica) se asocio con una mayor mejoría clínica (incluida la supervivencia) comparado con el tratamiento convencional38. Sin embargo, hay que esperar al resultado de los ensayos clínicos en marcha para determinar la verda-dera eficacia del farmaco.
El anakinra posee una semivida corta (4-6 h) y un aceptable perfil de seguridad. Los principales efectos adversos notificados son infecciónes graves (principalmente de vías respiratorias), trastor-nos hematologicos (neutropenia, trombocitopenia), reacciones en el lugar de la inyeccion y aumento de la concentración plasmática de colesterol. No se recomienda iniciar este tratamiento en pacien-tes con neutropenia o infecciónes activas y hay que tener precau-cion ante la alteración de la función hepática. En cuanto a las inter-acciones medicamentosas, por un mecanismo similar al comentado con el tocilizumab, podría ser conveniente monitorizar la acción de fármacos con indices terapéuticos estrechos que se metabolizan por CYP39.
ConclusionesLa rápida evolución de la pandemia de COVID-19 ha representado un reto sociosanitario sin precedentes en nuestra generacion. De hecho, se puede afirmar que la realidad clínica ha ido muy por delante de la capacidad para generar evidencia científica de calidad sobre potenciales tratamientos contra la enfermedad, con lo que en deter-minadas circunstancias se han utilizado fármacos sin un claro benefi-cio o directamente futiles y con efectos secundarios potencialmente graves. Están en marcha un gran número de ensayos clinicos (se calcula que más de 300) que sin duda aportarán información relevante en el futuro proximo para ayudar a seleccionar y personalizar el tratamiento de estos pacientes. A la espera de esos resultados y, aun-que desafortunadamente no existen todavía tratamientos farmacolo-gicos claramente efectivos contra el SARS-CoV-2 (es el deseo de los autores que este hecho cambie lo antes posible), es relevante conocer la eficacia y la seguridad de los fármacos antivirales y antiinflamato-rios que se han empleado. Desde el punto de vista cardiológico, algu-nos de estos fármacos presentan efectos adversos graves y otros con-dicionan interacciones farmacológicas peligrosas. Al igual que se ha realizado un esfuerzo conjunto encomiable en la práctica clínica por un buen número de especialidades (neumologia, enfermedades infec-ciosas, cuidados intensivos, anestesia, medicina interna, cardiologia, etc.) para hacer frente a está crisis, es deseable mantener ese enfoque multidisciplinario a la hora de generar y evaluar la evidencia disponible, con el fin de optimizar los protocolos asistenciales.
Conflicto de interesesJ.L. Ferreiro declara haber recibido honorarios por ponencias de Eli Lilly Co., Daiichi Sankyo, Inc., AstraZeneca, Roche Diagnostics, Pfizer, Abbott, Boehringer Ingelheim, Bristol-Myers Squibb y Ferrer; honorarios por consultorias de AstraZeneca, Eli Lilly Co., Ferrer, Boston Scientific, Pfizer, Boehringer Ingelheim, Daiichi Sankyo Inc. y Bristol-Myers Squibb, y honorarios por becas de investigación de AstraZeneca. O. Murillo declara haber recibido honorarios por ponencias de Pfizer. Los demás autores no tienen conflictos de inte-reses que declarar.
información sobre el suplementoEste artículo forma parte del suplemento titulado «COVID-19 y enfermedad cardiovascular. Un nuevo reto para la cardiologia», que ha sido patrocinado por Boehringer Ingelheim España.