La pandemia ocasionada por la rápida expansión del SARS-CoV-2 ha producido la mayor crisis sanitaria de la época moderna. La estrecha relación del virus con la enzima de conversión de la angiotensina ha suscitado un torrente de especulaciones por el posible papel del sistema renina-angiotensina-aldosterona (SRAA) en la regulación de la infección. La alerta generada ha cuestionado el empleo de fármacos inhibidores del SRAA, tanto los inhibidores de la enzima de conversión de la angiotensina como los antagonistas del receptor de la angiotensina II. Esta situación ha motivado la publicación de varios estudios que no han encontrado asociación entre el uso de inhibidores del SRAA y una mayor susceptibilidad a la infección o a una peor evolución clínica.
En esta revisión se abordan los aspectos más relevantes de la interacción del SARS-CoV-2 con el SRAA y las implicaciones clínicas en torno al uso de inhibidores del SRAA durante la pandemia.
Palabras clave
El coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2) es el nuevo coronavirus causante de la enfermedad denominada enfermedad coronavírica de 2019 (COVID-19). El 11 de marzo de 2020, la Organization Mundial de la Salud (OMS) declaró la situación de pandemia ante la rápida expansión de la enfermedad. España ha sido una de las zonas del mundo más castigadas, con gran número de casos y fallecimientos. Las primeras observaciones epide-miologicas pusieron de manifiesto la alta prevalencia de enfermeda-des cardiovasculares (ECV), especialmente hipertension arterial (HTA), en pacientes con afección grave por COVID-19. La comorbilidad cardiovascular se asocio con un mayor riesgo de complicaciones y muerte hospitalaria1. En la búsqueda de una explication, se ha involucrado al sistema renina-angiotensina-aldosterona (SRAA) debido a su estrecha relación con el virus2. está hipótesis ha llegado a cuestionar el empleo de fármacos inhibidores del SRAA (iSRAA) durante la pandemia2,4. La polémica desatada ha producido una ingente publicacion de trabajos cientificos que han intentado aclarar la cuestion desíi los iSRAA se asocian con una mayor infección por SARS-CoV-2 y una peor evolución de la enfermedad.
Esta revisión pretende dar una visión global del problema, prestando especial atención a la compleja interrelación del virus con el SRAA y a la evidencia que se ha generado en torno al uso de iSRAA.
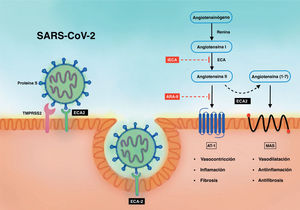
SARS-CoV-2 Y sistema renina-angiotensina-aldosteronaEl SRAA tiene un papel esencial en la homeostasis del sistema cardiovascular a través de sus efectos en la regulation de la presión arterial y el equilibrio electrolítico5. En su vía clásica, la renina degrada el angiotensinogeno en angiotensina I, que posteriormente se convierte en angiotensina II por accion de la enzima de conversión de la angio-tensina (ECA) (figura 1 ). La angiotensina II, principal efector del SRAA, es un potente agente vasoconstrictor que además induce hipertrofia y fibrosis en el tejido miocárdico. La desregulacion del SRAA induce inflamación y remodelado estructural, lo que interviene de manera decisiva en la génesis de las ECV.
Relacion entre el SARS-CoV-2 y el SRAA. ARA-II: antagonistas del receptor de la angiotensina II; AT-1: receptor tipo 1 de la angiotensina II; ECA: enzima de conversión de la angiotensina I; ECA2: enzima de conversión de la angiotensina II; IECA: inhibidores de la ECA; MAS: receptor acoplado a proteína G; SARS-CoV-2: coronavirus 2 del síndro-me respiratorio agudo grave; SRAA: sistema renina-angiotensina-aldosterona; TMPRSS2: proteasa transmembrana de serina 2 asociada con la superficie del huésped.
El SARS-CoV-2 tiene una estrecha relación con el SRAA, a través de la enzima de conversión de la angiotensina II (ECA2)6. La ECA2 es un péptido ubicuo, altamente representado en la superficie de células epiteliales del alvéolo pulmonar, células del endotelio vascular y en el epitelio intestinal7. El virus emplea está enzima como receptor funcio-nal para introducirse en las células del tracto respiratorio y facilitar la infección8. La proteína S (spike protein) del virus contiene el dominio de unión al receptor de ECA2 y, con la ayuda de la serina proteasa TMPRSS2, permite la fusión de ambas membranas y de está manera permite la entrada del genoma viral en el interior celular (figura 1).
La ECA2 es fundamental en la actividad del SRAA, ya que es un elemento clave en la respuesta contrarreguladora ante la activación del SRAA9. La ECA2 degrada la angiotensina II para producir angiotensina (1-7) y en menor medida convierte la angiotensina I en angiotensina (1-9). Estos péptidos presentan propiedades vasodilatadoras, antioxidantes y antiinflamatorias, lo que atenua los efectos deletéreos de la angiotensina II10. Estos efectos cardioprotectores representan una potencial diana terapéutica para el tratamiento de las ECV.
En modelos experimentales realizados con el SARS-CoV, causante del brote epidémico en 2003, se observó que la infección por el virus produce una disminución de la ECA2, resultado de su unión a la proteína S11. De manera secundaria, la regulación a la baja de la ECA2 ocasiona una mayor concentración de angiotensina II y un mayor daño pulmonar que se reduce mediante el bloqueo del receptor 1 de la angiotensina II (AT1). Estos hallazgos indican que la activación pulmonar del SRAA participa en la patogenicidad del virus por su capacidad para amplificar la respuesta inflamatoria y contri-buir al daño pulmonar12, 13. Aunque estos hallazgos no se han confirmado en la infección por SARS-CoV-2, dada la similitud de ambos virus es plausible que también produzca una regulación a la baja de la ECA-2.
iSRAA Y COVID-19El empleo de fármacos iSRAA está ampliamente extendido y son la primera línea de tratamiento de multitud de ECV y nefropatías14. Se ha demostrado que protegen y revierten el daño cardiovascular y renal debido a sus potentes efectos antiarterioescleroticos, antiproli-ferativos y antiinflamatorios. Los inhibidores de la ECA (IECA) y los antagonistas del receptor 1 de la angiotensina II (ARAII) son los far-macos más usados de está familia terapéutica.
Efectos de los iSRAA en la ECA2Debido a que los IECA y ARA-II actúan a diferentes niveles en el SRAA, sus efectos en la expresión de la ECA2 y la concentración de angiotensina II se presumen distintos. En estudios animales, el trata-miento con IECA produce una disminución de la ECA que no afecta directamente a la actividad de la ECA2. Como consecuencia, dismi-nuye significativamente la angiotensina II y aumenta la angiotensina (1-7)15-17. Por el contrario, se ha observado que el tratamiento con ARA-IIsíi incrementa la actividad de la ECA2, Además de aumentar la concentración de angiotensina II y angiotensina (1-7)16,18,19. Es importante destacar que la concentración plasmática de la ECA2 puede no ser un indicador fiable de la actividad del receptor de membrana, ya que a este lo regula de manera independiente la proteasa ADAM1720. Los resultados contradictorios de los diferentes modelos experimentales, junto con la heterogénea expresión de la ECA2 en los tejidos y la difícil traslacion a la fisiología humana, hacen que sea extremadamente complejo predecir el efecto de los diferentes iSRAA en la activi-dad de la ECA2.
Recientemente, en un subanalisis del estudio BIOSTAT-CHF, se rea-lizaron mediciones de la ECA2 plasmática en pacientes con insufi-ciencia cardiaca (IC)21. Al contrario que en los trabajos previos, no se observó un incremento de la ECA2 en pacientes en tratamiento con IECA o ARA-II, mientras que sí se observó con los antagonistas del receptor de mineralocorticoides (ARM).
COVID-19 y enfermedad cardiovascularEn los trabajos iniciales se ha observado una alta prevalencia de ECV (enfermedad coronaria, IC y enfermedad renal cronica) en pacientes con COVID-19. Un Metanálisis de población de China con 1.576 pacientes con COVID-19 mostro unas prevalencias de HTA, diabetes mellitus y ECV del 21,1, el 9,7 y el 8,4% respectivamente22. Las ECV se han asociado de manera recurrente con una manifestacion más grave de la enfermedad, mayores complicaciones y una elevada mortalidad22-25. En el Metanálisis de Li et al.26, el antecedente de HTA y ECV incremento por 2 y por 3 el riesgo de tener una infección más grave con necesidad de ingreso en unidad de cuidados intensivos (UCI). Todavía se desconocen los mecanismos precisos que intervie-nen en está asociacion24.
Controversia sobre los efectos de los iSRAA en la COVID-19Desde el inicio de la pandemia por SARS-CoV-2, ha surgido un profundo dilema alrededor del empleo de los iSRAA27. Varios autores mostraron su preocupacion por el potencial riesgo de estos fármacos en favorecer la infección y su virulencia23. Pese a que estas especula-ciones no están fundamentadas en evidencia solida, llegaron a publi-carse trabajos con algoritmos que recomendaban suspender el trata-miento en determinadas situaciones28. rápidamente, las principales sociedades científicas respondieron con varios comunicados advir-tiendo de los serios riesgos para la salud que conllevaba la suspension del tratamiento con iSRAA29,30. En España, la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) ha difundido varias notas informativas durante la pandemia, con información actualizada sobre el problema y con recomendaciones basadas en la evidencia disponible31. En el otro sentido, también se han publicado trabajos que defienden un posible papel protector de los iSRAA, por su capacidad para atenuar los efectos negativos de la infección y disminuir la res-puesta inflamatoria32,33. Las 2 principales hipótesis sobre el impacto del tratamiento con iSRAA son:
- 1.
Efectos daninos de los iSRAA: Según esta teoría, los iSRAA predisponen a padecer una enfermedad más grave. Se fundamenta en el aumento de expresión de la ECA (upregulation) observado en estudios previos16,18. Este hecho aumentaría los receptores disponibles para facilitar la infección y favorecería su agresividad3,34,35. está hipótesis explicaría las altas prevalencias de HTA, diabetes y ECV en pacientes con una manifestacion grave de la enfermedad res-pecto a aquellos con un curso leve24.
- 2.
Efectos beneficiosos de los iSRAA: la infección por el virus condi-ciona una regulación a la baja (downregulation) de la ECA2, lo que favorece una producción excesiva de angiotensina II y la conse-cuente amplificacion de la respuesta inflamatoria y el daño pul-monar32. El tratamiento con ARA-II podría ser protector por 2 mecanismos complementarios: aumento de la expresión de la ECA2 (upregulation), con la consecuente degradacion de la angio-tensina II a angiotensina (1-7), y por otro lado podría contrarrestar los efectos deletéreos de la angiotensina II mediante el bloqueo de los receptores AT111.
La controversia suscitada en torno al uso de los iSRAA durante la pandemia ha generado una respuesta rápida y eficiente de la comuni-dad científica, con la publicacion de numerosos trabajos que han intentado responder a la cuestion desíi los iSRAA se asocian con mayor riesgo de infección y peor evolución clínica (tabla 1).
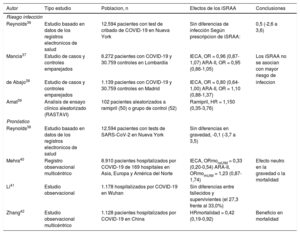
Principales estudios que evaluan ios efectos del uso de iSRAA en ei riesgo y la gravedad de la infección por SARS-CoV-2.
| Autor | Tipo estudio | Poblacion, n | Efectos de los iSRAA | Conclusiones |
|---|---|---|---|---|
| Riesgo infección | ||||
| Reynolds36 | Estudio basado en datos de los registros electronicos de salud | 12.594 pacientes con test de cribado de COVID-19 en Nueva York | Sin diferencias de infección Según prescripcion de iSRAA: | 0,5 (-2,6 a 3,6) |
| Mancia37 | Estudio de casos y controles emparejados | 6.272 pacientes con COVID-19 y 30.759 controles en Lombardía | IECA, OR = 0,96 (0,87-1,07) ARA-II, OR = 0,95 (0,86-1,05) | Los iSRAA no se asocian con mayor riesgo de |
| de Abajo38 | Estudio de casos y controles emparejados | 1.139 pacientes con COVID-19 y 30.759 controles en Madrid | IECA, OR = 0,80 (0,64-1,00) ARA-II, OR = 1,10 (0,88-1,37) | infeccion |
| Amat39 | Analisis de ensayo clínico aleatorizado (RASTAVI) | 102 pacientes aleatorizados a ramipril (50) o grupo de control (52) | Ramipril, HR = 1,150 (0,35-3,76) | |
| Pronóstico | ||||
| Reynolds36 | Estudio basado en datos de los registros electronicos de salud | 12.594 pacientes con tests de SARS-CoV-2 en Nueva York | Sin diferencias en gravedad, -0,1 (-3,7 a 3,5) | |
| Mehra40 | Registro observacional multicéntrico | 8.910 pacientes hospitalizados por COVID-19 de 169 hospitales en Asia, Europa y América del Norte | IECA, ORmoraUlM = 0,33 (0,20-0,54) ARA-II, ORmomUlM = 1,23 (0,87-1,74) | Efecto neutro en la gravedad o la mortalidad |
| Li41 | Estudio observacional | 1.178 hospitalizados por COVID-19 en Wuhan | Sin diferencias entre fallecidos y supervivientes (el 27,3 frente al 33,0%) | |
| Zhang42 | Estudio observacional multicéntrico | 1.128 pacientes hospitalizados por COVID-19 en China | HRmortalidad = 0,42 (0,19-0,92) | Beneficio en mortalidad |
ARA-II: antagonistas del receptor de la angiotensina II; HR: hazard ratio; 1ECA: inhibidores de la enzima de conversión de la angiotensina; iSRAA: inhibidores del SRAA; OR: odds ratio; SRAA: sistema renina-angiotensina-aldosterona.
Reynolds et al.36 evaluaron la relación entre varios fármacos anti-hipertensivos (iSRAA, bloqueadores beta, diuréticos tiacídicos y antagonistas del calcio) y la probabilidad de contraer la infección por SARS-CoV-2. Para ello analizaron los registros electronicos de salud de 12.594 pacientes en la ciudad de Nueva York y realizaron un Análisis de propension emparejando a todos los pacientes que se realizaron un test de cribado de la COVID-19 con aquellos con HTA. El tratamiento previo con iSRAA, incluidos IECA y ARA-II, no se aso-cio con un mayor riesgo de infección ni de sufrir una afección grave por la COVID-19. En la misma línea, Mancia et al.37 realizaron un estudio de casos y controles con 6.272 pacientes con infección por SARS-CoV-2 a los que se emparejo con 30.759 controles Según la edad, el sexo y el lugar de residencia. Se observó un mayor uso de iSRAA entre los pacientes con infección debido a la mayor prevalencia de ECV, pero no se observó asociación entre el uso de iSRAA y un curso más agresivo de la enfermedad. Estos resultados confirman que la mayor prevalencia de ECV en pacientes con COVID-19 refleja una peor condicion de salud que los hace más vulnerables a la enfermedad y a una evolución más agresiva. Mehra et al.40 analizaron los datos de 8.910 pacientes hospitalizados con COVID-19 procedentes de 169 hospitales de Asia, Europa y América, con una mortalidad hospitalaria del 5,8%. Los factores que se asociaron con mayor mortalidad fueron la edad > 65 anos, cursar con enfermedad coronaria, IC o EPOC y el tabaquismo. No se observó un mayor riesgo de morta-lidad asociado con la toma previa de IECA o ARA-II. Por último, Zhang et al.42 observaron una menor mortalidad en 1.128 pacientes hipertensos en tratamiento con iSRAA hospitalizados en 9 centros de la provincia de Hubei (China), lo que indica un posible beneficio clínico.
Pese a que aun no se dispone de ensayos clínicos aleatorizados y que toda la evidencia se sustenta en estudios observacionales36-37,40-42, el mensaje es contundente: «no hay evidencia de que el uso de iSRAA produzca mayor daño en pacientes con COVID-19».
ECA-2: diana terapéutica en la COVID-19La unión de la proteína S al receptor de ECA2 es un paso clave para la infección por SARS-CoV-2. Bloquear la unión de proteínas S a la ECA2 podría ser una diana terapéutica efectiva para el tratamiento de la infección43. Son numerosas las moléculas candidatas por su capacidad de intervenir en el proceso e inhibir la proliferación viral. La emo-dina44, la nicotinamida45 y la promazina46 podrían bloquear la interac-cion entre la proteína S y la ECA2 al competir por el sitio de unión de estas.
El potencial efecto protector de la ECA2 ha promovido el desarrollo de un estudio que evalua el beneficio del tratamiento con ECA2 recombinante en pacientes con COVID-19 (Clinicaltrials.gov; NCT04287686). Su capacidad de disminuir la activación pulmonar del SRAA y atenuar la respuesta inflamatoria podría reducir la gravedad de la enfermedad.
Implicaciones clínicasLos iSRAA son fármacos que se prescriben habitualmente para el tratamiento de la HTA, la enfermedad renal crónica y múltiples ECV (IC, enfermedad coronaria). La suspension inapropiada del tratamiento podría tener un impacto significativo en eventos clínicos, dada la elevada prevalencia de las ECV y el contrastado beneficio de está familia terapéutica. Las consecuencias variarían Según la enfer-medad de base, el riesgo individual de cada paciente y el potencial beneficio derivado del uso de los iSRAA.
Hipertensión arterialLa HTA es una comorbilidad frecuente en todo el mundo47, con una prevalencia que supera el 60% de los mayores de 60 anos48. Los iSRAA son los fármacos antihipertensivos más utilizados y están especial-mente indicados para los pacientes con ECV y nefropatía49. Los primeras trabajos en pacientes hospitalizados con COVID-19 informaron de una elevada prevalencia de HTA24, pero parece que el papel confusor de la edad y las comorbilidades influye activamente en está asocia-cion50,51. Este hecho ha planteado múltiples preguntas sobresíi la HTA per se es un factor que condiciona una peor evolución de la COVID-19 o si, por el contrario, el tratamiento con iSRAA es lo que interviene en está asociacion. La desregulacion del sistema inmunitario producida por la HTA podría ser una explicacion de está potencial vinculacion, pero no existe evidencia solida que lo confirme52.
Las especulaciones sobre los efectos perjudiciales de los iSRAA, basados en el aumento de la expresión de la ECA2, han cuestionado el uso de estos fármacos en el contexto de la pandemia por COVID-19, e incluso se ha llegado a proponer el cambio por otros fármacos antihi-pertensivos28.
Los estudios clínicos no han observado un efecto danino por el uso de iSRAA en pacientes con COVID-19. Por el contrario, algun estudiosíi ha encontrado una menor mortalidad asociada con los iSRAA en pacientes hipertensos hospitalizados por COVID-1953.
Por lo tanto, actualmente no hay evidencia para interrumpir el tratamiento con iSRAA de los pacientes estables con HTA y COVID-19.
Insuficiencia cardiacaLos trabajos que informan sobre la presencia de IC en pacientes con COVID-1920,23,24 ponen de manifiesto una alta prevalencia de está condicion y una elevada susceptibilidad a una peor evolucion. Mehra et al.40 informaron de una prevalencia del 2,12% en un registro multi-céntrico de 8.910 pacientes hospitalizados por COVID-19, mientras que Inciardi et al.54 describieron una prevalencia superior, que alcanza el 21%, con mayor frecuencia de comorbilidad cardiovascular. El ante-cedente de IC condiciono un aumento de las complicaciones y una mayor mortalidad hospitalaria. Los mecanismos que pueden explicar está peor evolución son la hiperactivación simpatica consecuencia del estado febril y la hipoxemia y la respuesta inflamatoria exagerada que ocasiona el virus56.
El SRAA es fundamental en la fisiopatología de la IC57. En fases pre-coces de la enfermedad, se observa un aumento de la actividad del SRAA, lo que participa en la progresión de la IC. En paralelo, se produce un incremento compensador de la actividad plasmática de la ECA258. Clasicamente, los iSRAA son la primera línea de tratamiento de la IC con función sistólica reducida por su efecto en mejorar la calidad de vida y aumentar la supervivencia59. Los resultados de la cohorte BIOS-TAT-CHF no confirman la hipótesis de que los iSRAA incrementen la expresión de la ECA2, por lo que no se debería considerar interrumpir-los a la población en riesgo de infección por SARS-CoV-221.
La suspension de los iSRAA privaría de sus indudables beneficios clí-nicos en la IC, con el consiguiente riesgo de precipitar un episodio de descompensacion. En el estudio TRED-HF se evaluo el efecto de suspender el tratamiento (incluidos los iSRAA) de pacientes con IC y fraccion de eyeccion del ventrículo izquierdo (FEVI) recuperada. A los 6 meses se observó un deterioro clínico en el 44% de los pacientes que suspendie-ron el tratamiento, lo que confirma la importancia de continuarlo60.
Recientemente, el grupo de IC de la Sociedad Europea de Cardiologia ha publicado un documento de posicionamiento en el que se abor-dan de manera práctica los retos del tratamiento de la IC en pacientes con COVID-1961.
ConclusionesEl SARS-CoV-2 tiene una estrecha relación con el SRAA a través de la ECA2, lo que ha suscitado diferentes hipótesis sobre los efectos de los iSRAA en el transcurso de la enfermedad.
En estudios observacionales, el uso de IECA o ARA-II no se asocia con un mayor riesgo de infección por SARS-CoV-2 ni con un curso más agresivo en caso de que aparezca la enfermedad.
No se recomienda la suspension del tratamiento con iSRAA por el potencial riesgo de empeoramiento de la afección de base.
FinanciacionTrabajo financiado por el Instituto de Salud Carlos III (Ministerio de Economia, Industria y Competitividad) y cofinanciado por el Fondo Europeo de Desarrollo Regional, a través del CIBER en enfermedades cardiovasculares [CB16/11 /00502].
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Información sobre el suplementoEste artículo forma parte del suplemento titulado «COVID-19 y enfermedad cardiovascular. Un nuevo reto para la cardiologia», que ha sido patrocinado por Boehringer Ingelheim España.