El desarrollo de procedimientos intervencionistas en el tratamiento de las cardiopatías estructurales confiere a las técnicas de imagen un papel fundamental. Permiten explorar detalles anatómicos de las estructuras del corazón necesarios para conseguir excelentes resultados.
Hasta el 98% de las comunicaciones interauriculares ostium secundum pueden cerrarse con éxito de manera percutánea. Una sistemática evaluación de la anatomía del septo interauricular, que incluya la detección y la cuantificación del tamaño y la forma de todos los defectos, los bordes del tejido que rodea el defecto y el grado y la dirección del cortocircuito, permite la correcta selección de candidatos. La ecocardiografía tridimensional ha mejorado significativamente la evaluación y los resultados. En el futuro, su fusión con otras modalidades de imágenes, como la tomografía computarizada cardiaca y la fluoroscopia, será especialmente útil para guiar el procedimiento.
El cierre percutáneo de la orejuela izquierda es una alternativa para el tratamiento de pacientes con fibrilación auricular y contraindicación para la anticoagulación oral. Se prevé incluso que, en el futuro, se podrá cambiar el enfoque clínico para la prevención del ictus en pacientes seleccionados. Es un procedimiento eficaz y seguro, con éxito del implante del dispositivo en un 94-99% de los casos. Sin embargo, requiere un equipo con experiencia en intervencionismo cardiaco estructural. La ecocardiografía tridimensional actualmente es la herramienta de imagen más adecuada para evaluar la idoneidad de la anatomía, seleccionar tipo y tamaño del dispositivo y guiar el procedimiento conjuntamente con la fluoroscopia y en el seguimiento posterior al implante.
Palabras clave
Los avances en la tecnología y la habilidad y la destreza humanas han hecho posible el desarrollo de procedimientos de intervencionismo percutáneo. Gracias a estas técnicas y la aparición de dispositivos adecuados, se puede tratar a un número creciente de pacientes con cardiopatía estructural. Con la introducción de dichos procedimientos que han surgido en los últimos veinte años, se ha hecho más importante y necesario comprender los detalles anatómicos de las estructuras del corazón, dispuestas en una geometría tridimensional compleja, con el objetivo de facilitar la elección correcta del dispositivo y su posicionamiento óptimo, el adecuado implante de la prótesis o la localización y el tamaño de la fuga periprotésica.
En este marco, la ecocardiografía hace un papel fundamental para conseguir excelentes resultados. Por un lado, la fluoroscopia permite visualizar el catéter en tiempo real y la angiografía ayuda a la localización de estructuras, pero no proporcionan los detalles necesarios de la anatomía cardiaca. Por otra parte, la resonancia magnética y la tomografía computarizada (TC) proporcionan un alto nivel de detalle anatómico, pero ninguna visualización en tiempo real. Sin embargo, la ecocardiografía transesofágica tridimensional (ETE 3D) en tiempo real proporciona imágenes con una calidad sin precedentes y se ha convertido en el perfecto aliado del intervencionismo en las cardiopatías estructurales. La ETE 3D tiene la capacidad única de representar las estructuras cardiacas como son en la realidad, proporciona excelentes detalles anatómicos, permite la visualización completa de área en que se realizan los procedimientos, todo ello con una significativa reducción de los tiempos de procedimiento1–4.
Recientemente, se ha desarrollado un nuevo sistema que fusiona las imágenes fluoroscópicas y de ETE 3D (EchoNavigator) que sirve como guía durante los procedimientos ofreciendo imágenes en tiempo real. El movimiento del arco de rayos X se sincroniza con la sonda transesofágica del ecocardiograma, y de este modo la imagen ecocardiográfica y radiológica se mueven conjuntamente.
También la ecocardiografía intracardiaca, que apareció como técnica auxiliar para procedimientos complejos de electrofisiología, es una modalidad de imagen cuya principal ventaja es evitar la sedación o anestesia. Tiene la ventaja de que permite obtener imágenes de las estructuras cardiacas próximas a la sonda con una calidad igual o superior a la de las obtenidas mediante ETE, al tiempo que se evitan sus limitaciones5,6. Como desventajas cabe destacar el alto coste del catéter, la necesidad de una formación específica en esa técnica y, durante el procedimiento, una segunda vaina venosa y la posibilidad de que ocurran arritmias auriculares o derrame pericárdico. Por el momento, la ecocardiografía intracardiaca ofrece imagen bidimensional, es decir, solo una «rebanada» de imagen, lo que hace que sea imposible evaluar un defecto septal en su verdadera extensión anatómica en el espacio tridimensional. Entre las novedades tecnológicas que se esperan para el próximo futuro, destaca la tecnología 3D en estas sondas de ecocardiografía intracardiaca7.
Este nuevo intervencionismo, denominado estructural, necesita un abordaje multidisciplinario, una selección de pacientes adecuada y el conocimiento de los diferentes dispositivos que se utilizan. Además, la evaluación mediante técnicas de imagen de los pacientes a los que se realizan tratamientos percutáneos difiere de la que habitualmente se realiza a los otros pacientes.
COMUNICACIÓN INTERAURICULARAl nacer, los defectos del septo interauricular son aproximadamente un 6–10% de los defectos congénitos del corazón. Al llegar a la edad adulta, la comunicación interauricular (CIA) es la cardiopatía congénita observada más frecuentemente, con una prevalencia del 30 al 40% y predominio del sexo femenino.
Anatomía de los defectos del septo interauricular y otras anomalías asociadasForamen oval permeableNo es una verdadera deficiencia del septo interauricular, sino más bien un espacio potencial o separación entre el septum secundum y el septum primum situado en una posición anterosuperior. No se considera un verdadero defecto del septo, porque ninguna deficiencia estructural del tejido septal auricular está presente. El foramen oval permeable (FOP) se observa en un 20–25% de los adultos.
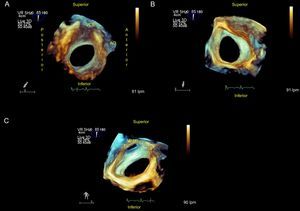
Comunicación interauricular tipo ostium secundumEs la forma de CIA más común (80%), está situada en el centro del septo y es la única susceptible de cierre percutáneo (figura 1 y figura 2).
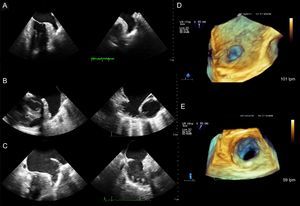
Comunicación interauricular tipo ostium secundum. A: vista desde desde la aurícula derecha; se puede medir sus remanentes y su relación con estructuras vecinas. B: desde la aurícula izquierda. C: inclinando la imagen, se ve la entrada de la vena pulmonar superior derecha a la aurícula izquierda. AO: aorta; VCS: vena cava superior; VPSD: vena pulmonar superior derecha.
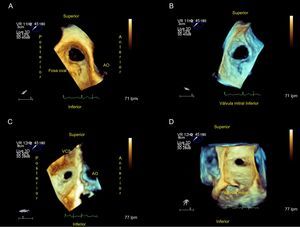
Estos defectos pueden variar de forma (que puede ser ovalada, redonda o irregular), tamaño (desde varios milímetros hasta > 3 cm) o de número (único o múltiples) (figura 1, figura 2 y figura 3). Estas variaciones anatómicas pueden tener implicaciones importantes para el cierre del defecto y podrían favorecer el uso de dispositivos diseñados para múltiples comunicaciones o exigir varios dispositivos para el cierre. Aunque estos defectos no suelen afectar a las venas cavas, las válvulas auriculoventriculares, las venas pulmonares o el seno coronario, es importante conocer la proximidad del defecto a estas estructuras cuando se considera el cierre percutáneo.
Aneurisma del septo interauricularEl aneurisma del septo interauricular es una redundancia o deformidad sacular del septum interauricular que se asocia con aumento de su movilidad. El aneurisma del septo interauricular se define como excursión del tejido septal (típicamente la fosa oval) > 10 mm desde el plano del septo auricular hacia las aurículas derecha e izquierda o una excursión total, suma del desplazamiento a derecha e izquierda ≥ 15 mm. La prevalencia de aneurisma del septo interauricular es de un 2–3% de la población y se ha asociado con la presencia de FOP y un aumento en la prevalencia de ictus criptogénico y otros eventos embólicos. El aneurisma del septo interauricular también se ha asociado con CIA múltiples8,9.
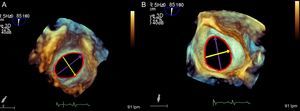
Tipos de dispositivos que se utilizan para el cierre de la comunicación interauricularLas indicaciones y contraindicaciones para el cierre percutáneo de CIA se resumen en la tabla. En términos generales, los dispositivos para cierre de CIA tienen una base metálica de una aleación de níquel y titanio (nitinol)10–12. El nitinol es un metal muy elástico con una gran memoria de forma (figura 4).
Indicaciones y contraindicaciones para el cierre percutáneo de comunicación interauricular
| Indicaciones • CIA ostium secundum con relación flujo pulmonar/sistémico (Qp/Qs) > 1,5 • Signos de sobrecarga de volumen del ventrículo derecho |
| Contraindicaciones (absolutas o relativas) • Pequeña CIA con Qp/Qs < 1,5 o sin signos de sobrecarga de volumen del ventrículo derecho • Un solo defecto demasiado grande para el cierre (> 38 mm) • Múltiples defectos no aptos para el cierre percutáneo • Defecto demasiado cerca de vena cava superior o inferior, venas pulmonares, válvulas auriculoventriculares o seno coronario • Bordes anterior, posterior, superior o inferior < 5 mm, si bien un borde retroaórtico < 5 mm es frecuente y no contraindica el cierre percutáneo si los demás remanentes están presentes • Drenaje venoso pulmonar anómalo • Anomalías congénitas asociadas que requieren cirugía cardiaca • CIA con hipertensión arterial pulmonar grave y cortocircuito bidireccional o de derecha a izquierda • Alergia al níquel |
CIA: comunicación interauricular.
Es el más usado y consta de tres elementos: disco izquierdo, cintura y disco derecho, cuyo interior contiene poliéster, que facilita la trombosis y la oclusión total del defecto. El tamaño del dispositivo que debe utilizarse viene dado por el diámetro de la cintura, que se adapta a los bordes del defecto, desde 4 a 40 mm. Se elegirá añadiendo 1 o 2 mm al diámetro mayor del defecto (figura 3 y figura 4). Los dos discos planos se extienden radialmente más allá de la cintura central para proporcionar un anclaje más seguro.
Los pacientes con CIA ostium secundum con indicación de cierre tienen, por lo general, cortocircuito izquierda-derecha, y es este el motivo de que el disco auricular izquierdo sea mayor que el disco auricular derecho.
Es importante conocer la longitud máxima del tabique interauricular, sobre todo en los niños; se mide en la proyección de cuatro cámaras porque, lógicamente, no puede ser inferior a la longitud de los discos.
Dispositivo Occlutech Figulla Flex IISimilar al Amplatzer, la tercera generación Occlutech consiste en dos discos con una gruesa cintura intermedia, con reducción del material empleado y de bordes más suaves. Es importante no subestimar el tamaño del defecto para que luego no se produzcan flujos residuales.
Dispositivo Nit-Occlud ASD-RSe compone de dos discos hechos de una malla de alambre de nitinol unidos por una cintura de conexión corta. Se teje a partir de un solo cable de nitinol sin soldadura ni tornillos. Reduce de manera significativa la cantidad de metal, un 50% menos metal que el Amplatzer. Ambos discos tienen igual diámetro. Se escoge el dispositivo de igual tamaño que el defecto o 1-2 mm mayor.
Evaluación previa a la intervenciónPara la valoración inicial del defecto, se utiliza ecocardiografía transtorácica; las proyecciones más útiles son la paraesternal en eje largo y el eje corto desde ventana subxofoidea, desde la ventana apical, la proyección cuatro cámaras y, desde la ventana paraesternal, la proyección en eje corto.
Con el modo transesofágico, en una posición medioesofágica es necesario hacer un recorrido desde 0° hasta 150° (cuatro cámaras, 0°, 15°, 30°; eje corto con aorta, 45°, 60°, 75°; plano de cavas, 90°, 105°, 120°; eje largo, 135°, 150°). El modo ETE 3D nos proporciona una imagen directa del defecto y muchas de las características del defecto que precisamos conocer.
Son varias las características específicas de la CIA que se debe conocer (figura 1, figura 2, figura 3). En primer lugar, según se describe en la , el tipo de CIA (ostium secundum, ostium primum, seno venoso, seno coronario, presencia de FOP, drenaje venoso pulmonar anómalo)13–18, su tamaño (diámetros máximos, mínimo y área), su forma (redonda, ovalada o irregular), la presencia de fenestraciones múltiples y su localización en el septo interauricular.
En segundo lugar, la dirección del flujo con Doppler color: de izquierda a derecha, de derecha a izquierda o flujo bidireccional. Debe analizarse la presencia o ausencia y las características del aneurisma del septo interauricular, la válvula de Eustaquio y la red de Chiari. Se debe medir todos los remanentes o bordes del defecto: remanente de la vena cava superior, borde superior, entre CIA y vena cava superior; remanente aórtico o borde anterosuperior, entre la CIA y la raíz aórtica; remanente de la válvula auriculoventricular o borde anteroinferior, entre la CIA y válvula auriculoventricular; remanente de vena cava inferior o posteroinferior, entre CIA y vena cava inferior; remanente posterior entre el borde posterior de la CIA y las paredes auriculares posteriores, y remanente de vena pulmonar superior derecha entre el borde posterior de la CIA y la vena pulmonar superior derecha. Se debe tener cuidado para identificar la presencia de los remanentes posterior e inferior y la naturaleza dinámica del defecto (variaciones de su tamaño durante el ciclo cardiaco).
Monitorización durante el procedimiento de cierreSe vuelve a medir el tamaño de la CIA durante el procedimiento. La ETE 3D permite ver el defecto de frente y medir directamente sus diámetros. Otra posibilidad en caso de dudas es medir el diámetro de un balón inflado a través del defecto hasta observar el cese de flujo por Doppler color. El diámetro del balón dentro del septo interauricular se mide en varios planos.
Posteriormente el dispositivo elegido se avanza por dentro de una vaina conectada al cable o alambre de transporte a través del orificio. Tras ello, se realiza el despliegue del disco auricular izquierdo, seguido de una correcta aposición de este al tabique interauricular y el posterior despliegue del disco auricular derecho. Antes de la liberación del dispositivo, se debe realizar una evaluación completa del dispositivo de cierre, el tabique auricular y las estructuras adyacentes. Se debe intentar identificar la presencia de tejido septal auricular entre los discos izquierdo y derecho del dispositivo. No es infrecuente observar pequeñas comunicaciones residuales en el dispositivo.
Evaluación del resultado finalTras el despliegue del dispositivo, hay que realizar una evaluación detallada para detectar posibles alteraciones en las válvulas y las venas, además de cualquier comunicación periférica residual. Se debe realizar un nuevo control ecográfico a todos los pacientes antes del alta hospitalaria y evaluaciones de seguimiento ecocardiográficas 1, 6 y 12 meses tras el procedimiento, con posteriores evaluaciones cada 1-2 años.
Complicaciones agudas y crónicas del cierre percutáneo19- •
Perforación cardiaca que causa derrame pericárdico y taponamiento.
- •
Embolización del dispositivo que obliga a su recogida percutánea o quirúrgica.
- •
Hemorragia.
- •
Embolia pulmonar.
- •
Trombosis del dispositivo.
- •
Endocarditis infecciosa.
- •
Fractura del dispositivo.
- •
Erosión. Esta es una complicación extremadamente rara: entre los factores de riesgo de erosión por el dispositivo Amplatzer se incluye20–22:
- –
Remanente aórtico deficiente desde varias proyecciones.
- –
Remanente superior deficiente en múltiples vistas.
- –
Ubicación superior de la CIA ostium secundum.
- –
Dispositivo de cierre de gran tamaño, > 26 mm.
- –
Mala alineación de los discos respecto al defecto.
- –
Tenting de la pared libre auricular después de la colocación del dispositivo.
- –
Derrame pericárdico presente después de la colocación del dispositivo.
- –
La fibrilación auricular (FA) es la arritmia cardiaca más frecuente. Su incidencia guarda estrecha relación con la edad, pues afecta a un 3–5% de la población mayor de 65 años. Su prevalencia aumentará en los próximos años debido al envejecimiento progresivo de la población. Se calcula que actualmente en España hay más de 1 millón de personas con FA.
Entre los múltiples procesos asociados a la FA, el accidente cerebrovascular (ACV) de origen cardioembólico probablemente sea la complicación más grave (15–25%), al tratarse de una enfermedad con altas tasas de discapacidad y mortalidad. Se sabe que la mayoría de los trombos que pueden embolizar se originan en la orejuela auricular izquierda (OI), en especial (hasta el 90% de los casos) en la FA no valvular. Para estimar el riesgo de ACV, se recomienda usar la puntuación CHA2DS2-VASc, que utiliza los siguientes parámetros: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 años (que conlleva doble puntuación), diabetes mellitus, ACV previo o accidente isquémico transitorio (asimismo con doble puntuación), enfermedad vascular, edad entre 65 y 74 años y sexo femenino23.
El tratamiento anticoagulante oral (ACO) permanente es el recomendado para pacientes con FA no valvular y CHA2DS2-VASc ≥ 2. Sin embargo, el principal problema de estos fármacos es el incremento del riesgo de hemorragia, la necesidad de controles periódicos, la interacción con alimentos o fármacos y la inestabilidad de acción en algunos casos. Se puede estimar el riesgo de hemorragia con la puntuación HAS-BLED (hipertensión, función anormal hepática o renal, ACV, antecedente de sangrado previo, International Normalized Ratio [INR] lábil, personas mayores, drogas/alcohol concomitantemente). Por lo tanto, es fundamental una evaluación individualizada de la relación riesgo-beneficio. Por diferentes razones, entre un 30 y un 50% de los pacientes con indicación para ACO en realidad no los están tomando.
Los nuevos ACO, desarrollados y probados en los últimos años en grandes ensayos clínicos, han mostrado tasas de sangrado variables y no desdeñables, sobre todo digestivo.
La cirugía con ligadura de la OI muestra unos resultados dispares, lo que se ha atribuido a la dificultad del cierre completo de la orejuela. Además, el cierre quirúrgico de la OI era a menudo incompleto, lo que aumenta la preocupacion sobre la seguridad de interrumpir la anticoagulación farmacológica.
Como consecuencia, en los últimos años se ha desarrollado la técnica de oclusión percutánea de la OI como una alternativa al tratamiento con ACO, especialmente para pacientes de alto riesgo cardioembólico para quienes el tratamiento con ACO no es posible o no se desea.
Dispositivos utilizados para la oclusión de la orejuela izquierdaActualmente, los dos dispositivos que más se utilizan en el mundo son el sistema Amplatzer-Amulet de St. Jude y el sistema Watchman de Boston Scientific:
Dispositivo Amplatzer-Amulet, segunda generación del Amplatzer Cardiac PlugEstá fabricado con una malla de nitinol muy flexible. El diseño del dispositivo es circular, se compone de un tapón o lóbulo y un disco, unidos por una cintura que actúa de articulación muy flexible, que le permite adaptarse y acomodarse al ser liberado. El tapón o lóbulo se acopla a la pared interna de la OI y los anzuelos o guías de estabilización del lóbulo ayudan a su fijación interna. El disco está diseñado para cubrir el orificio de entrada de la OI y debe quedar embutido en ella, traccionado por el tapón. Con el sistema Amplatzer-Amulet, el lóbulo se implanta a 10 mm de profundidad del ostium y el disco cubre por completo el ostium de la OI.
Dispositivo WatchmanEs una especie de tapón formado por una red o estructura de nitinol y está recubierto con una membrana de polietileno con unas barbas que fijan el dispositivo a la orejuela. Al no llevar disco, no puede interferir con las venas pulmonares o la válvula mitral. El sistema Watchman se implanta a 10 mm del ostium de la OI y, por lo tanto, no lo cubre.
Ambos dispositivos, Watchman y Amulet, se implantan por vía transeptal a través de la vena femoral. Ambas prótesis son altamente flexibles y disponen de un sistema de guías estabilizadoras que se anclan a la pared de la OI y evitan así su embolización. Estos dispositivos de cierre de la OI que se describen están disponibles para uso clínico en Europa.
Dos ensayos controlados aleatorizados y varios estudios observacionales recogen datos de más de 2.400 pacientes con FA no valvular a los que se implantó el dispositivo Watchman para reducir el riesgo de ACV.
El estudio PROTECT AF, el único estudio aleatorizado que ha comparado el tratamiento con warfarina con el cierre de OI (con el dispositivo Watchman) en pacientes con FA no valvular, mostró que, pasados 4 años del comienzo del estudio, el cierre de la OI es superior a la warfarina en lo que era el objetivo primario combinado de ACV, embolia sistémica y muerte cardiovascular o no explicada, pero evidenció al comienzo del estudio una preocupante tasa de eventos periprocedimiento, con una incidencia de derrame pericárdico grave del 4,4%24–26.
El procedimiento tiene una curva de aprendizaje con riesgo elevado de derrame pericárdico en los primeros procedimientos.
El dispositivo oclusor LAA Watchman recibió aprobación de la Food and Drug Administration muy recientemente, en marzo de 201527. El primer dispositivo Amplatzer Cardiac Plug comenzó a utilizarse en 2008. Se evaluó en varios registros retrospectivos, en su mayoría involucra experiencias de Europa, Canadá, Asia y América Latina, que muestran buen perfil de seguridad y éxito en el procedimiento28–33. El dispositivo Amulet actual incorpora modificaciones que facilitan el implante y una fijación mayor. El dispositivo se puso en el mercado de manera restringida a partir de octubre de 201434–36.
Indicaciones actualesEn la práctica clínica real, la mayoría de los procedimientos se indican en pacientes anticoagulados derivados del servicio de neurología tras un episodio de hemorragia intracraneal o del servicio de gastroenterología tras objetivar hemorragias digestivas recidivantes sin causa tratable. La labilidad del INR o la aparición de un evento cardioembólico a pesar del tratamiento con ACO e INR adecuada son otras situaciones en las que podría estar justificado el cierre percutáneo de la OI. En todo caso, se hace necesaria una decisión multidisciplinaria e individualizada que evalúe no solo el riesgo cardioembólico y hemorrágico, sino también otros factores fundamentales como la efectividad del tratamiento, la fragilidad del paciente o el cumplimiento terapéutico, especialmente del tratamiento con ACO. El cierre de la OI proporciona protección embólica y permite a la mayoría de los pacientes interrumpir la terapia de ACO para toda la vida.
Recomendaciones de la Sociedad Europea de Cardiología para el cierre de la orejuela izquierda (año 2012)Se puede considerar el cierre percutáneo de la OI en pacientes con alto riesgo de ACV y contraindicaciones para la ACO a largo plazo (clase IIb, nivel de evidencia B)37–39.
Esta recomendación se basa en estudios que utilizaban el dispositivo Watchman y pacientes que no tenían contraindicación para la anticoagulación. Teniendo en cuenta la evolución que ha seguido la oclusión de la OI desde la publicación de estas directrices, en particular la aprobación del dispositivo Watchman por la Food and Drug Aadministration, las recomendaciones pueden cambiar o ampliarse con las revisiones posteriores.
Valoración previa al intervencionismoAntes de indicar el cierre percutáneo de la OI, es esencial tener un conocimiento anatómico de la aurícula izquierda y, en especial, de la morfología de la OI40,41.
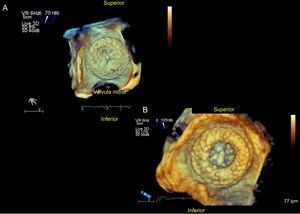
La característica principal de la OI es su variabilidad (figura 5). Es útil dividir la OI anatómicamente en tres regiones: el ostium, el cuello y la región lobular. Su orificio de entrada y cuello es similar a una escalera de caracol. El tamaño de la OI puede ser grande, como ocurre en casos de FA de larga evolución, en los que se triplica el volumen de la orejuela, o puede ser pequeño. A menudo tiene forma ovalada, con marcadas diferencias entre sus diámetros mayor y menor, y a veces es circular. Las OI muestran cambios significativos en sus diámetros a lo largo del ciclo cardiaco en ritmo sinusal y mínimos cambios en FA, y hay que tener en cuenta que una sobrecarga de volumen puede hacer cambiar sus valores. También se debe prestar especial atención al número de lobulaciones, su salida y su orientación espacial.
Con la ETE bidimensional, es necesario realizar las mediciones con la sonda en posición medioesofágica en múltiples planos, a 0°, 45°, 90° y 135°, para obtener los diámetros menor (45-70°) y mayor del ostium de la orejuela (aproximadamente 135°) y reconstruir su anatomía. Los diámetros medidos en los diversos planos pueden variar significativamente cuando son ovaladas y mínimamente cuando son redondas.
Los diámetros del ostium van desde 10 a 40 mm; la longitud de la OI, de 16 a 51 mm (media, 31 mm), y el volumen, de 0,7 a 19,2 ml. Habitualmente las velocidades son bajas en el interior de la OI, < 20cm/s, y muestran ecocontraste espontáneo. La OI puede mostrar uno, dos o varios lóbulos con diversas septaciones en su interior. También hay que medir la distancia entre la OI y el anillo mitral y entre la OI y la arteria circunfleja.
La OI debe estar libre de trombos antes del intento de cierre percutáneo, debe tener unas dimensiones adecuadas, una longitud o profundidad mínima y un ancho en la zona de implante del dispositivo apropiado a los tamaños de dispositivos actualmente disponibles. Habitualmente el diámetro de la zona de aterrizaje (landing zone) se mide en la proyección de aorta en eje corto a 45° con ETE, en el borde de la pared interna de la OI, en la proximidad de la arteria circunfleja, ligeramente hacia el interior de la orejuela y hasta el techo de la OI, por lo menos a 10 mm por debajo del orificio de entrada.
Con imagen multiplanar mediante ETE 3D, se puede ver dos planos ortogonales simultáneamente. Es útil realizar mediciones similares en los diferentes planos (0°, 45°, 90°, 135°), sobre todo en el plano perpendicular a 45° (es decir, 135°), y medir los diámetros de la zona de aterrizaje del dispositivo.
Con la ETE 3D se observa también una imagen cualitativa de la OI de frente. La OI puede mostrar uno, dos o varios lóbulos con diversas septaciones o membranas en su interior. De todas las técnicas, la ETE es fundamental y absolutamente necesaria para valorar las posibilidades del implante y evaluar sus medidas.
Algunos autores están utilizando la TC como método de diagnóstico y selección del tamaño del dispositivo42,43. Esta técnica proporciona información espacial que podría ayudar a optimizar la estrategia de implante y la selección del tamaño del dispositivo.
Estudios recientes con TC multicorte han demostrado que se trata de una técnica útil, rápida y precisa en la detección de trombos, lo que la convierte en una alternativa válida al ETE. Al mismo tiempo, permite una valoración rápida y completa de la anatomía y las dimensiones de la OI antes del cierre con dispositivos, así como un control de su posicionamiento tras el implante.
Se han realizado estudios con diferentes técnicas de imagen (TC, fluoroscopia y ETE), y se han correlacionado las diferentes mediciones obtenidas por las tres modalidades para la zona de aterrizaje: la medida mayor se obtiene con la TC, luego con ETE y finalmente la fluoroscopia.
Asimismo se ha estudiado la morfología de la OI con TC multidetectores (TCMD) y resonancia magnética cardiaca, y se ha correlacionado la morfología con la historia de ACV y accidente isquémico transitorio44. Cuatro diferentes morfologías se han utilizado para describir la OI: chicken wing (ala de pollo) (con una frecuencia del 48%9), cactus (30%), windsock (manga de viento) (19%) y cauliflower (coliflor) (3%). Los pacientes con morfología en ala de pollo son menos propensos a sufrir un evento embólico. También se han descrito mayores dificultades a la hora del cierre con dicha morfología45.
En pacientes con alto riesgo de sangrado esofágico para quienes la ETE esté contraindicada, la ecografía endoscópica podría utilizarse con mayor seguridad para guiar el procedimiento de cierre de la OI, ya que las raras complicaciones que puedan producirse se identifican inmediatamente durante el procedimiento. Ensayos clínicos avalan su uso en situaciones de hemorragia gastrointestinal en pacientes con varices esofágicas, si bien no se ha descrito su utilización para la valoración específica de estructuras cardiacas ni como técnica útil para guiar procedimientos de intervencionismo cardiovascular46.
Guía durante el intervencionismoLa ETE es imprescindible durante el procedimiento para el correcto posicionamiento, la liberación del dispositivo y las comprobaciones finales de la oclusión de la OI. La ETE 3D aporta más seguridad y facilidad. Los principales pasos que se realizan durante la técnica de implante son:
- 1.
Punción transeptal47
Habitualmente se recomienda pinchar en las zonas inferior y posterior de la fosa oval (figura 6). Debe evitarse en general el paso por un FOP. Se debe controlar con la ETE el posicionamiento de la aguja, la punción transeptal en «tienda de campaña» y la canalización de la OI. Asimismo, mediante el sistema EchoNavigator, se puede obtener la fusión de la imagen ecocardiográfica sobre la imagen de escopia en tiempo real, con lo que se facilita el guiado de la punción48.
- 2.
Sondaje de la aurícula izquierda y la orejuela izquierda
Una vez se ha accedido a la AI, se avanza una guía hasta la OI. Generalmente esta maniobra no suele requerir mucho tiempo y su visualización mediante ETE ayuda a verificar el correcto sondaje de la OI. La visualización completa de los catéteres intracardiacos y dispositivos es extremadamente importante para evitar complicaciones. Debe tenerse en cuenta en todo momento la fragilidad de la pared de la OI, por lo que se debe ser muy cuidadoso en los movimientos para evitar una perforación, que podría causar un taponamiento cardiaco y complicaciones mayores graves.
- 3.
Medición de la orejuela izquierda y elección del dispositivo
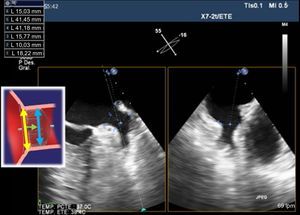
Durante el procedimiento, la técnica de referencia debe ser siempre la ETE. También será de gran utilidad la información complementaria de la que se pueda disponer con TC cardiaca o cardiorresonancia magnética. Los tamaños mínimo y máximo de orejuelas que se puede ocluir está entre 11 y 31 mm de diámetro de la zona de aterrizaje donde se pondrá el lóbulo del dispositivo Amplatzer-Amulet. Se necesita una profundidad mínima de 10 mm en OI para implantar el dispositivo (figura 7).
La selección del tamaño del dispositivo Amulet se basa en la sobredimensión de unos 2 mm respecto al diámetro del cuello de la OI. Se recomienda cierto grado de sobredimensionamiento de tamaño del dispositivo respecto a las medidas por ETE y angiografía, ya que se consigue reducir la tasa de fugas residuales sin aumentar el riesgo de rotura de la pared de la OI. Este sobredimensionamiento permitirá una mejor oclusión, al quedar encajado el tapón, los que a su vez evita el desplazamiento o la embolización. Ahora bien, si el tamaño seleccionado es demasiado grande, el dispositivo quedará excesivamente comprimido (aspecto de fresa), y podría embolizar o, en algún caso, afectar a estructuras vecinas (aparato valvular mitral o arteria circunfleja). Por el contrario, si se selecciona un dispositivo pequeño, no será oclusivo y también podría embolizar o dejar flujos residuales relevantes dentro de la OI. En el caso del dispositivo Watchman, se mide el diámetro máximo del ostium de la OI, y es posible cerrar las orejuelas con diámetros entre 17 y 31 mm.
- 4.
Despliegue, posicionamiento y liberación del dispositivo
Una vez desplegado el lóbulo en la zona de aterrizaje, se libera el disco, que debe quedar con morfología cóncavo-convexa, embutido idealmente en la entrada de la OI (figura 8).
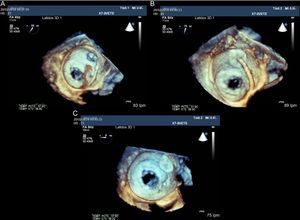
Figura 8.Ecografía transesofágica tridimensional, visión desde la porción superior de la aurícula izquierda de la entrada de la orejuela izquierda y la válvula mitral abierta. A: se observa la guía que atraviesa en septo interauricular y se dirige a la orejuela izquieda. B: el dispositivo Amplatzer Cardiac Plug posicionado en la orejuela izquieda todavía no liberado. C: relación anatómica respecto a la válvula mitral una vez liberado el dispositivo.
(0.27MB).La comprobación de las correctas posición y fijación del dispositivo se realiza con fluoroscopia y ETE, mediante una maniobra de tracción suave y suelta del cable liberador o tug test. Antes de liberar el dispositivo, se debe comprobar que está bien asentado y que es oclusivo, sin flujo residual en la orejuela. Además, este no debe afectar a estructuras vecinas como el aparato mitral o la arteria circunfleja.
La ETE 3D es de especial ayuda para descartar el desplazamiento del dispositivo tras la liberación y valorar de nuevo sus relaciones con las estructuras vecinas49.
El lóbulo debe de estar ligeramente comprimido, como la morfología de la llanta de un coche. El disco debe ser convexo, hacia el interior de la OI (figura 9). No se debe observar con Doppler color ningún paso de flujo hacia el interior de la OI. Hay que descartar la presencia de trombos (figura 10). Al final del procedimiento, la ecocardiografía se utiliza para evaluar las posibles complicaciones inmediatas:
- •
Derrame pericárdico o taponamiento.
- •
Desprendimiento del dispositivo y embolización.
- •
Embolización del dispositivo, que suele estar relacionada con una medición imprecisa del orificio de entrada de la OI o con problemas en la liberación del dispositivo.
- •
Cierre incompleto de la OI, que aumenta el riesgo de trombosis y eventos embólicos49,50.
- •
Interferencia con estructuras vecinas. Es importante confirmar que el dispositivo no interfiere con el flujo mitral o el flujo de la vena pulmonar y descartar alteraciones de la contractilidad segmentaria que puedan ser secundarias a compresión de la arteria circunfleja.
- •
CIA residual tras la punción transeptal.
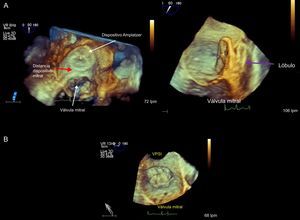
Visión de ecografía transesofágica tridimensional desde el techo de la AI (A) y en plano sagital (B); apréciese la distancia que separa el dispositivo Amplatzer Cardiac Plug de la válvula mitral (flecha roja) y la posición del lóbulo (flecha morada) en el interior de la orejuela izquierda. En la parte inferior, dispositivo Watchman ocluyendo la orejuela izquierda. VPSI: vena pulmonar superior izquierda.
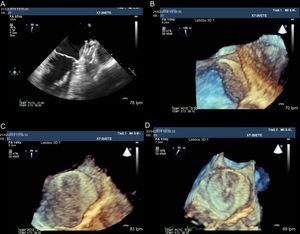
Imágenes de ecografía transesofágica bidimensional y tridimensional de la imagen de un trombo localizado en la cara auricular del disco del dispositivo Amplatzer Cardiac Plug (A). B y C: se ha perdido parcialmente la visión en forma de 8 de la malla del dispositivo. D: tras 2 meses de tratamiento con heparina de bajo peso molecular, se recupera la imagen en forma de 8 de la malla del dispositivo, lo que indica la desaparición del trombo.
Después del procedimiento, se recomienda nuevo estudio ecocardiográfico antes del alta hospitalaria del paciente, para confirmar que no se ha producido ninguna alteración en el dispositivo y excluir la aparición de un derrame pericárdico. Posteriormente se realiza estudio ecocardiográfico de seguimiento a los 1, 3 o 6 y 12 meses, y luego anualmente.
CONFLICTO DE INTERESESA. Bethencourt González es proctor de St. Jude Medical.