El objetivo del tratamiento de los pacientes hipertensos no sólo es reducir las cifras de presión arterial, sino también disminuir su riesgo cardiovascular total. Es importante, por lo tanto, que los fármacos utilizados, además de su acción hipotensora, posean un perfil metabólico beneficioso. Los antagonistas de los receptores de angiotensina II (ARA-II) son de demostrada eficacia antihipertensiva y también tienen efectos beneficiosos en cuanto al metabolismo de los lípidos y los hidratos de carbono y en la prevención de nuevos casos de diabetes mellitus. Estas acciones se deben al bloqueo de los receptores AT1, pero en algunos ARA-II, aunque no parece que se trate de un efecto de clase, también a través de una acción parcialmente agonista de los receptores nucleares PPARγ. Si estos efectos metabólicos beneficiosos, demostrados hasta ahora experimentalmente y en algunos estudios, se corroboran en ensayos clínicos más amplios, los convertirían en los fármacos ideales para el tratamiento de los pacientes hipertensos con otros factores de riesgo cardiovascular y/o con síndrome metabólico.
Palabras clave
La participación de la angiotensina II en las diferentes etapas del continuo cardiovascular la ha convertido en una de las principales dianas terapéuticas en el tratamiento tanto de la hipertensión arterial como de algunas manifestaciones clínicas de la enfermedad cardiovascular. Entre los diferentes grupos farmacológicos que bloquean el sistema renina-angiotensina-aldosterona, se ha demostrado que los antagonistas de los receptores de la angiotensina II (ARA-II) tienen, además de su efecto antihipertensivo, diferentes grados de capacidad para mejorar el perfil metabólico de los pacientes hipertensos. Estos beneficios en el metabolismo de los hidratos de carbono y también de los lípidos los convertirían en los fármacos antihipertensivos ideales para los pacientes hipertensos con otros factores de riesgo cardiovascular, por ejemplo, los diabéticos, los obesos o los que cumplen criterios de síndrome metabólico, cuya prevalencia, por desgracia, actualmente amenaza con alcanzar proporciones epidémicas en España.
MECANISMO DE ACCIÓN DE LOS ARA-IILa inhibición del sistema renina-angiotensina-aldosterona (SRAA) se considera clave en la estrategia terapéutica de la patología cardiovascular. Los inhibidores de la enzima de conversión de angiotensina (IECA), utilizados desde hace aproximadamente tres décadas, se han demostrado eficaces en el tratamiento de la hipertensión y de la insuficiencia cardiaca, así como en la prevención de la aparición de diabetes mellitus y de la nefropatía diabética. Pero la evidencia de que no ejercen un bloqueo completo, pues hay también síntesis de angiotensina II a través de otras vías enzimáticas, ha favorecido el desarrollo de agentes farmacológicos con una acción más específica; es el caso de los antagonistas de los receptores AT1 de la angiotensina II1.
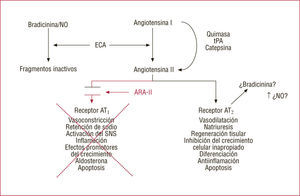
Estos fármacos inhiben de forma selectiva la acción de la angiotensina II a través de los receptores AT1, origen de muchos de sus efectos patológicos, entre los que se encuentran la vasoconstricción, la secreción de aldosterona y la liberación de catecolaminas o la hipertrofia y la fibrosis cardiacas. No están bien definidas la funciones de la angiotensina II a través de los receptores AT2, pero al favorecerse su unión mediante el bloqueo de los AT1, se cree que se ejercerían acciones beneficiosas vasodilatadoras, antiinflamatorias y de inhibición del crecimiento celular inapropiado (fig. 1)2.
Mecanismo de acción de los antagonistas de los receptores AT1 de la angiotensina II (ARA-II). ECA: enzima de conversión de angiotensina; NO: óxido nítrico; SNS: sistema nervioso simpático; tPA: activador del plasminógeno tisular. Modificada de Steckelings et al2.
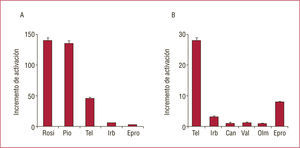
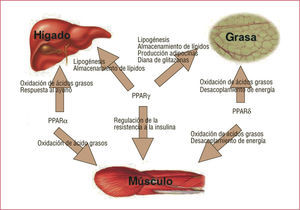
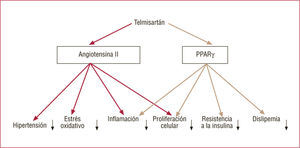
Uno de los ARA-II utilizados en la actualidad, el telmisartán, posee una estructura química que le permite actuar también como un agonista parcial de PPARγ receptor nuclear cuya expresión influye en el metabolismo de lípidos e hidratos de carbono, y se ha demostrado en animales de experimentación una reducción en los niveles de glucosa, insulina y triglicéridos. Ninguno de los demás ARA-II disponibles comercialmente presenta propiedades de activación PPARγ a las dosis utilizadas en clínica (fig. 2)3. A diferencia de las glitazonas, fármacos antidiabéticos que aumentan la sensibilidad a la insulina precisamente por activación PPARγ el telmisartán no causa aumento de peso ni aparición de edemas. Se han identificado otros receptores PPAR cuya participación en la regulación del metabolismo de las grasas y los hidratos de carbono los puede convertir en dianas terapéuticas ideales para la prevención cardiovascular (fig. 3)4. Por lo tanto, el telmisartán, a través de su doble mecanismo de acción como ARA-II y como agonista parcial PPARγ, tendría un papel beneficioso en la prevención y el tratamiento de la diabetes mellitus y la enfermedad cardiovascular en población de alto riesgo (fig. 4)5.
Incremento de la activación de PPARγ con diferentes fármacos antidiabéticos y antihipertensivos, a las dosis utilizadas en clínica. A: se comparan fármacos antidiabéticos (glitazonas) con algunos antihipertensivos, antagonistas de los receptores de angiotensina II (ARA-II). B: se compara telmisartán con otros ARA-II. Can: candesartán; Epro: eprosartán; Irb: irbesartán; Olm: olmesartán; Pio: pioglitazona; Rosi: rosiglitazona; Tel: telmisartán; Val: valsartán. Modificado de Benson et al3.
Acciones mediadas por los diferentes PPAR en los tejidos. Modificado de Evans et al4.
Efecto pluripotencial de telmisartán en el riesgo cardiovascular. Modificado de Kurtz et al5.
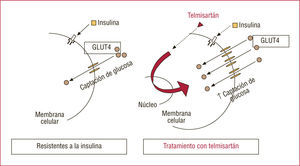
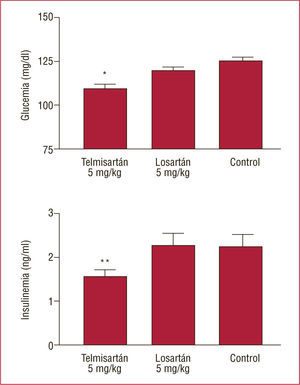
Hay varias evidencias sobre la capacidad de algunos ARA-II, especialmente telmisartán, de aumentar la sensibilidad a la insulina en los tejidos. Experimentalmente, en adipocitos de cultivo que no poseen receptores AT1 para la angiotensina II, el telmisartán actúa directamente sobre estas células haciéndolas sensibles a la insulina y aumentando la captación de 2-desoxiglucosa, al incrementar la expresión de la proteína GLUT4 (fig. 5)6. En estudios realizados en ratas que reciben una alimentación rica en grasas e hidratos de carbono, la administración de telmisartán (5mg/kg) redujo de forma significativa los valores plasmáticos de glucosa al cabo de 5 semanas respecto a un grupo control y otro que había recibido la misma dosis de losartán; se redujo también la insulinemia (p = 0,09); cuando se realizó en estos animales el test de sobrecarga oral de glucosa, la glucemia alcanzada fue equivalente en los tres grupos, pero la insulina plasmática fue significativamente menos en el que recibió telmisartán (fig. 6)3.
Captación de glucosa en tejidos periféricos resistentes a la insulina. El tratamiento con telmisartán aumenta la captación de 2-desoxiglucosa, al incrementar la expresión de la proteína GLUT4. Modificado de Fugimoto et al6.
Efecto del tratamiento con telmisartán y losartán en la glucemia y la insulinemia en ratas que reciben una alimentación rica en grasas e hidratos de carbono, al cabo de 5 semanas. *p < 0,01. **p = 0,025. Modificado de Benson et al3.
Las primeras investigaciones en clínica corroboraron estos hallazgos. En un paciente de 52 años, hipertenso, obeso y con intolerancia a la glucosa, la administración de 80mg de telmisartán durante 10 semanas se acompañó de normalización de la presión arterial (PA), una mejoría en la resistencia a la insulina y una disminución significativa de la glucemia y la insulinemia respecto a las basales; pero tras cambiar el tratamiento a 160mg diarios de valsartán, al cabo de 5 semanas habían desaparecido estos efectos metabólicos beneficiosos (sin cambios significativos en las cifras de PA), que se recuperaron tras volver a administrar telmisartán durante las siguientes 4 semanas7. También se demostró reducción de la insulinemia basal en un grupo de 18 pacientes hipertensos con diabetes mellitus tipo 2, tratados previamente con 80mg de valsartán u 8mg de candesartán, cuando se sustituyó esos fármacos por telmisartán (40mg), sin cambios en la PA ni en la glucemia basal y la glucohemoglobina8.
Los ensayos clínicos más recientes en pacientes hipertensos, la mayoría diabéticos o con síndrome metabólico, que compararon varios fármacos ARA-II, han mostrado resultados discrepantes; así, en 42 pacientes hipertensos con síndrome metabólico, el tratamiento con 80mg de telmisartán comparado con 50mg de losartán durante 8 semanas consiguió similar reducción de la PA y ningún cambio en la resistencia a la insulina, pero sí un descenso significativo en la glucemia basal (p < 0,0001)9. Estos datos contrastan con los hallazgos de un estudio muy parecido en 53 japoneses hipertensos con síndrome metabólico, en los que una dosis tan baja como 20mg de telmisartán durante 4 semanas redujo la PA lo mismo que 40mg de valsartán, pero sólo en los primeros hubo cambios significativos en la resistencia a la insulina10. También en 188 diabéticos con síndrome metabólico tratados con 4mg de rosiglitazona, el tratamiento con 40mg de telmisartán, comparado con 150mg de irbesartán, se acompañó de una mejoría más marcada y más precoz del perfil glucémico y la resistencia a la insulina11.
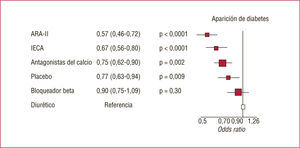
Prevención de la diabetes mellitus tipo 2La propiedad de los fármacos que bloquean el SRAA de prevenir o retrasar la aparición de diabetes, como se ha demostrado en múltiples ensayos clínicos en pacientes hipertensos, se ha justificado básicamente por su capacidad de interferir los efectos metabólicos adversos de la angiotensina II12. También, en el caso de los IECA, se han invocado efectos a través de la vía óxido nítrico-quininas. Otro de los mecanismos de acción de los ARA-II y de telmisartán en particular es su función parcialmente agonista del PPARγ, que mejora la resistencia a la insulina5. En un metaanálisis que incluyó más de 143.000 pacientes y comparó los principales agentes antihipertensivos con los diuréticos, grupo con mayor propensión a la aparición de diabetes, los ARA-II fueron los que mayor protección ejercieron contra su aparición (fig. 7)13. Entre otras limitaciones. debemos considerar que, en la mayoría de los ensayos incluidos en el análisis, estos datos se obtuvieron post hoc. Recientemente, hemos conocido los resultados del estudio ONTARGET, uno de cuyos objetivos secundarios era la aparición de nuevos casos de diabetes: no hubo diferencias significativas entre los pacientes que recibieron ramipril (6,7%), telmisartán (7,5%) o la combinación de ambos (6,1%), y se descartó la superioridad de un grupo frente al otro, sin haberse podido demostrar una mayor influencia de vías diferentes del bloqueo SRAA como causantes del efecto14.
Metaanálisis con más de 143.000 pacientes que comparó los principales agentes antihipertensivos con los diuréticos, que inducen mayor propensión a la aparición de diabetes. Modificado de Elliot et al13.
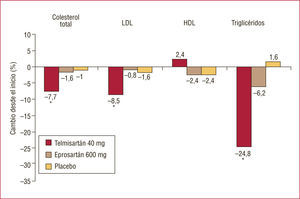
De la misma manera que se ha demostrado una acción beneficiosa de telmisartán en el metabolismo de la glucosa, hay evidencia experimental y de estudios clínicos de que causa una mejoría de las concentraciones de lípidos en plasma3. En este sentido, uno de los primero trabajos publicados fue el de Derosa et al15, realizado en 119 pacientes diabéticos tipo 2 con hipertensión ligera, aleatorizados a recibir telmisartán (40mg/día), eprosartán (600mg/día) o placebo durante 1 año. Al inicio del estudio, se les aconsejó también sobre medidas dietéticas y de ejercicio físico. Al cabo de 12 meses, hubo una reducción significativa de la PA con ambos ARA-II, aunque fue mayor con telmisartán. No hubo cambios en el índice de masa corporal ni en los parámetros que evaluaron el metabolismo de la glucosa (glucemia e insulinemia basales, glucohemoglobina y resistencia a insulina) en ninguno de los 3 grupos. El telmisartán, pero no el eprosartán, produjo un descenso significativo de los valores plasmáticos de colesterol total, colesterol de las lipoproteínas de baja densidad (cLDL) y triglicéridos (fig. 8). Además del efecto parcialmente agonista PPARγ (y quizá también PPARα), los autores especulaban con la posible influencia de otras propiedades farmacológicas del telmisartán, como su larga duración de acción y su alto poder lipofílico, e incluso con una hipotética relación entre el bloqueo de los receptores de angiotensina II y la inhibición de la HMGCoA reductasa.
Cambio en la concentración de lípidos en diabéticos hipertensos tras 1 año de tratamiento. *p < 0,05. Modificado de Derosa et al15.
Se han publicado otros estudios de pocos casos en que se demuestra que el tratamiento con telmisartán en hipertensos diabéticos se acompaña de una reducción significativa de los triglicéridos en plasma; mejoría que no se mantiene cuando se utilizan en los mismos pacientes valsartán y candesartán, a pesar de obtenerse similares reducciones de la PA7,8. Al igual que sucedía respecto al metabolismo de la glucosa, otros autores no han encontrado diferencias entre los distintos ARA-II en lo que respecta a lípidos en plasma, aunque hay que tener en cuenta que se utilizan distintas dosis, en poblaciones no siempre comparables y con diferentes tiempos de seguimiento9-11,16. Aún no se conocen los resultados del estudio ONTARGET14 en cuanto a lípidos; se trata del mayor ensayo clínico con telmisartán, tanto por el gran número de pacientes como por la duración del estudio, por lo que se espera que esos datos aporten una valiosa información respecto a la importancia clínica de los hallazgos de laboratorio.
TRATAMIENTO DEL SÍNDROME METABÓLICOLas características específicas del telmisartán en cuanto a sus efectos metabólicos, no compartidos de forma generalizada por todos los ARA-II, lo convierten, teóricamente, en el candidato ideal para el tratamiento de pacientes con síndrome metabólico (SM), según los criterios de la International Diabetes Federation (IDF) (tabla 1)17,18.
Diagnóstico de síndrome metabólico según la International Diabetes Federation
|
Además del aumento de la circunferencia abdominal, deben cumplirse otros dos criterios. Modificado de Alberti et al17.
Como ya hemos comentado, se han descrito casos de pacientes que cumplen criterios de SM en los que el tratamiento con telmisartán, pero no con otros ARA-II a dosis equivalentes, se acompañó de una mejoría evidente en la glucemia, la resistencia a la insulina y los triglicéridos, pero manteniendo el mismo grado de control tensional7, aunque estos resultados se han reproducido sólo parcialmente en otros estudios con pacientes de las mismas características9-11.
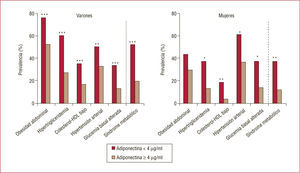
El tratamiento con telmisartán en pacientes con SM se ha acompañado de un aumento en la concentración de adiponectina y reducciones de la proteína C reactiva ultrasensible (PCRus), efecto beneficioso en dos marcadores relacionados con la progresión de la aterosclerosis (tabla 2)8. También se ha reproducido en diferentes modelos experimentales el aumento de la adiponectina y la reducción de peso tras la administración de telmisartán19,20. Precisamente, algunos autores defienden la utilización de adiponectina como biomarcador para el diagnóstico de SM porque está muy relacionada con el fenotipo clínico y los factores de riesgo que lo componen (fig. 9)21.
Valores de insulinemia, triglicéridos, adiponectina y proteína C reactiva ultrasensible (PCRus) en pacientes con síndrome metabólico tratados con candesartán o valsartán tras cambiarlos a telmisartán
| Candesartán o valsartán | Telmisartán | ||
| Insulinemia en ayunas (mU/l) | 10,7 | 8,6 | p < 0,01 |
| Triglicéridos (mg/dl) | 133,6 | 118,7 | p < 0,05 |
| Adiponectina (mg/l) | 6,95 | 7,97 | p < 0,05 |
| PCRus | 0,154 | 0,109 | p < 0,05 |
Modificado de Miura et al8.
Relación entre las concentraciones de adiponectina y los diferentes componentes del síndrome metabólico en ambos sexos. *p < 0,05. **p < 0,01. ***p < 0,001. Modificado de Ryo et al21.
Los ARA-II, además de su efecto antihipertensivo, han mostrado un perfil metabólico favorable, una de cuyas principales manifestaciones es la prevención de nuevos casos de diabetes mellitus tipo 2. Hay múltiples evidencias experimentales y de algunos estudios realizados en pacientes hipertensos, aunque con resultados desiguales, en parte debido a los distintos protocolos de investigación empleados. En el caso de telmisartán, además del bloqueo de los receptores AT1, parece que la capacidad parcialmente agonista de los receptores nucleares PPARγ produce efectos beneficiosos en la resistencia a la insulina y el metabolismo de los lípidos.
Las propiedades de telmisartán demostradas hasta la fecha lo convertirían en el fármaco antihipertensivo ideal para los pacientes hipertensos que cumplan criterios de síndrome metabólico y también, teóricamente, para los obesos.
Resultados aún pendientes del estudio ONTARGET y de otros estudios en marcha completarán la información disponible y permitirán conocer si esos efectos metabólicos beneficiosos se traducen en la práctica clínica en beneficios en la morbimortalidad de los pacientes hipertensos.