Palabras clave
INTRODUCCIÓN
La aterosclerosis es la principal causa subyacente de la enfermedad coronaria, y las plaquetas desempeñan un papel clave en las complicaciones aterotrombóticas que se producen en los pacientes con síndrome coronario agudo (SCA) y en los tratados con intervencionismo coronario percutáneo (ICP)1-3. Tras la rotura de una placa aterosclerótica, se inician los mecanismos que dan lugar a trombosis, en la que intervienen las plaquetas, a través de un proceso que consta de tres pasos: adhesión, activación y agregación. Cada una de estas fases constituye una posible diana para el desarrollo de fármacos antiplaquetarios. Los inhibidores de la adhesión plaquetaria están todavía en fase de investigación y no han sido autorizados para uso clínico. Los inhibidores de la agregación plaquetaria (es decir, los inhibidores de la glucoproteína IIb/IIIa intravenosos) se reservan tan sólo para el tratamiento de la fase aguda en los pacientes con SCA de alto riesgo a los que se practica una ICP. Los inhibidores de los procesos de activación plaquetaria constituyen la piedra angular del tratamiento para la prevención a corto y largo plazo de la recurrencia de episodios isquémicos en los pacientes con SCA e ICP.
Existen en la actualidad dos grupos de inhibidores de la activación plaquetaria autorizados en la práctica clínica para la prevención de la recurrencia de episodios isquémicos en pacientes con SCA/ICP. Se trata del ácido acetilsalicílico y las tienopiridinas. El ácido acetilsalicílico inhibe la activación plaquetaria a través de un bloqueo irreversible de la ciclooxigenasa (COX) 1, lo que a su vez impide la producción de tromboxano A2. El efecto beneficioso del tratamiento con ácido acetilsalicílico para la prevención secundaria a corto y a largo plazo de los episodios trombóticos está ampliamente demostrado4,5. Sin embargo, la elevada tasa de recurrencia de episodios isquémicos, en especial en un contexto de alto riesgo, ha sido el estímulo que ha impulsado el desarrollo de fármacos antiagregantes plaquetarios dirigidos a otras vías de señalización cruciales, como aquellas en las que interviene el adenosindifosfato (ADP). Las tienopiridinas son una clase de antiagregantes plaquetarios que inhiben el subtipo P2Y12 de los receptores de ADP y constituyen en la actualidad la piedra angular del tratamiento, asociados al ácido acetilsalicílico, en pacientes con SCA/ICP. En la actualidad, el clopidogrel es la tienopiridina de elección. A pesar de los efectos clínicos beneficiosos observados con el tratamiento adyuvante de clopidogrel, se han identificado también algunos inconvenientes de este fármaco6,7. En este artículo se presenta una visión general del estado actual y las perspectivas futuras respecto al antagonismo del receptor P2Y12, haciendo especial referencia en la variabilidad interindividual en la respuesta a clopidogrel y en las estrategias destinadas a mejorar la inhibición del P2Y12 plaquetario, incluidos los fármacos antiagregantes plaquetarios desarrolados más recientemente.
RECEPTORES PURINÉRGICOS PLAQUETARIOS
Los receptores purinérgicos expresados en las plaquetas son los siguientes: P2X1, P2Y1 y P2Y12. El ATP es el agonista fisiológico de P2X1. El P2X1 es un canal catiónico operado por ligando que interviene en el cambio de la forma plaquetaria a través de un flujo de entrada de calcio extracelular y facilita una amplificación de las respuestas plaquetarias mediadas por otros agonistas8. El ADP es el agonista fisiológico y, por lo tanto, ejerce su acción sobre las plaquetas a través de los receptores purinérgicos de siete dominios transmembranarios acoplados a proteína G, P2Y1 y a través del P2Y129,10. La activación del receptor P2Y1 produce un cambio transitorio de la forma de las plaquetas, movilización del calcio intracelular y liberación de gránulos de otros mediadores para finalmente, iniciar una fase transitoria y débil de agregación plaquetaria8,9. Aunque son necesarios ambos receptores P2Y para producir una agregación completa11, los efectos estimulados por el ADP en las plaquetas se producen predominantemente a través de la vía de señalización del receptor P2Y12 acoplado a Gi. La activación de los receptores P2Y12 causa una serie de procesos intracelulares que conducen a movilización del calcio, liberación del contenido de los gránulos, generación de tromboxano A2 y activación del receptor de la glucoproteína (GP) IIb/IIIa, lo que da lugar a una amplificación de la agregación plaquetaria y la estabilización del agregado plaquetario10-12. En consecuencia, el bloqueo del receptor P2Y12 plaquetario es crucial para inhibir la activación y la agregación plaquetarias e impedir, por lo tanto, la formación del trombo plaquetario (fig. 1).
Fig. 1. Receptores purinérgicos y mecanismo de acción del clopidogrel. El clopidogrel es un profármaco que se hidroliza en aproximadamente un 85% por esterasas de la sangre, para dar lugar a metabolitos inactivos, mientras que tan sólo un 15% se metaboliza por el sistema del citocromo P450 (CYP) en el hígado y da lugar a un metabolito activo. Dicho metabolito activo inhibe de manera irreversible el receptor P2Y12 del adenosindifosfato (ADP). El receptor P2X1, que utiliza adenosintrifosfato (ATP) como agonista, interviene en el cambio de la forma plaquetaria a través del flujo de entrada de calcio extracelular y facilita la amplificación de las respuestas plaquetarias que se producen a través de otros agonistas. La activación del receptor P2Y1 causa una modificación en la forma de las plaquetas e inicia una fase débil y transitoria de agregación plaquetaria. La unión del ADP al receptor P2Y1 acoplado a Gq activa la fosfolipasa C (PLC), que genera diacilglicerol (DAG) e inositol trifosfato (IP3) a partir de fosfatidilinositol bifosfato (PIP2). El diacilglicerol activa la proteincinasa C (PKC) y da lugar a una fosforilación de la cinasa de cadena ligera de miosina (MLCK-P) y el IP3 induce una movilización del calcio intracelular. El receptor P2Y1 se acopla a otra proteína G, la G12, que activa la proteína «Ro» y da lugar al cambio de forma de la plaqueta. La unión de ADP al receptor P2Y12 acoplado a Gi libera las subunidades αi y βγ de la proteína Gi y da lugar a la estabilización de la agregación plaquetaria. La subunidad αi inhibe la adenililciclasa (AC) y, por lo tanto, reduce las concentraciones de adenosinmonofosfato cíclico (AMPc), lo cual reduce la fosforilación de la fosfoproteína estimulada por vasodilatador (VASP-P) a través de la acción del AMPc. El estado de la VASP-P modula la activación del receptor de glucoproteína (GP) IIb/IIIa. La subunidad βγ activa la fosfatidilinositol-3 cinasa (PI3K), lo que da lugar a la activación del receptor de GPIIb/IIIa a través de la activación de una serina-treonina proteincinasa B (PKB/Akt) y de las proteínas de unión de GTP Rap1b. La prostaglandina E1 (PGE1) activa la AC, que aumenta las concentraciones de AMPc y el estado de la VASP-P. Las flechas continuas indican activación; las flechas punteadas indican inhibición. Reproducido con permiso de Angiolillo et al6.
Antagonismo del receptor P2Y12
Las tienopiridinas son inhibidores no directos e irreversibles del receptor P2Y12 y son los únicos bloqueadores del P2Y12 actualmente autorizados para uso clínico. La ticlopidina, una tienopiridina de primera generación, en combinación con ácido acetilsalicílico mostró ser superior al ácido acetilsalicílico solo y a la anticoagulación en combinación con ácido acetilsalicílico en el contexto de ICP13-16. La preocupación existente por los problemas de seguridad, principalmente por las tasas elevadas de neutropenia, hizo que pronto la ticlopidina fuera reemplazada ampliamente por clopidogrel, una tienopiridina de segunda generación con una eficacia similar y mejor perfil de seguridad17. Además, el clopidogrel alcanza sus efectos de manera más rápida que la ticlopidina mediante la administración de una dosis de carga18. Posteriormente, el reinado del clopidogrel en los contextos clínicos de la ICP y el SCA, incluidos la angina inestable, el síndrome coronario agudo sin elevación del segmento ST (SCASEST) y el infarto de miocardio con elevación del segmento ST (IAMCEST), ha sido indiscutible hasta ahora, dado que varios ensayos clínicos a gran escala han puesto de manifiesto un claro efecto beneficioso en cuanto a la prevención de recurrencias de episodios isquémicos, como trombosis del stent, al combinar el clopidogrel con ácido acetilsalicílico19-23. De hecho, las directrices terapéuticas actuales aceptan el tratamiento antiagregante plaquetario combinado con ácido acetilsalicílico y clopidogrel como el tratamiento antiagregante plaquetario de elección para pacientes en todo el espectro del SCA, incluidos los que presentan angina inestable, SCASEST24,25 o IAMCEST26,27, así como para aquellos a los que se practica ICP28,29. A pesar de estos efectos clínicos beneficiosos, un número considerable de pacientes pueden continuar presentando episodios cardiovasculares recurrentes. Cada vez son más las observaciones de que la variabilidad de los perfiles individuales de respuesta al clopidogrel es uno de los mecanismos que explican esta eficacia limitada6,7. Esto ha llevado a realizar diferentes estudios para intentar identificar los mecanismos asociados a la variabilidad de la respuesta al clopidogrel, así como estrategias útiles para superar las limitaciones que presentan las pautas de tratamiento actuales30,31.
CLOPIDOGREL: VARIABILIDAD INTERINDIVIDUAL DE RESPUESTA
El clopidogrel, como todas las tienopiridinas, es un profármaco que debe sufrir una biotransformación hepática para convertirse en su metabolito activo que se une de manera irreversible al receptor plaquetario P2Y12 y lo bloquea. Aproximadamente un 85% del clopidogrel absorbido en el torrente circulatorio a partir del intestino es hidrolizado por esterasas e inactivado, mientras que el 15% restante se metaboliza en el hígado por un doble proceso de oxidación en el que intervienen varias isoformas del citocromo P450 (CYP), para convertirse en un metabolito activo6,7. Dado el bloqueo irreversible del receptor P2Y12 por su metabolito activo, los efectos del clopidogrel persisten durante todo el periodo de vida de la plaqueta (7-10 días).
El inicio tardío de la acción del clopidogrel es una de sus limitaciones y exige el empleo de una dosis de carga para reducir el tiempo necesario para el inicio de acción cuando se requiere una inhibición rápida, como ocurre en el contexto de SCA o ICP18. Actualmente, las dosis autorizadas por las autoridades reguladoras son de 300 mg como dosis de carga y 75 mg como dosis de mantenimiento. Dado que hay cada vez más evidencia de que el efecto es más rápido y potente y, siendo además mayor el efecto clínico con la dosis de carga de 600 mg, esta pauta de administración se ha convertido ya en estándar en la práctica clínica y también está avalada por las guías de práctica clínica28,32-34. El principal problema existente con el clopidogrel es su amplia variabilidad de respuesta en los individuos tratados, de tal manera que hay un porcentaje relativamente elevado de pacientes que muestran unos efectos subóptimos, lo que ha hecho que se acuñaran para ellos los términos «pobres respondedores» o «resistentes». Éstos son entre el 5 y el 40% de los pacientes, según las características de la población, así como el tipo de función plaquetaria analizado y los valores de corte empleados6,7. La variabilidad en la respuesta al clopidogrel es un fenómeno bien conocido cuya trascendencia se pone de relieve en el hecho de que multitud de estudios han observado una asociación entre la baja respuesta y eventos cardiovasculares adversos6,7. Estos estudios se han realizado principalmente en pacientes sometidos a ICP (tabla 1), en los que el uso de clopidogrel es obligado, pero también en pacientes en tratamiento crónico con clopidogrel35-57.
MECANISMOS QUE INTERVIENEN EN LA VARIABILIDAD DE LA RESPUESTA AL CLOPIDOGREL
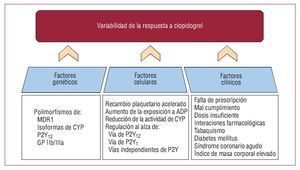
Se han identificado múltiples mecanismos que influyen en la variabilidad de respuesta al clopidogrel. Pueden resumirse en tres grandes categorías: factores genéticos, celulares y clínicos (fig. 2).
Fig. 2. Mecanismos involucrados en la variabilidad de la respuesta a clopidogrel. Hay múltiples mecanismos involucrados en la variabilidad de la respuesta a clopidogrel, y pueden agruparse en tres categorías: factores genéticos, celulares y clínicos. ADP: adenosindifosfato; CYP: citocromo P450; GP: glucoproteína; MDR: transportador de resistencia a múltiples fármacos.
Factores genéticos
Los estudios de farmacogenética han evaluado los polimorfismos de diferentes genes involucrados en los efectos farmacocinéticos y farmacodinámicos del clopidogrel58. Entre ellos se incluyen genes que codifican proteínas y enzimas que participan en la absorción y el metabolismo hepático del clopidogrel, así como genes que codifican receptores de la membrana plaquetaria.
El gen ABCB1 codifica la glucoproteína P intestinal denominada MDR1 (transportador de resistencia a múltiples fármacos o multidrug resistance transporter), que interviene en la absorción del clopidogrel. Los pacientes portadores de dos variantes alélicas del ABCB1 pueden presentar una reducción de la generación del metabolito activo tras la administración de una dosis de carga de clopidogrel59. Simon et al60 observaron que la presencia de estas variantes alélicas se asociaba a una tasa más alta de episodios cardiovasculares (muerte por cualquier causa, ictus no fatal e infarto de miocardio) tras 1 año de seguimiento en una población de 2.208 pacientes con infarto agudo de miocardio a los que se administró tratamiento con clopidogrel. Sin embargo, no se observó que ese mismo polimorfismo de ABCB1 se asociara con los valores agregación plaquetaria estimulada por ADP después de 1 semana de tratamiento con clopidogrel, en un estudio61 de asociación genómica recientemente publicado, que se realizó en una población homogénea (Amish) de individuos sanos61.
En los pasos de oxidación hepática que convierten el clopidogrel en su metabolito activo, intervienen diversas isoenzimas del CYP. En concreto, las isoenzimas CYP3A4, CYP3A5, CYP2C9 y CYP1A2 intervienen en uno de los pasos, mientras que las isoenzimas CYP2B6 y CYP2C19 participan en ambos. En diferentes estudios se ha descrito que los polimorfismos de CYP3A462, CYP3A563 y CYP2C964 se asocian con la capacidad de respuesta al clopidogrel, aunque los estudios de farmacogenética a gran escala no han podido observar asociación alguna entre estos polimorfismos y los eventos clínicos60,65. Sin embargo, varios estudios recientes a gran escala han mostrado una intensa asociación entre las variantes alélicas de pérdida de función de CYP2C19 (principalmente la CYP2C19*2) y una peor evolución clínica60-61,65-68. Esto concuerda con lo indicado por numerosos estudios que muestran una relación entre los alelos de reducción de función de CYP2C19 y la menor formación del metabolito activo, la menor inhibición plaquetaria y el empeoramiento de los resultados clínicos64,69-71. En el estudio de Simon et al60, pacientes con infarto agudo de miocardio portadores de dos cualesquiera de los alelos de pérdida de función de CYP2C19 (*2,*3,*4 o *5), sobre todo aquellos sometidos a ICP, presentaban una tasa más elevada de episodios cardiovasculares tras 1 año de seguimiento. En consonancia con estos datos, un subestudio del ensayo TRITON-TIMI 38 (Trial to Assess Improvement in Therapeutic Outcomes by Optimizing Platelet Inhibition with Prasugrel-Thrombolysis in Myocardial Infarction) puso de manifiesto que los portadores de al menos un alelo de pérdida de función de CYP2C19 presentaban una tasa de episodios cardiovasculares superior en el grupo de pacientes tratados con clopidogrel (n = 1.477)65. Además, se ha observado que la variante CYP2C19*2 es un predictor independiente de episodios cardiovasculares en los pacientes tratados crónicamente con clopidogrel tras un infarto de miocardio66 o en aquellos en los que se practica ICP61, y que además se asocia de manera significativa a un aumento del riesgo de trombosis del stent tras la implantación de stents coronarios67,68.
En los estudios de farmacogenética se han evaluado también polimorfismos de genes que codifican receptores de la membrana plaquetaria, entre ellos: P2YR12 (receptor P2Y12 de ADP), ITGB3 (receptor GPIIb/IIIa de fibrinógeno plaquetario), ITGA2 (receptor GPIa de colágeno plaquetario) y PAR-1 (receptor activado por proteasa 1, un receptor de trombina). Se ha señalado que algunas variantes de estos genes influyen en la variabilidad de respuesta al clopidogrel, aunque los resultados obtenidos hasta la fecha han sido poco consistentes72-78.
Factores celulares
Los efectos antiagregantes plaquetarios inducidos por el clopidogrel pueden verse afectados también por varios factores celulares. Por ejemplo, se ha indicado que un recambio plaquetario acelerado reduce la capacidad de respuesta al clopidogrel79. El recambio plaquetario está representado por la presencia de plaquetas reticuladas (inmaduras), que podrían tener una mayor reactividad y, por lo tanto, empeorar la respuesta al clopidogrel. La asociación entre un mayor porcentaje de plaquetas reticuladas circulantes y una menor respuesta al clopidogrel se ha observado en pacientes con enfermedad coronaria, tanto de alto riesgo79 como estables80. La generación del metabolito activo podría verse afectada por factores celulares como el diferente grado de actividad metabólica basal del sistema del CYP81. Además, se ha propuesto también que la regulación al alza tanto de las vías de señalización plaquetarias purinérgicas (P2Y12 y P2Y1) como de las independientes de P2Y puede estar involucrada en la variabilidad de la respuesta al clopidogrel, sobre todo en los pacientes con diabetes mellitus, que pueden presentar uno o varios de estos trastornos celulares82-84.
Factores clínicos
Múltiples factores asociados a una respuesta insuficiente al clopidogrel corresponden a esta categoría. Entre ellos, el cumplimiento terapéutico es el más importante6,7. La posología de clopidogrel puede participar también y más adelante será comentado si las dosis de carga y de mantenimiento actualmente aprobadas son o no las óptimas. Algunas características clínicas afectan también a la reactividad plaquetaria basal y a la respuesta al clopidogrel. Concretamente la presencia de un SCA85,86, diabetes mellitus82,83,87,88 o la obesidad89,90 se han asociado a un efecto inferior del clopidogrel, y ello puede contribuir también a las tasas más elevadas de episodios aterotrombóticos que presentan estos pacientes.
El sistema del CYP activa y metaboliza innumerables fármacos y sustancias que podrían interferir, por lo tanto, en la formación hepática del metabolito activo del clopidogrel. Se ha señalado que algunos fármacos de uso frecuente en la terapéutica cardiovascular deterioran los efectos antiagregantes plaquetarios inducidos por el clopidogrel; entre estos fármacos se encuentran las estatinas lipófilas, los antagonistas del calcio (AC) y los inhibidores de la bomba de protones (IBP).
Inicialmente, en estudios mecanísticos se observó una relación entre el uso de estatinas lipófilas (p. ej., simvastatina, lovastatina y atorvastatina), que son metabolizadas por isoenzimas del CYP (principalmente la CYP3A4), y una disminución de los efectos inhibidores producidos por el clopidogrel91,92. Sin embargo, esos resultados no fueron corroborados en otros estudios funcionales y, lo que es más importante, análisis post-hoc de ensayos clínicos o registros de gran tamaño no mostraron asociación alguna con una evolución clínica adversa93-96. Con los AC (metabolizados por el CYP3A4), principalmente las dihidropiridinas, se ha descrito también una reducción de los efectos inhibidores del clopidogrel en las plaquetas, así como un empeoramiento de la evolución clínica al combinar ambos fármacos97,98.
Recientemente se ha descrito una interacción farmacológica entre los IBP y el clopidogrel que ha motivado una importante preocupación a causa de la frecuencia con que se combinan ambos tipos de fármacos. Los diferentes IBP comercializados son metabolizados por isoformas del CYP (principalmente CYP2C19 y CYP3A4), pero con diferentes especificidades99. Los resultados más consistentes obtenidos hasta la fecha en los estudios funcionales han sido con omeprazol, que es metabolizado principalmente por la isoenzima CYP2C19100,101. En un estudio a doble ciego, aleatorizado y controlado con placebo, el omeprazol redujo significativamente los efectos antiagregantes plaquetarios del clopidogrel en los pacientes (n = 124) tratados con doble terapia antiagregante plaquetaria a los que se implantó un stent coronario100. Otros IBP se han evaluado también en estudios funcionales, sin que se haya demostrado efecto alguno del pantoprazol o del esomeprazol en la capacidad de respuesta al clopidogrel102, mientras que con lansoprazol se ha descrito una reducción de los efectos antiagregantes plaquetarios tras el empleo de una dosis de carga de clopidogrel de 300 mg tan sólo en los individuos con la respuesta más alta (tercil superior), y no en los pacientes a los que se administró una dosis de carga de prasugrel103. Los análisis de datos de estudios clínicos a gran escala, principalmente registros y análisis post-hoc de ensayos clínicos aleatorizados, han aportado resultados contradictorios al evaluar el efecto en los resultados clínicos del tratamiento concomitante con IBP y clopidogrel. Ho et al104 observaron que el tratamiento simultáneo con IBP y clopidogrel se asociaba de manera significativa a un aumento relativo del 25% en los resultados clínicos adversos a largo plazo (combinación de muerte y reingreso hospitalario por SCA) en una cohorte de 8.205 pacientes tratados con clopidogrel tras el alta por un SCA. Otros IBP distintos de omeprazol se utilizaron con muy poca frecuencia, por lo que el estudio no tuvo potencia suficiente para determinar sus efectos. El uso general de IBP fue un factor predictivo de reinfarto en un estudio de casos y controles de base poblacional (n = 2.791) después del alta tras el tratamiento de un infarto de miocardio. Al evaluar por separado los diversos IBP, el pantoprazol (metabolizado principalmente por el citocromo CYP2C9) no se asoció a un mayor riesgo de reinfarto105. En cambio, los resultados del estudio Clopidogrel Medco Outcomes presentados en las 2009 Annual Scientific Sessions de la Society for Cardiovascular Angiography and Interventions (SCAI) (Las Vegas, Nevada, Estados Unidos) indicaron un efecto de clase. En ese amplio registro (n = 16.690), los IBP se asociaron a un aumento del riesgo (razón de riesgos [HR] = 1,51) de episodios cardiovasculares a los 12 meses de seguimiento en los pacientes tratados con clopidogrel tras la implantación de stents coronarios. Cada uno de los IBP (omeprazol, esomeprazol, pantoprazol y lansoprazol) se asociaba a un riesgo superior (39%-61%) de episodios cardiovasculares que el uso de clopidogrel solo. Sin embargo, un análisis post-hoc del ensayo TRITON-TIMI 38 no ha podido demostrar asociación alguna entre el empleo de IBP y los parámetros de evolución clínica en los pacientes tratados con clopidogrel ni en los tratados con prasugrel, a pesar de que un análisis post-hoc del estudio PRINCIPLE-TIMI 44 (Prasugrel in Comparison to Clopidogrel for Inhibition of Platelet Activation and Aggregation-Thrombolysis in Myocardial Infarction 44) observó que la agregación plaquetaria 6 h después de una dosis de carga de 600 mg de clopidogrel era inferior en los pacientes tratados con un IBP. Sin embargo, no se observó una diferencia significativa tras el empleo de una dosis de carga de 60 mg de prasugrel106. Estos resultados clínicos concuerdan con los del ensayo COGENT-1 (Clopidogrel and the Optimization of Gastrointestinal Events), que fue presentado recientemente en el congreso de TCT de 2009 (San Francisco, California, Estados Unidos) y es el único ensayo prospectivo, aleatorizado, a doble ciego y controlado con placebo realizado hasta la fecha para comparar un IBP (omeprazol) con placebo en pacientes tratados con clopidogrel. En este estudio participaron 3.627 pacientes en los que se preveía la necesidad de un tratamiento concomitante con clopidogrel y ácido acetilsalicílico durante un mínimo de 12 meses. No se observaron diferencias en cuanto al riesgo de episodios cardiovasculares o infartos de miocardio (HR = 1,02; intervalo de confianza [IC] del 95%, 0,70-1,51) tras una mediana de seguimiento de 133 días, mientras que sí hubo un efecto beneficioso en cuanto a reducción de los efectos gastrointestinales, que era la variable de valoración principal del estudio, en los pacientes tratados con IBP (HR = 0,55; p < 0,007).
El tabaquismo es un importante factor de riesgo de procesos cardiovasculares aterotrombóticos, y se considera que dejar de fumar es una recomendación de clase I para la prevención secundaria de episodios isquémicos en pacientes con enfermedad coronaria24-29. El consumo de cigarrillos es también un potente inductor de la isoforma CYP1A2107; por lo tanto, puede aumentar la biotransformación del clopidogrel. Algunos estudios recientes han indicado que un hábito tabáquico intenso potencia los efectos inhibidores inducidos por el clopidogrel en las plaquetas108-109 y mejora los resultados clínicos en los pacientes tratados con clopidogrel110-111. Sin embargo, un estudio mecanístico observó una asociación entre consumo de cigarrillos y una menor producción de uno de los metabolitos del clopidogrel112. Así pues, el papel del tabaquismo en relación con los efectos del clopidogrel deberá ser investigado con mayor detalle en nuevos estudios.
PERSPECTIVAS FUTURAS
Las implicaciones pronósticas de la variabilidad de los efectos inducidos por el clopidogrel han llevado inevitablemente a la cuestión de cómo abordar y superar este fenómeno. Tras asegurar que el paciente cumpla el tratamiento antiagregante plaquetario y descartar posibles interacciones farmacológicas en el paciente polimedicado, se proponen tres posibles estrategias para superar la variabilidad de respuesta al clopidogrel6,7: a) aumentar la dosis de clopidogrel; b) tratamiento antiagregante plaquetario triple, y c) nuevos antagonistas del receptor P2Y12.
Aumentar la dosis de clopidogrel
En la actualidad, las dosis de carga y de mantenimiento estándar de clopidogrel son de 300 mg y 75 mg/día, respectivamente, aunque en la práctica clínica es frecuente el empleo de una dosis de carga de 600 mg, sobre todo en los pacientes a los que se practica ICP. Se alcanza una inhibición más rápida y mayor con una dosis de carga de clopidogrel elevada, de 600 mg, en comparación con lo que se obtiene con una dosis de carga estándar de 300 mg32,113,114, mientras que la dosis de carga de 900 mg tan sólo aporta un aumento marginal de la inhibición plaquetaria en comparación con la dosis de 600 mg113,114. Esta mayor inhibición plaquetaria con dosis de carga elevadas se ha traducido en una mejor evolución clínica de los pacientes tratados con ICP33,34,115.
En el contexto de ICP, las experiencias aleatorizadas existentes han observado un efecto beneficioso de una pauta de mantenimiento a dosis altas (150 mg/día) de clopidogrel en cuanto a potenciación de la inhibición plaquetaria en comparación con la dosis estándar116-119. En un estudio observacional realizado en una cohorte de pacientes no seleccionados (n = 2.954) a los que se practicó ICP con implantación de stents coronarios, Lemesle et al120 compararon el efecto de una dosis de carga elevada seguida de una dosis de mantenimiento elevada (600 mg y 150 mg/día, respectivamente) de clopidogrel con el uso de dosis estándar durante los primeros 15 días siguientes a la ICP. En ese registro, la pauta de dosis alta se asoció de manera significativa a una disminución de la variable de valoración combinada formada por muerte, infarto de miocardio y trombosis del stent (HR = 0,694) a los 2 meses, sin que hubiera un aumento significativo de las complicaciones hemorrágicas. Estos resultados concuerdan con los del estudio CURRENT/ OASIS-7 (Clopidogrel optimal loading dose Usage to Reduce recurrent EveNTs/Optimal Antiplatelet Strategy for InterventionS; Congreso de 2009 de la European Society of Cardiology, Barcelona, España). En este estudio multicéntrico, aleatorizado y de grupos paralelos, se incluyó a 25.087 pacientes con SCA en los que se había programado una angiografía en las 72 h siguientes a la llegada al hospital. Se les asignó aleatoriamente una dosis alta (600 mg de clopidogrel el primer día, seguidos de 150 mg una vez al día durante 7 días, seguidos de 75 mg diarios durante el resto del mes) o una dosis estándar de clopidogrel durante 1 mes. En ese estudio se utilizó un diseño factorial 2 x 2 y se asignó también aleatoriamente a los pacientes la administración de dosis altas (300-325 mg diarios) o bajas (75-100 mg diarios) de ácido acetilsalicílico. Aunque el estudio no identificó una diferencia significativa para la variable de valoración principal (combinación de muerte cardiovascular, infarto de miocardio e ictus a los 30 días) en el conjunto de la población en estudio, la pauta de dosis altas de clopidogrel redujo el riesgo de trombosis en el stent en un 30% y el riesgo de infarto de miocardio en un 22% en el subgrupo de pacientes tratados con ICP (n = 17.232), mientras que no se observó efecto beneficioso alguno en los pacientes que no fueron tratados con ICP. Sin embargo, el efecto beneficioso observado en el subgrupo de ICP se vio limitado por un aumento de las hemorragias mayores en el grupo de dosis altas, aunque esto no fue significativo para las hemorragias intracerebrales o mortales. No hubo diferencias significativas de eficacia ni de sangrados entre dosis altas y bajas de ácido acetilsalicílico, aunque sí se observó una tendencia a una tasa más elevada de hemorragias digestivas en el grupo de dosis alta (el 0,38 frente al 0,24%; p = 0,051).
Ha surgido también un gran interés por el aumento de la dosis de clopidogrel en función del grado de respuesta de un determinado paciente, en lo que se ha definido como un tratamiento «a medida» o «individualizado». Bonello et al121,122 observaron que las dosis de carga adicionales de 600 mg de clopidogrel (hasta un máximo de 2.400 mg) administradas a pacientes con respuesta pobre (tratamiento «a medida») reducen las tasas de episodios adversos, incluida la trombosis del stent, en comparación con los pacientes tratados de forma convencional, sin que con ello aumente el riesgo de sangrado. La eficacia y la seguridad del tratamiento individualizado con una dosis de mantenimiento alta de clopidogrel en los pacientes con una respuesta baja a la dosis estándar de este fármaco se están evaluando actualmente en varios ensayos clínicos en curso, entre ellos: GRAVITAS (Gauging Responsiveness With a VerifyNow Assay: Impact on Thrombosis and Safety; NCT00645918)123, ARCTIC (Double Randomization of a Monitoring Adjusted Antiplatelet Treatment Versus a Common Antiplatelet Treatment for DES Implantation, and Interruption Versus Continuation of Double Antiplatelet Therapy; NCT00827411) y DANTE (Dual Antiplatelet Therapy Tailored on the Extent of Platelet Inhibition, NCT00774475).
Tratamiento antiagregante plaquetario triple
La adición de un tercer fármaco antiagregante plaquetario es una opción que se puede considerar tanto en la fase aguda de tratamiento como en la fase de mantenimiento. Los inhibidores de la GPIIb/IIIa pueden usarse en la fase aguda, puesto que aumentan notablemente la inhibición plaquetaria cuando se añaden al uso de clopidogrel44. Los estudios en los que se ha evaluado el tratamiento individualizado en función del grado de respuesta en comparación con el tratamiento antiagregante plaquetario estándar han obtenido resultados prometedores. En una cohorte de pacientes con pobre respuesta al clopidogrel (n = 149) que fueron remitidos para ICP electivo y fueron asignados aleatoriamente a un «grupo convencional» (tratamiento antiagregante plaquetario doble estándar) o a un «grupo activo» (adición de abciximab al tratamiento antiagregante plaquetario doble), Cuisset et al124 observaron que los pacientes del grupo activo presentaban una tasa de episodios cardiovasculares a 1 mes significativamente inferior (odds ratio [OR] = 2,8). En el ensayo 3T/2R (Tailoring Treatment With Tirofiban in Patients Showing Resistance to Aspirin and/or Resistance to Clopidogrel), recientemente publicado, se incluyó a pacientes con angina estable o inestable de bajo riesgo a los que se practicaba un ICP electivo y respondían mal (n = 263) al ácido acetilsalicílico o al clopidogrel. Se los asignó aleatoriamente a la adición de tirofiban (n = 132) o placebo (n = 131) sobre la pauta estándar de ácido acetilsalicílico y clopidogrel. La tasa de eventos cardiovasculares adversos mayores en un plazo de 30 días se redujo en el grupo de tirofiban (el 3,8 frente al 10,7%), sin que hubiera aumento alguno del riesgo de sangrado125.
En la fase de mantenimiento del tratamiento, se ha observado que el empleo adyuvante de cilostazol añadido al doble tratamiento antiagregante plaquetario estándar aumenta el grado de inhibición plaquetaria126. El aumento de la inhibición plaquetaria obtenido con este tratamiento triple puede contribuir a la mejor evolución clínica observada en los pacientes a los que se practica ICP, incluyendo las tasas de trombosis del stent127-129. Es de destacar que este efecto beneficioso no parece verse limitado por un aumento de los episodios de sangrado127. Sin embargo, el uso de cilostazol se ve dificultado por la elevada frecuencia de efectos secundarios, principalmente cefaleas, palpitaciones y alteraciones gastrointestinales126.
Nuevos antagonistas del receptor P2Y12
Los efectos beneficiosos alcanzados con el bloqueo de la cascada de señales iniciada en el P2Y12 en los pacientes con enfermedad coronaria, en cuanto a la prevención de nuevos episodios recurrentes, son indiscutibles. Así pues, está justificada la búsqueda de nuevos fármacos con mayores efectos inhibidores y una menor variabilidad que la del clopidogrel (fig. 3). En la actualidad, hay varios nuevos inhibidores de P2Y12 que se encuentran en diferentes fases de desarrollo clínico130,131 (tabla 2).
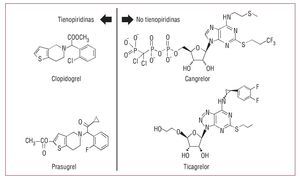
Fig. 3. Estructura química de los antagonistas de los receptores P2Y12.
En este apartado se presenta una visión general de estos nuevos fármacos.
Prasugrel
El prasugrel, una tienopiridina de tercera generación, es un profármaco que se administra por vía oral y debe sufrir una biotransformación hepática para convertirse en su metabolito activo antes de ejercer su efecto de bloqueo irreversible del receptor P2Y12132. La principal diferencia farmacocinética respecto al clopidogrel es que el prasugrel se convierte en su metabolito activo de manera más efectiva, a través de un proceso que comporta una hidrolisis producida por carboxiesterasas, principalmente en el intestino, seguido de un único paso dependiente del CYP hepático. Dado que los metabolitos activos del clopidogrel y del prasugrel son equipotentes en cuanto a la inhibición plaquetaria, la mayor producción de metabolito activo que se obtiene con prasugrel proporciona una inhibición plaquetaria superior132. Además, el prasugrel tiene un inicio de acción más rápido y una menor variabilidad interindividual de respuesta que el clopidogrel, incluso cuando éste último se administra en pautas de dosis altas132,133.
En el ensayo TRITON-TIMI 38 se evaluó la eficacia clínica y la seguridad del prasugrel (dosis de carga de 60 mg seguida de una dosis de mantenimiento de 10 mg), en comparación con las pautas de dosis de carga y mantenimiento estándar de clopidogrel, en 13.608 pacientes con un SCA de riesgo moderado a alto tratados con ICP134. En este estudio de fase III, aleatorizado, a doble ciego y de grupos paralelos, comparado con el clopidogrel, el prasugrel obtuvo una reducción relativa significativa, del 19% (el 9,9% con prasugrel frente al 12,1% con clopidogrel; HR = 0,81; p < 0,001), en las tasas de la variable de valoración principal (combinación de muerte cardiovascular, infarto de miocardio no mortal e ictus no mortal), así como una reducción significativa de las tasas de trombosis del stent (el 9,7 frente al 11,9%; HR = 0,81; p = 0,0001)135, durante un periodo de seguimiento de 15 meses. Esto se produjo a costa de un aumento del riesgo de hemorragias mayores según criterios TIMI, no relacionadas con bypass coronario (el 2,4 frente al 1,8%; p = 0,03), que se observaron sobre todo en la fase de mantenimiento con prasugrel134. Una característica importante de este ensayo es la realización de un análisis de beneficio clínico neto (una combinación de las variables de valoración de eficacia y de hemorragia), en el que el prasugrel continuó siendo superior a pesar del mayor número de sangrados (el 12,2 frente al 13,9%; HR = 0,87; p = 0,004). El efecto clínico beneficioso del prasugrel se debió en gran parte a una notable reducción de los IM no mortales, mientras que no se observaron diferencias en cuanto a la mortalidad y los ictus. Determinados subgrupos parecieron obtener un mayor beneficio con el empleo de prasugrel, como fue el caso de los pacientes con diabetes mellitus136 y los pacientes con IAMCEST137, en los que no se observó aumento alguno del riesgo hemorrágico. En cambio, el análisis neto mencionado anteriormente no mostró beneficio en los pacientes de edad avanzada (≥ 75 años) ni en los que tenían un peso < 60 kg, y evidenció un efecto neto negativo en los pacientes con antecedentes de ictus o accidente isquémico cerebral transitorio134. Un análisis de marca temporal de ese ensayo puso de manifiesto una reducción significativa de los episodios isquémicos en el grupo de prasugrel al tercer día, que persistía posteriormente durante todo el periodo de seguimiento138. Es importante señalar que este análisis indicó un efecto clínico beneficioso y continuo al obtener una mayor inhibición plaquetaria durante la fase de mantenimiento del tratamiento.
Las autoridades reguladoras han aprobado recientemente el prasugrel para uso clínico, pero tan sólo en el contexto de los pacientes con SCA a los que se practica un ICP. La eficacia clínica del prasugrel en pacientes con angina inestable/SCASEST que reciben tratamiento médico está siendo evaluada actualmente en el ensayo TRILOGY-SCA (Targeted Platelet Inhibition to Clarify the Optimal Strategy to Medically Manage Acute Coronary Syndromes) (NCT00699998).
Ticagrelor
El ticagrelor es una ciclopentiltriazolopirimidina de administración oral, que inhibe de manera directa y reversible el receptor P2Y12 plaquetario132,139. Sus propiedades farmacocinéticas y farmacodinámicas son las siguientes: a) absorción e inicio de acción rápidas; b) inhibición de la agregación plaquetaria superior a la obtenida con clopidogrel, y c) desaparición rápida de la acción, puesto que tiene una semivida de 12 h (requiere administración dos veces al día)140,141. En el ensayo PLATO (Platelet Inhibition and Patient Outcomes), recientemente publicado, se evaluó el efecto beneficioso del ticagrelor (dosis de carga de 180 mg seguida de 90 mg dos veces al día) en comparación con clopidogrel (dosis de carga de 300-600 mg seguida de 75 mg diarios) en la prevención de los episodios cardiovasculares en 18.624 pacientes con SCA, con o sin elevación del segmento ST142. En este ensayo, el tratamiento con ticagrelor redujo de manera significativa la tasa de episodios de la variable de valoración principal (muerte por causas vasculares, infarto de miocardio o ictus) a los 12 meses (el 12,3 frente al 10,2%; HR = 0,84; p = 0,0001) y es de destacar que redujo también la tasa de muertes cardiovasculares (el 4 frente al 5,1%; p = 0,001), muertes por cualquier causa (el 4,5 frente al 5,9%; p < 0,001) y la frecuencia de trombosis del stent definida o probable (el 2,2 frente al 2,9%; p = 0,02) en el subgrupo de pacientes tratados con ICP. Aunque no se observó aumento alguno de las hemorragias mayores aplicando la definición establecida en el protocolo (el 11,6 frente al 11,2%; p = 0,43), el ticagrelor se asoció a una tasa superior de hemorragias mayores no relacionadas con bypass coronario (el 4,5 frente al 3,8%; p = 0,03). Al utilizar la definición TIMI de hemorragia mayor no relacionada con bypass en el ensayo TRITON, hubo un aumento similar en la tasa de hemorragias con ticagrelor (el 2,8 frente al 2,2%; p = 0,03). Además, aparecieron algunos elementos de preocupación en cuanto a la seguridad, no relacionados con las hemorragias. La disnea fue más frecuente en el grupo de ticagrelor (el 13,8 frente al 7,8%; p < 0,001), y ello motivó una tasa significativamente superior de abandonos del tratamiento en comparación con clopidogrel (el 0,9 frente al 0,1%; p < 0,001). Además, los pacientes en el grupo de ticagrelor presentaron un aumento significativamente superior de los valores de creatinina y ácido úrico respecto a la situación basal, en comparación con lo observado en el grupo de clopidogrel, al cabo de 1 y 12 meses (p < 0,001 en ambos casos), así como un porcentaje superior de pausas ventriculares (≥ 3 s) en la primera semana (p = 0,01), si bien no hubo diferencias en los episodios de bradicardia. Estos efectos secundarios no hemorrágicos probablemente sean atribuibles a efectos del ticagrelor o sus metabolitos en lugares distintos de su diana terapéutica.
Cangrelor
El cangrelor es un análogo de ATP de administración intravenosa, que inhibe de manera reversible y directa, sin biotransformación, el receptor P2Y12132,139. Las principales propiedades farmacocinéticas y farmacodinámicas de cangrelor son: a) inicio de acción rápido, puesto que alcanza las concentraciones estables en unos minutos; b) grado elevado de inhibición plaquetaria (> 90%); c) efectos dosis-dependientes, y d) desaparición rápida de la acción, puesto que tiene una semivida extremadamente breve (2-5 min) a causa de una rápida desactivación por ectonucleotidasas plasmáticas143,144. Los resultados prometedores obtenidos en estudios de fase II, que demostraron que el cangrelor es un inhibidor plaquetario potente con un perfil relativamente seguro143,144, no se han corroborado en estudios de fase III. El programa CHAMPION (Cangrelor Versus Standard Therapy to Achieve Optimal Management of Platelet Inhibition) incluyó los ensayos CHAMPION (n = 8.716) y CHAMPION-PLATFORM (n = 5.362) . Dichos estudios tuvieron como objetivo evaluar la eficacia del cangrelor en pacientes, la mayoría de ellos con SCA, tratados con ICP. El tratamiento con cangrelor no fue superior a la hora de reducir las tasas de la variable de valoración principal (combinación de muerte por cualquier causa, infarto de miocardio o revascularización guiada por la presencia de isquemia a las 48 horas (comparado con el uso de clopidogrel (el 7,5% frente al 7,1%, OR = 1,05; p = 0,56) en el CHAMPION-PCI145, o comparado con placebo (el 7,0% frente al 8,0%; OR = 0,87; p = 0,17) en el CHAMPION-PLATFORM146. Sin embargo, las propiedades farmacológicas del cangrelor hacen que este fármaco sea prometedor en el contexto de los pacientes que necesitan una intervención quirúrgica que requiere una estrategia antiagregante plaquetaria de puente, lo que está siendo estudiado en el ensayo BRIDGE (NCT 00767507), actualmente en curso.
Elinogrel
El elinogrel es un nuevo inhibidor del P2Y12 de acción directa y reversible, que puede administrarse por vía oral o intravenosa147. Actualmente se encuentra en las fases preliminares del desarrollo, pero los estudios de fase I han mostrado interesantes propiedades farmacológicas: a) inicio de acción rápido (casi inmediato si se administra por vía intravenosa); b) grado de inhibición plaquetaria superior a la del clopidogrel, y c) desaparición rápida de la acción, pues su semivida es de 50 min o 12 h según se administre por vía intravenosa u oral, respectivamente147. Recientemente se han presentado los resultados de un estudio farmacodinámico en el Congreso de 2008 de la American Heart Association (New Orleans, Louisiana, Estados Unidos), en el que se puso de manifiesto que una sola dosis oral de elinogrel mejoró la inhibición plaquetaria en pacientes estables con enfermedad coronaria que respondían mal al clopidogrel148. En la actualidad, el ensayo en curso INNOVATE (a Randomized, Double-Blind, Active-Controlled Trial to Evaluate Intravenous and Oral PRT060128, a Selective and Reversible P2Y12 Inhibitor, vs Clopidogrel, as a Novel Antiplatelet Therapy in Patients Undergoing Non-Urgent PCI) (NCT00751231) está evaluando la eficacia clínica, la actividad biológica, la tolerabilidad y la seguridad del elinogrel en pacientes tratados con ICP no urgente, mediante el análisis de tres dosis diferentes (oral 50, 100 y 150 mg dos veces al día tras un bolo intravenoso).
CONCLUSIONES
La inhibición del receptor P2Y12 plaquetario con el empleo de clopidogrel ha supuesto un avance importante en el tratamiento de la enfermedad aterotrombótica, en especial en los casos de SCA tratados con ICP. A pesar del claro beneficio clínico asociado al clopidogrel en estos pacientes, experiencias clínicas y de laboratorio ha permitido identificar algunas de sus limitaciones, la más relevante de las cuales es la amplia variedad existente en el perfil de respuesta inhibitoria plaquetaria. Se han involucrado factores genéticos, celulares y clínicos en la variabilidad de respuesta al clopidogrel, que se ha demostrado que se asocia a una evolución clínica adversa. Así pues, está claramente justificada la búsqueda de nuevas estrategias para optimizar la inhibición plaquetaria. De hecho, el desarrollo de nuevos bloqueadores de los receptores P2Y12 con unos perfiles farmacocinéticos y farmacodinámicos más favorables constituye un nuevo e importante paso en este campo. La evaluación de los ensayos a gran escala recientemente presentados y los resultados que aportarán las investigaciones clínicas en curso proporcionarán los fundamentos futuros para el uso de pautas de tratamiento antiagregante plaquetario individualizadas y más específicas.
AGRADECIMIENTOS
Queremos expresar nuestra gratitud a la Dra. Mariana Muñoz por su ayuda en la preparación de las figuras.
Full English text available from: www.revespcardiol.org
Declaración de conflictos de intereses de Dominick J. Angiolillo: Honorarios/conferencias: Bristol-Myers-Squibb; Sanofi-Aventis; Eli Lilly & Co.; Daiichi Sankyo, Inc.
Honorarios/consejo asesor: Bristol-Myers-Squibb; Sanofi-Aventis; Eli Lilly & Co.; Daiichi Sankyo, Inc.; Astra Zeneca; The Medicines Company; Portola Pharmaceuticals; Novartis; Arena Pharmaceuticals.
Subvenciones de investigación: GlaxoSmithKline; Otsuka; Accumetrics; Eli Lilly & Co.; Daiichi Sankyo, Inc.; The Medicines Company; Astra Zeneca; Eisai; Portola Pharmaceutical; Schering-Plough; Johnson & Johnson.
Correspondencia: Dr. D.J. Angiolillo.
University of Florida College of Medicine-Jacksonville.
655 West 8th Street. Jacksonville. Florida 32209. Estados Unidos.
Correo electrónico: dominick.angiolillo@jax.ufl.edu