Los anticoagulantes orales directos (ACOD) se han mostrado eficaces y seguros en pacientes con fibrilación auricular; sin embargo, los pacientes con FA y bioprótesis están infrarrepresentados en los ensayos clínicos, por lo que la evidencia en este grupo es menor. Nuestro objetivo fue analizar la seguridad y eficacia de los ACODs en esta población revisando la información existente en la literatura.
MétodosSe realizó una búsqueda y revisión sistemática con los ensayos clínicos aleatorizados y estudios observacionales comparativos desde 2017 a enero de 2022, que comparasen ACODs y antagonistas de vitamina K (AVK) en pacientes con FA y bioprótesis. Se utilizó la hazard ratio al 95% del intervalo de confianza para comparar ambos grupos en términos de mortalidad total y cardiovascular, ictus/embolia sistémica y hemorragia mayor. Se realizó un metanálisis combinando los resultados de los estudios incluidos.
ResultadosSe incluyeron 12 estudios (un total de 30.283 pacientes). Los ACODs se asociaron a una reducción significativa del 9% de la mortalidad total (HR=0,91; IC95%, 0,85-0,97; p=0,0068; I2=8%), sin diferencias significativas en el riesgo de ictus/embolismo sistémico (HR=0,87; IC95%, 0,67-1,14; p=0,29; I2=45%) o hemorragia mayor (HR=0,82; IC95%, 0,67-1,00; p=0,054; I2=48.7%).
ConclusionesEn pacientes con FA portadores de bioprótesis, los ACODs podrían asociarse a una reducción de la mortalidad total sin reducción de eficacia en la prevención de ictus/embolia sistémica o aumento del riesgo de hemorragia mayor.
Palabras clave
Los anticoagulantes orales directos (ACOD) se utilizan cada vez más para la profilaxis de eventos cardioembólicos en pacientes con fibrilación auricular (FA) no valvular. Los grandes ensayos clínicos aleatorizados publicados hasta la fecha han demostrado que estos fármacos son al menos tan eficaces como los antagonistas de la vitamina K (AVK) en la prevención de eventos tromboembólicos y generalmente presentan mejor perfil de riesgo hemorrágico. Sin embargo, los pacientes con bioprótesis valvulares aparecen infrarrepresentados en estos estudios. Es más, los estudios utilizados para validar la escala CHA2DS2-VASc no incluyen pacientes con bioprótesis1. Las guías de práctica clínica europeas2 hacen una recomendación IIA con el nivel de evidencia C respecto al uso de ACOD en este grupo (IIB en los primeros 3 meses después del recambio valvular) en función de los resultados de los subestudios realizados como parte de estos ensayos clínicos3. En cambio, las guías de práctica clínica norteamericanas no respaldan esta recomendación4 ya que 2 de estos subestudios son análisis post hoc en un pequeño grupo de pacientes5,6 y otro estudio que comparó la warfarina con el dabigatrán fue interrumpido antes de tiempo a causa del reducido número de población a estudio7.
A pesar de que la evidencia sobre la seguridad y la eficacia de los ACOD en esta población de pacientes aún no está bien establecida, estos medicamentos se utilizan de forma cada vez más frecuente en la práctica clínica8.
El objetivo de este estudio fue evaluar la seguridad y la eficacia de los ACOD en pacientes con FA y bioprótesis valvulares mediante una revisión sistemática y un metanálisis que incluyera la evidencia reciente de estudios comparativos de cohortes y resultados de vida real.
MÉTODOSSe llevó a cabo una revisión sistemática de la bibliografía científica y un metanálisis posterior siguiendo las directrices de la declaración PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses)9 sobre revisiones sistemáticas (figura 1).
Búsqueda sistemáticaLas primeras búsquedas no formales se realizaron en enero de 2022 mediante la combinación de los términos bioprosthetic valves y directanticoagulants en las bases de datos PubMed y Scopus. Posteriormente, se llevó a cabo una búsqueda sistemática en la base de datos PubMed utilizando operadores booleanos, restringiendo la búsqueda a los artículos publicados desde 2017 hasta enero de 2022 (ambos inclusive). La combinación de términos que proporcionan los mejores resultados se presenta en el material adicional. En concreto, se obtuvieron 609 resultados. Las fuentes secundarias se buscaron posteriormente mediante referencias de artículos y revisiones identificados inicialmente. Los criterios de inclusión y exclusión se establecieron antes de la selección del estudio (tabla 1).
Criterios de inclusión y exclusión en la selección de estudios para el metanálisis
| Criterios de inclusión | Criterios de exclusión |
|---|---|
| - ECA o estudios observacionales comparativos- Comparación de ACOD frente a antagonistas de la vitamina K- En pacientes con FA o aleteo auricular y bioprótesis valvular- Incluidos los resultados de mortalidad por cualquier causa, hemorragia mayor y embolia sistémicaa- Publicado entre enero de 2017 y enero de 2022 | - Estudios no comparativos- Pacientes sin FA ni aleteo auricular- Metanálisis |
FA, fibrilación auricular; ACOD, anticoagulantes orales directos; ECA, ensayo clínico aleatorizado.
El cribado para la selección de estudios fue realizado por 2 autores de forma independiente y enmascarada mediante la lectura de títulos y resúmenes, para seleccionar los estudios en función de nuestros criterios de inclusión y exclusión. Las discrepancias se resolvieron por consenso.
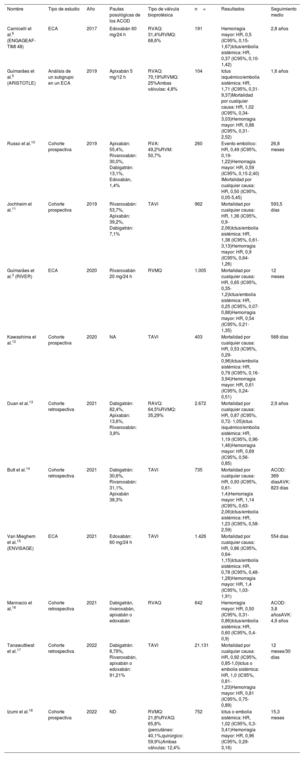
De todos los estudios seleccionados, 50 cumplían los requisitos para una evaluación exhaustiva y 12 se seleccionaron finalmente para su inclusión en el análisis cuantitativo. Este proceso y los motivos de exclusión se resumen en el diagrama de flujo de PRISMA (figura 1). Las características de los estudios incluidos en el metanálisis se describen en la tabla 2.
Características clave de los estudios incluidos en el metanálisis
| Nombre | Tipo de estudio | Año | Pautas posológicas de los ACOD | Tipo de válvula bioprotésica | n= | Resultados | Seguimiento medio |
|---|---|---|---|---|---|---|---|
| Carnicelli et al.6 (ENGAGEAF-TIMI 48) | ECA | 2017 | Edoxabán 60 mg/24 h | RVAQ: 31,4%RVMQ: 68,6% | 191 | Hemorragia mayor: HR, 0,5 (IC95%, 0,15-1,67)Ictus/embolia sistémica: HR, 0,37 (IC95%, 0,10-1,42) | 2,8 años |
| Guimarães et al.5 (ARISTOTLE) | Análisis de un subgrupo en un ECA | 2019 | Apixabán 5 mg/12 h | RVAQ: 70,19%RVMQ: 25%Ambas válvulas: 4,8% | 104 | Ictus isquémico/embolia sistémica: HR, 1,71 (IC95%, 0,31-9,37)Mortalidad por cualquier causa: HR, 1,02 (IC95%, 0,34-3,03)Hemorragia mayor: HR, 0,88 (IC95%, 0,31-2,52) | 1,6 años |
| Russo et al.10 | Cohorte prospectiva | 2019 | Apixabán: 55,4%, Rivaroxabán: 30,0%, Dabigatrán: 13,1%, Edoxabán, 1,4% | RVA: 49,2%RVM: 50,7% | 260 | Evento embólico: HR, 0,49 (IC95%, 0,19-1,22)Hemorragia mayor: HR, 0,59 (IC95%, 0,15-2,40) IMortalidad por cualquier causa: HR, 0,50 (IC95%, 0,05-5,45) | 26,8 meses |
| Jochheim et al.11 | Cohorte prospectiva | 2019 | Rivaroxabán: 53,7%, Apixabán: 39,2%, Dabigatrán: 7,1% | TAVI | 962 | Mortalidad por cualquier causa: HR, 1,36 (IC95%, 0,9-2,06)Ictus/embolia sistémica: HR, 1,38 (IC95%, 0,61-3,13)Hemorragia mayor: HR, 0,9 (IC95%, 0,64-1,26) | 593,5 días |
| Guimarães et al.3 (RIVER) | ECA | 2020 | Rivaroxabán 20 mg/24 h | RVMQ | 1.005 | Mortalidad por cualquier causa: HR, 0,65 (IC95%, 0,35-1,2)Ictus/embolia sistémica: HR, 0,25 (IC95%, 0,07-0,88)Hemorragia mayor: HR, 0,54 (IC95%, 0,21-1,35) | 12 meses |
| Kawashima et al.12 | Cohorte prospectiva | 2020 | NA | TAVI | 403 | Mortalidad por cualquier causa: HR, 0,53 (IC95%, 0,29-0,96)Ictus/embolia sistémica: HR, 0,79 (IC95%, 0,16-3,94)Hemorragia mayor: HR, 0,61 (IC95%, 0,24-0,51) | 568 días |
| Duan et al.13 | Cohorte retrospectiva | 2021 | Dabigatrán: 82,4%, Apixabán: 13,6%, Rivaroxabán: 3,8% | RAVQ: 64,5%RVMQ: 35,29% | 2.672 | Mortalidad por cualquier causa: HR, 0,87 (IC95%, 0,72- 1,05)Ictus isquémico/embolia sistémica: HR, 1,19 (IC95%, 0,96-1,46)Hemorragia mayor: HR, 0,69 (IC95%, 0,56-0,85) | 2,9 años |
| Butt et al.14 | Cohorte retrospectiva | 2021 | Dabigatrán: 30,6%, Rivaroxabán: 31,1%, Apixabán 38,3% | TAVI | 735 | Mortalidad por cualquier causa: HR, 0,93 (IC95%, 0,61-1,4)Hemorragia mayor: HR, 1,14 (IC95%, 0,63-2,06)Ictus/embolia sistémica: HR, 1,23 (IC95%, 0,58-2,59) | ACOD: 369 díasAVK: 823 días |
| Van Mieghem et al.15 (ENVISAGE) | ECA | 2021 | Edoxabán: 60 mg/24 h | TAVI | 1.426 | Mortalidad por cualquier causa: HR, 0,86 (IC95%, 0,64-1,15)Ictus/embolia sistémica: HR, 0,78 (IC95%, 0,48-1,28)Hemorragia mayor: HR, 1,4 (IC95%, 1,03-1,91) | 554 días |
| Mannacio et al.16 | Cohorte retrospectiva | 2021 | Dabigatrán, rivaroxabán, apixabán o edoxabán | RVAQ | 642 | Hemorragia mayor: HR, 0,50 (IC95%, 0,31-0,86)Ictus/embolia sistémica: HR, 0,60 (IC95%, 0,4-0,9) | ACOD: 3,8 añosAVK: 4,9 años |
| Tanawuttiwat et al.17 | Cohorte retrospectiva | 2022 | Dabigatrán: 8,79%, Rivaroxabán, apixabán o edoxabán: 91,21% | TAVI | 21.131 | Mortalidad por cualquier causa: HR, 0,92 (IC95%, 0,85-1,0)Ictus o embolia sistémica: HR, 1,0 (IC95%, 0,81-1,23)Hemorragia mayor: HR, 0,81 (IC95%, 0,75-0,89) | 12 meses/30 días |
| Izumi et al.18 | Cohorte prospectiva | 2022 | ND | RVMQ: 21,8%RVAQ: 65,8% (percutáneo: 40,1%,quirúrgico: 59,9%)Ambas válvulas: 12,4% | 752 | Ictus o embolia sistémica: HR, 1,02 (IC95%, 0,3-3,41)Hemorragia mayor: HR, 0,96 (IC95%, 0,29-3,16) | 15,3 meses |
ACOD, anticoagulantes orales directos; ECA, ensayo clínico aleatorizado; HR, hazard ratio; IC95%, intervalo de confianza del 95%; ND, no disponible; RVAQ, recambio valvular aórtico quirúrgico; RVMQ, recambio valvular mitral quirúrgico; TAVI, implante percutáneo de válvula aórtica.
El objetivo primario de eficacia fue la mortalidad por cualquier causa. Los objetivos secundarios fueron la embolia sistémica o ictus y la mortalidad cardiovascular. El objetivo de seguridad fue la hemorragia grave. Se aceptó la definición de hemorragia grave de cada estudio. La embolia sistémica o ictus se definió como ictus isquémico, embolia sistémica o accidente isquémico transitorio.
Análisis estadísticosMedidas de interés y softwareLos datos extraídos de todos los estudios consistieron en la HR de cada uno de los resultados de interés. La medida de incertidumbre se calculó utilizando un intervalo de confianza del 95% (IC95%). Aunque el metanálisis se basó inicialmente en 12 estudios, aquellos con datos ausentes, ya fuera del tamaño del efecto (hazard ratio [HR]) o el IC95%, se excluyeron de cada análisis.
Los datos extraídos para evaluar el efecto de la intervención fueron los derivados del análisis por intención de tratar para ensayos clínicos aleatorizados (ECA) y modelos ajustados para estudios observacionales. Los efectos de la intervención seleccionados fueron extraídos del periodo de seguimiento más largo de cada estudio.
La función metagen en la biblioteca meta del paquete estadístico R19 se utilizó para trabajar con HR en una escala logarítmica. Tanto el modelo de efectos aleatorios como el modelo de efectos fijos se ajustaron simultáneamente a los datos y se actualizaron en función de los tests de heterogeneidad.
Se usó el método de la varianza inversa para obtener el estimador del tamaño del efecto global y el estimador de Paule-Mandel del error aleatorio. Se utilizó el método del perfil Q para el IC de este error y se aplicó la corrección de Hartung-Knapp cuando se utilizó un modelo de efectos aleatorios.
Moderador del análisis de subgruposTeniendo en cuenta la diferenciación inicial entre los estudios (ECA y estudios observacionales), se probaron a priori las diferencias mediante el modelo plural de efectos fijos de Borenstein y Higgins20.
Metanálisis y heterogeneidadLas conclusiones respecto a la heterogeneidad entre los estudios se basaron en el IC del error aleatorio tau (μ), la prueba Q de Cochran, el valor muestral de Higgins y Thomson (I2) (que describe el porcentaje de variabilidad de los tamaños del efecto a causa de la heterogeneidad) y el estadístico H basado en la Q deCochran que compara la variabilidad observada con la esperada. Si alguna de las pruebas aportaba evidencia de heterogeneidad, se elegía el modelo de efectos aleatorios. El tamaño del efecto global se estimó con el modelo elegido (efectos fijos o aleatorios) y las conclusiones se basaron en su significación e IC.
Los resultados también se expusieron en gráficos de bosque donde también se mostraron los pesos dados a los estudios combinados, según la precisión de las estimaciones.
Análisis de influenciaSe llevó a cabo un análisis de influencia para identificar estudios atípicos utilizando la función find.outliers de la biblioteca meta en R. También se realizó un análisis de la influencia de aquellos estudios con pesos altos en el metanálisis con el fin de estudiar su sensibilidad (o robustez) al prescindir de ellos.
Sesgo de publicaciónEl análisis del sesgo de publicación se realizó utilizando el método trim and fill de Duval y Tweedie21 solo en el caso de que se utilizase el modelo de efectos aleatorios con los estudios disponibles. Este procedimiento replica estudios con un tamaño del efecto que difiere significativamente de los de los otros estudios que utilizan valores espejo (a partir de la media) y reajusta el metanálisis de efectos aleatorios.
Riesgo de sesgo en estudios individualesLa calidad del estudio se evaluó con la herramienta ROB-2.0 de la Colaboración Cochrane22 () en el caso de los ECA y con la Escala de Newcastle-Ottawa23 () en el caso de los estudios observacionales.
RESULTADOSNuestro análisis incluyó 12 estudios, 4 ECA y 8 estudios observacionales con 30.283 pacientes seleccionados en total.
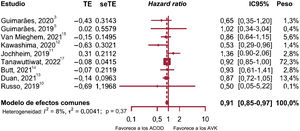
Mortalidad por cualquier causa y mortalidad cardiovascularEl análisis de subgrupos no aportó diferencias entre los estudios observacionales y los ECA (p=0,37), ni heterogeneidad dentro de los subgrupos (p=0,32); por tanto, se combinaron 6 estudios observacionales y 3 ECA que proporcionaron datos sobre la mortalidad por cualquier causa (figura 2)3,5,10–15,17.
El estudio de Tanawuttiwat et al.17 fue el más preciso de todos en calcular la HR y el estudio con mayor impacto en el metanálisis (72% de peso). No hubo evidencia de heterogeneidad, por tanto, se utilizó un modelo de efectos fijos. Se observó una reducción del 9% de la mortalidad por cualquier causa en pacientes tratados con ACOD (HR, 0,91; p=0,0068; IC95%, 0,85-0,97; I2=8%). El análisis de influencia no identificó ningún estudio atípico.
Excluir el estudio de Tanawuttiwat et al.17 del análisis de sensibilidad no dio como resultado diferencias significativas entre los 2 tratamientos (HR, 0,88; p=0,06; IC95%, 0,77-1,01; I2=16,3%). Sin embargo, este estudio no se identificó como atípico, y después de su inclusión no hubo evidencia de heterogeneidad, por lo que fue incluido en el análisis.
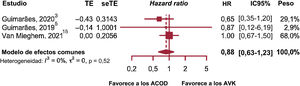
Al evaluar la mortalidad cardiovascular, solo 3 de los estudios incluidos en el metanálisis aportaban información al respecto, lo que inevitablemente representó una limitación para la interpretación de los resultados junto con el resto de conclusiones extraídas de este estudio (figura 3)3,5,15.
No se encontraron diferencias significativas entre los tratamientos (HR, 0,88; p=0,446; IC95%, 0,63-1,23; I2=0%) y no se reveló evidencia de heterogeneidad. Tampoco había evidencia de resultados atípicos. Se encontró que el estudio de Van Mieghem et al.15 era el más preciso de todos en calcular la HR y recibió un peso del 68%. Excluir este estudio del análisis de sensibilidad no dio como resultado diferencias significativas entre los 2 tratamientos.
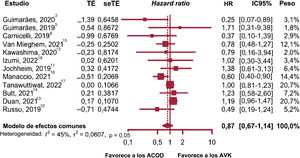
Ictus y embolia sistémicaEl análisis de subgrupos no mostró diferencias entre los estudios observacionales y los ECA (p=0,22), o heterogeneidad dentro de los subgrupos (p=0,08); por tanto, se combinaron 4 ECA y 8 estudios observacionales (figura 4)3,5,6,10–18.
Los pesos variaron ampliamente y a los estudios de Tanawuttiwat et al.17 y Duan et al.13 se les asignó el peso máximo del 20,7%. Se utilizó un modelo de efectos aleatorios al haber datos de heterogeneidad significativa. No hubo evidencia que mostrara un efecto significativo del tratamiento con ACOD sobre la reducción del riesgo de ictus y embolia (HR, 0,87; p=0,29; IC95%, 0,67-1,14; I2=45%).
El análisis de influencia no identificó ningún estudio atípico y no se encontró evidencia de sesgo de publicación.
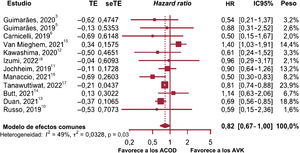
Hemorragia graveEl análisis de subgrupos no mostró diferencias entre los estudios observacionales y los ECA (p=0,1471), o heterogeneidad dentro de los subgrupos (p=0,1827). Por tanto, los resultados de los 12 estudios se combinaron para obtener el riesgo relativo de hemorragia grave asociada con el tratamiento con ACOD (figura 5)3,5,6,10–18.
En este caso, los pesos variaron ampliamente y el estudio de Tanawuttiwat et al.17 presentó el peso máximo (23,9%) con un error de estimación claramente menor que el resto (0,04 para el error estándar). A pesar de que el error aleatorio (τ) no fue significativamente >0 y el IC del estadístico H contenía el valor de 1(lo cual no da evidencias de heterogeneidad entre estudios), se observó que hasta el 48,7% de la variación entre los tamaños del efecto entre estudios era atribuible a la heterogeneidad, como se infiere del valor I2 y del test de heterogeneidad de Cochran (p=0,029). Por tanto, el modelo de efectos aleatorios se consideró superior y aportó una estimación del tamaño del efecto global de 0,82 en función del HR (p=0,054; IC95%, 0,67-1,00). Esto no fue significativo al nivel del 95%, aunque los resultados estaban en el límite (el valor de p fue mayor que el 5% habitual y el valor 1 es el límite del IC en la estimación del HR); sin embargo, no se puede afirmar que se produjera un efecto significativo del tratamiento con ACOD en la reducción de hemorragias graves.
Respecto a la evaluación del posible sesgo de publicación, se realizó un ajuste de trim and fill21 al añadir 3 estudios para complementar el metanálisis (Guimarães et al.3, Carnicelli et al.6 y Mannacio et al.16). Se utilizó un modelo de efectos fijos, ya que no se encontró evidencia de heterogeneidad entre estudios, y las conclusiones que se extrajeron, a partir de los resultados obtenidos, fueron similares a las ya mencionadas. Incluso cuando se utilizó un modelo de efectos aleatorios, no se encontró ningún efecto global significativo a favor de una reducción del riesgo de hemorragia con el tratamiento con ACOD.
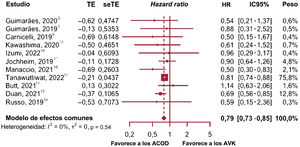
Posteriormente se realizó un análisis de robustez y el estudio de Van Mieghem et al.15 se identificó como un estudio atípico en comparación con los otros estudios incluidos. Por ello, procedimos a repetir el metanálisis sin los resultados de ese estudio y, puesto que no se encontró evidencia de heterogeneidad, se utilizó un modelo de efectos fijos. En este caso, el tamaño del efecto global fue una HR de 0,79 (p=0,0001; IC95%, 0,73-0,85; I2=0%), con una reducción del 21,1% en el riesgo de hemorragia grave con el tratamiento con ACOD en comparación con AVK (figura 6)3,5,6,10–14,16–18.
Gráfico de bosque de hemorragia mayor excluyendo ENVISAGE15. ACOD, anticoagulantes orales directos; AVK, antagonistas de la vitamina K.
El estudio de Tanawuttiwat et al.17 presentó un peso alto (75,8%), pero, al excluir este estudio del análisis de sensibilidad, se mostraron resultados similares con un modelo de efectos fijos (HR, 0,73; p=0,0001; IC95%, 0,63-0,84).
DISCUSIÓNSe ha demostrado que los ACOD tienen un perfil de seguridad adecuado y han facilitado el control y el seguimiento del tratamiento anticoagulante en pacientes con FA. Con todo, estos beneficios no están esclarecidos en los pacientes con bioprótesis valvulares.
Las conclusiones se derivaron primero de subestudios que incluían a pocos pacientes y formaban parte de los ensayos fundamentales realizados para cada uno de los ACOD.
Los resultados del estudio post hoc del ensayo RIVER3 demostraron la no inferioridad del rivaroxabán frente a la warfarina en pacientes con FA y bioprótesis mitrales en un resultado combinado de muerte y eventos cardiovasculares o hemorrágicos graves a los 12 meses.
En un subestudio del ensayo ARISTOTLE5, con un subgrupo de 108 pacientes con bioprótesis valvular y FA, se comparó a aquellos que recibieron apixabán (n=56) con los que recibieron warfarina (n=52), y no se encontraron diferencias en ictus o embolia sistémica, hemorragia grave o mortalidad por cualquier causa.
Un análisis preespecificado del ensayo ENGAGE AF-TIMI 48, 6 que comparó warfarina y edoxabán en pacientes con bioprótesis valvular y FA mostró incidencias similares de ictus y embolia sistémica, así como reducción de hemorragias graves en el grupo de edoxabán
Por último, en el ECA reciente ENVISAGE TAVI-AF15, los pacientes con FA a quienes se había realizado un implante percutáneo de válvula aórtica (TAVI) con éxito fueron asignados aleatoriamente a recibir AVK o edoxabán, y se demostró la no inferioridad del edoxabán en el resultado compuesto de eventos adversos clínicos (mortalidad por cualquier causa, infarto de miocardio, ictus isquémico o embolia sistémica, trombosis valvular o hemorragia grave). Sin embargo, el edoxabán no cumplió con los criterios de no inferioridad respecto a la seguridad, ya que los eventos hemorrágicos graves aumentaron a expensas de una mayor incidencia de hemorragia gastrointestinal en el grupo tratado con edoxabán. Estos resultados concuerdan con el aumento de hemorragias gastrointestinales encontrado en el ensayo ENGAGE AF-TIMI 4824.
Varios estudios de cohortes que aportan evidencia adicional de los ACOD en pacientes con bioprótesis valvulares también han llegado a conclusiones dispares. En la cohorte prospectiva OCEAN12, que incluyó pacientes con TAVI, la mortalidad por cualquier causa disminuyó en el grupo de ACOD. Un estudio basado en los registros France-TAVI y FRANCE-2 también encontró una disminución de mortalidad por cualquier causa y hemorragia grave, y resultados comparables de ictus isquémico en pacientes que recibieron ACOD frente a otros que recibieron AVK25. También se han obtenido resultados contradictorios respecto al riesgo de ictus y embolia sistémica. En un estudio multicéntrico con 962 pacientes con TAVI11 se encontró un número más elevado de eventos isquémicos y un número similar de eventos hemorrágicos con ACOD. Sin embargo, en una cohorte japonesa de 894 pacientes con válvulas bioprotésicas (registro BPV-AF)18, el 30% de los cuales aproximadamente estaban recibiendo tratamiento con ACOD, el riesgo de hemorragia grave, ictus y embolia sistémica fue semejante al de los pacientes que recibieron warfarina. Se obtuvieron resultados similares en una cohorte danesa de pacientes con TAVI14.
Adicionalmente, el estudio de Tanawuttiwat et al.17 analizó los datos de los 21.131 pacientes identificados que recibieron AVK o ACOD de una de las mayores cohortes de pacientes con TAVI (Registro STS/ACC) y encontraron que los ACOD se asociaron a un riesgo similar de ictus con un menor riesgo de hemorragia, hemorragia intracraneal y mortalidad a 1 año.
Por último, entre los últimos metanálisis publicados hay algunos que no muestran diferencias entre ambos tratamientos26,27 o bien muestran hallazgos a favor de los ACOD28–30 en cuanto a seguridad y eficacia.
Nuestro estudio mostró una reducción del 9% de la mortalidad por cualquier causa en los pacientes tratados con ACOD. Esta reducción podría atribuirse a una disminución de las hemorragias graves notificadas en los estudios incluidos (excepto en el estudio ENVISAGE). Aunque este resultado sugiere un beneficio a favor de los ACOD, debe tenerse en cuenta que, en el registro de Tanawuttiwat et al., el menor riesgo de hemorragia de los pacientes tratados con ACOD podría atribuirse a que esta población de estudio presentaba un menor riesgo hemorrágico. Por tanto, este resultado, notificado principalmente en estudios observacionales, podría deberse a diferencias basales significativas entre los 2 grupos por la falta de aleatorización.
En el estudio de Yokoyama et al.30, que combinó datos de 4 ECA y 6 estudios comparativos de cohortes, el uso de ACOD se asoció con una reducción significativa del riesgo relativo de hemorragia y no se asoció con ningún aumento del riesgo de eventos embólicos o de mortalidad por cualquier causa. Las diferencias en la reducción de la hemorragia grave entre el estudio de Yokoyama et al. y el nuestro podrían deberse a la inclusión en nuestro trabajo de los resultados del ensayo ENVISAGE15.
En nuestro metanálisis, el análisis de sensibilidad indicó que el estudio ENVISAGE15 era un estudio atípico, en términos estadísticos, en cuanto a los resultados de hemorragia grave. Cabe destacar que con la exclusión de este estudio del metanálisis se objetivaron diferencias significativas a favor de los ACOD; sin embargo, los resultados de este estudio fueron finalmente incluidos en el metanálisis, dado que se trata de uno de los ECA más recientes, presenta datos de alta calidad y es el único ECA que evaluó el uso de AVK frente al edoxabán en pacientes con FA después de TAVI. Además, su inclusión en nuestro trabajo proporcionaba información sobre su influencia en el análisis global y, por tanto, consideramos que sus resultados merecen mención. El mayor riesgo de hemorragia gastrointestinal observado en el grupo de edoxabán puede deberse a la inclusión de pacientes de edad avanzada y con un mayor número de comorbilidades, incluida una mayor probabilidad de presentar un déficit adquirido del factor de von Willebrand. Asimismo, la indicación de tratamiento antiagregante plaquetario concomitante dependió del criterio médico y el tratamiento antiagregante plaquetario doble podía utilizarse durante los primeros 3 meses. El estudio también notificó mayores niveles de interrupción del tratamiento en pacientes tratados con AVK. Un factor adicional que puede haber contribuido a estos resultados es que, aunque el índice internacional normalizado (INR, international normalized ratio) objetivo fue de 2,0 a 3,0, los valores se mantuvieron entre1,6 a 2,6 en el grupo de pacientes>70 años, si bien este grupo no suponía una parte signficiativa del total de la población de estudio. En la cohorte de Izumi et al.18, el 52% de los pacientes<70 años tenían un INR por debajo del objetivo<2,0, y el 91,1% de los pacientes>70 años tenían un INR<2,6, y en este estudio no se detectaron diferencias significativas en el riesgo de hemorragia grave entre ambos grupos. Sin embargo, ese estudio incluyó a pacientes con otros tipos de bioprótesis valvulares y solo el 26,4% de los pacientes habían sido sometidos a implante de TAVI.
A diferencia de los resultados del ensayo ENVISAGE, Tanawuttiwat et al.17 notificaron una disminución significativa de la hemorragia y la mortalidad por cualquier causa, aunque el edoxabán fue el ACOD menos representado en ese estudio. Por tanto, otro motivo que podría explicar esta discrepancia podría ser la existencia de distintos perfiles de riesgo de hemorragia entre los diversos ACOD. De hecho, ATLANTIS RCT31 trató de demostrar la superioridad del apixabán sobre los AVK (en caso de estar indicada la anticoagulación) o el tratamiento antiagregante plaquetario (si no existía esa indicación) en pacientes con TAVI, pero no encontró diferencias en cuanto a hemorragia grave.
El presente estudio tiene algunas limitaciones. En primer lugar, tiene las limitaciones inherentes a los estudios incluidos y a la combinación de los resultados de los estudios de cohortes observacionales comparativas y los estudios post hoc procedentes de los ECA, lo que implica una fuente potencial de sesgo.
En segundo lugar, los tamaños de las muestras variaron ampliamente entre estudios. El estudio de Tanawuttiwat et al.17 tuvo, con diferencia, el mayor tamaño muestral entre los estudios incluidos, y llegó a representar el 70% de los pacientes incluidos en nuestro metanálisis. Además, dado que ese estudio tenía un diseño de cohortes retrospectivo, puede haber introducido una fuente potencial de sesgo.
En tercer lugar, los tiempos de seguimiento en general fueron cortos, ya que fueron de menos de 18 meses en la mayoría de los estudios y de más de 24 meses en solo 46,10,13,16, de los cuales solo 1 fue un ECA6.
En cuarto lugar, no se estudiaron los riesgos individuales de cada tipo de bioprótesis valvular, sino que se incluyó a todos los pacientes en un único grupo. La proporción de diversos tipos de bioprótesis valvular evaluadas en cada estudio varió y algunos incluyeron solo a pacientes con TAVI11,12,14,15,17. En nuestro metanálisis, solo a aproximadamente un 18% de los pacientes se les realizó recambio valvular aórtico quirúrgico o recambio valvular mitral quirúrgico, y los pacientes con TAVI fueron la mayoría. En general, los resultados en los pacientes con recambio valvular aórtico quirúrgico o recambio valvular mitral quirúrgico favorecen el tratamiento con ACOD frente a los AVK por lo que respecta a eficacia y seguridad, mientras que los resultados en los pacientes con TAVI son más heterogéneos, sobre todo respecto a la incidencia de hemorragias graves. Además, las pautas posológicas de antiagregantes plaquetarios también fueron diferentes y pueden haber contribuido a mayores diferencias en los eventos hemorrágicos.
Esta variabilidad refleja la falta de un tratamiento estándar óptimo para todas las válvulas bioprotésicas, como es evidente a partir de las guías de práctica clínica actuales2,4. Se necesitan más estudios para aportar evidencia sólida sobre el tratamiento anticoagulante óptimo para cada tipo de bioprótesis valvular de acuerdo con su ubicación (aórtica o mitral) y el tipo de abordaje (quirúrgico o percutáneo).
En quinto lugar, los 4 ACOD comercializados actualmente se incluyeron en nuestro metanálisis, pero su seguridad y eficacia no se evaluaron por separado. Su uso varió entre los estudios, la mayor parte de los cuales no definieron claramente el inicio del tratamiento con ACOD después del implante de la bioprótesis valvular. Por tanto, los hallazgos de nuestro estudio no se pueden extrapolar a los diferentes ACOD por separado.
Por último, a excepción del ensayo RIVER3, no hay datos sobre eventos relevantes durante los primeros 3 meses después del recambio valvular. Por ello, nuestro estudio no puede aportar nueva información sobre la seguridad y eficacia de los ACOD durante ese periodo de tiempo.
CONCLUSIONESEste metanálisis combina los resultados de 30.283 pacientes con bioprótesis valvular y FA y es uno de los metanálisis con la mayor población de pacientes hasta la fecha, que combina los resultados de los ECA y de las cohortes comparativas que aportan datos de la vida real.
Nuestro estudio encontró que el tratamiento con ACOD se asocia con una reducción significativa de la mortalidad por cualquier causa sin aumento significativo del riesgo de embolia sistémica o ictus. Nuestros resultados sugieren que los ACOD podrían ser más seguros que los AVK en este grupo de pacientes (figura 7). Aunque nuestros resultados no apuntan a diferencias significativas en el riesgo de hemorragia entre los 2 grupos, deben analizarse con precaución. Es probable que los estudios basados principalmente en cohortes de pacientes con TAVI no aporten evidencia a favor de una reducción de hemorragias graves con el tratamiento con ACOD debido al mayor perfil de riesgo hemorrágico de estos pacientes o al uso concomitante de antiagregantes plaquetarios; además, los beneficios pueden ser diferentes entre los distintos ACOD y bioprótesis valvulares. Se necesitan futuros ECA que comparen los distintos ACOD disponibles actualmente en el mercado con los AVK en pacientes con bioprótesis valvulares y FA, que evalúen los diversos tipos de ACOD y bioprótesis por separado.
- •
El beneficio de los ACOD en pacientes con FA y válvulas bioprotésicas no está establecido dado que esta población está infrarrepresentada en la bibliografía.
- •
Nuestro metanálisis, que combina los resultados de un gran número de pacientes procedentes de ECA y los registros poblacionales más recientes, revela una reducción significativa del riesgo relativo de mortalidad por cualquier causa en pacientes con FA y bioprótesis valvulares tratados con ACOD en comparación con los tratados con AVK, sin aumento significativo de la hemorragia grave o del riesgo de embolia sistémica o ictus.
- •
Se necesitan más estudios para evaluar la seguridad y eficacia a largo plazo de los distintos ACOD y tipos de bioprótesis, así como en los primeros 3 meses tras la intervención.
Figura central. Metanálisis de 4 ensayos clínicos aleatorizados y 8 estudios observacionales que compara los ACOD frente a los antagonistas de la vitamina K (AVK) en pacientes con fibrilación auricular (FA) y válvulas bioprotésicas que muestran menor mortalidad por cualquier causa con ACOD en comparación con los antagonistas de la vitamina K. ACOD, anticoagulantes orales directos.
Ninguna.
CONTRIBUCIÓN DE LOS AUTORESP. Guardia Martínez: diseño del estudio, obtención de datos, búsqueda sistemática y selección de estudios, revisión y edición. A. Luis Avilés Toscano: obtención de datos, búsqueda sistemática y selección de estudios, revisión y edición. M.A. Martínez Mayoral: diseño del estudio, metodología, análisis estadístico y revisión. J. Moltó Miralles: diseño del estudio, metodología, análisis estadístico y revisión. Todos los autores son responsables de la revisión del original y de la aprobación de la versión final.
CONFLICTO DE INTERESESNo se declara ninguno.
Agradecemos el apoyo de la Unidad de Investigación de la Agencia Sanitaria Costa del Sol en la traducción del original.