En el infarto agudo de miocardio con elevación del segmento ST, el ADN libre circulante podría originarse de los leucocitos activados en la lesión coronaria. El objetivo fue investigar la relación entre el ADN libre y la reperfusión coronaria.
MétodosSe incluyó a 116 pacientes, tratados con angioplastia primaria y tromboaspiración. Se cuantificó el ADN libre coronario (durante la aspiración) y periférico (al final del procedimiento), así como la troponina T ultrasensible y la mieloperoxidasa. El objetivo primario fue la no resolución del segmento ST (RST) (≥ 70%) y el secundario la ausencia de flujo Thrombolysis In Myocardial Infarction 3 (TIMI 3) final.
ResultadosSe obtuvo RST en 51 (44%) pacientes y flujo TIMI 3 en 97 (84%). Los pacientes sin RST y flujo TIMI 3 tuvieron un menor gradiente ADN libre periférico-coronario (p = 0,02 y p = 0,04, respectivamente). Un gradiente pequeño de ADN libre (< 1,82 ng/ml) se asoció a una mayor frecuencia de no RST (65 frente al 30%; p = 0,001) y de falta de flujo TIMI 3 (21 frente al 3%; p = 0,05. Tras el ajuste multivariable, un gradiente de ADN libre pequeño fue predictivo de no RST (OR = 4,50; IC95%, 1,60-12,62; p = 0,004), en tanto que hubo una tendencia no significativa para el flujo TIMI 3 (p = 0,14). El ADN libre no se correlacionó con la troponina o la mieloperoxidasa.
ConclusionesUn gradiente pequeño de ADN libre periférico-coronario, como expresión de una alta carga de ADN libre coronario, se asocia con no RST en el infarto agudo de miocardio. El ADN libre coronario podría reflejar la activación de los neutrófilos. La potencial contribución de este fenómeno al fracaso de la tromboaspiración requiere nuevos estudios.
Palabras clave
Se han propuesto varios mecanismos para explicar la lesión microvascular y la falta de reperfusión tisular en el infarto de miocardio con elevación del segmento ST (IAMCEST) tratado mediante intervención percutánea primaria1. La hiperactivación de las células polimorfonucleares, que da lugar a la liberación de su contenido nuclear al espacio extracelular (ADN libre [sin células]), con lo que se forman trampas extracelulares de neutrófilos (NET), podría desempeñar un papel en ello2. Las NET constituyen un armazón para la agregación plaquetaria y la trombosis, que favorece la microembolización y la obstrucción microcirculatorias3,4. La tromboaspiración manual no consigue evitar este fenómeno, lo cual podría explicar en parte la falta de efectividad evidenciada en ensayos clínicos recientes5,6.
En algunos estudios se han cuantificado el ADN libre y las NET en el IAMCEST 3,4,7–10. Sin embargo, estos estudios se llevaron a cabo en cohortes de pacientes pequeñas y los resultados no se ajustaron por las variables clínicas y de la intervención. En el presente estudio se midió el ADN libre intracoronario y periférico durante la intervención percutánea primaria mediante tromboaspiración en una serie de IAMCEST.
El objetivo es analizar la asociación entre el ADN libre y la reperfusión coronaria, tras introducir un ajuste por factores clínicos y de la intervención de conocido valor predictivo. Se analizó asimismo la relación entre el ADN libre y la mieloperoxidasa y los valores de troponina T cardiaca de alta sensibilidad.
MÉTODOSDiseño del estudioEn este estudio se utilizó un diseño prospectivo y se incluyó a un total de 116 pacientes con IAMCEST reclutados entre abril de 2014 y septiembre de 2015 en 2 hospitales de España (el Hospital Clínic Universitari, de Valencia, y el Hospital Clínic, de Barcelona). Se trató a todos los participantes mediante intervención percutánea primaria y se consideró que eran candidatos adecuados para tromboaspiración manual, dada la elevada carga de trombo en la angiografía. Los criterios de inclusión fueron un IAMCEST en las primeras 12 h tras el inicio del dolor y en la angiografía coronaria diagnóstica un trombo de grado 4 (un trombo definido y con una dimensión mayor ≥ 2 veces el diámetro del vaso) o de grado 5 (oclusión total) en la escala Thrombolysis In Myocardial Infarction (TIMI). Los criterios de exclusión fueron el infarto agudo de miocardio secundario a trombosis del stent y unas características de la lesión culpable que se consideraran inapropiadas para el uso de un catéter de aspiración (tortuosidad o lesiones en el óstium o muy distales). Todos los pacientes firmaron el correspondiente documento de consentimiento informado por escrito para su participación en el estudio, que fue aprobado por los comités de ética de ambos centros.
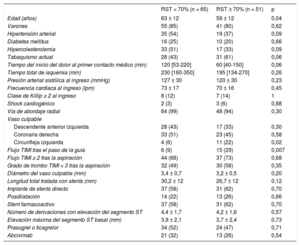
Tratamiento de los pacientesAntes de la intervención en la sala de cateterismo, se realizó un electrocardiograma inicial, que se definió como el electrocardiograma basal. Se utilizaron abordajes por vía radial con introductores y catéteres guía de 6 Fr en casi todos los participantes. Todos los pacientes recibieron heparina y ácido acetilsalicílico, tratamiento antitrombótico adyuvante (inhibidores del receptor de P2Y12 y abciximab) y el cardiólogo intervencionista decidió en cada caso la técnica primaria de intervención percutánea. Se recomendaron como mínimo 4 tromboaspiraciones, con el objetivo de restablecer el flujo coronario e implantar directamente el stent, si ello era viable. Se obtuvieron muestras de sangre intracoronaria procedentes de la aspiración, así como muestras de sangre a partir de la vaina radial tras la retirada del catéter guía al final de la intervención. Las muestras de sangre periférica y coronaria no se obtuvieron de manera simultánea debido a que la luz de la vaina radial estaba bloqueada por el catéter guía durante la intervención percutánea primaria. Se registró el tiempo transcurrido entre ambas extracciones. Una hora después de finalizada la intervención, se repitió el electrocardiograma y se comparó con el basal. Se obtuvieron de cada paciente datos de un total de 37 variables clínicas, electrocardiográficas, angiográficas y de la intervención (tabla 1). Un mismo investigador, al que se ocultaron los resultados de la intervención percutánea primaria, llevó a cabo los análisis del electrocardiograma.
Características de la población de pacientes y variables de la intervención
| Edad (años) | 61 ± 12 |
| Varones | 96 (83) |
| Hipertensión arterial | 54 (47) |
| Diabetes mellitus | 26 (22) |
| Hipercolesterolemia | 50 (43) |
| Tabaquismo actual | 59 (51) |
| Tiempo de inicio del dolor a primer contacto médico (min) | 90 [45-149] |
| Tiempo primer contacto médico-balón (min) | 104 [84-145] |
| Tiempo total de isquemia (min) | 213 [150-304] |
| Presión arterial sistólica al ingreso (mmHg) | 124 ± 30 |
| Frecuencia cardiaca al ingreso (lpm) | 72 ± 16 |
| Clase Killip ≥ 2 al ingreso | 15 (13) |
| Vía de abordaje radial | 112 (97) |
| Número de vasos con estenosis significativa | |
| 1 | 67 (58) |
| 2 | 40 (35) |
| 3 | 9 (8) |
| Arteria principal izquierda | 1 (0,9) |
| Arteria culpable | |
| Descendente anterior izquierda | 45 (39) |
| Coronaria derecha | 56 (48) |
| Circunfleja izquierda | 15 (13) |
| Flujo TIMI basal | |
| 0 | 113 (97) |
| 1 | 2 (2) |
| 2 | 1 (1) |
| Flujo TIMI tras el paso de la guía | |
| 0 | 58 (50) |
| 1 | 37 (32) |
| 2 | 19 (16) |
| 3 | 2 (2) |
| Flujo TIMI tras la aspiración | |
| 0 | 21 (18) |
| 1 | 14 (12) |
| 2 | 58 (50) |
| 3 | 23 (20) |
| Flujo TIMI tras la intervención | |
| 0 | 1 (1) |
| 1 | 3 (3) |
| 2 | 15 (13) |
| 3 | 97 (83) |
| Grado de trombo TIMI basal | |
| 4 | 4 (3) |
| 5 | 112 (97) |
| Grado de trombo TIMI tras la aspiración | |
| < 3 | 62 (53) |
| ≥ 3 | 54 (47) |
| Diámetro del vaso culpable (mm) | 3,3 ± 0,6 |
| Diámetro del stent (mm) | 3,4 ± 0,5 |
| Longitud total tratada con stents (mm) | 28,7 ± 12 |
| Implante de stents directo | 58 (50) |
| Posdilatación | 27 (23) |
| Stent farmacoactivo | 68 (59) |
| Ubicación del infarto de miocardio | |
| Anterior | 42 (36) |
| Inferior | 66 (57) |
| Lateral | 8 (7) |
| Número de derivaciones con elevación del segmento ST | 4 ± 2 |
| Elevación máxima del segmento ST basal (mm) | 3,8 ± 2,2 |
| Resolución del segmento ST tras la intervención (%) | 60 ± 31 |
| Ácido acetilsalicílico | 115 |
| Clopidogrel | 59 (51) |
| Prasugrel | 47 (40) |
| Ticagrelor | 11 (10) |
| Abciximab | 34 (29) |
TIMI: Thrombolysis In Myocardial Infarction.
Los datos expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
El plasma se obtuvo mediante centrifugación de las muestras de sangre total a 2.000 g durante 10 min a 4°C; a continuación se centrifugaron los sobrenadantes a 16.000 g durante 10 min a 4°C, con objeto de eliminar del plasma los restos celulares. Las muestras se congelaron y se conservaron a −80°C hasta el momento del análisis. Se aisló el ADN libre circulante de 500 μl de plasma con el MagMAX Cell-Free DNA Isolation Kit (Applied Biosystems, Thermofisher; Madrid, España) siguiendo las instrucciones del fabricante, y se realizó una elución en un volumen final de 100 μl de solución tampón de Tris-EDTA. Con objeto de evaluar la posible pérdida de ADN libre durante el procedimiento de aislamiento, se recogió el producto de todos los pasos de lavado en un tubo aparte para cada muestra y se determinó la cantidad total de ADN libre en el producto de elución intermedio y final mediante espectrometría (NanoDrop, Thermofisher; Madrid, España).
Se determinó la proporción de ADN libre genómico humano mediante reacción en cadena de la polimerasa cuantitativa directa en tiempo real. Las determinaciones se realizaron por triplicado empleando 5 μl de ADN libre en un volumen de 20 μl mediante el SYBR Select Master Mix (Applied Biosystems, Thermofisher; Madrid, España). Los cebadores fueron MSTN (NM_005259.2) Directo: 5’-TTATGCTGATTGTTGCTGGTCC-3’ e Inverso: 5’-TGCATTACACAGCCCCTCTT-3’ y se utilizaron los siguientes parámetros de ciclo: 95°C durante 10 min, seguido de 40 ciclos de 95°C durante 15 s y 60°C durante 1 min. El número de copias de ADN genómico se estableció mediante la comparación con una curva de calibración basada en cantidades conocidas de ADN genómico aislado de células haploides humanas y se expresó en ng/ml de ADN.
El ADN sistémico puede mostrar una alta variabilidad interindividual debido a la amplia variedad de situaciones (apoptosis fisiológica) y enfermedades, incluido el cáncer (apoptosis patológica y necrosis), que pueden aumentar sus concentraciones11, por lo que se utilizó la diferencia (gradiente) de ADN libre periférico-coronario como indicador de la producción coronaria de ADN libre en cada paciente individual. Además, dadas las mencionadas limitaciones logísticas de la intervención coronaria primaria, la muestra de sangre utilizada para la determinación del ADN libre periférico se extrajo un poco más tarde que la muestra coronaria, es decir, en una fase del infarto algo más evolucionada. Este hecho podría inducir una concentración de ADN periférico superior. Se partió del supuesto de que cuanto menor fuera el gradiente entre el ADN libre periférico y el coronario, mayor sería la carga de ADN libre coronario.
También se determinaron la mieloperoxidasa y la troponina T cardiaca de alta sensibilidad intracoronarias y periféricas en un subgrupo de 95 pacientes del Hospital Clínico Universitario de Valencia (España). La mieloperoxidasa se determinó mediante un kit de ELISA de mieloperoxidasa humana (Cayman Chemical; Ann Arbor, Michigan, Estados Unidos) y se utilizó un test Elecsys (Roche Diagnostics; Basilea, Suiza) para la determinación de la troponina.
OBJETIVOSEl objetivo principal fue la falta de resolución del segmento ST (RST) (≥ 70%) 60 min después de la intervención como parámetro indicativo de la reperfusión coronaria. El objetivo secundario fue la ausencia de un flujo TIMI 3 al final de la intervención.
Análisis estadísticoLas variables continuas se expresan como media ± desviación estándar y se compararon con pruebas de la t para datos no emparejados, mientras que las variables discretas se presentan mediante números absolutos y porcentajes y se compararon con pruebas de la χ2. Los valores de ADN libre no mostraban una distribución gaussiana según la prueba de Kolmogorov-Smirnov, por lo que estos valores se presentan con la mediana [intervalo intercuartílico] y se comparan con las pruebas de Wilcoxon y de la U de Mann-Whitney. La correlación se evaluó con el coeficiente de Spearman.
Se elaboraron curvas de características operativas del receptor para evaluar la exactitud de la discriminación del ADN libre para las variables de valoración. Se obtuvieron los valores de corte óptimos a partir de las curvas maximizando la especificidad para la variable de valoración principal. La relación del gradiente entre el ADN libre periférico y el coronario con la falta de RST o el flujo final TIMI 3 se evaluó con un análisis univariable. También se realizó un análisis univariable preliminar para identificar, de entre las variables clínicas, angiográficas y de la intervención (tabla 1), las que estaban relacionadas con los criterios de valoración (p < 0,10). Las variables relacionadas con la RST fueron el tiempo transcurrido desde el inicio del dolor hasta el primer contacto médico, la edad, la hipertensión, la hipercolesterolemia, el tabaquismo, el flujo TIMI tras el paso de la guía y que la arteria culpable fuera la circunfleja izquierda. Para el flujo final TIMI 3, las variables relacionadas fueron la clase de Killip ≥ 2, el trombo de grado < 3 después de la aspiración, el diámetro del vaso culpable y la longitud del stent. A continuación, se elaboró un modelo de regresión logística que incluía el gradiente de ADN libre junto con las variables relacionadas identificadas en el análisis univariable. Se estimaron las odds ratio (OR) con sus intervalos de confianza del 95% (IC95%) y el estadístico C de los modelos. Por último, se analizó también la relación entre el ADN libre y la mieloperoxidasa o la troponina.
RESULTADOSCaracterísticas basales de los pacientesLas características de la población de pacientes se muestran en la tabla 1. La media de la elevación máxima del segmento ST antes de la intervención percutánea primaria era 3,8 ± 2,2 mm y el flujo coronario en la arteria relacionada con el infarto fue TIMI 0 en 113 pacientes (97%), TIMI 1 en 2 y TIMI 2 en 1. Tras cruzar la lesión relacionada con el infarto con la guía, 21 pacientes (18%) presentaban un flujo TIMI ≥ 2. Se llevó a cabo una media de 4,1 ± 1,7 aspiraciones manuales, y se obtuvo un trombo macroscópico de 80 pacientes (69%). Tras la tromboaspiración, 62 pacientes (53%) tenían un trombo residual angiográficamente mínimo (grado de trombo TIMI < 3) y 81 (70%) mostraron un flujo TIMI ≥ 2. Al final de la intervención, se observó un flujo TIMI 3 en 97 pacientes (83%) y la resolución del segmento ST en 51 (44%).
ADN libreLos valores de ADN libre periférico y coronario mostraron una clara correlación (ρ = 0,80; p = 0, 0001). No hubo diferencias significativas entre ellos: ADN libre periférico, 5,31 [3,03-11,84], y ADN libre coronario, 5,27 [2,73-13,41] ng/ml (p = 0,57).
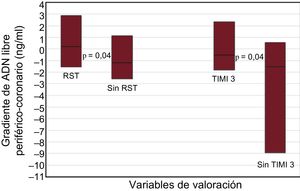
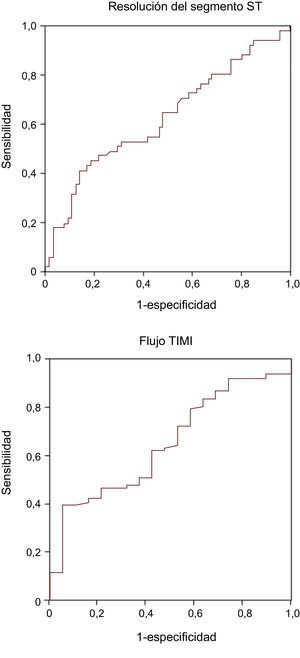
Un total de 52 pacientes (45%) presentaron un gradiente positivo entre el ADN libre periférico y el coronario y 64 (55%), negativo. Los pacientes sin RST y en flujo TIMI 3 final presentaron menor gradiente (p = 0,02 y p = 0,04 respectivamente) (figura 1). En la figura 2 se muestran las curvas de características operativas del receptor del gradiente de ADN libre y del flujo TIMI 3 final. El valor de corte óptimo establecido fue 1,82 ng/ml, con una especificidad del 86% y una sensibilidad del 41% para la RST. De hecho, un bajo gradiente entre el ADN libre periférico y el coronario (< 1,82 ng/ml) se asociaba con mayor tasa de falta de RST (el 65 frente al 30%; OR = 4,4; IC95%, 1,8-10,7; p = 0,001) y ausencia de flujo TIMI 3 final (el 21 frente al 3%; OR = 7,7; IC95%, 1,0-60,2; p = 0,05). La media de tiempo transcurrido entre las extracciones de muestras de sangre coronaria y de sangre periférica fue 21 ± 11 min. No hubo diferencias en el tiempo entre muestras al comparar los subgrupos situados por encima o por debajo del valor de corte del gradiente de ADN libre (21,0 ± 10,5 frente a 20,1 ± 11,9 min).
Comparación del gradiente de ADN libre en valores absolutos (ng/ml) entre los pacientes con y sin RST y entre los pacientes con y sin flujo TIMI 3 al final de la intervención coronaria percutánea primaria. Los recuadros representan los intervalos intercuartílicos y la línea horizontal de cada recuadro, la mediana. RST: resolución del segmento ST; TIMI: Thrombolysis In Myocardial Infarction. RST, 0,87 [–1,55 a 2,87] ng/ml; Sin RST, –0,89 [–257 a 1,12] ng/ml; TIMI 3, –0,38 [–1,80 a 2,32] ng/ml; ausencia de TIMI 3, –1,08 [–8,94 a 0,57] ng/ml.
Curvas de características operativas del receptor del gradiente de ADN libre periférico-coronario para la resolución del segmento ST (arriba, estadístico C = 0,63) y del flujo TIMI 3 (abajo, estadístico C = 0,65) al final de la intervención. TIMI: Thrombolysis In Myocardial Infarction.
En la tabla 2 se muestran las variables clínicas, angiográficas y de la intervención que estaban relacionadas con la RST en el análisis univariable. En comparación con los pacientes con RST, los pacientes sin RST eran de más edad, la arteria circunfleja izquierda era la arteria relacionada con el infarto de manera menos frecuente y era menos probable que tuvieran un flujo TIMI ≥ 2 tras el paso de la guía. Además, el mayor tiempo entre el inicio del dolor y el primer contacto médico, la hipertensión, la hipercolesterolemia y la ausencia de tabaquismo tendían a mostrar una asociación con la ausencia de RST. En el análisis de regresión logística, un gradiente entre el ADN periférico y el coronario < 1,82 ng/ml predijo la falta de RST (OR = 4,50; IC95%, 1,60-12,62; p = 0,004), que estuvieran afectadas la arteria coronaria descendente anterior izquierda o la arteria coronaria derecha (OR = 4,54; IC95%, 1,17-17,63; p = 0,03) y el flujo TIMI inicial < 2 tras el paso de la guía (OR = 6,19; IC95%, 1,86-20,57; p = 0,003); otras variables en las que se observó una tendencia no significativa fueron el tiempo entre el inicio del dolor y el primer contacto médico (p = 0,09), la hipercolesterolemia (p = 0,1) y el tabaquismo (p = 0,06). El estadístico C del modelo fue 0,80 (IC95%, 0,72-0,88; p = 0,0001). Las variables que predecían que no se alcanzara un flujo TIMI 3 al final de la intervención fueron la clase Killip ≥ 2 al ingreso (OR = 9,7; IC95%, 2,3-41,2; p = 0,002), el diámetro de la lesión culpable (por mm, OR = 5,1; IC95%, 1,7-15,2; p = 0,003) y la longitud total tratada con stents (por mm, OR = 1,05; IC95%, 1,0-1,1; p = 0,05), mientras que el gradiente de ADN libre no alcanzó significación estadística (p = 0,14). El estadístico C del modelo fue 0,84 (IC95%, 9,74-0,94; p = 0,0001).
Características clínicas, angiográficas y de la intervención de los pacientes con RST < 70% y RST ≥ 70%
| RST < 70% (n = 65) | RST ≥ 70% (n = 51) | p | |
|---|---|---|---|
| Edad (años) | 63 ± 12 | 59 ± 12 | 0,04 |
| Varones | 55 (85) | 41 (80) | 0,62 |
| Hipertensión arterial | 35 (54) | 19 (37) | 0,09 |
| Diabetes mellitus | 16 (25) | 10 (20) | 0,66 |
| Hipercolesterolemia | 33 (51) | 17 (33) | 0,09 |
| Tabaquismo actual | 28 (43) | 31 (61) | 0,06 |
| Tiempo del inicio del dolor al primer contacto médico (min) | 120 [53-220] | 60 [40-150] | 0,06 |
| Tiempo total de isquemia (min) | 230 [160-350] | 195 [134-270] | 0,26 |
| Presión arterial sistólica al ingreso (mmHg) | 127 ± 30 | 120 ± 30 | 0,23 |
| Frecuencia cardiaca al ingreso (lpm) | 73 ± 17 | 70 ± 16 | 0,45 |
| Clase de Killip ≥ 2 al ingreso | 8 (12) | 7 (14) | 1 |
| Shock cardiogénico | 2 (3) | 3 (6) | 0,88 |
| Vía de abordaje radial | 64 (99) | 48 (94) | 0,30 |
| Vaso culpable | |||
| Descendente anterior izquierda | 28 (43) | 17 (33) | 0,30 |
| Coronaria derecha | 33 (51) | 23 (45) | 0,58 |
| Circunfleja izquierda | 4 (6) | 11 (22) | 0,02 |
| Flujo TIMI tras el paso de la guía | 6 (9) | 15 (29) | 0,007 |
| Flujo TIMI ≥ 2 tras la aspiración | 44 (68) | 37 (73) | 0,68 |
| Grado de trombo TIMI < 3 tras la aspiración | 32 (49) | 30 (58) | 0,35 |
| Diámetro del vaso culpable (mm) | 3,4 ± 0,7 | 3,2 ± 0,5 | 0,20 |
| Longitud total tratada con stents (mm) | 30,2 ± 12 | 26,7 ± 12 | 0,12 |
| Implante de stents directo | 37 (58) | 31 (62) | 0,70 |
| Posdilatación | 14 (22) | 13 (26) | 0,66 |
| Stent farmacoactivo | 37 (58) | 31 (62) | 0,70 |
| Número de derivaciones con elevación del segmento ST | 4,4 ± 1,7 | 4,2 ± 1,6 | 0,57 |
| Elevación máxima del segmento ST basal (mm) | 3,9 ± 2,1 | 3,7 ± 2,4 | 0,73 |
| Prasugrel o ticagrelor | 34 (52) | 24 (47) | 0,71 |
| Abciximab | 21 (32) | 13 (26) | 0,54 |
RST: resolución del segmento ST; TIMI: Thrombolysis In Myocardial Infarction.
Los datos expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Las concentraciones de troponina fueron muy superiores en las muestras periféricas que en las coronarias (mediana, 478 [138-1.269] frente a 89 [43-204] ng/l; p = 0,0001). Los valores de troponina no mostraron una correlación con el ADN libre (coronario, r = –0,13; p = 0,2; periférico, r = –0,01; p = 0,9). El gradiente de troponina entre las concentraciones periféricas y las coronarias fue similar en los pacientes con y sin RST (p = 0,9). Lo mismo se observó por lo que respecta al flujo TIMI 3 (p = 0,3).
No hubo diferencias entre los valores de mieloperoxidasa periféricos y coronarios (229 [130-309] frente a 220 [125-291] ng/ml; p = 0,3). La concentración de mieloperoxidasa coronaria mostró una correlación débil con el ADN libre coronario (r = –0,21; p = 0,04), y no hubo correlación entre los valores periféricos (r = –0,03; p = 0,8). Ninguno de los parámetros de mieloperoxidasa medidos (concentraciones periférica y coronaria o su gradiente) mostró relación con la RST.
DISCUSIÓNEn este estudio se determinaton las concentraciones de ADN libre periférico y coronario en pacientes con IAMCEST tratados con intervención percutánea primaria y tromboaspiración. El principal resultado es que un menor gradiente de ADN libre entre la circulación periférica y la coronaria se asocia con la falta de reperfusión coronaria. La explicación más plausible es que la concentración de ADN libre intracoronario tenga en parte su origen en leucocitos hiperactivados y que la alta concentración intracoronaria de ADN libre en comparación con la sistémica indique una mayor actividad inflamatoria local en la lesión culpable coronaria que impida una reperfusión efectiva.
ADN libre en el infarto agudo de miocardio con elevación del segmento STSon pocos los estudios que hayan evaluado el ADN libre en el IAMCEST. Dos estudios observaron un aumento de las concentraciones séricas que se atribuyó a la necrosis y la apoptosis miocárdicas7,10. La correlación observada con la concentración de troponina parece confirmar esta hipótesis8,10. En el presente estudio, en cambio, no se observa una correlación entre el ADN libre y la troponina. Los valores de troponina en sangre periférica fueron muy superiores a los coronarios. Esto podría reflejar la evolución temporal en el infarto agudo, puesto que las muestras de sangre periférica se obtuvieron tras una media de 21 min. Sin embargo, el ADN libre no siguió el mismo patrón: no hubo diferencias entre las cifras periféricas y las coronarias. Es posible que la cinética de liberación del ADN libre sea más lenta que la de la troponina. De hecho, algunos estudios han observado una correlación entre la troponina y el ADN libre tan solo en las etapas posteriores del infarto7,9. No obstante, no se puede descartar que la diferencia en el tiempo de obtención hubiera influido en la concentración del ADN libre periférico, aunque no hubo diferencias significativas en la demora entre los pacientes con alto o bajo gradiente de ADN libre.
La activación de los neutrófilos con liberación de su contenido nuclear en la placa ateroesclerótica coronaria complicada también podría determinar la cantidad de ADN libre circulante. Los pacientes con bajo gradiente de ADN libre entre la circulación periférica y la coronaria presentaron una mejor probabilidad de RST, incluso tras aplicar un ajuste completo respecto a los factores predictivos clínicos y de la intervención conocidos. Nuestra hipótesis es que este resultado refleja el mayor grado de inflamación intracoronaria.
Activación leucocitaria en el infarto agudo de miocardio con elevación del segmentoSTLos leucocitos experimentan una intensa activación durante el IAMCEST. y participan directamente en el proceso de complicación local de la placa12–17. Se ha observado un aumento de los agregados de leucocitos y plaquetas en la lesión culpable en muestras de sangre obtenidas mediante aspiración intracoronaria18,19. El mecanismo principal de este fenómeno es la liberación de fibras de cromatina de los neutrófilos hacia el espacio extracelular; con ello se forman NET que actúan como armazón para la agregación plaquetaria y la trombosis2. Las NET intracoronarias se detectaron en la fase muy temprana del infarto y están relacionadas con la trombosis microvascular3,4. El ADN libre es el principal componente estructural de las NET y su concentración está estrechamente correlacionada con la carga intracoronaria de NET4,20.
La mieloperoxidasa es una proteína granulosa liberada por los leucocitos activados y cataliza la formación de especies moleculares reactivas que intervienen en el crecimiento y la rotura de la placa ateroesclerótica21. No se observa correlación entre los valores de mieloperoxidasa y los de ADN libre. Este resultado concuerda con lo indicado por un estudio previo10. La explicación podría estar en que la mieloperoxidasa no procede de las NET.
Consecuencias clínicasEn un estudio de referencia, Ito et al.22 demostraron que restablecer un flujo sanguíneo coronario epicárdico normal no asegura la reperfusión miocárdica en el IAMCEST. La resolución del segmento ST es una medida indirecta sencilla e inmediata de la reperfusión miocárdica23. Se han propuesto varias estrategias para prevenir y tratar la lesión microvascular, aunque no se ha demostrado que ninguna de ellas sea plenamente eficaz1,24,25. La tromboaspiración fue una herramienta prometedora, pero en ensayos aleatorizados amplios no se confirmó su eficacia5,6. Este estudio indica que el ADN libre puede desempeñar un papel en la falta de reperfusión tras la tromboaspiración. Nuestra hipótesis es que esto se debe a que los complejos resultantes de la interacción entre las NET, las plaquetas y la fibrina facilitan la microembolización y hacen que el sustrato sea difícil de aspirar cuando se emplea una técnica de aspiración sencilla. Serán necesarios nuevos estudios para determinar si el tratamiento concomitante con ADNasa en este contexto puede mejorar la efectividad de la tromboaspiración.
Puntos fuertes y limitacionesLos puntos fuertes de este estudio son su tamaño muestral mayor que el de estudios previos, el análisis de la correlación entre el ADN libre y la troponina o la mieloperoxidasa y el ajuste respecto a los factores predictivos clínicos y de la intervención bien conocidos.
Las limitaciones son las siguientes: a) la tasa de RST del 44% es inferior a la de otros estudios, lo cual se explica porque la inclusión en el estudio exigía que todos los pacientes debían presentar alta carga de trombo en la angiografía inicial (grado de trombo TIMI 4 o 5); b) como se ha señalado antes, las muestras de sangre coronaria y periférica no se obtuvieron simultáneamente. Cabría plantear la hipótesis de que la cantidad de ADN libre periférico, comparativamente superior a la del coronario en los pacientes con una reperfusión satisfactoria, pudiera ser consecuencia del lavado del contenido intracelular de las células miocárdicas, puesto que la sangre intracoronaria se extrajo antes de abrir la arteria coronaria, mientras que la sangre periférica se obtuvo inmediatamente después. Sin embargo, el lapso de 21 min parece demasiado breve para que se modifiquen de manera relevante los valores de ADN libre. Se ha señalado que la cinética de la liberación de ADN libre producido por la necrosis miocardiocitaria es un proceso lento7,9. Además, la concentración de troponina, que es el parámetro más puro indicativo de la lesión miocárdica, no mostró correlación con el ADN libre. De todas maneras, no se puede descartar la posibilidad de que la actividad inflamatoria ligada al proceso de reperfusión pudiera haber afectado a la concentración periférica de ADN libre; c) la irrigación del catéter de aspiración antes de la trombectomía podría haber interferido en la determinación del ADN libre coronario, y d) el discreto tamaño muestral limita las conclusiones del estudio.
CONCLUSIONESLa alta concentración intracoronaria de ADN libre en comparación con la periférica se asocia con la falta de RST en el IAMCEST. Este resultado puede reflejar la activación de los neutrófilos con producción de NET. Dado que se trató con tromboaspiración a todos los pacientes, cabe plantear la hipótesis de que este fenómeno pudiera contribuir al fallo de esta técnica. Será imprescindible realizar otros estudios para examinar la activación de los neutrófilos y la producción de NET como posible nueva diana terapéutica.
FINANCIACIÓNEste trabajo se ha financiado mediante subvenciones del Ministerio de Economía y Competitividad de España, a través del Instituto de Salud Carlos III: RD12/0042/0010 y CB16/11/00420; Fondo de Desarrollo Regional Europeo; Fondo de Investigaciones Sanitarias.
CONFLICTO DE INTERESESJ. Núñez ha recibido pagos personales de Novartis, Abbott y Vifor Pharma, sin relación con este trabajo.
- –
La elevación del ADN libre circulante en el IAMCEST se ha atribuido a la necrosis y la apoptosis miocárdicas.
- –
La hiperactivación de los neutrófilos que forman trampas extracelulares de neutrófilos en la lesión coronaria culpable podría desempeñar un papel en el fallo de la reperfusión en el IAMCEST.
- –
El ADN libre es un importante componente estructural de las NET.
- –
Una carga coronaria de ADN libre alta respecto a la periférica se asocia con la falta de RST tras una intervención coronaria primaria con tromboaspiración.
- –
Una carga coronaria de ADN libre elevada sería consecuencia de un mayor grado de inflamación en la lesión culpable intracoronaria que impediría la reperfusión coronaria.
- –
La activación de los neutrófilos con producción de NET podría contribuir al fallo de la tromboaspiración en el IAMCEST tratado mediante intervención coronaria primaria.


![Comparación del gradiente de ADN libre en valores absolutos (ng/ml) entre los pacientes con y sin RST y entre los pacientes con y sin flujo TIMI 3 al final de la intervención coronaria percutánea primaria. Los recuadros representan los intervalos intercuartílicos y la línea horizontal de cada recuadro, la mediana. RST: resolución del segmento ST; TIMI: Thrombolysis In Myocardial Infarction. RST, 0,87 [–1,55 a 2,87] ng/ml; Sin RST, –0,89 [–257 a 1,12] ng/ml; TIMI 3, –0,38 [–1,80 a 2,32] ng/ml; ausencia de TIMI 3, –1,08 [–8,94 a 0,57] ng/ml. Comparación del gradiente de ADN libre en valores absolutos (ng/ml) entre los pacientes con y sin RST y entre los pacientes con y sin flujo TIMI 3 al final de la intervención coronaria percutánea primaria. Los recuadros representan los intervalos intercuartílicos y la línea horizontal de cada recuadro, la mediana. RST: resolución del segmento ST; TIMI: Thrombolysis In Myocardial Infarction. RST, 0,87 [–1,55 a 2,87] ng/ml; Sin RST, –0,89 [–257 a 1,12] ng/ml; TIMI 3, –0,38 [–1,80 a 2,32] ng/ml; ausencia de TIMI 3, –1,08 [–8,94 a 0,57] ng/ml.](https://static.elsevier.es/multimedia/03008932/0000007200000004/v1_201903190611/S0300893218300940/v1_201903190611/es/main.assets/thumbnail/gr1.jpeg?xkr=eyJpdiI6IndVdlBkdkwzZDM1eHFiSktUNG41WGc9PSIsInZhbHVlIjoiR2xscUtQaEpBbnp0Q0pJYkNzZHhicExQcGJ5Sys1S0doQXg0RW9sM3FQQT0iLCJtYWMiOiI0MmEzYTY4ZjlhNmUzNjRlMTZiYzMzMGE3MWE5NzFlZTg0Njk0N2JiNzMzYjhiNmRmNTMxMDM4NzJhYzk5YTFhIiwidGFnIjoiIn0=)
