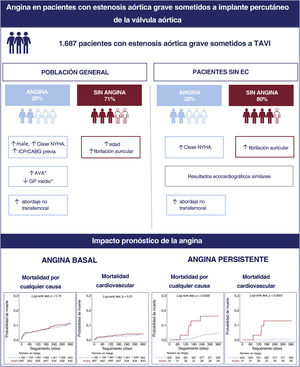
Evaluar la prevalencia, las características clínicas y el impacto de la angina en pacientes con estenosis aórtica sometidos a implante percutáneo de válvula aórtica (TAVI).
MétodosSe analizó a 1.687 pacientes consecutivos con estenosis aórtica sometidos a TAVI, clasificados en función de la presencia o ausencia basal de angina. Los datos basales, del procedimiento y del seguimiento se recogieron en una base de datos local.
ResultadosUn total de 497 pacientes (29%) presentaban angina antes del TAVI. Los pacientes con angina basal presentaban peor clase funcional (NYHA> II, el 69% frente al 63%; p=0,017) y una mayor prevalencia de enfermedad coronaria (el 74% frente al 56%; p <0,001). La angina basal no mostró impacto pronóstico a 1 año en mortalidad por cualquier causa (HR=1,02; IC95%, 0,71-1,48; p=0,898) ni en mortalidad cardiovascular (HR=1,2; IC95%, 0,69-2,11; p=0,517). Sin embargo, la persistencia de angina 30 días después del procedimiento se asoció con un incremento en la mortalidad a 1 año, tanto total (HR=4,86; IC95%, 1,71-13,8; p=0,003) como de causa cardiovascular (HR=20,7; IC95%, 3,50-122,6; p=0,001).
ConclusionesMás de un cuarto de los pacientes con estenosis aórtica sometidos a TAVI tenían angina antes del procedimiento. La angina basal no mostró impacto pronóstico alguno. Sin embargo, la persistencia de angina 30 días después del procedimiento se asoció con una mayor mortalidad al año.
Palabras clave
La estenosis aórtica (EA) es la cardiopatía valvular más frecuente en el mundo occidental1. En 1968, Ross y Braunwald describieron la angina, la disnea y el síncope como los 3 síntomas principales de la EA y señalaron el pronóstico desfavorable asociado con la aparición de estos síntomas2. El dogma sobre la aparición de los síntomas y su asociación con un pronóstico sombrío continúa siendo válido. Por tanto, las guías de práctica clínica actuales aún recomiendan la «observación atenta» de la mayoría de los pacientes con EA grave asintomática3,4. Mientras que el síncope se atribuye tradicionalmente a la incapacidad de aumentar de manera adecuada el gasto cardiaco ante una mayor necesidad periférica y la disnea al parecer está impulsada sobre todo por el aumento de las presiones de llenado, la angina generalmente se entiende como un desequilibrio entre la necesidad de oxígeno del miocardio y el suministro de oxígeno, ya sea debido a la estenosis aórtica en sí o a la coexistencia de enfermedad coronaria (EC) significativa5,6.
La EA degenerativa y la EC comparten algunos factores etiológicos y a menudo coexisten7. En ensayos clínicos aleatorizados se encontró EC en más del 60% de los pacientes con riesgo intermedio y EA grave8,9. La angina es un síntoma común tanto en la EC como en la EA y aparece en casi 2 tercios de los pacientes con EA grave10.
La prevalencia de EC coexistente y el valor predictivo de la angina para detectar EC en pacientes con EA grave se han analizado en estudios anteriores de series quirúrgicas11–13. Sin embargo, se sabe poco sobre la prevalencia y las implicaciones clínicas de la angina en los pacientes con EA grave sometidos a implante percutáneo de válvula aórtica (TAVI). Por lo tanto, el objetivo de este estudio es analizar la prevalencia, las características clínicas y el impacto de la angina en los pacientes sometidos a TAVI por EA grave.
MÉTODOSPoblación de estudioSe analizó a 1.910 pacientes consecutivos con EA grave sometidos a TAVI en un centro universitario especializado entre 2007 y 2021. De estos, se excluyó a 223 pacientes con datos ausentes o dudosos sobre los síntomas de angina asociados con EA antes del TAVI, lo que resultó en una población de estudio final de 1.687 pacientes. El equipo cardiovascular evaluó las indicaciones de TAVI, el tipo de dispositivo y la planificación de la intervención tras una estricta evaluación clínica y anatómica preoperatoria. El abordaje transfemoral se utilizó por defecto y los accesos alternativos, como el transcarotídeo, el transapical, el transubclavio y el transaórtico, se reservaron para pacientes con anatomía femoral desfavorable. La selección del acceso arterial secundario (transfemoral o transradial) se dejó a criterio de los operadores.
Se clasificó a los pacientes en función de la presencia de angina antes del TAVI. La clasificación se basó en los síntomas de angina comunicados por el paciente en el momento de la derivación y la evaluación previa al TAVI (sin clasificación posterior de los síntomas de angina según otro sistema de clasificación).
Los datos se recogieron de forma prospectiva en una base de datos local que incluye variables de basales, variables relacionadas con la intervención y datos de seguimiento prospectivos para evaluar los eventos clínicos y la supervivencia a corto y largo plazo. El seguimiento clínico se realizó mediante visitas clínicas o contacto telefónico a 1 mes, 12 meses y anualmente a partir de entonces. Los eventos clínicos se definieron según los criterios del Valve Academic Research Consortium-214. La recopilación y el registro de la información de los pacientes fueron aprobados por el comité de ética local y los pacientes dieron su consentimiento informado firmado para las intervenciones, la recopilación de datos anónimos y su publicación.
Evaluación de la enfermedad coronariaComo parte de la evaluación preoperatoria, se realizó a todos los pacientes una coronariografía antes del TAVI. Los resultados de la coronariografía se obtuvieron del informe médico, incluido el número y la ubicación de cualquier lesión angiográficamente significativa. La EC se definió como significativa cuando se objetivó una estenosis ≥ 70% en una arteria coronaria epicárdica (≥ 50% en el caso del tronco común izquierdo). Las lesiones significativas abordables vía percutánea se trataron de manera sistemática independientemente de los síntomas. La revascularización se consideró completa si todas las lesiones importantes de los vasos de diámetro ≥ 2mm se habían tratado con éxito con intervención coronaria percutánea (ICP) o cirugía de revascularización coronaria. La estrategia de tratamiento de la EC, incluida la decisión sobre la necesidad de revascularización completa, se decidió en función del consenso del equipo cardiovascular local.
Análisis estadísticosLas variables continuas se presentan como media ± desviación estándar o mediana [intervalo intercuartílico] según la normalidad de la distribución de datos evaluada con la prueba de Shapiro-Wilk. Las variables cualitativas se expresan como frecuencia (%). Se utilizó la prueba de la χ2 o la prueba exacta de Fisher para comparar las variables cualitativas y la prueba de la t de Student o la prueba de la U de Mann-Whitney para comparar las variables continuas. En cuanto al análisis de supervivencia a 1 año, se utilizó el método de Kaplan-Meier para obtener curvas de eventos. La diferencia entre la probabilidad de aparición de eventos se evaluó mediante log-rank test. Se realizó un análisis de regresión de riesgos proporcionales de Cox para evaluar el impacto de la angina en la supervivencia de los pacientes. Los modelos se ajustaron en relación con los factores de confusión de referencia en función del conocimiento causal previo. Un valor p< 0,05 se consideró significativo en todas las pruebas estadísticas. Todos los datos se analizaron con el paquete estadístico STATA, versión 15.0 (StataCorp LP, Estados Unidos).
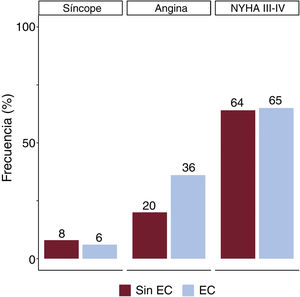
RESULTADOSDe los 1.687 receptores de TAVI por EA, 497 pacientes (29%) tenían angina antes del TAVI. La figura 1 muestra la distribución de los 3 síntomas cardinales de la EA (angina, disnea y síncope) en pacientes con y sin EC coexistente.
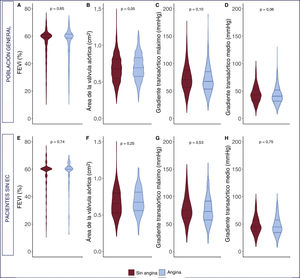
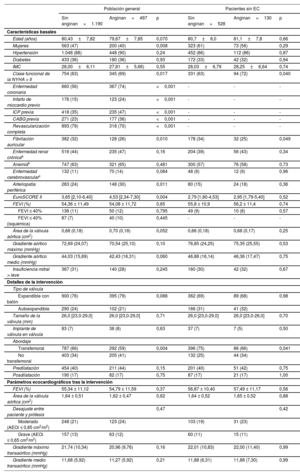
Las características basales y de la intervención, de acuerdo con la existencia de angina en la población total y así como en el subgrupo sin EC, se muestran en la tabla 1. Al comparar a los pacientes con y sin angina, se observó un predominio del sexo masculino (el 60 frente al 53%; p=0,008), una menor edad (79,67 ± 7,85 frente a 80,43±7,82 años; p=0,07) y una peor clase funcional de la New York Heart Association (NYHA > II, el 69 frente al 63%; p=0,017). También se observó una mayor prevalencia de EC (el 74 frente al 56%; p <0,001), una mayor tasa de revascularización previa (ICP previa, el 47 frente al 35%; p <0,001; cirugía de revascularización coronaria previa: el 36 frente al 23%; p <0,001) y una menor tasa de revascularización completa (el 70 frente al 79%; p <0,001). La comparación de los parámetros ecocardiográficos basales entre los pacientes con y sin angina se muestra en la figura 2. Salvo una tendencia a un gradiente medio más bajo y una mayor área de la válvula aórtica en pacientes con angina al inicio del estudio, no se encontraron diferencias entre los grupos en cuanto a los parámetros ecocardiográficos iniciales. Tampoco se encontraron diferencias en el procedimiento, salvo una mayor frecuencia de acceso no transfemoral (el 41 frente al 34%; p=0,004) en los pacientes con angina. Los resultados de la intervención de TAVI, evaluados por ecocardiografía Doppler tras ella, también fueron similares entre los grupos.
Características basales y de la intervención de la población general y de los pacientes sin enfermedad coronaria
| Población general | Pacientes sin EC | |||||
|---|---|---|---|---|---|---|
| Sin anginan=1.190 | Anginan=497 | p | Sin anginan=528 | Anginan=130 | p | |
| Características basales | ||||||
| Edad (años) | 80,43±7,82 | 79,67±7,85 | 0,070 | 80,7±8,0 | 81,1±7,8 | 0,66 |
| Mujeres | 563 (47) | 200 (40) | 0,008 | 323 (61) | 73 (56) | 0,29 |
| Hipertensión | 1.048 (88) | 448 (90) | 0,24 | 452 (86) | 112 (86) | 0,87 |
| Diabetes | 433 (36) | 180 (36) | 0,93 | 172 (33) | 42 (32) | 0,94 |
| IMC | 28,00±6,11 | 27,81±5,66) | 0,55 | 28,03±6,79 | 28,25±6,64 | 0,74 |
| Clase funcional de la NYHA > II | 754 (63) | 345 (69) | 0,017 | 331 (63) | 94 (72) | 0,040 |
| Enfermedad coronaria | 660 (56) | 367 (74) | <0,001 | - | - | - |
| Infarto de miocardio previo | 176 (15) | 123 (24) | <0,001 | - | - | - |
| ICP previa | 418 (35) | 235 (47) | <0,001 | - | - | - |
| CABG previa | 271 (23) | 177 (36) | <0,001 | - | - | - |
| Revascularización completa | 893 (79) | 318 (70) | <0,001 | - | - | - |
| Fibrilación auricular | 382 (32) | 128 (26) | 0,010 | 178 (34) | 32 (25) | 0,049 |
| Enfermedad renal crónicaa | 516 (44) | 235 (47) | 0,16 | 204 (39) | 56 (43) | 0,34 |
| Anemiab | 747 (63) | 321 (65) | 0,481 | 300 (57) | 76 (58) | 0,73 |
| Enfermedad cerebrovascularc | 132 (11) | 70 (14) | 0,084 | 48 (9) | 12 (9) | 0,96 |
| Arteriopatía periférica | 283 (24) | 148 (30) | 0,011 | 80 (15) | 24 (18) | 0,36 |
| EuroSCORE II | 3,65 [2,10-6,40] | 4,53 [2,34-7,30] | 0,004 | 2,79 [1,80-4,53] | 2,95 [1,79-5,40] | 0,52 |
| FEVI (%) | 54,36 ± 11,49 | 54,08 ± 11,72 | 0,65 | 55,8 ± 10,9 | 56,2 ± 11,4 | 0,74 |
| FEVI ≤ 40% | 136 (11) | 50 (12) | 0,795 | 49 (9) | 10 (8) | 0,57 |
| FEVI ≤ 40% (isquémica) | 87 (7) | 40 (10) | 0,445 | - | - | - |
| Área de la válvula aórtica (cm2) | 0,68 (0,18) | 0,70 (0,18) | 0,052 | 0,66 (0,18) | 0,68 (0,17) | 0,25 |
| Gradiente aórtico máximo (mmHg) | 72,69 (24,07) | 70,54 (25,10) | 0,10 | 76,85 (24,25) | 75,35 (25,55) | 0,53 |
| Gradiente aórtico medio (mmHg) | 44,03 (15,69) | 42,43 (16,31) | 0,060 | 46,88 (16,14) | 46,36 (17,47) | 0,75 |
| Insuficiencia mitral > leve | 367 (31) | 140 (28) | 0,245 | 160 (30) | 42 (32) | 0,67 |
| Detalles de la intervención | ||||||
| Tipo de válvula | ||||||
| Expandible con balón | 900 (76) | 395 (79) | 0,088 | 362 (69) | 89 (68) | 0,98 |
| Autoexpandible | 290 (24) | 102 (21) | 166 (31) | 41 (32) | ||
| Tamaño de la válvula (mm) | 26,0 [23,0-29,0] | 26,0 [23,0-29,0] | 0,71 | 26,0 [23,0-29,0] | 26,0 [23,0-26,0] | 0,70 |
| Implante de válvula en válvula | 83 (7) | 38 (8) | 0,63 | 37 (7) | 7 (5) | 0,50 |
| Abordaje | ||||||
| Transfemoral | 787 (66) | 292 (59) | 0,004 | 396 (75) | 86 (66) | 0,041 |
| No transfemoral | 403 (34) | 205 (41) | 132 (25) | 44 (34) | ||
| Predilatación | 454 (40) | 211 (44) | 0,15 | 201 (40) | 51 (42) | 0,75 |
| Posdilatación | 190 (17) | 82 (17) | 0,75 | 87 (17) | 21 (17) | 1,00 |
| Parámetros ecocardiográficos tras la intervención | ||||||
| FEVI (%) | 55,34 ± 11,12 | 54,79 ± 11,59 | 0,37 | 56,87 ± 10,40 | 57,49 ± 11,17 | 0,56 |
| Área de la válvula aórtica (cm2) | 1,64 ± 0,51 | 1,62 ± 0,47 | 0,62 | 1,64 ± 0,52 | 1,65 ± 0,52 | 0,88 |
| Desajuste entre paciente y prótesis | 0,47 | 0,42 | ||||
| Moderado (AEOi ≤ 0,85 cm2/m2) | 248 (21) | 123 (24) | 103 (19) | 31 (23) | ||
| Grave (AEOi ≤ 0,65 cm2/m2) | 157 (13) | 63 (12) | 60 (11) | 15 (11) | ||
| Gradiente máximo transaórtico (mmHg) | 21,74 (10,34) | 20,96 (9,76) | 0,16 | 22,01 (10,83) | 22,00 (11,40) | 0,99 |
| Gradiente medio transaórtico (mmHg) | 11,68 (5,92) | 11,27 (5,92) | 0,21 | 11,88 (6,31) | 11,88 (7,30) | 0,99 |
AEOi: área efectiva del orificio indexada; CABG: cirugía de revascularización coronaria; EC: enfermedad coronaria; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IMC: índice de masa corporal; NYHA: New York Heart Association.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
Comparación de los parámetros ecocardiográficos al inicio del estudio de los pacientes con y sin angina en la población general (panel superior) y pacientes sin EC coexistente (panel inferior). A: fracción de eyección del ventrículo izquierdo. B: área de la válvula aórtica. C: gradiente transaórtico máximo. D: gradiente transaórtico medio. EC: enfermedad coronaria; FEVI: fracción de eyección del ventrículo izquierdo.
Entre los 658 pacientes sin EC coexistente, se identificó a 130 (20%) con angina previa al TAVI. El análisis de este subgrupo no mostró diferencias significativas en las variables basales entre pacientes con y sin angina, salvo una mayor prevalencia de fibrilación auricular (el 25 frente al 34%; p=0,049) y una peor clase funcional de la NYHA (NYHA > II: el 72 frente al 63%; p=0,04) en el grupo de angina. No hubo diferencias en los parámetros ecocardiográficos basales de los pacientes sin EC (tabla 1).
Durante el estudio previo al TAVI, se realizó una ICP en el 22% de los pacientes, sin diferencias en la cifra de ICP entre pacientes con y sin angina al inicio del estudio (el 23 frente al 21%; p=0,39). La revascularización completa durante el estudio diagnóstico del TAVI fue más común (tendencia no significativa) en los pacientes sin angina (el 75 frente al 66%; p=0,062). La información detallada sobre los resultados de la coronariografía previa al TAVI y la ICP en pacientes con y sin angina se muestra en la tabla 1 del material adicional.
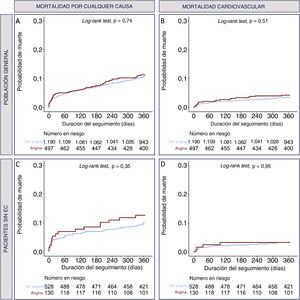
Importancia pronóstica de la angina basalLos resultados clínicos a 1 año según la existencia de angina en la población general y el subgrupo sin EC se muestran en la tabla 2. La angina basal no tuvo impacto en la mortalidad por cualquier causa (hazard ratio [HR] = 1,02; intervalo de confianza del 95% [IC95%], 0,71-1,48; p=0,898) ni en la mortalidad cardiovascular (HR = 1,2; IC95%, 0,69-2,11; p=0,517) a 1 año. El análisis de subgrupos de pacientes sin EC coexistente no mostró ningún impacto de la angina en la mortalidad por cualquier causa (HR = 1,18; IC95%, 0,64-2,27; p=0,598) ni en la mortalidad cardiovascular (HR = 1,04; IC95%, 0,35-3,12; p=0,545) a 1 año. Las curvas de Kaplan-Meier en el seguimiento a 1 año respecto a la mortalidad por cualquier causa y la mortalidad cardiovascular posterior al TAVI según la existencia de angina en la población general y el subgrupo sin EC se muestran en la figura 3.
Comparación de la presentación de eventos y el riesgo de eventos a 1 año entre pacientes con y sin angina
| Población general | ||||||
|---|---|---|---|---|---|---|
| Total(N=1.687) | Sin angina(n=1.190) | Angina(n=497) | p | HR(IC95%) | p | |
| Mortalidad por cualquier causaa | 180(11) | 125(11) | 55(11) | 0,733 | 1,02(0,71-1,48) | 0,898 |
| Mortalidad cardiovasculara | 60(4) | 40(3) | 20(4) | 0,503 | 1,20(0,69-2,11) | 0,517 |
| Síndrome coronario agudob | 29(2) | 13(1) | 16(3) | 0,002 | 2,10(0,97-4,53) | 0,058 |
| Hospitalización por insuficiencia cardiacac | 135(8) | 99(8) | 36(7) | 0,458 | 0,83(0,56-1,22) | 0,331 |
| Pacientes sin EC | ||||||
|---|---|---|---|---|---|---|
| Total(n=658) | Sin angina(n=528) | Angina(n=130) | p | HR (IC95%) | p | |
| Mortalidad por cualquier causaa | 68(10) | 52(10) | 16(12) | 0,409 | 1,18(0,64-2,27) | 0,598 |
| Mortalidad cardiovasculara | 21(3) | 4(3) | 17(3) | 0,934 | 1,04(0,35-3,12) | 0,545 |
| Síndrome coronario agudob | 3(< 1) | 1(< 1) | 2(2) | 0,041 | 9,10(0,82-100,57) | 0,072 |
| Hospitalización por insuficiencia cardiacac | 46(7) | 38(7) | 8(6) | 0,676 | 0,84(0,58-1-24) | 0,398 |
EC: enfermedad coronaria; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%, intervalo de confianza del 95%.
Los valores expresan n (%).
Modelo de riesgos proporcionales de Cox para la mortalidad: edad, sexo, FEVI reducida, EC y revascularización completa (la EC y la revascularización completa se excluyeron del análisis de los pacientes sin EC).
Curvas de Kaplan-Meier a 1 año de seguimiento de los pacientes con y sin angina. A: mortalidad por cualquier causa en la población general. B: mortalidad cardiovascular en la población general. C: mortalidad por cualquier causa en pacientes sin EC. D: mortalidad cardiovascular en pacientes sin EC. EC: enfermedad coronaria.
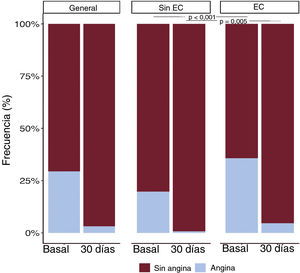
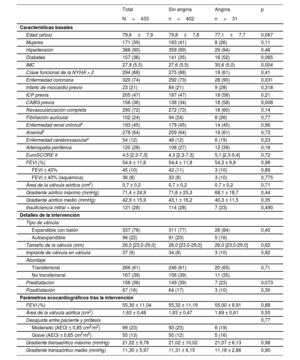
Se dispuso de datos de un amplio seguimiento que incluyó un cuestionario sobre los síntomas de 433 (87%) de los 497 pacientes con angina al inicio del estudio. A los 30 días de seguimiento, 31 pacientes (7%) mostraron angina persistente y el 90% de ellos (28 pacientes) presentaban EC importante conocida previamente (estenosis importante en la evaluación angiográfica previa al TAVI o estado de la revascularización coronaria). Entre los pacientes sin EC, prácticamente no había angina persistente (< 1%) a los 30 días del TAVI (figura 4). Las características basales y de la intervención de los pacientes con y sin angina persistente 30 días después del TAVI se muestran en la tabla 3. Los pacientes con angina persistente tenían un índice de masa corporal mayor (30,6 ± 5,0 frente a 27,6 ± 5,5; p=0,004), una mayor prevalencia de diabetes mellitus (el 52 frente al 35%; p=0,065), una mayor prevalencia de EC (el 90 frente al 73%; p=0,031) y una mayor proporción de cirugía de revascularización coronaria previa (el 58 frente al 34%; p=0,008). No hubo diferencias entre los grupos en los parámetros ecocardiográficos basales ni en las características del procedimiento. La información detallada sobre los resultados de la coronariografía previa al TAVI y la ICP en pacientes con y sin angina persistente 30 días tras el TAVI se muestra en la tabla 2 del material adicional. A 15 pacientes con angina persistente (48%) se les realizó una nueva coronariografía después del TAVI y a 7 (23%), una ICP (mediana de tiempo entre TAVI e ICP, 208 [intervalo intercuartílico, 169-319] días). La indicación predominante para la ICP tras el TAVI fue angina en 6 pacientes (86%) e infarto de miocardio sin elevación del segmento ST en 1.
Características basales y de la intervención de los pacientes con y sin angina persistente a los 30 días
| Total | Sin angina | Angina | p | |
|---|---|---|---|---|
| N=433 | n=402 | n=31 | ||
| Características basales | ||||
| Edad (años) | 79,6±7,9 | 79,8±7,8 | 77,1±7,7 | 0,067 |
| Mujeres | 171 (39) | 163 (41) | 8 (26) | 0,11 |
| Hipertensión | 388 (90) | 359 (89) | 29 (94) | 0,46 |
| Diabetes | 157 (36) | 141 (35) | 16 (52) | 0,065 |
| IMC | 27,9 (5,5) | 27,6 (5,5) | 30,6 (5,0) | 0,004 |
| Clase funcional de la NYHA > 2 | 294 (68) | 275 (68) | 19 (61) | 0,41 |
| Enfermedad coronaria | 320 (74) | 292 (73) | 28 (90) | 0,031 |
| Infarto de miocardio previo | 23 (21) | 84 (21) | 9 (28) | 0,318 |
| ICP previa | 205 (47) | 187 (47) | 18 (58) | 0,21 |
| CABG previa | 156 (36) | 138 (34) | 18 (58) | 0,008 |
| Revascularización completa | 290 (72) | 272 (73) | 18 (60) | 0,14 |
| Fibrilación auricular | 102 (24) | 94 (24) | 8 (26) | 0,77 |
| Enfermedad renal crónicaa | 193 (45) | 179 (45) | 14 (45) | 0,96 |
| Anemiab | 278 (64) | 259 (64) | 19 (61) | 0,73 |
| Enfermedad cerebrovascularc | 54 (12) | 48 (12) | 6 (19) | 0,23 |
| Arteriopatía periférica | 120 (28) | 108 (27) | 12 (39) | 0,16 |
| EuroSCORE II | 4,5 [2,3-7,3] | 4,3 [2,3-7,3] | 5,1 [2,3-9,4] | 0,72 |
| FEVI (%) | 54,4 ± 11,6 | 54,4 ± 11,8 | 54,3 ± 9,8 | 0,98 |
| FEVI ≤ 40% | 45 (10) | 42 (11) | 3 (10) | 0,89 |
| FEVI ≤ 40% (isquémica) | 36 (8) | 33 (8) | 3 (10) | 0,775 |
| Área de la válvula aórtica (cm2) | 0,7 ± 0,2 | 0,7 ± 0,2 | 0,7 ± 0,2 | 0,71 |
| Gradiente aórtico máximo (mmHg) | 71,4 ± 24,9 | 71,6 ± 25,3 | 68,1 ± 18,7 | 0,44 |
| Gradiente aórtico medio (mmHg) | 42,9 ± 15,9 | 43,1 ± 16,2 | 40,3 ± 11,5 | 0,35 |
| Insuficiencia mitral > leve | 121 (28) | 114 (28) | 7 (23) | 0,490 |
| Detalles de la intervención | ||||
| Tipo de válvula | ||||
| Expandible con balón | 337 (78) | 311 (77) | 26 (84) | 0,40 |
| Autoexpandible | 96 (22) | 91 (23) | 5 (16) | |
| Tamaño de la válvula (mm) | 26,0 [23,0-29,0] | 26,0 [23,0-29,0] | 26,0 [23,0-29,0] | 0,62 |
| Implante de válvula en válvula | 37 (9) | 34 (8) | 3 (10) | 0,82 |
| Abordaje | ||||
| Transfemoral | 266 (61) | 246 (61) | 20 (65) | 0,71 |
| No transfemoral | 167 (39) | 156 (39) | 11 (35) | |
| Predilatación | 156 (38) | 149 (39) | 7 (23) | 0,073 |
| Posdilatación | 67 (16) | 64 (17) | 3 (10) | 0,30 |
| Parámetros ecocardiográficos tras la intervención | ||||
| FEVI (%) | 55,30 ± 11,04 | 55,32 ± 11,19 | 55,00 ± 8,91 | 0,88 |
| Área de la válvula aórtica (cm2) | 1,63 ± 0,48 | 1,63 ± 0,47 | 1,69 ± 0,61 | 0,55 |
| Desajuste entre paciente y prótesis | 0,77 | |||
| Moderado (AEOi ≤ 0,85 cm2/m2) | 99 (23) | 93 (23) | 6 (19) | |
| Grave (AEOi ≤ 0,65 cm2/m2) | 55 (13) | 50 (12) | 5 (16) | |
| Gradiente transaórtico máximo (mmHg) | 21,02 ± 9,78 | 21,02 ± 10,02 | 21,07 ± 6,13 | 0,98 |
| Gradiente transaórtico medio (mmHg) | 11,30 ± 5,97 | 11,31 ± 6,15 | 11,18 ± 2,86 | 0,90 |
AEOi: área efectiva del orificio indexada; CABG: cirugía de revascularización coronaria; EC: enfermedad coronaria; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IMC: índice de masa corporal; NYHA: clase funcional de la New York Heart Association.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo intercuartílico].
A diferencia de la angina antes del TAVI, la angina persistente a los 30 días del TAVI se asoció con un aumento de la mortalidad por cualquier causa (HR = 4,86; IC95%, 1,71-13,82; p=0,003) y la mortalidad cardiovascular (HR = 20,7; IC95%, 3,50-122,61; p=0,001) a 1 año de seguimiento (tabla 4). Las curvas de Kaplan-Meier a 1 año de seguimiento que ilustran la mortalidad por cualquier causa y la mortalidad cardiovascular tras el TAVI según hubiera angina persistente a los 30 días del TAVI se muestran en la figura 5.
Comparación de la presentación de eventos y el riesgo de eventos a 1 año en pacientes con y sin angina persistente a los 30 días del TAVI
| Angina persistente | ||||||
|---|---|---|---|---|---|---|
| Total(N=433) | Sin angina(n=402) | Angina(n=31) | p | HR (IC95%) | p | |
| Mortalidad por cualquier causaa | 23(5) | 4(5) | 5(16) | 0,005 | 4,86(1,71-13,82) | 0,003 |
| Mortalidad cardiovasculara | 6 (1) | 2(< 1) | 4(13) | < 0,001 | 20,7(3,50-122,61) | 0,001 |
| Síndrome coronario agudob | 11(3) | 8(2) | 3(10) | 0,009 | 2,99(0,61-14,63) | 0,179 |
| Hospitalización por insuficiencia cardiacac | 30(7) | 28(7) | 2(6) | 0,914 | 0,92(0,22-3,95) | 0,915 |
EC: enfermedad coronaria; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%: intervalo de confianza del 95%; TAVI: implante percutáneo de válvula aórtica.
Los valores expresan n (%).
Figura central. Características basales y de la intervención y resultados clínicos que comparan a los pacientes con y sin angina receptores de TAVI por estenosis aórtica grave. Curvas de Kaplan-Meier a 1 año de seguimiento de pacientes con y sin angina basal (panel inferior izquierdo) y angina persistente a los 30 días del TAVI (panel inferior derecho). AVA: área de la válvula aórtica; CABG: cirugía de revascularización coronaria; EC: enfermedad coronaria; GP: gradiente de presión; ICP: intervención coronaria percutánea; NYHA: clase funcional de la New York Heart Association; TAVI: implante percutáneo de válvula aórtica. *Estadísticamente no significativo.
Los principales resultados de este estudio son los siguientes: a) el 29% de los pacientes con EA grave receptores de TAVI presentaban angina al inicio del estudio (el 20% de los pacientes sin EC significativa); b) los receptores de TAVI con angina al inicio del estudio solieron ser varones, con peor clase funcional de la NYHA, una mayor prevalencia de EC, una menor tasa de revascularización completa y más frecuencia de un acceso no transfemoral para el TAVI; c) la angina basal no tuvo ninguna repercusión negativa en los resultados clínicos, y d) la angina persistente a los 30 días del TAVI fue infrecuente (el 7% de todos los pacientes con angina al inicio del estudio) y casi inexistente en los pacientes sin EC preexistente; sin embargo, la angina se asoció con mayor riesgo de mortalidad por cualquier causa y mortalidad cardiovascular a 1 año de seguimiento.
Importancia de la anginaVarios estudios previos en pacientes quirúrgicos mostraron que la mitad de los pacientes con angina y EA grave preexistente presentaban una EC significativa12,15. En nuestra población de pacientes sometidos a TAVI, se encontró EC significativa en el 74% de los pacientes con angina. En los pacientes sin angina la EC fue menos frecuente, pero aun así se observó en más de la mitad (56%). En la mayoría de los estudios, incluida nuestra publicación actual, no solo se aceptó estenosis coronaria importante, sino también cirugía de revascularización coronaria previa e ICP previa como definiciones de EC. Por lo tanto, la prevalencia de EC significativa que puede justificar la revascularización antes del TAVI podría ser considerablemente inferior a las cifras comunicadas16. Respalda esto un estudio reciente de Case et al.17, que muestra una EC importante en el 39% de los candidatos a TAVI y necesidad de ICP previa a la intervención en solo el 8,5% de los pacientes. En nuestra población de estudio, se sometió a ICP al 22% de los pacientes durante el estudio diagnóstico del TAVI a pesar de una prevalencia de EC del 61%.
La menor prevalencia de EC en la serie quirúrgica (frente a TAVI) puede explicarse por el hecho de que los pacientes con TAVI son relativamente mayores y presentan una mayor carga de comorbilidad que los sometidos a reemplazo quirúrgico de la válvula aórtica. La cuestión de si la angina es un síntoma fiable para diagnosticar (o excluir) la EC en pacientes con EA es controvertida18,19. La tesis más consolidada es que la presencia o ausencia de angina en la EA es de poca ayuda en el momento de predecir o excluir una EC coexistente y las guías de práctica clínica y las normas actuales continúan recomendando la coronariografía sistemática como parte del estudio diagnóstico previo al recambio de la válvula aórtica (sea quirúrgico o TAVI), independientemente de la presencia o ausencia de angina20,21. La cifra relativamente mayor de pacientes con EC silente (66%) de nuestra población con TAVI respaldaría la opinión actual de que la predicción o exclusión de EC importante basada únicamente en los síntomas de los pacientes no es fiable.
Curiosamente, en la población del estudio había una proporción bastante alta tanto de pacientes con EC silente como con angina sin EC significativa (aproximadamente un quinto de todos los pacientes con angina al inicio del estudio). Este grupo es especialmente interesante para comprender mejor los síntomas de angina secundarios a la EA y evitar la superposición con los síntomas relacionados con la EC. El conocimiento actual de la angina en pacientes sin estenosis coronaria importante se basa en los siguientes aspectos fisiopatológicos: el consumo miocárdico de oxígeno depende de la frecuencia cardiaca y la contractilidad y la tensión parietales, directamente proporcionales a la presión ventricular22. En la EA, la presión ventricular y el estrés parietal están elevados, lo que genera un aumento de la demanda de oxígeno. Respecto al suministro de oxígeno, se sabe que el flujo sanguíneo coronario en la EA no se puede aumentar lo suficiente a causa de la menor presión aórtica media y del tiempo de perfusión diastólica22,23. Por lo tanto, la angina en pacientes sin EC importante podría explicarse por el desequilibrio en el suministro y la demanda de oxígeno causado por la EA24–27. En nuestro estudio, no se observó que la angina en pacientes sin EC fuera un signo de una enfermedad valvular más avanzada.
En la población general del estudio, los pacientes con y sin angina basal tenían similares características clínicas basales, salvo una peor clase funcional de la NYHA, una mayor incidencia de EC (incluida una mayor tasa de revascularización previa), una menor tasa de revascularización completa y un mayor empleo de acceso no transfemoral durante el TAVI en el grupo de angina. Llaman la atención las diferencias entre grupos en la revascularización completa. Puesto que los pacientes con angina tenían más oclusiones crónicas totales (tendencia no significativa) y más lesiones de puentes coronarios, la menor tasa de revascularización completa podría explicarse por una anatomía coronaria más compleja y, por consiguiente, una mayor tasa de fracaso o rechazo de la revascularización. El uso más frecuente de accesos alternativos, no transfemorales, en el grupo de angina puede explicarse por la mayor prevalencia de arteriopatía periférica, ya que las vías de acceso arterial no transfemoral se establecen actualmente como una alternativa segura si el abordaje transfemoral no es factible28. La cifra especialmente elevada del empleo de acceso no transfemoral en nuestra población (sobre todo el acceso transcarotídeo) no solo se debe al hecho de que la serie es histórica, sino que también refleja la gran acogida de vías de acceso alternativas en nuestro centro. También llama la atención la gran proporción de pacientes de nuestra población con revascularización previa. Esto podría explicarse por la edad relativamente avanzada de la población y una práctica por lo general proactiva hacia el tratamiento invasivo de la EC significativa en nuestro centro.
En el pasado, los pacientes con EC y angina importantes solían presentar gradientes valvulares aórticos más bajos y áreas valvulares mayores18,26. En nuestro estudio, también encontramos una tendencia similar a un área valvular aórtica mayor y a gradientes valvulares más bajos en el grupo de pacientes con angina. Se podría especular que la isquemia miocárdica produce una caída en el gradiente medio de la válvula aórtica y, por ello, un aumento de los síntomas de angina como consecuencia de la reducción del flujo coronario. Además, más que causar los gradientes más bajos, la EC coexistente desenmascararía la EA a gradientes más bajos.
Valor pronóstico de la anginaEn la población quirúrgica, está aceptado que la EC es un factor pronóstico negativo29,30, lo cual motiva que se trate a los pacientes con EA grave y EC coexistente en una intervención combinada (reemplazo quirúrgico de la válvula aórtica y cirugía de revascularización coronaria). En la población con TAVI, la repercusión de la EC coexistente en los resultados y el papel de la revascularización antes del TAVI son controvertidos. Un metanálisis de Sankaramangalam et al.31 que analizó 15 estudios relacionados con el TAVI no mostró ninguna repercusión de la EC coexistente en la mortalidad a los 30 días, pero sí se asoció con un aumentó la mortalidad por cualquier causa 1 año después del TAVI. Otro metanálisis no mostró ninguna repercusión de la EC concomitante en los resultados al año de seguimiento después del TAVI32. En la mayoría de los centros, la coronariografía sistemática antes del TAVI es una práctica habitual, aunque los datos sobre la implicación pronóstica de la EC en los candidatos a TAVI son ambiguos. Recientemente se ha cuestionado la estrategia de la coronariografía invasiva sistemática antes del TAVI en un metanálisis que mostró ausencia de beneficio en supervivencia a los 30 días y a 1 año y ninguna mejora en los resultados cardiovasculares en pacientes tratados con ICP antes del TAVI por EC coexistente33. En el ensayo ACTIVATION, el primer ensayo aleatorizado que comparó la ICP con el tratamiento médico en pacientes candidatos a TAVI con EC importante, los tratados con revascularización previa al TAVI no obtuvieron mejores resultados34. Con todo, este ensayo se interrumpió prematuramente, lo que impidió obtener conclusiones definitivas. Si se tiene en cuenta que el beneficio de la ICP en los candidatos a TAVI es dudoso, parece que el tratamiento médico óptimo recomendado por la guía de práctica clínica de la EC estable y asintomática es una opción de tratamiento adecuada para los candidatos a TAVI35.
Hasta donde sabemos, el papel pronóstico de la angina en pacientes con EA no se había analizado antes en la población quirúrgica ni en la población con TAVI. Por lo tanto, nuestro estudio es el primero en demostrar que la angina basal no tiene repercusión en los resultados clínicos 1 año del TAVI, ya sea en la población general o en el subgrupo de pacientes sin EC coexistente. Este último grupo reviste especial interés, ya que se puede excluir la ‘contaminación’ por síntomas de una EC coexistente.
Angina persistente en la estenosis aórticaEn nuestra población con TAVI, la angina persistente a los 30 días después de la intervención fue infrecuente y se observó de manera casi exclusiva en pacientes con EC conocida. En aquellos sin EC coexistente, la angina desapareció después de reemplazar la válvula aórtica enferma en más del 99% de los casos. El infrecuente caso de angina persistente en pacientes sin EC no puede explicarse con nuestros datos y podría explicarse por la presencia de enfermedad microvascular. Curiosamente, la integridad de la revascularización previa a la intervención no fue considerablemente distinta entre los pacientes con angina persistente y sin ella. No obstante, en el grupo con angina persistente, menos del 50% de los pacientes con una intervención coronaria como parte del estudio diagnóstico previo al TAVI estaban completamente revascularizados. Por lo tanto, la tasa relativamente alta de revascularización incompleta, junto con el considerable porcentaje de pacientes con angina persistente que necesitan ICP 1 año después del TAVI, indica que la angina persistente es sobre todo consecuencia de una EC residual que queda oculta o progresa rápidamente y denota la importancia potencial de la revascularización completa en pacientes con angina previa al TAVI. La hipótesis de que en algunos pacientes la EC progresa rápidamente tras el TAVI también puede deducirse de otra publicación, que muestra que en alrededor del 10% de los pacientes apareció un síndrome coronario agudo tras el TAVI (seguimiento medio, 25 meses), mientras que no hubo diferencias en la integridad de la revascularización previa al TAVI entre los pacientes con y sin síndrome coronario agudo después36. Curiosamente, Stefanini et al.37 comunicaron recientemente una incidencia de solo el 0,9% de ICP no planificadas después del TAVI, y la mayoría de las ICP en los primeros 2 años tras el TAVI se debían a un síndrome coronario agudo. Según la hipótesis ya mencionada, el hallazgo angiográfico más común fueron las lesiones de novo secundarias a la progresión de la EC. Curiosamente, la angina persistente tras el TAVI no solo motivó que se repitieran la coronariografía y la ICP, sino que también predijo mayores mortalidad por cualquier causa y mortalidad cardiovascular 1 año después del TAVI. Este hallazgo debe validarse en grupos de estudio mayores. No obstante, parece que son aconsejables la evaluación sistemática de los síntomas de angina durante el seguimiento y un seguimiento más estrecho de los pacientes con angina persistente después del TAVI.
Limitaciones del estudioNuestro estudio comunica los resultados de un único centro especializado con amplia experiencia en el tratamiento de cardiopatías valvulares. Por lo tanto, no se puede descartar un sesgo específico del centro. Además, este es un análisis retrospectivo de datos prospectivos. Las vías de acceso alternativas, como el abordaje transcarotídeo del TAVI, son frecuentes en nuestro centro. El elevado porcentaje de vías de acceso no transfemoral puede haber tenido repercusiones en nuestros resultados y se debe considerarlo una posible limitación. La fragilidad y otras afecciones geriátricas relevantes no se incluyeron en nuestro análisis. Del mismo modo, nuestro análisis no incluyó el tratamiento médico después del TAVI. En particular, se espera que el tratamiento antianginoso contribuya al alivio de los síntomas y podría tener una influencia considerable en la angina persistente tras el TAVI. Por último, en nuestro centro, la decisión de revascularizar antes del TAVI resulta de una valoración crítica del equipo cardiovascular y no responde a una selección predeterminada.
CONCLUSIONESSe halló angina en el 29% de los candidatos a TAVI y no se encontró que fuera un signo de valvulopatía más avanzada o que tuviera repercusiones en los resultados clínicos después del TAVI. No obstante, la angina persistente después del TAVI se asoció con peores resultados, por lo cual debe considerarse una señal de advertencia.
- –
Junto con la disnea y el síncope, se sabe que la angina es uno de los síntomas principales en pacientes con EA grave.
- –
La angina en la EA se explica por una desproporción entre la necesidad miocárdica de oxígeno y el suministro de oxígeno, ya sea debido a la propia EA o por una EC importante coexistente.
- –
No se encontró que la angina basal en pacientes con EA grave se asociara con una valvulopatía más avanzada. La angina no tuvo repercusión en los resultados clínicos después del TAVI.
- –
La angina persistente después del TAVI se asoció con peores resultados.
- –
Es aconsejable la evaluación sistemática de los síntomas de angina durante el seguimiento y una estrategia de seguimiento más estrecho para los pacientes con angina persistente después del TAVI.
L.S. Keller recibe una subvención de la KK Stiftung für Kardiologie und Kreislauf (Suiza). J. Nuche recibe una subvención de la Fundación Alfonso Martín Escudero (Madrid, España).
CONTRIBUCIÓN DE LOS AUTORESL.S. Keller, J. Nuche y J. Rodés-Cabau concibieron y diseñaron el estudio. L.S. Keller obtuvo los datos. L.S. Keller y J. Nuche participaron en la interpretación de datos. L.S. Keller escribió el primer borrador del artículo. J. Nuche realizó el análisis estadístico, con aportes de J. Rodés-Cabau. Todos los autores participaron en la interpretación de los datos y en la redacción y revisión crítica del artículo. Todos los autores aprobaron la versión final del artículo y aseguraron la exactitud e integridad del trabajo. Todos los autores tuvieron acceso a todos los datos del estudio y asumieron la responsabilidad final de la decisión de enviar el artículo para su publicación. J. Rodés-Cabau es responsable del contenido general del estudio como garante.
CONFLICTO DE INTERESESJ. Rodés-Cabau ha recibido subvenciones institucionales de investigación y honorarios como conferenciante de Edwards Lifesciences, Medtronic y Boston Scientific, y es asesor de Edwards Lifesciences y Medtronic. El resto de los autores no tienen nada que declarar.
J. Rodés-Cabau ocupa la Cátedra de Investigación Fondation Famille Jacques Larivière para el Desarrollo de Intervenciones Estructurales de Enfermedades Cardiacas (Laval University, Quebec, Canadá).