Palabras clave
INTRODUCCIÓN
Los dispositivos de asistencia circulatoria (DAC) son una importante terapia en el manejo de los pacientes con insuficiencia cardiaca avanzada. Debido a que el número de donantes de órganos es limitado, se considera que el uso de estos dispositivos es una alternativa válida para salvar la vida de los pacientes con riesgo de muerte inminente.
El avance tecnológico en el área de los DAC ha reducido el riesgo de las complicaciones postoperatorias. Sin embargo, la estratificación del riesgo previo al implante del dispositivo es esencial para reducir el riesgo de complicaciones a corto y a largo plazo.
Los DAC permiten revertir la cascada fisiopatológica que se observa en pacientes con enfermedad cardiaca avanzada. Si bien hay protocolos para evaluar la recuperación ventricular tras el uso de los dispositivos, no hay aún parámetros establecidos que permitan predecir durante cuánto tiempo puede mantenerse la mejoría de la función cardiaca.
Este trabajo describe los DAC actualmente disponibles para uso clínico, las indicaciones para su empleo, los efectos favorables sobre la función ventricular y las ventajas y desventajas de cada dispositivo en particular.
INDICACIONES
Los DAC mejoran la sobrevida de los pacientes en quienes fracasa el tratamiento médico con inotrópicos o vasodilatadores intravenosos, el balón de contrapulsación aórtico y la asistencia respiratoria mecánica1.
Los pacientes que requieren de estos dispositivos pueden clasificarse en cuatro categorías: shock cardiogénico postinfarto agudo de miocardio, disfunción miocárdica tras cirugía cardiaca, insuficiencia cardiaca aguda secundaria a miocarditis e insuficiencia cardiaca crónica descompensada.
Los pacientes en shock cardiogénico tras un infarto agudo de miocardio son excelentes candidatos para soporte mecánico a corto y/o a largo plazo. En estos pacientes aún no se ha desarrollado disfunción sistémica de órganos y a la vez tienen un gran potencial de recuperación miocárdica, a diferencia de lo que se observa en pacientes con insuficiencia cardiaca crónica avanzada. En nuestra experiencia, el soporte mecánico temporal es inefectivo en pacientes con infarto agudo de miocardio masivo (creatincinasa > 10.000, troponina I > 300 o pérdida de los complejos QRS en las derivaciones precordiales), ya que en estos casos la posibilidad de recuperación miocárdica es mínima. En estos pacientes debería considerarse el uso de soporte mecánico a largo plazo y evaluar la posibilidad de un trasplante cardiaco de urgencia.
Los pacientes que muestran signos de recuperación miocárdica pueden recibir un DAC de corto plazo (5-7 días). Los pacientes que no muestran signos de recuperación dentro de los 7 días deberían ser considerados para implante de una asistencia a largo plazo. En los pacientes no candidatos a transplante cardiaco debería considerase el retiro del dispositivo sólo si el paciente no es candidato a un dispositivo a largo plazo como terapia definitiva o de destino.
Los pacientes en shock cardiogénico tras cirugía cardiaca pueden clasificarse en dos grupos: pacientes con disfunción ventricular previa a la cirugía y, por lo tanto, con pocas posibilidades de recuperación y pacientes que antes de la cirugía poseen una función ventricular conservada y en los que un dispositivo a corto plazo podría ayudar en su recuperación.
El Abiomed BVS 5000 puede ser la mejor opción para los pacientes con función ventricular intacta previa, mientras que una asistencia ventricular izquierda puede ser la elección más acertada en pacientes con disfunción miocárdica preexistente2,3. En ambos casos, el implante inmediato (en la sala de operaciones) del dispositivo está asociado a una mejor sobrevida en comparación con el implante tardío (en la unidad de cuidados intensivos).
La miocarditis aguda es otra de las indicaciones frecuentes de soporte mecánico circulatorio. El soporte mecánico a corto plazo está indicado en pacientes con inestabilidad hemodinámica persistente a pesar del máximo tratamiento médico. La ausencia de adecuada recuperación miocárdica obliga a considerar la conversión a una asistencia a largo plazo.
La insuficiencia cardiaca crónica descompensada es la indicación más común para el uso de dispositivos a largo plazo. En este estadio los pacientes deben ser evaluados para trasplante para excluir alguna contraindicación: a) enfermedades sistémicas primarias que pudieran limitar la sobrevida a largo plazo (insuficiencia renal crónica, insuficiencia hepática y/o enfermedad pulmonar crónica); b) enfermedad vascular periférica y/o enfermedad cerebrovascular sintomática; c) neoplasias recientes (< 3 años); d) discrasias sanguíneas; e) infecciones activas, y f) diabetes con afección de órgano diana. Otras contraindicaciones son los aspectos psicosociales como la adicción al tabaco, el abuso de drogas y/o alcohol y los trastornos psiquiátricos crónicos e inestables. Cabe destacar que muchos de estos factores son considerados contraindicaciones relativas por cada centro en particular.
Estratificar el riesgo previo al implante de un dispositivo es esencial para reducir el riesgo de complicaciones a corto y a largo plazo. Se ha diseñado una serie de siete niveles clínicos para establecer el riesgo de pacientes sometidos a una asistencia circulatoria mecánica. El registro INTERMACS (Interagency Registry for Mechanically Circulatory Support), auspiciado por los National Institutes of Health de Estados Unidos facilitará la introducción de nuevas tecnologías y estudiará la evaluación de eventos clínicos y la efectividad de los dispositivos.
OBJETIVOS DE LAS ASISTENCIAS MECÁNICAS CIRCULATORIAS
La mayor experiencia es con el uso de asistencias en forma temporal como puente al trasplante cardiaco. Una importante observación con el uso de asistencias como puente al trasplante es que algunos corazones experimentan una recuperación suficiente para poder retirar el dispositivo. Dada la escasez de órganos para donación, todos los pacientes sometidos a algun tipo de DAC deberían ser evaluados sistemáticamente en busca de alguna evidencia de recuperación de la función miocárdica4,5.
El uso de los DAC como puente a la recuperación miocárdica generalmente es más exitoso en pacientes con insuficiencia ventricular tras cirugía cardiaca, miocarditis aguda o infarto de miocardio, ya que estos pacientes tienen más posibilidades de recuperación cardiaca debido a la naturaleza de la enfermedad.
La descompresión mecánica del ventrículo mejora diferentes aspectos del miocardio insuficiente. Varios estudios han demostrado que las asistencias ventriculares izquierdas se asocian a beneficios hemodinámicos, neurohormonales, fisiológicos, electrofisiológicos y moleculares, lo que avala el uso de DAC como puente a la recuperación6-9.
La probabilidad de recuperación en pacientes con disfunción crónica del ventrículo izquierdo es desconocida, pero es probable que sea inferior al 20% de los pacientes con asistencia mecánica.
Aunque existen protocolos que evalúan el grado de recuperación ventricular tras el soporte mecánico, aún no hay parámetros suficientes que permitan estimar por cuánto tiempo persistirá la mejoría de la función cardiaca10-12. Debido a que las nuevas asistencias mecánicas rotatorias descargan el ventrículo en menor grado que las asistencias de flujo pulsátil, el número de pacientes que demuestran recuperación de la función ventricular ha disminuido. El éxito de los DAC como puente a la recuperación depende de la etiología de la disfunción ventricular, el tratamiento médico de la insuficiencia cardiaca, el tipo de dispositivo usado, la modalidad de uso del dispositivo y las condiciones de carga del corazón.
Recientes estudios demuestran beneficios clínicos con el uso de asistencias ventriculares izquierdas como alternativa al trasplante cardiaco (terapia definitiva o de destino). El estudio REMATCH (Randomized Evaluation of Mechanical for the Treatment of Congestive Heart Failure) incluyó a pacientes con insuficiencia cardiaca avanzada, no candidatos a trasplante cardiaco, aleatorizados a tratamiento médico óptimo o a una asistencia ventricular izquierda (Heart-Mate). El uso de estos dispositivos resultó en un significativo beneficio clínico, mejora en la calidad de vida y la sobrevida al año13. Recientemente, el estudio INTREPID (Investigation of Nontransplant-Elegible Patients Who Are Inotrope-Dependent) evaluó la efectividad del Novacor como soporte a largo plazo en pacientes no candidatos al trasplante cardiaco frente al tratamiento médico. Los pacientes que recibieron asistencia mecánica tuvieron una mejor sobrevida a los 6 meses (el 46 frente al 22%) y a los 12 meses (el 27 frente al 11%)14.
Los pacientes que reciben una asistencia del ventrículo izquierdo como terapia definitiva pueden eventualmente mejorar (reversión de hipertensión pulmonar, mejoría en la función renal, etc.) y ser considerados para trasplante.
DISPOSITIVOS DE ASISTENCIA VENTRICULAR
En la actualidad existen varios dispositivos de asistencia ventricular aprobados por la Food and Drug Administration (FDA) de Estados Unidos, además del balón de contrapulsación aórtico15.
Entre los dispositivos extracorpóreos, Abiomed BVS 5000 y Thoratec son capaces de proveer asistencia biventricular. El Novacor N1000PC y el HeartMate (neumático y eléctrico) son dispositivos implantables para asistencia exclusiva del ventrículo izquierdo.
Las futuras generaciones de dispositivos consisten en bombas de flujo axial, con flujo no pulsátil y totalmente implantables en el ventrículo izquierdo. El HeartMate II (Thoratec), el MicroMed DeBakey (Micro-Med), el Jarvis 2000 Heart (Jarvik Heart) y el VentrAssist (Ventracor) actualmente están en evaluación clínica.
DISPOSITIVOS EXTRACORPÓREOS
Abiomed BVS 5000
Es un sistema de soporte mecánico externo, de flujo pulsátil, que se puede usar como soporte univentricular o biventricular. Las ventajas de este dispositivo son la facilidad de su uso y su disponibilidad en muchos centros quirúrgicos. La troboembolia, las hemorragias y las infecciones limitan su uso a no más de 14 días.
Thoratec
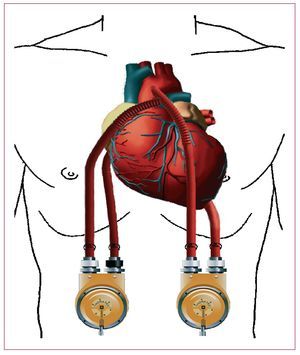
Es una asistencia ventricular extracorpórea con un sistema de flujo pulsátil neumático. Se utiliza como asistencia a largo plazo y se indica como puente al trasplante cardiaco y como puente a la recuperación (fig. 1).
Fig. 1. Thoratec.
Se posiciona la bomba sobre la pared abdominal con las cánulas de entrada y salida tunelizadas por debajo de las costillas. Este dispositivo puede utilizarse como soporte univentricular o biventricular. Como soporte del ventrículo izquierdo, la cánula de entrada se coloca en el ápex del ventrículo izquierdo o de la aurícula izquierda y la cánula de salida se anastomosa a la aorta ascendente. Como apoyo del ventrículo derecho, la cánula de entrada se coloca en la aurícula derecha o el ventrículo derecho y la cánula de salida se anastomosa al tronco de la arteria pulmonar16. Estas cánulas se conectan a una bomba externa (una para cada ventrículo), que consiste en una cámara rígida que contiene un saco de poliuretano que alberga la sangre. Desde una consola externa se envía aire a presión a la bomba, para comprimir el saco de sangre y de esta manera lograr la expulsión de la sangre por las válvulas mecánicas. El dispositivo, por ser extracorpóreo, puede ser sustituido quirúrgicamente en caso de avería del sistema, trombosis o infecciones. Al ser extracorpóreo, también permite su uso en pacientes de complexión pequeña, que no son candidatos ideales a asistencias intracorpóreas. Se requiere anticoagulación sistémica durante el tiempo que permanezca implantado el dispositivo.
Asistencias de flujo continuo
Los dispositivos de flujo continuo o no pulsátil se han desarrollado con el objetivo de asistir al ventrículo a mediano y/o a largo plazo. Estos sistemas de flujo no pulsátil o axial han demostrado algunas ventajas en contraste con los sistemas pulsátiles: menor tamaño, mayor eficiencia, menor incidencia de infecciones y de eventos tromboembólicos y menor coste17,18. La experiencia clínica inicial ha demostrado la buena tolerabilidad a largo plazo del sistema de flujo no pulsátil.
Bombas centrífugas
Estos dispositivos pueden utilizarse para asistencia del ventrículo izquierdo, el derecho o ambos. Utilizan un sistema de rodillos proporcionando un flujo no pulsátil. La inserción de bombas centrífugas requiere de una esternotomía, y si el paciente se encuentra inestable, la realización de bypass cardiopulmonar.
Existen varios inconvenientes con el uso de bombas centrífugas: la necesidad de anticoagulación sistémica, el tiempo limitado de uso, el desarrollo de edema intersticial debido al aumento de la permeabilidad capilar y la incapacidad de los pacientes para deambular o realizar ejercicios con el dispositivo implantado.
El uso de la membrana de oxigenación extracorpórea (extracorporeal membrane oxygenation [ECMO]) junto con una bomba centrífuga ha demostrado excelentes resultados como soporte de recién nacidos, lactantes y niños19. Esta asistencia es fácil de usar, se puede colocar rápidamente con anestesia local, se aplica a pacientes de todas las superficies corporales y pueden revertir la isquemia y la anoxia rápidamente.
El riesgo de hemólisis y de infecciones aumenta proporcionalmente a la duración de la asistencia ventricular.
DISPOSITIVOS INTRACORPÓREOS
HeartMate
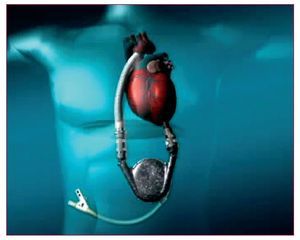
Se implanta en un bolsillo preperitoneal, anterior a la vaina posterior del recto del abdomen y justo por debajo del margen costal izquierdo (fig. 2). La cánula de entrada se conecta al ápex del ventrículo izquierdo y la cánula de salida se anastomosa a la aorta ascendente. Hay dos tipos de dispositivos HeartMate.
Fig. 2. HeartMate.
El neumático (implantable pneumatic LVAD [IPLVAD]) se alimenta y se controla desde una consola externa portátil de funcionamiento neumático. El eléctrico (vented electric LVAD [VE-LVAD]) contiene un motor eléctrico dentro de la bomba. Recibe alimentación externa y señales de control desde un microprocesador externo mediante un cable. Ambos sistemas poseen válvulas de origen porcino y la superficie de contacto con la sangre se cubre de una capa de seudoíntima. Esto se traduce en una muy baja incidencia de eventos tromboembólicos, por lo que los pacientes no requieren de anticoagulación sistémica. Cada vez son más los pacientes a los que se da el alta después de implantarles un HeartMate.
El principal inconveniente de los dispositivos de asistencia del ventrículo izquierdo es su gran tamaño y la necesidad de una conexión de alimentación eléctrica externa. El implante de un HeartMate es difícil en pacientes con una superficie corporal < 1,5 m2, debido a limitaciones anatómicas. Las principales complicaciones tempranas son la hemorragia y la insuficiencia cardiaca derecha. La incidencia de hemorragia perioperatoria es significativa. Los primeros informes demostraron un 50% de incidencia de reintervención quirúrgica por sangrado. Sin embargo, esa incidencia ha disminuido. Tras el implante de un dispositivo de asistencia ventricular izquierda, en un 20-30% de los pacientes se desarrolla disfunción ventricular derecha significativa refractaria al tratamiento farmacológico. Las infecciones siguen siendo una complicación común (30-50%) con el uso prolongado del dispositivo y es el mayor obstáculo para el éxito a largo plazo.
Novacor
El Novacor es un sistema eléctrico diseñado para soporte cardiaco a largo plazo. La bomba está construida de un saco de poliuretano, dentro del cual dos placas opuestas se mueven y generan el movimiento pulsátil de la sangre. Las conexiones de entrada y de salida están elaboradas de poliéster y selladas con una gelatina, y contienen válvulas bioprotésicas porcinas.
El Novacor tiene muchas semejanzas con el sistema HeartMate, como una consola externa portátil y un sistema de baterias portátiles como fuente de energía alternativa. Para implantar el dispositivo es necesario realizar una estereotomía. El conducto de entrada se coloca en el ápex del ventrículo izquierdo y el conducto de salida se anastomosa a la aorta ascendente.
La bomba se coloca en el abdomen y un cable de conexión eléctrica atraviesa la pared abdominal. Una consola externa o una unidad portátil regulan y controlan el sistema. El Novacor requiere de anticoagulación sistémica para prevenir tromboembolias. A pesar de la anticoagulación, el riesgo de complicaciones tromboembólicas con el Novacor sigue siendo elevado (20-25%). Esta complicación se ha reducido drásticamente (5-7%) con modificaciones en el diseño de la cánula de entrada. La incidencia de avería del dispositivo es muy rara20.
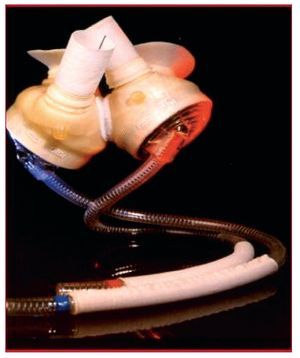
CardioWest, corazón artificial total
Actualmente es el único corazón artificial total aprobado por la FDA para su uso en Estados Unidos como dispositivo en investigación (fig. 3). Este dispositivo recibe impulso neumático y se implanta en posición ortotópica. La bomba en sí misma consta de una carcasa rígida que contiene dos cámaras esféricas de poliuretano. Ambas cámaras ventriculares se anastomosan a las aurículas innatas y los conductos de salida se anastomosan a los grandes vasos. Dos líneas de conducción neumática atraviesan la piel y se conectan a una consola que controla la presión y el rendimiento de la bomba. Son necesarios tratamiento antiplaquetario y anticoagulación sistémica. Este dispositivo se utiliza como puente al trasplante en pacientes con insuficiencia biventricular. La selección de los pacientes es importante, ya que la bomba no se ajusta a todos los casos. La superficie corporal es un criterio estricto para la selección de pacientes21,22. Las principales limitaciones son la falta de una unidad de control portátil y la necesidad de anticoagulación.
Fig. 3. CardioWest.
AbioCor, corazón artificial total
Es el primer corazón artificial totalmente implantable. Ha sido aprobado por la FDA como un nuevo dispositivo de investigación para probarlo en pacientes seleccionados23,24. El AbioCor consiste en una unidad torácica interna, una batería interna recargable, un dispositivo electrónico interno y baterías externas. La unidad torácica, de un peso aproximado de 1 kg, está equipada con un motor interno que es capaz de mover la sangre por los pulmones y el resto del cuerpo. El uso de transmisión de energía transcutánea elimina la necesidad de que el paciente esté inmovilizado permanentemente por tubos o cables conectados a una fuente de alimentación externa, por lo que es posible que se reduzca el riesgo de infecciones.
Dispositivos en ensayos clínicos
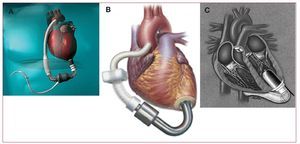
Algunos son el HeartMate II, el Micromed DeBakey VAD y el Jarvik 2000 (fig. 4). El Micromed DeBakey ya se ha implantado con éxito en un número reducido de pacientes en Europa25,26. El HeartMate II y el Jarvik 2000 también se han implantado con éxito en humanos27,28. En caso de avería del dispositivo, la única opción es el reemplazo. Además, debido a que estos dispositivos carecen de válvulas, si se produjera un fallo en su funcionamiento, el paciente podría tener el equivalente de una insuficiencia aórtica severa.
Fig. 4. Dispositivos de flujo continuo. A: HeartMate II. B: Micromed DeBakey VAD. C: Jarvik 2000.
La asistencia a corto plazo proporcionada por bombas centrífugas ha demostrado ser una forma segura y simple de apoyo cardiaco, con una incidencia de retirada del dispositivo del 50-60% y una sobrevida al alta hospitalaria de un 25-40%29-31. La utilización de dispositivos de corto plazo en pacientes de alto riesgo como puente al uso de dispositivos de largo plazo ha mostrado una sobrevida no significativamente diferente de la sobrevida observada con una asistencia a largo plazo32.
El trasplante se realiza con éxito en un 60-65% de los pacientes que recibieron un dispositivo a largo plazo. Entre el 28 y el 38% de los pacientes reciben el alta hospitalaria y son seguidos en forma ambulatoria33-35. Los pacientes con asistencias ventriculares izquierdas tienen una mejor sobrevida al trasplante que los pacientes que no recibieron asistencia mecánica36.
Los pacientes asistidos con un CardioWest tienen una sobrevida al trasplante del 75% y una sobrevida después del trasplante mayor que el 80%22,37-39. La experiencia con el uso de asistencias de flujo axial y con el AbioCor es aún limitada, pero los primeros resultados han mostrado seguridad, eficacia y fiabilidad24,40.
SELECCIÓN DE DISPOSITIVO
La selección del dispositivo no sólo depende de las características específicas de cada paciente y de la etiología de la insuficiencia cardiaca, sino también de las características del dispositivo, su disponibilidad y la experiencia del equipo quirúrgico15,41,42.
Los pacientes en shock cardiogénico severo tras cirugía cardiaca requieren soporte continuo para prevenir la disfunción permanente de los órganos y mejorar las posibilidades de sobrevida. Los dispositivos elegidos prefentemente son el Abiomed BVS 5000, el Thoratec y el ECMO. Éstos pueden proporcionar un soporte biventricular completo y restablecer los parámetros hemodinámicos mientras se espera la recuperación del miocardio. Si se considerara la posibilidad de soporte prolongado, debería optarse por la conversión a un dispositivo a largo plazo, utilizando una asistencia ventricular izquierda o un corazón artificial total. El Thoratec tiene la ventaja de ofrecer soporte extracorpóreo a largo plazo.
La selección de dispositivos a largo plazo es más complicada y frecuentemente la decisión se basa en la experiencia del cirujano. Para los pacientes de complexión pequeña (superficie corporal < 1,5 m2), el Thoratec o las asistencias de flujo continuo son las únicas opciones. Para los pacientes de mayor tamaño, todos los dispositivos son utilizables. Si bien las asistencias ventriculares izquierdas son utilizadas en estos casos, el CardioWest es también una opción válida para pacientes con insuficiencia biventricular severa.
CONCLUSIONES
Los sistemas de asistencia circulatoria mecánica han demostrado ser eficaces como terapia a corto plazo, como puente al trasplante y como soporte cardiaco permanente. La tecnología y los recursos humanos que se requieren para poner en marcha un programa de asistencia circulatoria mecánica son importantes limitaciones. Lamentablemente, esta tecnología se utiliza actualmente sólo en centros especializados.
El diseño de los dispositivos y su funcionamiento seguirán mejorando y sin duda serán más fiables, de menor complejidad para el paciente y menos costosos. Las próximas generaciones de dispositivos de asistencia mecánica brindarán mayores esperanzas para el creciente número de pacientes con insuficiencia cardiaca en fase terminal, independientemente de su elegibilidad para el trasplante.
Correspondencia: Dr. D.H. Delgado.
NCSB, 11C-1201. 585 University Avenue. Toronto, ON. Canada M5G2N2. Correo electrónico: Diego.Delgado@uhn.on.ca