Analizar la cinética de la enolasa neuroespecífica (EN) como biomarcador de pronóstico neurológico de los pacientes que sobreviven a una parada cardiaca tratados con control de temperatura.
MétodosAnálisis retrospectivo de pacientes ingresados tras sufrir una parada cardiaca dentro o fuera del hospital entre septiembre de 2006 y mayo de 2018 en un centro terciario y enfriados a 32-34°C durante 24 h. Las muestras de EN se tomaron al ingreso hospitalario y a las 24, 48 y 72 h del retorno a circulación espontánea (RCE). El estado neurológico se evaluó a los 3 meses mediante la escala Cerebral Performance Category (CPC) y se categorizó como favorable (CPC 1-2) o desfavorable (CPC 3-5).
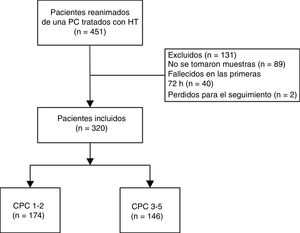
ResultadosDe los 451 pacientes, 320 cumplían los criterios de inclusión (el 80,3% varones; media de edad, 61±14,1 años). De estos, 174 (54,4%) sobrevivieron con una evolución neurológica favorable. Los pacientes con estado neurológico desfavorable tenían valores de EN más altos al ingreso hospitalario y a las 24, 48 y 72 h del RCE. A las 48 y las 72 h, los valores de EN predijeron un estado neurológico desfavorable, con áreas bajo la curva de 0,85 (IC95%, 0,81-0,90) y 0,88 (IC95%, 0,83-0,93). Además, el área bajo la curva de los valores delta de EN entre las 72 h y el ingreso hospitalario fue de 0,90 (IC95%, 0,85-0,95), y en el análisis multivariante resultó predictor independiente (p <0,001).
ConclusionesEn pacientes que sobrevivieron a una parada cardiaca tratados con control de la temperatura, se ha demostrado que los valores delta de EN entre las 72 h del RCE y el ingreso hospitalario son un potente predictor de resultado neurológico desfavorable.
Palabras clave
La parada cardiaca (PC) es una de las principales causas de mortalidad en el mundo desarrollado, con una incidencia de casi 556.000 personas al año en Estados Unidos1. A pesar de que la mayoría de las muertes por PC se producen antes o durante las maniobras de reanimación cardiopulmonar, un porcentaje significativo sobreviene a pacientes reanimados con éxito que después ingresan en una unidad de cuidados intensivos. En este subgrupo de pacientes, la mortalidad inicial es, en su mayor parte, secundaria a la inestabilidad hemodinámica, mientras que el daño neurológico explica la mayoría de las muertes tardías. Además, la limitación de tratamientos de soporte vital (LTSV) basada en un pronóstico neurológico desfavorable supone la principal causa de mortalidad en este subgrupo2,3. Así pues, el pronóstico neurológico sigue siendo un reto clínico significativo en los cuidados tras la reanimación y la vigente guía de práctica clínica recomienda abordarlo mediante una estrategia multimodal que incluye una exploración clínica neurológica, estudios electrofisiológicos (potenciales evocados somatosensoriales y electroencefalograma), técnicas de neuroimagen y biomarcadores, como la enolasa neuroespecífica (EN)4.
La EN es una enzima glucolítica que interviene en el metabolismo de la glucosa y se halla principalmente en las células neuronales y neuroendocrinas. Las concentraciones séricas de esta enzima no se ven afectadas por la hipotermia terapéutica y mantienen una correlación positiva tanto con la extensión del daño neurológico anóxico-isquémico como con patrones malignos del electroencefalograma después de una PC5,6. Un estudio prospectivo realizado antes de que se generalizara el control de temperatura objetivo publicó que una concentración sérica de EN> 33 μg/l en los primeros 3 días tras una PC era un potente predictor de un resultado neurológico desfavorable (tasa de falsos positivos [TFP] del 0%)7. Acto seguido, la American Academy of Neurology introdujo este valor de corte en su guía de 20068. Sin embargo, los resultados fueron más variables en estudios posteriores, que repetidamente informaron de unas TFP elevadas cuando se aplicaba este punto de corte a pacientes tratados y no tratados con control de temperatura9-11. Por estos motivos, y teniendo en cuenta la dificultad de establecer un umbral de EN consistente para identificar con precisión a pacientes en riesgo de un resultado neurológico desfavorable, la vigente guía de práctica clínica no recomienda ningún umbral de EN específico. En cambio, recomienda analizarla en múltiples momentos con el objetivo de determinar la evolución temporal de sus valores y reducir el riesgo de falsos positivos secundarios a hemolisis4. Aunque la evolución de los valores séricos de EN podría ser más exacta que las determinaciones aisladas, todavía hay incertidumbre con respecto a su interpretación, su secuencia temporal y la estrategia óptima5.
Desde 2009 se incluyó dentro del protocolo de cuidados tras una PC de nuestra unidad de cuidados agudos cardiológicos (UCAC) la estimación de los valores de EN al ingreso hospitalario y diariamente durante las primeras 72 h de hospitalización. El presente estudio se propone analizar la cinética de la EN y su correlación con el pronóstico neurológico de los pacientes supervivientes a una PC tratados con control de temperatura en nuestra UCAC.
MÉTODOSSe efectuó un análisis retrospectivo de un registro prospectivo de pacientes consecutivos que sobrevivieron a una PC tratados con control de temperatura en la UCAC de un hospital terciario entre septiembre de 2006 y mayo de 2018. La población del estudio incluye a los pacientes que sufrieron una PC dentro o fuera del hospital, con sospecha de origen cardiaco e independientemente del ritmo inicial, y fueron enfriados a 32-34°C durante 24 h, como se ha indicado previamente12. La elección de los pacientes estaba condicionada por la confirmación tanto de la persistencia del coma después del RCE como de la ausencia de contraindicaciones para la hipotermia terapéutica. Se incluyó únicamente a los pacientes de los que se disponía de al menos una determinación de EN sérica durante su hospitalización en la UCAC y que no hubieran fallecido en las primeras 72 h de ingreso. El comité de ética del hospital (PI-3328) aprobó el protocolo del presente estudio.
El protocolo de control de temperatura de este centro hospitalario consistía en implantar un catéter endovascular o un dispositivo de enfriamiento de superficie con retroalimentación automática de la temperatura y enfriar a los pacientes a una temperatura objetivo de 32-34°C durante 24 h. El recalentamiento se realizó a una velocidad estable de 0,1-0,2°C/h hasta alcanzar la normotermia (36,5-37°C) y se vigiló continuamente la temperatura corporal mediante una sonda vesical. Todos los pacientes recibieron ventilación mecánica y sedación con infusión intravenosa de midazolam ajustada conforme a la monitorización continua del índice biespectral (BIS, por sus siglas en inglés). Se procedió a la relajación muscular con infusión continua de cisatracurio hasta finalizar el recalentamiento. Ante la sospecha de síndrome coronario agudo como causa subyacente de la PC, se realizó una coronariografía en el laboratorio de hemodinámica, que está disponible las 24 h todos los días.
Se extrajeron muestras de sangre para la medición de la EN al ingreso hospitalario y a diario durante las primeras 72 h de hospitalización. Dichas muestras se procesaron sistemáticamente en el Servicio de Análisis Clínicos del hospital y se analizó la concentración sérica de EN por electroquimioluminiscencia en un analizador Cobas e411 (Roche Diagnostics). La amplitud de medida oscilaba entre 0,05 y 370 ng/ml, con un coeficiente de variación de precisión entre días <4,4% y un intervalo de referencia biológica <16,3 ng/ml. Se descartaron del análisis todas las muestras con hemolisis visible con el fin de evitar un falso incremento de los valores.
Una vez que los pacientes alcanzaban la normotermia y se retiraba la sedación y la relajación muscular, se les practicaba una exploración neurológica, seguida de un electroencefalograma (EEG) cuando no se registraba ninguna respuesta documentada a órdenes simples, además de considerar los valores de la monitorización del BIS. Se realizó una tomografía computarizada craneal complementaria siempre que así lo indicaran los cardiólogos clínicos que trataban al paciente. Tras 1 semana de hospitalización, si el paciente permanecía en coma, se llevaba a cabo un segundo EEG. En ese momento, a partir de las exploraciones neurológicas, los marcadores bioquímicos y los hallazgos de los EEG y las técnicas de neuroimagen, un equipo multidisciplinario determinaba la LTSV, siempre con el consentimiento de los representantes del paciente.
El objetivo primario del estudio fue el mejor estado neurológico alcanzado a los 3 meses tras la PC, establecido conforme a la puntuación de la escala Glasgow-Pittsburgh Cerebral Performance Categories (CPC) y categorizado como favorable (CPC 1-2) o desfavorable (CPC 3-5). La puntuación 3-5 de la escala CPC equivalía a discapacidad grave, estado vegetativo o muerte. Se evaluó la evolución neurológica del paciente de manera retrospectiva a partir de los datos obtenidos del seguimiento médico sistemático posterior a la PC o mediante entrevistas telefónicas con el paciente o sus familiares.
Análisis estadísticoLas variables continuas se presentan como media±desviación estándar y se compararon mediante la prueba de la t de Student para los valores de distribución normal. Las demás variables se resumen con la mediana [intervalo intercuartílico], y las diferencias se analizaron con la prueba de la U de Mann-Whitney. Se empleó la prueba exacta de Fisher para la comparación de proporciones. Se determinó la potencia discriminatoria de la EN para predecir el resultado neurológico desfavorable mediante el análisis de las curvas ROC (receiver-operating characteristics). Se facilitaron además diferentes umbrales de EN para el estado neurológico desfavorable como solución de equilibrio entre sensibilidad y especificidad al potenciar el índice de Youden (definido como sensibilidad+especificidad – 1) y aportando entre el 95 y el 100% de especificidad.
Se efectuó el análisis multivariante empleando el método escalonado de regresión logística. Todas las variables que demostraron significación estadística en el análisis univariante se seleccionaron como variables candidatas para el modelo predictivo. Con el objeto de evitar la colinealidad, la variable candidata seleccionada fue el parámetro con el área bajo la curva de las determinaciones de EN más alta (valor delta de EN entre las 72 h del RCE y el ingreso hospitalario). Los resultados expresan las odds ratio (OR) y sus intervalos de confianza del 95% (IC95%). Se empleó la prueba de Hosmer-Lemeshow para establecer la bondad del ajuste del modelo. Se evaluó la potencia predictiva complementaria que aportaba el valor delta de EN mediante el índice de reclasificación neta (net reclassification index [NRI]) y la mejora de discriminación integrada (MDI).
Se comparó este modelo con otros que incluían distintos valores absolutos o delta de EN. Los datos omitidos se excluyeron del análisis de todos los modelos mediante la eliminación por lista. La significación estadística se fijó en un valor de p <0,05. Los análisis estadísticos se ejecutaron en el paquete estadístico Stata, versión 14.2 (StataCorp LLC; College Station, Texas, Estados Unidos).
RESULTADOSCaracterísticas clínicasDurante el periodo de estudio, se ingresó en esta UCAC a 451 pacientes consecutivos que sobrevivieron a una PC hospitalaria o extrahospitalaria tratados con control de temperatura. De estos, se excluyó a 89 pacientes debido a la ausencia de determinaciones de EN durante el ingreso. Los pacientes excluidos pertenecían principalmente a la fase inicial del registro, que tuvo lugar entre 2006 y 2009, cuando los análisis de la EN no formaban parte del protocolo tras la reanimación. Además, 40 pacientes fallecieron en las primeras 72 h y se perdió a 2 pacientes para el seguimiento. Finalmente, se incluyó a 320 pacientes en el análisis estadístico definitivo (figura 1).
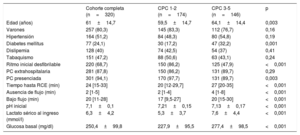
La media de edad de la cohorte era 61±14,1 años y el 80,2% eran varones. En su conjunto, 281 pacientes (87,8%) sufrieron una PC extrahospitalaria y 220 (68,7%) presentaban un ritmo inicial desfibrilable (taquicardia ventricular sin pulso o fibrilación ventricular). De conformidad con la escala CPC, a los 3 meses de seguimiento se asignó a 174 pacientes (54,4%) al grupo de evolución neurológica favorable (CPC 1-2) frente a los 146 (45,6%) en el grupo de estado neurológico desfavorable (CPC 3-5). En este se asignó CPC 3 a 9 pacientes, CPC 4 a 1 paciente y CPC 5 a 136. El grupo de evolución neurológica favorable resultó ser más joven, presentaba tiempos de RCE más cortos (incluidos los tiempos de ausencia de flujo y bajo flujo) y porcentajes más altos de ritmo inicial desfibrilable, junto con valores de pH, lactato sérico y glucosa menos alterados al ingreso hospitalario. Las características clínicas de la cohorte incluida en el estudio y conforme a la escala CPC se muestran en la tabla 1.
Características clínicas y de laboratorio del conjunto de la cohorte y estratificadas según su resultado neurológico
| Cohorte completa (n=320) | CPC 1-2 (n=174) | CPC 3-5 (n=146) | p | |
|---|---|---|---|---|
| Edad (años) | 61±14,7 | 59,5±14,7 | 64,1±14,4 | 0,003 |
| Varones | 257 (80,3) | 145 (83,3) | 112 (76,7) | 0,16 |
| Hipertensión | 164 (51,2) | 84 (48,3) | 80 (54,8) | 0,19 |
| Diabetes mellitus | 77 (24,1) | 30 (17,2) | 47 (32,2) | 0,001 |
| Dislipemia | 128 (40) | 74 (42,5) | 54 (37) | 0,41 |
| Tabaquismo | 151 (47,2) | 88 (50,6) | 63 (43,1) | 0,24 |
| Ritmo inicial desfibrilable | 220 (68,7) | 150 (86,2) | 125 (47,9) | <0,001 |
| PC extrahospitalaria | 281 (87,8) | 150 (86,2) | 131 (89,7) | 0,29 |
| PC presenciada | 301 (94,1) | 170 (97,7) | 131 (89,7) | 0,003 |
| Tiempo hasta RCE (min) | 24 [15-33] | 20 [12-29,7] | 27 [20-35] | <0,001 |
| Ausencia de flujo (min) | 2 [1-5] | 2 [1-4] | 4 [1-8] | <0,001 |
| Bajo flujo (min) | 20 [11-28] | 17 [9,5-27] | 20 [15-30] | <0,001 |
| pH inicial | 7,1±0,1 | 7,21±0,15 | 7,13±0,17 | <0,001 |
| Lactato sérico al ingreso (mmol/l) | 6,3±4,2 | 5,3±3,7 | 7,6±4,4 | <0,001 |
| Glucosa basal (mg/dl) | 250,4±99,8 | 227,9±95,5 | 277,4±98,5 | <0,001 |
CPC: Cerebral Performance Category; PC: parada cardiaca; RCE: retorno a circulación espontánea.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
Se disponía de determinaciones de EN de 202 pacientes al ingreso hospitalario, de 289 pacientes el primer día de ingreso, de 287 el segundo y de 223 el tercero. Igualmente, se encontraban disponibles los valores delta de EN de 195 pacientes entre el ingreso hospitalario y el primer día, de 192 entre el ingreso y el segundo día, y de 152 entre el ingreso y el tercer día. Los pacientes cuyos valores delta de EN entre el ingreso y el tercer día no estaban disponibles mostraban características basales semejantes, a excepción de un mayor porcentaje de ritmo inicial no desfibrilable (el 38,1 frente al 23,6%; p=0,006) y valores de pH más bajos al ingreso (7,15 frente a 7,19; p=0,028). Asimismo, sus valores de EN fueron significativamente más altos tanto a las 24 h (77,2 frente a 50,8 ng/ml; p <0,001) como a las 48 h del RCE (98,2 frente a 63,9 ng/ml; p <0,001), y mostraban un mayor porcentaje de puntuaciones CPC 3-5 a los 3 meses (el 53 frente al 37,5%; p=0,007). Por el contrario, los pacientes carentes de determinación de EN alguna durante el ingreso en la UCAC presentaban porcentajes de PC hospitalaria más altos (el 22,4 frente al 12,9%; p=0,015) con tendencia a una PC no presenciada (el 12,3 frente al 6,6%; p=0,052) y ritmo inicial no desfibrilable (el 38,2 frente al 31,7%; p=0,154) respecto a los pacientes con al menos una determinación disponible. De hecho, estos pacientes presentaban un peor estado neurológico a los 3 meses de seguimiento (CPC 3-5, el 65,8 frente al 51,3%; p=0,033).
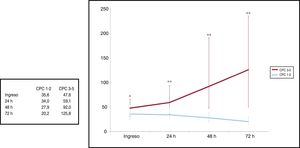
Valores de enolasa neuroespecífica y predicción de resultado neurológico desfavorableLa mediana de los valores de EN de los pacientes con puntuaciones CPC 1-2 fue significativamente más baja al ingreso que la de los pacientes con CPC 3-5: 35,6 [23,5-54,6] frente a 47,6 ng/ml [29,5-64,1]; p=0,032); a las 24 h, 34,0 [25,6-48,6] frente a 59,1 ng/ml [35,5-94,0]; p <0,001); a las 48 h, 27,9 [20-38,5] frente a 92,0 ng/ml [47,9-190,7]; p <0,001); y a las 72 h del RCE, 20,2 [14,8-30,2] frente a 125,8 ng/ml [45,9-235,3]; p <0,001) (figura 2).
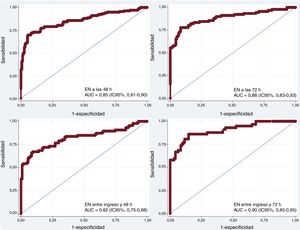
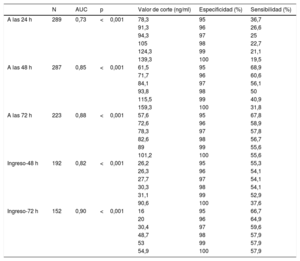
Las áreas bajo la curva (AUC) de la EN a las 24, 48 y 72 h del RCE para el pronóstico del estado neurológico fueron 0,73 (IC95%, 0,67-0,79), 0,85 (IC95%, 0,81-0,90) y 0,88 (IC95%, 0,83-0,93) respectivamente (p <0,001). Según el índice de Youden (sensibilidad+especificidad – 1), los valores de corte de EN óptimos como predictores de resultado neurológico desfavorable fueron 65,7 ng/ml el primer día (especificidad, 90,7% [IC95%, 85,2-94,3]; sensibilidad, 45,3% [IC95%, 37-53,9]), 57,7 ng/ml el segundo día (especificidad, 94,2% [IC95%, 89,3-96,9]; sensibilidad, 69,7% [IC95%, 61,4-79,6]) y 45,5 ng/ml el tercer día tras el RCE (especificidad, 91,7% [IC95%, 85,8-95,3]; sensibilidad, 77,8% [IC95%, 68,2-85,1]). Los valores de corte resultantes del 95-100% de especificidad a la hora de predecir el resultado neurológico desfavorable se muestran en la tabla 2.
Valores de corte de la enolasa neuroespecífica resultantes del 95-100% de especificidad al predecir el resultado neurológico desfavorable
| N | AUC | p | Valor de corte (ng/ml) | Especificidad (%) | Sensibilidad (%) | |
|---|---|---|---|---|---|---|
| A las 24 h | 289 | 0,73 | <0,001 | 78,3 | 95 | 36,7 |
| 91,3 | 96 | 26,6 | ||||
| 94,3 | 97 | 25 | ||||
| 105 | 98 | 22,7 | ||||
| 124,3 | 99 | 21,1 | ||||
| 139,3 | 100 | 19,5 | ||||
| A las 48 h | 287 | 0,85 | <0,001 | 61,5 | 95 | 68,9 |
| 71,7 | 96 | 60,6 | ||||
| 84,1 | 97 | 56,1 | ||||
| 93,8 | 98 | 50 | ||||
| 115,5 | 99 | 40,9 | ||||
| 159,3 | 100 | 31,8 | ||||
| A las 72 h | 223 | 0,88 | <0,001 | 57,6 | 95 | 67,8 |
| 72,6 | 96 | 58,9 | ||||
| 78,3 | 97 | 57,8 | ||||
| 82,6 | 98 | 56,7 | ||||
| 89 | 99 | 55,6 | ||||
| 101,2 | 100 | 55,6 | ||||
| Ingreso-48 h | 192 | 0,82 | <0,001 | 26,2 | 95 | 55,3 |
| 26,3 | 96 | 54,1 | ||||
| 27,7 | 97 | 54,1 | ||||
| 30,3 | 98 | 54,1 | ||||
| 31,1 | 99 | 52,9 | ||||
| 90,6 | 100 | 37,6 | ||||
| Ingreso-72 h | 152 | 0,90 | <0,001 | 16 | 95 | 66,7 |
| 20 | 96 | 64,9 | ||||
| 30,4 | 97 | 59,6 | ||||
| 48,7 | 98 | 57,9 | ||||
| 53 | 99 | 57,9 | ||||
| 54,9 | 100 | 57,9 |
AUC: área bajo la curva.
Además se evaluaron distintos valores delta de EN a fin de estimar su capacidad de discriminación predictiva de estado neurológico desfavorable (figura 3). De estos, los valores delta de EN entre el segundo día y el ingreso hospitalario y entre el tercer día y el ingreso hospitalario mostraron el AUC más alta, de 0,82 (IC95%, 0,75-0,88) y 0,90 (IC95%, 0,85-0,95) respectivamente (p <0,001). Los valores de corte óptimos según el índice de Youden fueron de+8,2 ng/ml entre el segundo día y el ingreso hospitalario (especificidad, 90,7% [IC95%, 83,6-94,8]; sensibilidad, 67,1% [IC95%, 56,5-76,1]) y –1,4 ng/ml entre el tercer día y el ingreso (especificidad, 85,3% [IC95%, 76,8-91]; sensibilidad, 86% [IC95%, 74,7-92,7]). Los valores de corte con un 100% de especificidad para un pronóstico neurológico desfavorable se situaron en+90,6 ng/ml (sensibilidad, 37,6%; TPF, 0%) entre y el segundo día y el ingreso y+54,9 ng/ml (sensibilidad, 57,9%; TPF, 0%) entre el tercer día y el ingreso (tabla 2).
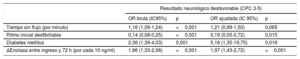
El modelo predictivo elegido, que emplea el método escalonado de regresión logística, se presenta en la tabla 3. Las variables que se asociaron de manera independiente a un estado neurológico desfavorable resultaron ser la diabetes mellitus (OR=5,16; IC95%, 1,35-19,75), el ritmo inicial de PC (ritmo inicial desfibrilable, OR=0,19; IC95%, 0,05-0,72) y el valor delta de EN entre las 72 h del RCE y el ingreso hospitalario (por cada 10 ng/ml, OR=1,97; IC95%, 1,43-2,72). Además, la variable tiempo sin flujo mostraba tendencia a un pronóstico desfavorable, pero no alcanzó la significación estadística (por minuto, OR=1,21; IC95%, 0,99-1,50). Se diseñó una curva ROC (AUC de 0,94; IC95%, 0,89-0,97) y se calcularon la sensibilidad (77,5%) y la especificidad (94,1%) para el modelo predictivo, con una TFP del 5,9%. Este modelo demostró una buena calibración conforme a la validación efectuada mediante la prueba de bondad de ajuste de Hosmer-Lemeshow (p=0,62). El valor delta de EN presentó un NRI de 1,40 (p <0,001) y una MDI de 0,39 (p <0,001). Cuando este parámetro individual se excluyó del modelo multivariante, se observó un descenso significativo del AUC (0,78; IC95%, 0,71-0,86; p <0,001). Además, el modelo elegido demostró un mejor rendimiento que otros modelos alternativos que incluían la EN como variable dicotómica con diferentes umbrales para la predicción de resultado desfavorable con una especificidad del 100% a las 72 h del RCE, delta entre las 48 h del RCE y el ingreso y delta entre las 72 h del RCE y el ingreso hospitalario (figura 4).
Variables que se asocian de manera independiente con un resultado desfavorable a los 3 meses de una PC*
| Resultado neurológico desfavorable (CPC 3-5) | ||||
|---|---|---|---|---|
| OR bruta (IC95%) | p | OR ajustada (IC 95%) | p | |
| Tiempo sin flujo (por minuto) | 1,16 (1,09-1,24) | <0,001 | 1,21 (0,99-1,50) | 0,065 |
| Ritmo inicial desfibrilable | 0,14 (0,08-0,25) | <0,001 | 0,19 (0,05-0,72) | 0,015 |
| Diabetes mellitus | 2,36 (1,39-4,03) | 0,001 | 5,16 (1,35-19,75) | 0,016 |
| ΔEnolasa entre ingreso y 72 h (por cada 10 ng/ml) | 1,66 (1,33-2,06) | <0,001 | 1,97 (1,43-2,72) | <0,001 |
CPC: Cerebral Performance Category; IC95%: intervalo de confianza del 95%; OR: odds ratio; PC: parada cardiaca.
Curvas receiver operating characteristic para los distintos modelos propuestos de pronóstico neurológico desfavorable. Entre los distintos modelos, el que incluía el valor delta de enolasa neuroespecífica entre las 72 h y el ingreso hospitalario muestra el área bajo la curva más alta (0,94; intervalo de confianza del 95%, 0,89-0,97; p=0,02).
El presente estudio describe la cinética de la EN durante los primeros días tras una PC en pacientes tratados con control de temperatura y analiza su correlación con el estado neurológico a los 3 meses. A pesar de que este biomarcador es una herramienta complementaria simple y accesible para el pronóstico neurológico, cuyas concentraciones no se ven afectadas por la sedación o el control de temperatura, además de su coste relativamente bajo, la EN como marcador de pronóstico neurológico está infrautilizada en la práctica clínica habitual13. Es probable que esta situación sea el reflejo tanto de las limitaciones técnicas como de los resultados inconclusos de los estudios previos, hecho que se explica tanto por el reducido tamaño muestral como por la falta de estándares de las técnicas de medición14,15. Los umbrales de EN como predictor de resultado neurológico desfavorable con un 0% de TFP oscilan en los artículos publicados entre los 25,0 y 151,5 ng/ml a las 48 h y entre los 57,2 y 78,9 ng/ml a las 72 h del RCE en pacientes tratados con control de temperatura4. Aunque la presente cohorte mostraba valores séricos de EN desde el ingreso hospitalario en el grupo de CPC 3-5 significativamente más altos que en el de CPC 1-2, estos valores reflejan una amplia variabilidad, especialmente en el grupo con estado neurológico desfavorable, lo que deja traslucir, al menos en parte, el reto que supone el intento de generalizar un valor de corte de este biomarcador con una alta especificidad y estrechos intervalos de confianza (figura 2). En línea con los hallazgos de otros trabajos6,16, el presente estudio identificó la mejor estrategia de empleo aislado de EN cuando las determinaciones se extraen a las 48 y las 72 h del RCE, con AUC de 0,85 y 0,88. Por el contrario, la capacidad predictora de la EN al ingreso y a las 24 h del RCE fue significativamente menor (AUC de 0,62 y 0,73 respectivamente).
La figura 2 también muestra la evolución temporal ascendente de los valores de EN del grupo CPC 3-5 comparados con los de evolución descendente del grupo CPC 1-2. La mayoría de las guías de práctica clínica actuales4,17 todavía consideran una laguna científica la escasa información disponible sobre la cinética de la EN en los primeros días tras una PC y, por ende, un obstáculo a la hora de determinar su utilidad como biomarcador pronóstico. Puesto que la determinación de EN ha formado parte de nuestro protocolo durante 9 años y se ha cuantificado a diario entre el ingreso y las 72 h del RCE, la fortaleza de este estudio radica en caracterizar la cinética de la EN en una amplia cohorte de pacientes que sobrevivieron a una PC tratados con control de temperatura y analizar su asociación con la mejor puntuación en la escala CPC a los 3 meses. Asimismo, todas las muestras de sangre de la cohorte se analizaron en el mismo laboratorio, lo que reduce la variación entre diferentes métodos analíticos. Debido a que la semivida estimada de la EN en suero es de 24 h aproximadamente18, la tendencia al alza de sus valores séricos puede explicarse por el daño cerebral hipóxico activo y la liberación continua de células neuronales necrosadas que se observa en los pacientes con pronóstico neurológico desfavorable19.
En nuestra cohorte, los valores delta de EN entre las 72 h del RCE y el ingreso hospitalario presentaron el AUC más alta y el punto de corte de+55 ng/ml presenta el 100% de especificidad para un resultado neurológico desfavorable. Además, se integraron también los valores delta de EN sérica en un modelo multivariable, donde cada incremento de EN de 10 ng/ml entre el ingreso hospitalario y el tercer día muestra OR=1,97 (IC95%, 1,43-2,72) para un resultado neurológico desfavorable. Aunque en este modelo no se incluyeron otras variables, como los potenciales evocados somatosensoriales, la exploración clínica o los registros electroencefalográficos, su AUC (0,94; IC95%, 0,89-0,97) resultó más alta que el área de los modelos propuestos en otras publicaciones que empleaban esta estrategia multimodal. Por ejemplo, el modelo predictivo propuesto por Oddo y Rossetti20, partiendo de una cohorte prospectiva de 134 pacientes, que incluía las variables de exploración clínica, EEG, determinaciones aisladas de EN y potenciales evocados somatosensoriales, presentó un AUC de 0,88 (IC95%, 0,82-0,93) para un resultado neurológico desfavorable (CPC 3-5) a los 3 meses de seguimiento. Esta exactitud pronóstica similar, si se compara con las determinaciones aisladas de EN a las 72 h del RCE y los valores delta de EN entre las 72 h del RCE y el ingreso hospitalario del presente estudio, ratifica el papel de la EN como biomarcador de pronóstico neurológico en pacientes que sobreviven a una PC. Sin embargo, la EN no es un marcador específico de daño neuronal, debido a que está presente en otros procesos ajenos al sistema nervioso central (hemolisis, tumores neuroendocrinos y alteraciones del plexo mientérico, músculo y tejido adiposo)17, y en sus valores influyen la edad, el sexo y el índice de masa corporal21. Por estos motivos, y en consonancia con las actuales guías y los estudios recientes6,19,22, los autores recomendamos la inclusión de la cinética de la EN dentro de una estrategia multimodal sustentada en la integración de varios métodos con el objetivo de aumentar su valor predictivo y facilitar la identificación de los pacientes con un pronóstico neurológico desfavorable.
Este estudio presenta ciertas limitaciones debido a su naturaleza retrospectiva. En primer lugar, se excluyó del análisis a un número de pacientes sustancial, bien por la falta de muestras de EN durante su ingreso o porque sus muestras mostraban hemolisis. El número de pacientes excluidos resultó ser superior debido a la ausencia de determinaciones de EN al ingreso hospitalario o a las 72 h del RCE, probablemente por la dificultad de solicitar este biomarcador en el contexto de un ingreso hospitalario tras una PC y por un posible sesgo de selección, a la vista de que las características de la PC y el pronóstico neurológico de estos pacientes eran peores. En segundo lugar, los valores séricos de EN estuvieron disponibles en su mayoría en el momento del pronóstico neurológico, lo que con probabilidad influyó en la toma de decisiones sobre la LTSV. En tercer lugar, no se pudo incluir en este modelo predictivo ciertas variables como los registros electroencefalográficos, los potenciales evocados somatosensoriales, la exploración clínica o los hallazgos de las técnicas de neuroimagen. Sin embargo, consideramos que los resultados del presente estudio representan la práctica diaria actual de un centro terciario de referencia en los cuidados posteriores a una PC, cuyo registro incluía una numerosa cohorte de pacientes en comparación con otros estudios. El valor de corte delta de EN+55 ng/ml entre el ingreso hospitalario y las 72 h del RCE para un resultado neurológico desfavorable debe evaluarse y validarse en una cohorte prospectiva externa antes de su implantación en la práctica actual.
CONCLUSIONESEl presente estudio demuestra que el valor delta de EN entre el ingreso hospitalario y las 72 h del RCE tiene un alto valor predictivo de resultado neurológico desfavorable. Los resultados del estudio respaldan la idea de que las mediciones de EN seriadas en lugar de aisladas deberían incluirse en una estrategia multimodal de pronóstico neurológico tras una PC. El valor de corte delta de EN+55 ng/ml entre las 72 h del RCE y el ingreso hospitalario de esta cohorte presentó el 100% de especificidad para el resultado neurológico desfavorable a los 3 meses de seguimiento.
FINANCIACIÓNEste estudio está financiado por la Sección de Cardiopatía Isquémica y Cuidados Agudos Cardiovasculares de la Sociedad Española de Cardiología. Beca para la Formación e Investigación en Cuidados Agudos Cardiovasculares concedida por la Sección de Cardiopatía Isquémica y Cuidados Agudos Cardiovasculares de la Sociedad Española de Cardiología.
CONFLICTO DE INTERESESNo se declara ninguno.
- –
Un porcentaje significativo de muertes por PC sobreviene a pacientes ingresados en unidades de cuidados intensivos. La LTSV basada en un pronóstico neurológico desfavorable representa la principal causa de fallecimiento en estos pacientes.
- –
Las guías actuales recomiendan que la evaluación del pronóstico neurológico tras una PC se sustente en una estrategia multimodal que incluya biomarcadores como la EN.
- –
Las actuales guías no recomiendan ningún valor de corte de EN específico para establecer un pronóstico neurológico desfavorable, sino que recomiendan el muestreo de esta enzima en múltiples momentos con el objetivo de identificar la evolución de los valores y reducir el riesgo de resultados falsamente altos por hemolisis. Sin embargo, el mejor modo de interpretar la evolución temporal de estos valores aún es incierto.
- –
Puesto que la determinación de EN ha formado parte de nuestro protocolo de tratamiento tras una PC durante 9 años y se ha cuantificado a diario entre el ingreso hospitalario y las 72 h del RCE, la fortaleza de este estudio radica en caracterizar la cinética de la EN en una amplia cohorte de pacientes que sobrevivieron a una PC tratados con control de temperatura y valorar su asociación con la mejor puntuación en la escala CPC a los 3 meses de la PC.