Este estudio compara los resultados clínicos a largo plazo de pacientes tratados con stents liberadores de paclitaxel o de everolimus en el infarto agudo de miocardio con elevación del segmento ST, así como la influencia de la trombectomía.
MétodosEl ESTROFA-IM es un registro, en 16 centros, retrospectivo de pacientes consecutivos con infarto agudo de miocardio con elevación del segmento ST tratados con stents de paclitaxel o everolimus. Se realizó análisis de emparejamiento por propensión de tratamiento para seleccionar grupos comparables tanto para el modelo de stent como para uso de trombectomía.
ResultadosDespués del emparejamiento, se incluyó en el análisis a 350 pacientes tratados con stents de paclitaxel y 350 con stents de everolimus. Las características clínicas y angiográficas eran comparables. La incidencia a 2 años de muerte, infarto y revascularización de la lesión tratada fue del 14,9% del grupo de paclitaxel y el 11,5% del de everolimus (p = 0,04) y la incidencia de trombosis definitiva/probable, del 4,3 y el 1,4% (p = 0,01). El stent de paclitaxel fue un predictor independiente de eventos ((hazard ratio = 2,44, intervalo de confianza del 95%, 1,28-4,65; p = 0,006). El beneficio de los stents de everolimus respecto a la trombosis de stent fue más evidente en el grupo sin trombectomía (el 5,4 frente al 1,4%; p = 0,01).). Se detectó una interacción significativa en los subgrupos según trombectomía para el objetivo de trombosis de stent (p = 0,039).
ConclusionesEstos resultados indican mejor evolución clínica con los stents de everolimus en el infarto agudo de miocardio con elevación del segmento ST. El menor riesgo de trombosis con estos stents podría ser más relevante en ausencia de trombectomía.
Palabras clave
La angioplastia primaria en el infarto agudo de miocardio con elevación del segmento ST (IAMCEST) es la estrategia de reperfusión óptima1. La seguridad de los stents liberadores de fármacos (SLF) en este contexto se puso en duda inicialmente tras la aparición de los resultados de algunos registros grandes2–4 y un estudio anatomopatológico que mostró un retraso en la cobertura intimal de los SLF implantados en la lesión origen del IAMCEST en en comparación con los tratados con SLF por una angina estable5.
Sin embargo, en ensayos aleatorizados y en un amplio metanálisis, se ha puesto de relieve que el uso de SLF se asocia a una reducción de la necesidad de nuevas intervenciones de revascularización, mientras que la incidencia de trombosis tardía no parece aumentar respecto a la de los stents metálicos sin recubrimiento6–10. No obstante, la evidencia existente procede sobre todo de estudios llevados a cabo con SLF de primera generación, en especial los stents liberadores de paclitaxel (SLP)8. Un metanálisis publicado recientemente ha puesto de manifiesto que el efecto beneficioso temprano de los SLF de primera generación en la angioplastia primaria del IAMCEST se ve contrarrestado por un aumento del riesgo de trombosis de stent muy tardía11.
Los SLF de segunda generación y principalmente los stents liberadores de everolimus (SLE) han mostrado más eficacia y seguridad que los SLP, tanto en ensayos clínicos como en registros amplios12–15. Se ha comparado los SLE con los stents metálicos sin recubrimiento y con los stents liberadores de sirolimus en ensayos sobre IAMCEST, y parecen indicar que los SLE tienen un perfil más favorable16,17. Así pues, parece pertinente evaluar los SLE en registros amplios de IAMCEST y compararlos con los SLP.
Por otro lado, la trombectomía mediante aspiración ha pasado a ser una práctica común en la angioplastia primaria cuando es factible, dado el efecto clínico beneficioso observado en los ensayos clínicos18–21. Sin embargo, tras la publicación de los ensayos INFUSE-AMI22 y TASTE23, la eficacia clínica de la trombectomía en el IAMCEST sigue siendo incierta.
Se ha identificado que la carga de trombo elevada es un predictor independiente de trombosis de stent en los pacientes tratados con SLF de primera generación por un IAMCEST24. En consecuencia, aspirar el trombo o no podría tener un efecto diferencial en los resultados clínicos obtenidos con diferentes generaciones de SLF.
El objetivo principal de este estudio multicéntrico fue comparar los resultados clínicos a largo plazo de dos series amplias de pacientes tratados con SLP o SLE en el ámbito de la práctica clínica ordinaria de la angioplastia primaria.
MÉTODOSSe diseñó un registro retrospectivo multicéntrico, con la participación de 16 centros de toda España que colaboraron voluntariamente. El estudio contó con el apoyo oficial de la Sección de Cardiología Intervencionista de la Sociedad Española de Cardiología y forma parte del proyecto y la red de estudios ESTROFA.
En cada uno de los centros participantes, se incluyeron dos series consecutivas de pacientes tratados con intervenciones de angioplastia primaria con SLP (TaxusTM) o SLE (Xience VTM o PromusTM). Para reducir el sesgo de selección, los pacientes tratados con SLP incluidos fueron los tratados en el periodo inmediatamente anterior a la disponibilidad del SLE en cada centro, entre 2005 y 2007. La inscripción de los pacientes tratados con SLE se realizó en el periodo de 2006 a 2009. Un requisito para la inclusión de los pacientes con enfermedad multivaso fue que las lesiones no culpables fueran tratadas con el mismo stent que la lesión culpable. Se utilizaron series de pacientes estrictamente consecutivas y cada centro aportó un número de casos similar de ambos tipos de stent. El posible sesgo derivado del hospital se redujo al utilizar un número equivalente de pacientes procedentes de cada centro para cada grupo de stents (aproximadamente 30 pacientes por grupo de stents/centro).
El único criterio de exclusión clínico o angiográfico fue la presencia de shock cardiogénico en el momento de la intervención.
Dado el carácter retrospectivo del registro, las intervenciones se realizaron según las normas y las preferencias de cada centro y cada operador en el momento de la intervención. Todos los datos clínicos, angiográficos, de la intervención y de seguimiento se incluyeron en una base de datos diseñada específicamente para el estudio. Se formó a un investigador de cada centro para introducir la información en la base de datos y realizar el seguimiento, que incluyó el examen de todos los registros médicos disponibles en los departamentos, hospitales y servicios de salud; se solicitó también el contacto telefónico con el paciente.
La base de datos se analizó en el centro de coordinación, el Hospital Universitario Marqués de Valdecilla, Santander, por dos investigadores que desconocían la asignación al grupo de estudio. Los eventos se adjudicaron según las definiciones que se presentan en este artículo. A pesar de que estas definiciones las aceptaron y aplicaron todos los investigadores, la adjudicación final de los eventos la realizaron dos investigadores independientes, con un diseño ciego, en el centro de coordinación del estudio ESTROFA. Dichos investigadores examinaron la adjudicación de cada evento y los datos clínicos aportados respecto a los pacientes con eventos adjudicados y no adjudicados. Se solicitó información adicional, que se comentó con los correspondientes investigadores principales cuando había alguna duda, y se readjudicaron los eventos para asegurar un proceso de adjudicación homogéneo.
Objetivos y definiciones del estudioEl objetivo principal del estudio fue la combinación de los eventos muerte, infarto de miocardio (IM) y revascularización de la lesión diana (RLD) a los 2 años. Los objetivos secundarios fueron muerte, la combinación de muerte e infarto y la incidencia de trombosis definitiva o probable.
Se definieron los siguientes eventos adversos cardiacos mayores: mortalidad como la muerte por cualquier causa; muerte cardiaca como la mortalidad debida a etiologías cardiacas como infarto, insuficiencia cardiaca o trombosis de stent, incluidas las muertes súbitas de causa no definida, e IM si se cumplían unos criterios detallados. Los criterios de IM fueron: a) detección de aumento y disminución de biomarcadores cardiacos (preferiblemente troponina) con al menos un valor superior al percentil 99 del límite de referencia superior, junto con signos de isquemia miocárdica con al menos uno de estos síntomas: dolor torácico, alteraciones en el electrocardiograma (cambios de ST-T de nueva aparición o bloqueo de rama izquierda del haz de His de nueva aparición) o aparición de ondas Q patológicas, movimiento regional de la pared de nueva aparición o anomalías de la perfusión; b) muerte súbita con parada cardiaca, a menudo con síntomas previos indicativos de isquemia, acompañada de una elevación del segmento ST presumiblemente de nueva aparición o un bloqueo de rama izquierda del haz de His de nueva aparición o evidencia de un trombo reciente en la angiografía o en la autopsia (si la muerte se producía antes de obtener muestras de sangre o antes de la aparición de los marcadores cardiacos en la sangre), y c) signos anatomopatológicos de infarto agudo de miocardio.
La RLD se definió como la revascularización percutánea de una lesión de reestenosis de stent, incluida la de los segmentos adyacentes proximal o distal (5mm) al stent. Se consideró también una RLD toda intervención quirúrgica de revascularización por reestenosis en el stent. La trombosis definitiva o probable del stent se determinó según las definiciones del Academic Research Consortium. La trombosis definitiva del stent se confirmó mediante angiografía o por confirmación anatomopatológica de una trombosis aguda en los pacientes con síndrome coronario agudo. La trombosis probable del stent se definió como una muerte inexplicada en un plazo de 30 días o un infarto del vaso diana sin confirmación angiográfica de la trombosis ni identificación de otra lesión culpable.
Análisis estadísticoLa estimación del tamaño muestral necesario se basó en los resultados de ensayos previos realizados con SLP en el IAMCEST y de múltiples ensayos de comparación de SLP y SLE fuera del contexto del IAMCEST8,12–15. La incidencia observada del objetivo principal para el SLP a los 2 años fue del 16-17% y la incidencia esperada para el SLE, del 9-10%. El registro se diseñó inicialmente para la inclusión de 800 pacientes, con objeto de asegurar una potencia estadística del 80% en la detección de esta reducción de la incidencia a 2 años del objetivo principal. Tras la inclusión de > 1.000 pacientes, se observaron diferencias significativas entre los grupos, sobre todo en cuanto al uso de la trombectomía. Se realizó un emparejamiento según las puntuaciones de propensión para introducir un ajuste respecto a las diferencias existentes en las características clínicas, angiográficas y de la intervención. El método de emparejamiento se aplicó por separado para las cohortes con trombectomía y sin ella. Se utilizó el programa psmatching conjuntamente con el programa SPSS versión 19. El programa psmatching realiza todos los análisis en R mediante el SPSS R-Plugin (versión 2.10.1).
El procedimiento consta de tres fases: a) se estiman las puntuaciones de propensión empleando regresión logística, en la que se utilizaba el tipo de SLF o la trombectomía para cada procedimiento de emparejamiento como variable de valoración del resultado y todas las covariables como factores predictivos; b) se empareja a los pacientes utilizando los emparejamientos de vecindad más próximos a 1,1, imponiendo un calibre de 0,2 de la desviación estándar del logit de la puntuación de propensión para excluir los malos emparejamientos, y c) se realiza una serie de verificaciones de la adecuación del modelo para determinar si se alcanza el equilibrio de las covariables mediante el procedimiento de emparejamiento.
Las variables continuas se presentan en forma de media ± desviación desviación estándar. Las variables discretas se expresan en porcentajes. Las variables continuas se compararon mediante la prueba de la t de Student si seguían una distribución normal o con la prueba de Wilcoxon en caso contrario (el tipo de distribución se evaluó con la prueba de Kolmogorov-Smirnov). Las variables discretas se compararon con la prueba de la χ2 o la exacta de Fischer, según fuera necesario. Se obtuvieron las curvas de Kaplan-Meier de la supervivencia libre de eventos para cada grupo o subgrupo preespecificado utilizando log rank test. Se utilizó una regresión de riesgos proporcionales de Cox para determinar las razones de riesgos de algunos objetivos y para llevar a cabo un análisis de subgrupo para el objetivo principal mediante una prueba de asignación de grupo de estudio según la interacción del subgrupo. Se incluyeron en el modelo todas las variables que mostraron asociación con la incidencia de eventos adversos cardiacos mayores en el análisis univariable (p < 0,1). Se incluyó también el hospital y el periodo de inscripción. Se consideró estadísticamente significativo un valor de p = 0,05. Todos los análisis estadísticos se realizaron con el programa SPSS versión 19 para Windows.
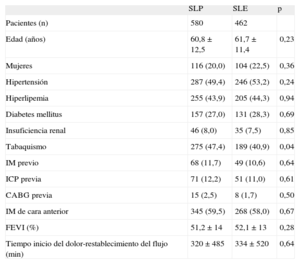
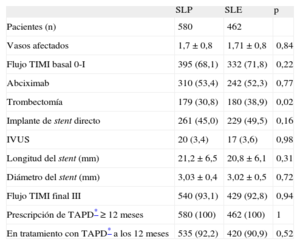
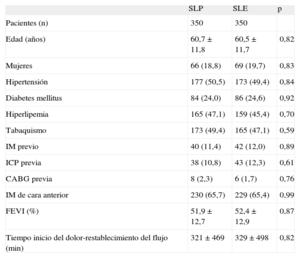
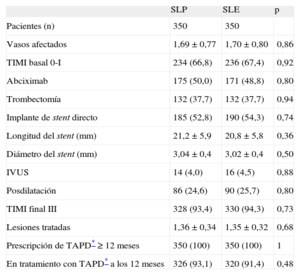
RESULTADOSEl registro incluyó a un total de 1.042 pacientes, 580 tratados con SLP y 462 con SLE. Las características clínicas y de la intervención de ambos grupos se indican en las tablas 1 y 2. Los grupos mostraban una diferencia significativa en el hábito tabáquico y más significativa aún en el uso de la aspiración del trombo. En consecuencia, se realizó un emparejamiento según la puntuación de propensión por separado para la cohorte de 683 pacientes sin trombectomía y la cohorte de 359 pacientes con trombectomía. El proceso de emparejamiento seleccionó a un total de 700 pacientes, 350 tratados con SLE y 350 con SLP. En cada grupo, a 132 (37,7%) pacientes se les había practicado una trombectomía. Las características clínicas se muestran en la tabla 3. Las características angiográficas y de la intervención se describen en la tabla 4. No se observaron diferencias significativas; ambos grupos estaban bien equilibrados respecto a todas las variables. Se completó el seguimiento de 694 (99,1%) pacientes y se perdió a 3 pacientes de cada grupo.
Características clínicas
| SLP | SLE | p | |
| Pacientes (n) | 580 | 462 | |
| Edad (años) | 60,8 ± 12,5 | 61,7 ± 11,4 | 0,23 |
| Mujeres | 116 (20,0) | 104 (22,5) | 0,36 |
| Hipertensión | 287 (49,4) | 246 (53,2) | 0,24 |
| Hiperlipemia | 255 (43,9) | 205 (44,3) | 0,94 |
| Diabetes mellitus | 157 (27,0) | 131 (28,3) | 0,69 |
| Insuficiencia renal | 46 (8,0) | 35 (7,5) | 0,85 |
| Tabaquismo | 275 (47,4) | 189 (40,9) | 0,04 |
| IM previo | 68 (11,7) | 49 (10,6) | 0,64 |
| ICP previa | 71 (12,2) | 51 (11,0) | 0,61 |
| CABG previa | 15 (2,5) | 8 (1,7) | 0,50 |
| IM de cara anterior | 345 (59,5) | 268 (58,0) | 0,67 |
| FEVI (%) | 51,2 ± 14 | 52,1 ± 13 | 0,28 |
| Tiempo inicio del dolor-restablecimiento del flujo (min) | 320 ± 485 | 334 ± 520 | 0,64 |
CABG: cirugía de revascularización aortocoronaria; FEVI: fracción de eyección del ventrículo izquierdo; IM: infarto de miocardio; SLE: stents liberadores de everolimus; SLP: stents liberadores de paclitaxel.
Salvo otra indicación, los valores expresan n (%) o media ± desviación estándar.
Características angiográficas y de la intervención
| SLP | SLE | p | |
| Pacientes (n) | 580 | 462 | |
| Vasos afectados | 1,7 ± 0,8 | 1,71 ± 0,8 | 0,84 |
| Flujo TIMI basal 0-I | 395 (68,1) | 332 (71,8) | 0,22 |
| Abciximab | 310 (53,4) | 242 (52,3) | 0,77 |
| Trombectomía | 179 (30,8) | 180 (38,9) | 0,02 |
| Implante de stent directo | 261 (45,0) | 229 (49,5) | 0,16 |
| IVUS | 20 (3,4) | 17 (3,6) | 0,98 |
| Longitud del stent (mm) | 21,2 ± 6,5 | 20,8 ± 6,1 | 0,31 |
| Diámetro del stent (mm) | 3,03 ± 0,4 | 3,02 ± 0,5 | 0,72 |
| Flujo TIMI final III | 540 (93,1) | 429 (92,8) | 0,94 |
| Prescripción de TAPD* ≥ 12 meses | 580 (100) | 462 (100) | 1 |
| En tratamiento con TAPD* a los 12 meses | 535 (92,2) | 420 (90,9) | 0,52 |
IVUS: ecografía intravascular; SLE: stents liberadores de everolimus; SLP: stents liberadores de paclitaxel; TAPD: tratamiento antiagregante plaquetario combinado doble; TIMI: Thrombolysis In Myocardial Infarction.
Salvo otra indicación, los valores expresan n (%) o media ± desviación estándar.
Características clínicas en grupos igualados por puntuación de propensión
| SLP | SLE | p | |
| Pacientes (n) | 350 | 350 | |
| Edad (años) | 60,7 ± 11,8 | 60,5 ± 11,7 | 0,82 |
| Mujeres | 66 (18,8) | 69 (19,7) | 0,83 |
| Hipertensión | 177 (50,5) | 173 (49,4) | 0,84 |
| Diabetes mellitus | 84 (24,0) | 86 (24,6) | 0,92 |
| Hiperlipemia | 165 (47,1) | 159 (45,4) | 0,70 |
| Tabaquismo | 173 (49,4) | 165 (47,1) | 0,59 |
| IM previo | 40 (11,4) | 42 (12,0) | 0,89 |
| ICP previa | 38 (10,8) | 43 (12,3) | 0,61 |
| CABG previa | 8 (2,3) | 6 (1,7) | 0,76 |
| IM de cara anterior | 230 (65,7) | 229 (65,4) | 0,99 |
| FEVI (%) | 51,9 ± 12,7 | 52,4 ± 12,9 | 0,87 |
| Tiempo inicio del dolor-restablecimiento del flujo (min) | 321 ± 469 | 329 ± 498 | 0,82 |
CABG: cirugía de revascularización aortocoronaria; FEVI: fracción de eyección del ventrículo izquierdo; ICP: intervención coronaria percutánea; IM: infarto de miocardio; SLE: stents liberadores de everolimus; SLP: stents liberadores de paclitaxel.
Salvo otra indicación, los valores expresan n (%) o media ± desviación estándar.
Características angiográficas y de la intervención de los grupos igualados por puntuación de propensión
| SLP | SLE | p | |
| Pacientes (n) | 350 | 350 | |
| Vasos afectados | 1,69 ± 0,77 | 1,70 ± 0,80 | 0,86 |
| TIMI basal 0-I | 234 (66,8) | 236 (67,4) | 0,92 |
| Abciximab | 175 (50,0) | 171 (48,8) | 0,80 |
| Trombectomía | 132 (37,7) | 132 (37,7) | 0,94 |
| Implante de stent directo | 185 (52,8) | 190 (54,3) | 0,74 |
| Longitud del stent (mm) | 21,2 ± 5,9 | 20,8 ± 5,8 | 0,36 |
| Diámetro del stent (mm) | 3,04 ± 0,4 | 3,02 ± 0,4 | 0,50 |
| IVUS | 14 (4,0) | 16 (4,5) | 0,88 |
| Posdilatación | 86 (24,6) | 90 (25,7) | 0,80 |
| TIMI final III | 328 (93,4) | 330 (94,3) | 0,73 |
| Lesiones tratadas | 1,36 ± 0,34 | 1,35 ± 0,32 | 0,68 |
| Prescripción de TAPD* ≥ 12 meses | 350 (100) | 350 (100) | 1 |
| En tratamiento con TAPD* a los 12 meses | 326 (93,1) | 320 (91,4) | 0,48 |
IVUS: ecografía intravascular; SLE: stents liberadores de everolimus; SLP: stents liberadores de paclitaxel; TAPD: tratamiento antiagregante plaquetario combinado doble; TIMI: Thrombolysis In Myocardial Infarction.
Salvo otra indicación, los valores expresan n (%) o media ± desviación estándar.
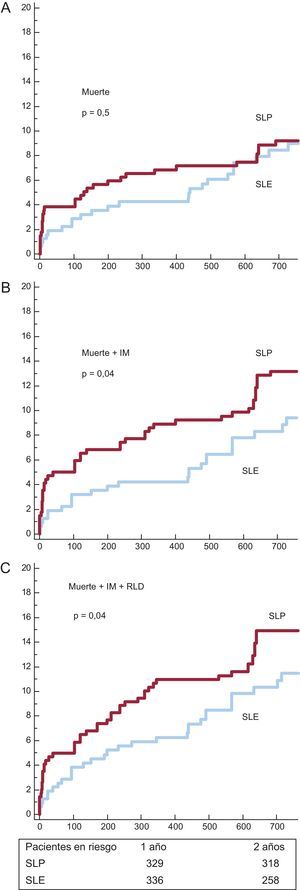
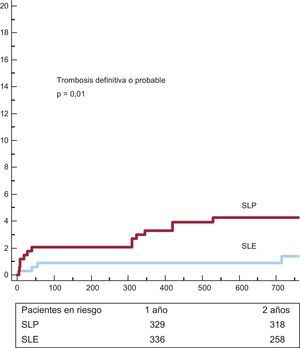
Las curvas de supervivencia y los valores de incidencia acumulada de eventos adversos mayores se muestran en las figuras 1 y 2 y la tabla 5 respectivamente. La incidencia de muerte fue bastante comparable, pero la incidencia de los objetivos combinados (muerte e IM y muerte, IM y RLD) fue significativamente inferior en el grupo de SLE. El riesgo de trombosis de stent definitiva o probable fue también inferior en el grupo de SLE.
Curvas de supervivencia para los eventos agudos cardiovasculares mayores. A: incidencia de muerte. B: incidencia de muerte e infarto de miocardio. C: incidencia de muerte, infarto de miocardio y revascularización de lesión diana. IM: infarto de miocardio; RLD: revascularización de lesión diana; SLE: stents liberadores de everolimus; SLP: stents liberadores de paclitaxel.
Incidencia acumulada de eventos agudos cardiovasculares mayores a los 2 años*
| SLP | SLE | p | |
| Todos los grupos | |||
| Muerte | 31 (9,2 ± 1,6%) | 28 (9 ± 1,8%) | 0,51 |
| Muerte+IM | 45 (13,2 ± 1,8%) | 31 (9,4 ± 1,8%) | 0,04 |
| RLD | 16 (4,6 ± 1,1%) | 9 (2,9 ± 1,06%) | 0,08 |
| Muerte+IM+RLD | 52 (14,9 ± 1,8%) | 39 (11,5 ± 1,9%) | 0,04 |
| Trombosis definitiva o probable | 14 (4,3 ± 1,1%) | 4 (1,4 ± 0,7%) | 0,01 |
| Subgrupos de aspiración del trombo | |||
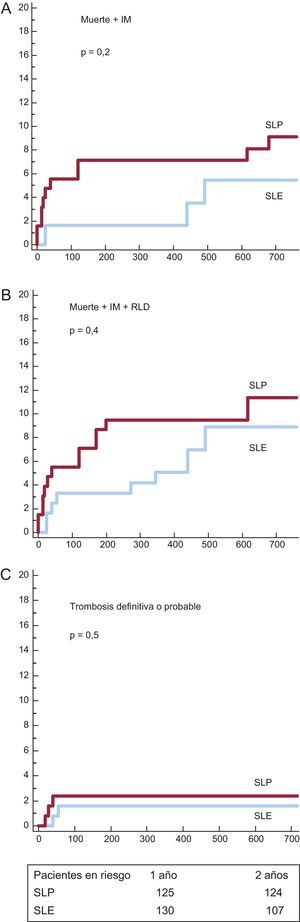
| Muerte+IM | 12 (9,1 ± 2,6%) | 10 (5,5 ± 2,1%) | 0,22 |
| Muerte+IM+RLD | 16 (11,4 ± 2,9%) | 12 (8,9 ± 2,7%) | 0,43 |
| Trombosis definitiva o probable | 3 (2,4 ± 1,4%) | 2 (1,6 ± 1,1%) | 0,51 |
| Subgrupos sin aspiración del trombo | |||
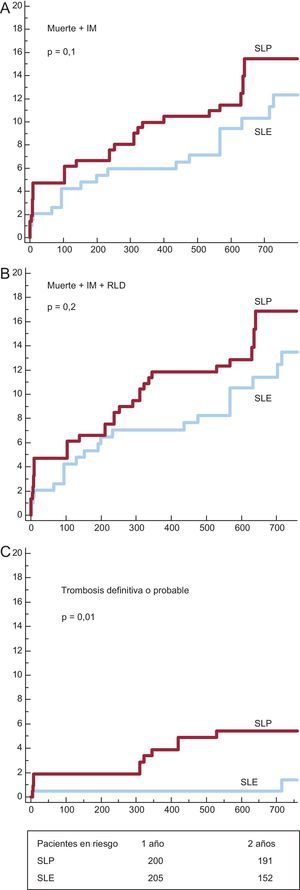
| Muerte+IM | 33 (15,5 ± 2,5%) | 21 (12,3 ± 2,7%) | 0,12 |
| Muerte+IM+RLD | 36 (16,9 ± 2,6%) | 27 (13,5 ± 2,8%) | 0,24 |
| Trombosis definitiva o probable | 11 (5,4 ± 1,6%) | 2 (1,4 ± 1%) | 0,01 |
IM: infarto de miocardio; RLD: revascularización de lesión diana; SLE: stents liberadores de everolimus; SLP: stents liberadores de paclitaxel.
La incidencia acumulada se expresa en forma de n (media±desviación estándar).
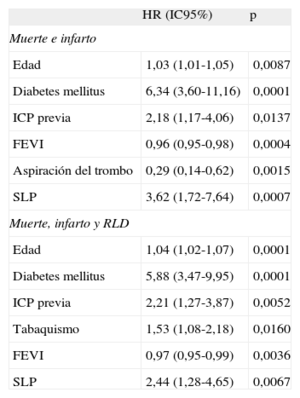
En la tabla 6 se indican los factores independientes predictivos de los objetivos combinados muerte e IM y muerte, IM y RLD. La SLP fue un factor predictivo independiente de ambas. El uso de la aspiración del trombo fue un predictor independiente de muerte e IM.
Factores independientes predictivos de eventos agudos cardiovasculares mayores
| HR (IC95%) | p | |
| Muerte e infarto | ||
| Edad | 1,03 (1,01-1,05) | 0,0087 |
| Diabetes mellitus | 6,34 (3,60-11,16) | 0,0001 |
| ICP previa | 2,18 (1,17-4,06) | 0,0137 |
| FEVI | 0,96 (0,95-0,98) | 0,0004 |
| Aspiración del trombo | 0,29 (0,14-0,62) | 0,0015 |
| SLP | 3,62 (1,72-7,64) | 0,0007 |
| Muerte, infarto y RLD | ||
| Edad | 1,04 (1,02-1,07) | 0,0001 |
| Diabetes mellitus | 5,88 (3,47-9,95) | 0,0001 |
| ICP previa | 2,21 (1,27-3,87) | 0,0052 |
| Tabaquismo | 1,53 (1,08-2,18) | 0,0160 |
| FEVI | 0,97 (0,95-0,99) | 0,0036 |
| SLP | 2,44 (1,28-4,65) | 0,0067 |
FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; RLD: revascularización de lesión diana; SLE: stents liberadores de everolimus; SLP: stents liberadores de paclitaxel.
Se analizaron los subgrupos de SLF por lo que respecta a la aspiración del trombo. Las curvas de supervivencia y los valores de incidencia acumulada de eventos adversos mayores se muestran en las figuras 3 y 4 y la tabla 5 respectivamente. En el subgrupo con aspiración del trombo (figura 3), se observó una tendencia no significativa favorable al SLE. En el subgrupo sin trombectomía (figura 4) hubo también una tendencia no significativa favorable al SLE para los objetivos combinados, pero con una incidencia significativamente inferior de trombosis del stent con el SLE.
Curvas de supervivencia para los eventos agudos cardiovasculares mayores en los subgrupos con trombectomía. A: incidencia de muerte e infarto de miocardio. B: incidencia de muerte, infarto de miocardio y revascularización de lesión diana. C: incidencia de trombosis definitiva y probable. IM: infarto de miocardio; RLD: revascularización de lesión diana; SLE: stents liberadores de everolimus; SLP: stents liberadores de paclitaxel.
Curvas de supervivencia para los eventos agudos cardiovasculares mayores en los subgrupos sin trombectomía. A: incidencia de muerte e infarto de miocardio. B:incidencia de muerte, infarto de miocardio y revascularización de lesión diana. C: incidencia de trombosis definitiva y probable. IM: infarto de miocardio; RLD: revascularización de lesión diana; SLE: stents liberadores de everolimus; SLP: stents liberadores de paclitaxel.
Se observó una interacción significativa en los subgrupos con y sin trombectomía en la comparación de SLP y SLE para el objetivo de trombosis del stent (p = 0,039).
DISCUSIÓNLos resultados del estudio son los siguientes: a) en este registro de emparejamiento por la puntuación de propensión, el uso de SLE comparado con SLP en el contexto del IAMCEST se asoció a menor incidencia de eventos adversos cardiacos mayores a los 2 años; b) la incidencia de trombosis definitiva o probable a los 2 años fue inferior con el SLE, y c) el menor riesgo de trombosis con el SLE parece ser mayor en ausencia de trombectomía.
Se ha demostrado que los SLF de segunda generación y en especial los SLE tienen más eficacia y mejor perfil de seguridad que los SLP tanto en ensayos clínicos como en múltiples registros12–15. En consecuencia, es importante evaluar los resultados de estos nuevos stents en el contexto del IAMCEST. Sin embargo, muy pocos estudios publicados lo han hecho. De hecho, la guía europea más reciente sobre el tratamiento del IAMCEST recomienda los SLF con preferencia a los stents metálicos sin recubrimiento en este contexto clínico25, pero no hace distinción alguna entre los SLF de primera y los de segunda generación26.
En el ensayo EXAMINATION16 se compararon los SLE con los stents metálicos sin recubrimiento y no se observó ninguna diferencia en el objetivo principal a 1 año, pero sí hubo una incidencia significativamente inferior de trombosis en el grupo de SLE. En otro ensayo recientemente publicado, se compararon los SLE con los liberadores de sirolimus en 625 pacientes con IAMCEST y se evidenció la no inferioridad de los SLE y se hallaron indicios de superioridad17. En un subanálisis del estudio unicéntrico COMPARE27 se analizaron las diferencias entre los SLP y los SLE a los 2 años en 452 pacientes con IAMCEST. Este estudio observó una incidencia inferior del objetivo principal combinado de muerte, infarto y RLD con los SLE. Esta diferencia podría explicarse en su mayor parte por las diferencias de la RLD. La trombosis fue significativamente inferior con los SLE (el 1 frente al 3%). En un metanálisis de 22 ensayos de comparación de diferentes SLF o de SLF con stents metálicos sin recubrimiento en el IAMCEST, el perfil más favorable fue el de los SLE28. Nuestro registro multicéntrico con inclusión de todos los pacientes consecutivos, en el que se utilizaron series de pacientes emparejados, obtuvo algunos resultados que concuerdan con los de este último estudio. El mejor perfil de seguridad observado con los SLE concuerda con lo observado en múltiples ensayos y registros llevados a cabo en pacientes en contextos distintos del IAMCEST12–15. Como se ha demostrado ya en el ensayo EXAMINATION16 antes mencionado, el perfil de seguridad de los SLE podría ser incluso superior al de los stents metálicos sin recubrimiento.
Este mejor resultado de los SLE podría explicarse por la endotelización más completa y homogénea proporcionada por estos stents, lo que podría estar relacionado también con los siguientes factores: a) menor grosor de los struts; b) los resultados del polímero fluorado, muy biocompatible con menor trombogenicidad, menor inflamación y una activación plaquetaria más atenuada, y c) las acciones celulares y moleculares diferentes del grupo lactona macrocíclico (fármacos de tipo «-limus») y paclitaxel y la diferente cinética de liberación podrían desempeñar un papel29,30. En un estudio de 35 pacientes con IAMCEST aleatorizados a tratamiento con SLE o stent liberador de sirolimus, la evaluación con tomografía de coherencia óptica a los 7 meses mostró mejor respuesta de endotelización con los SLE31.
Por lo que respecta a las cifras muy bajas de RLD, clínicamente es menos probable la necesidad de una nueva revascularización de un vaso que irriga un miocardio infartado. De hecho, la incidencia de RLD es generalmente inferior en el contexto del IAMCEST en comparación con otros contextos. Así, las diferencias de RLD entre SLF y stents metálicos sin recubrimiento son menores tras el infarto, y son necesarias muestras grandes de pacientes para identificar una diferencia significativa. Por ejemplo, los SLP no fueron superiores a los stents metálicos sin recubrimiento en la RLD en el ensayo PASSION7 con 619 pacientes, pero fueron superiores en el ensayo HORIZONS8 con 3.006 pacientes. Sin embargo, en el ensayo EXAMINATION16, los SLE no alcanzaron una incidencia significativamente inferior de RLD a 1 año (el 7% con los stents metálicos sin recubrimiento y el 3,9% con los SLE), pero esto podría explicarse por el buen resultado de los stents metálicos sin recubrimiento no farmacoactivos utilizados (stents de cromo-cobalto).
La incidencia de trombosis y RLD con los SLP en nuestro estudio fue comparable a lo observado en el ensayo HORIZONS8 o en el subgrupo de IAMCEST del ensayo COMPARE27. Además, la incidencia de trombosis y RLD con los SLE en nuestro estudio fue del mismo orden que la observada con estos stents en el ensayo EXAMINATION16 o en el subestudio del ensayo COMPARE27.
El uso de la trombectomía requiere consideración especial, que no se ha analizado de manera específica en los estudios antes citados. Es de destacar que, aunque los pacientes tratados con SLE tendieron a alcanzar mejores resultados clínicos independientemente del uso de trombectomía, el menor riesgo de trombosis con los SLE fue más evidente en los casos sin trombectomía.
El riesgo de trombosis con los SLF de primera generación en el IAMCEST está relacionado con la carga de trombo24. Los resultados de nuestro estudio inadican que, en ausencia de aspiración del trombo, una posiblemente mayor carga de trombo subyacente aumentaba el riesgo de trombosis del stent con los SLP pero no con los SLE, tal vez debido a los factores protectores mencionados que están en relación con el diseño de estos últimos stents.
Varios estudios clínicos y metanálisis han señalado un efecto beneficioso de la aspiración del trombo18–21. Sin embargo, dos estudios recientemente publicados no han observado efecto beneficioso asociado a la aspiración del trombo respecto a la reducción del tamaño del infarto ni en cuanto a ventaja de supervivencia a 30 días22,23.
En nuestro estudio, el uso selectivo de la trombectomía por aspiración manual fue un predictor independiente de muerte e infarto. El efecto beneficioso aportado por la trombectomía podría explicarse por su aplicación selectiva y podría estar relacionado con una menor carga de trombo residual en el vaso y en torno al stent, junto con una reperfusión microvascular más apropiada. La extracción del trombo de la lesión antes de implantar el stent puede reducir la probabilidad de aposición incompleta tardía y puede aumentar la rapidez de cobertura de neoíntima. Esto podría ser una explicación mecanicista de la interacción entre aspiración del trombo y modelo de SLF, puesto que se ha demostrado que los SLP son más propensos a presentar una cobertura retardada y una mala aposición tardía, factores de riesgo bien conocidos de trombosis tardía del stent.
LimitacionesEste estudio es un registro retrospectivo comparativo, con periodos de tratamiento diferentes y con diferencias basales entre los grupos. Esto comporta varias limitaciones, principalmente por la carga de posibles factores de confusión, que no siempre se excluyen, ni siquiera después de introducir un ajuste con un análisis de emparejamiento como el de la puntuación de propensión. La diferencia de los momentos de reclutamiento de los dos grupos de stents es una limitación, ya que algunas diferencias del tratamiento médico podrían haber influido en los resultados. El hecho de que la inclusión fuera consecutiva no se verificó externamente y su fiabilidad queda limitada al compromiso del investigador.
Dado el carácter retrospectivo del estudio, las intervenciones se realizaron según las normas y preferencias locales y del operador en el momento de llevarlas a cabo. No obstante, estas normas son comparables entre los distintos centros. Dicho esto, la inclusión en el análisis multivariable del momento de inclusión y el hospital no afectó a los resultados y estas variables no fueron factores independientes predictivos de los resultados.
El estudio no tuvo la potencia estadística suficiente para las variables de valoración utilizadas. En consecuencia, estos resultados deben considerarse generadores de hipótesis y serán necesarios ensayos aleatorizados más amplios con SLE o con trombectomía en el contexto del IAMCEST.
CONCLUSIONESLos resultados de este registro retrospectivo multicéntrico indican que el uso de SLE en el IAMCEST podría asociarse a mejor resultado clínico que con el uso de SLP. La reducción del riesgo de trombosis con los SLE podría ser más relevante en ausencia de trombectomía.
CONFLICTO DE INTERESESJosé M. de la Torre Hernández ha recibido una subvención de investigación y es consultor de Boston Scientific y Abbott Vascular.