SEC 2022 - El Congreso de la Salud Cardiovascular
Introducción
Dr. Juan José Gómez Doblas
Presidente del Comité Científico del Congreso
Comité ejecutivo
Comité de evaluadores
Listado de sesiones
Índice de autores
4011. Novedades en el trasplante cardiaco
4011-5. LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
1Hospital Universitario Vall d'Hebron, Barcelona, 2Hospital Universitario la Fe, Valencia, 3Hospital Universitario Marqués de Valdecilla, Santander, 4Hospital Universitario de Bellvitge, Barcelona, 5Hospital Universitario Central de Asturias, Oviedo, 6Hospital General Universitario Gregorio Marañón, Madrid, 7Hospital Universitario Virgen del Rocío, Sevilla, 8Hospital Universitario Puerta de Hierro, Majadahonda, Madrid, 9Hospital Clínico Universitario Virgen de la Arrixaca, Murcia, 10Complexo Hospitalario Universitario A Coruña, 11Hospital Clínic, Barcelona, 12Hospital Universitario 12 de Octubre, Madrid, 13Hospital Universitario Miguel Servet, Zaragoza y 14Hospital de la Santa Creu i Sant Pau, Barcelona.
Introducción y objetivos: El fallo primario del injerto (FPI) en trasplante cardiaco (TC) se produce entre un 2 y 28% de los TC, causando más del 30% de mortalidad del primer mes post-TC. En FPI grave, por definición se requiere de soporte mecánico circulatorio (SMC), el cual puede canularse a nivel central o periférico. En síndrome poscardiotomía la evidencia es conflictiva, pero no se ha demostrado la superioridad de una estrategia frente la otra, y en el caso del TC tan solo se dispone de un estudio retrospectivo con solo 25 pacientes que compare los dos abordajes.
Métodos: Revisión de la base de datos de la Red Nacional de Trasplante Cardiaco de todos los trasplantes cardiacos en España con FPI grave entre 2010 y 2020 según la definición del 2014 de ISHLT. Los datos cualitativos se presentan como n (%) y se comparan con Chi-Cuadrado y los datos cuantitativos como media ± DE y t-Student. Se compara canulación central vs periférica del SMC mediante curvas de supervivencia Kaplan-Meier y el test log rank.
Resultados: De 2.376 TC, 504 (21,1%) tuvieron FPI, 242 (48,0%) grave. 104 pacientes recibieron SMC con canulación central (44,1%) y 132 periférica (55,9%). En comparación con la central, la canulación periférica se asoció a más infecciones no relacionadas con el SMC (34,6 vs 56,8%, p 0,001), pero menos infecciones relacionadas con SMC (43,3 vs 22,7%, p 0,001) y menos sangrados mayores relacionados con SMC (43,3 vs 22,7%, p 0,001), sin diferencias en sangrados mayores no relacionados con SMC (tabla). Los pacientes con canulación periférica presentaron más daño vascular periférico grave (1,92 vs 18,18%, p < 0,001) y mayor tasa de linforragia en el punto de acceso (1,9 vs 15,2%, p 0,02). No hubo diferencias significativas en tiempo de ventilación mecánica, ictus, embolias, trombosis venosas ni necesidad de terapia de reemplazo renal. La supervivencia fue superior en canulación periférica a los 3 meses (32,42 vs 52,74%, log rank p 0,001) y al año (28,19 vs 48,56%, log rank p 0,0007), con diferencias precoces en las curvas de supervivencia (fig.).
|
Complicaciones canulación central vs periférica |
|||||
|
Tipo canulación de SMC |
Central (n = 104) |
Periférica (n = 132) |
p |
||
|
Extubado bajo SMC |
12/100 |
12,00% |
25/128 |
19,53% |
0,126 |
|
Días intubación |
15,4 ± 13,65 |
14,47 ± 17,94 |
0,124 |
||
|
Infección mayor relacionada con SMC |
2/103 |
1,94% |
6/132 |
4,55% |
0,471 |
|
Infección mayor no relacionada con SMC |
36 |
34,62% |
75 |
56,82% |
0,001 |
|
Ictus isquémico |
8 |
7,69% |
6 |
4,55% |
0,407 |
|
Ictus hemorrágico |
5 |
4,81% |
3 |
2,27% |
0,306 |
|
Sangrado mayor relacionado con SMC |
45 |
43,27% |
30 |
22,73% |
0,001 |
|
Sangrado mayor no relacionado con SMC |
43 |
41,35% |
65 |
49,24% |
0,227 |
|
Linforragia punto acceso |
2 |
1,92% |
20 |
15,15% |
< 0,001 |
|
Daño vascular periférico grave |
2 |
1,92% |
24 |
18,18% |
< 0,001 |
|
Trombosis venosa |
4 |
3,85% |
17 |
12,88% |
0,020 |
|
Terapia de reemplazo renal |
53/104 |
50,96% |
55/131 |
41,98% |
0,170 |
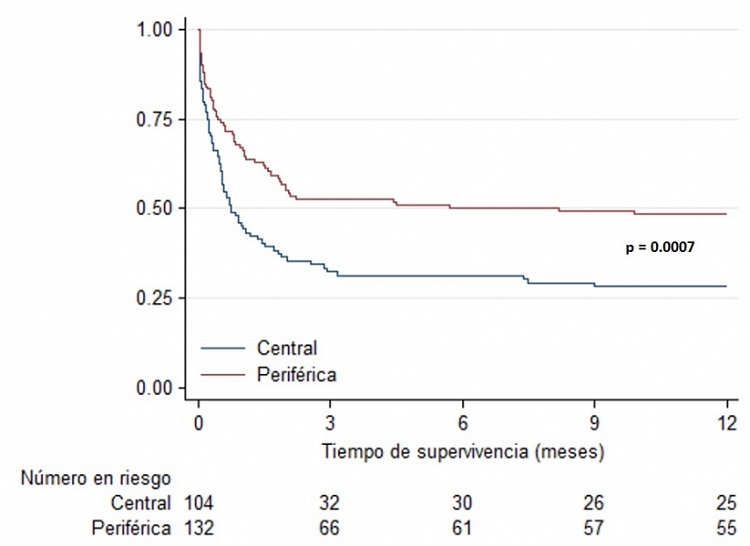
Conclusiones: La canulación periférica del SMC en FPI grave ofrece mejor supervivencia frente a la central, con menos infecciones y sangrados relacionados con el SMC a expensas de más infecciones no relacionadas con el dispositivo, daño vascular y linforragia del punto de acceso.
Comunicaciones disponibles de "Novedades en el trasplante cardiaco"
- 4011-1. MODERADOR
- Antonio Grande Trillo, Sevilla
- 4011-2. EVOLUCIÓN Y COMPLICACIONES DE LA DISFUNCIÓN GRAVE DEL INJERTO EN TRASPLANTE CARDIACO: REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- Aleix Olivella San Emeterio1, Víctor Donoso Trenado2, Francisco González Vílchez3, Elena García Romero4, Beatriz Díaz Molina5, Zorba Blázquez Bermejo6, José Manuel Sobrino Márquez7, Sara Lozano Jiménez8, Iris Paula Garrido Bravo9, Eduardo Barge Caballero10, Marta Farrero Torres11, Dolores García Cosío12, M. Teresa Blasco Peiro13, Antonia Pomares Varó14 y José González Costello4
1Hospital Universitario Vall d'Hebron, Barcelona, 2Hospital Universitario la Fe, Valencia, 3Hospital Universitario Marqués de Valdecilla, Santander, 4Hospital Universitario de Bellvitge, Barcelona, 5Hospital Universitario Central de Asturias, Oviedo, 6Hospital General Universitario Gregorio Marañón, Madrid, 7Hospital Universitario Virgen del Rocío, Sevilla, 8Hospital Universitario Puerta de Hierro, Majadahonda, Madrid, 9Hospital Clínico Universitario Virgen de la Arrixaca, Murcia, 10Complexo Hospitalario Universitario A Coruña, 11Hospital Clínic, Barcelona, 12Hospital Universitario 12 de Octubre, Madrid, 13Hospital Universitario Miguel Servet, Zaragoza y 14Hospital de la Santa Creu i Sant Pau, Barcelona.
- 4011-3. LA FRAGILIDAD DE LOS PACIENTES INCLUIDOS EN LISTA DE TRASPLANTE CARDIACO ES REVERSIBLE CON EL TRASPLANTE Y NO INFLUYE EN EVENTOS ADVERSOS A LARGO PLAZO
- Ana Ayesta López1, María Jesús Valero Masa2, Javier Segovia Cubero3, María Dolores García-Cosío4, Raquel Luna López4, Jorge Vázquez López-Ibor3, Pedro J. Caravaca Pérez4, María Teresa Vidán Astiz5, Laura Pérez Gómez3, Juan Francisco Delgado Jiménez4, Clara Fernández Cordón2, Manuel Gómez Bueno3, Javier Martínez Díaz1 y Manuel Martínez-Selles2
1Área del Corazón. Servicio de Cardiología. Hospital Universitario Central de Asturias, Oviedo, 2Servicio de Cardiología. Hospital General Universitario Gregorio Marañón, Madrid, 3Servicio de Cardiología. Hospital Universitario Puerta de Hierro, Majadahonda (Madrid), 4Servicio de Cardiología. Hospital Universitario 12 de Octubre, Madrid y 5Servicio de Geriatría. Hospital General Universitario Gregorio Marañón, Madrid.
- 4011-4. PROGRESIÓN DE LA ENFERMEDAD CORONARIA TRANSMITIDA POR EL DONANTE EN RECEPTORES DE TRASPLANTE CARDIACO Y FACTORES RELACIONADOS. RESULTADOS DEL ESTUDIO MULTICÉNTRICO DONOR-CAD
- David Couto Mallón1, Raquel López Vilella2, Francisco José Hernández Pérez3, Juan Carlos López-Azor García4, María Jesús Valero Masa5, María Ángeles Castel Lavilla6, Sonia Mirabet Pérez7, Amador López Granados8, Carles Díez López9, Iris Paula Garrido Bravo10, Rebeca Manrique Antón11, Carmen Neri Fernández Pombo12, Javier Muñiz13 y María G. Crespo Leiro1
1Servicio de Cardiología. Complexo Hospitalario Universitario A Coruña. Instituto de Investigación Biomédica A Coruña (INIBIC). CIBERCV., 2Hospital Universitario la Fe, Valencia, 3Servicio de Cardiología. Hospital Universitario Puerta de Hierro, Majadahonda, Madrid, 4Servicio de Cardiología. Hospital Universitario 12 de Octubre, Madrid, 5Servicio de Cardiología. Hospital General Universitario Gregorio Marañón, Madrid, 6Servicio de Cardiología. Hospital Clínic, Barcelona, 7Servicio de Cardiología. Hospital de la Santa Creu i Sant Pau, Barcelona, 8Servicio de Cardiología. Hospital Universitario Reina Sofía, Córdoba, 9Servicio de cardiología. Hospital Universitario de Bellvitge, Hospitalet de Llobregat, Barcelona, 10Servicio de Cardiología. Hospital Clínico Universitario Virgen de la Arrixaca, Murcia, 11Servicio de Cirugía Cardiaca. Clínica Universidad de Navarra, Pamplona, 12Servicio de Cardiología. Complexo Hospitalario Universitario A Coruña. Instituto de Investigación Biomédica A Coruña (INIBIC) y 13Instituto Universitario de Ciencias de la Salud, Universidad de A Coruña.
- 4011-5. LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- Aleix Olivella San Emeterio1, Raquel López Vilella2, Francisco González Vílchez3, Carles Díez López4, Beatriz Díaz Molina5, Zorba Blázquez Bermejo6, José Manuel Sobrino Márquez7, Sara Lozano Jiménez8, Iris Paula Garrido Bravo9, Eduardo Barge Caballero10, Marta Farrero Torres11, Dolores García Cosío12, M. Teresa Blasco Peiro13, Antonia Pomares Varó14 y José González Costello4
1Hospital Universitario Vall d'Hebron, Barcelona, 2Hospital Universitario la Fe, Valencia, 3Hospital Universitario Marqués de Valdecilla, Santander, 4Hospital Universitario de Bellvitge, Barcelona, 5Hospital Universitario Central de Asturias, Oviedo, 6Hospital General Universitario Gregorio Marañón, Madrid, 7Hospital Universitario Virgen del Rocío, Sevilla, 8Hospital Universitario Puerta de Hierro, Majadahonda, Madrid, 9Hospital Clínico Universitario Virgen de la Arrixaca, Murcia, 10Complexo Hospitalario Universitario A Coruña, 11Hospital Clínic, Barcelona, 12Hospital Universitario 12 de Octubre, Madrid, 13Hospital Universitario Miguel Servet, Zaragoza y 14Hospital de la Santa Creu i Sant Pau, Barcelona.
- 4011-6. IMPACTO PRONÓSTICO DE LA ENFERMEDAD ARTERIAL CORONARIA TRANSMITIDA POR EL DONANTE EN PACIENTES TRASPLANTADOS CARDIACOS. RESULTADOS DEL ESTUDIO MULTICÉNTRICO DONOR-CAD
- David Couto Mallón1, Luis Almenar Bonet2, Francisco José Hernández Pérez3, Juan Carlos López-Azor García4, María Jesús Valero Masa5, María Ángeles Castel Lavilla6, Sonia Mirabet Pérez7, Amador López Granados8, Carles Díez López9, Iris Paula Garrido Bravo10, Rebeca Manrique Antón11, Carmen Neri Fernández Pombo12, Javier Muñiz13 y María G. Crespo Leiro14
1Servicio de Cardiología. Complexo Hospitalario Universitario A Coruña. Instituto de Investigación Biomédica A Coruña (INIBIC) CIBERCV, 2Servicio de Cardiología. Hospital Universitario La Fe, Valencia, 3Servicio de Cardiología. Hospital Universitario Puerta de Hierro, Majadahonda, Madrid, 4Servicio de Cardiología. Hospital Universitario 12 de Octubre, Madrid, 5Servicio de Cardiología. Hospital General Universitario Gregorio Marañón, Madrid, 6Servicio de Cardiología. Hospital Clínic, Barcelona, 7Servicio de Cardiología. Hospital de la Santa Creu i Sant Pau, Barcelona, 8Servicio de Cardiología. Hospital Universitario Reina Sofía, Córdoba, 9Servicio de cardiología. Hospital Universitario de Bellvitge, Hospitalet de Llobregat, Barcelona, 10Servicio de Cardiología. Hospital Clínico Universitario Virgen de la Arrixaca, Murcia, 11Servicio de Cirugía Cardiaca. Clínica Universidad de Navarra, Pamplona, 12Servicio de Cardiología. Complexo Hospitalario Universitario A Coruña. Instituto de Investigación Biomédica A Coruña (INIBIC), 13Instituto Universitario de Ciencias de la Salud, Universidad de A Coruña y 14Servicio de Cardiología. Complexo Hospitalario Universitario A Coruña. Instituto de Investigación Biomédica A Coruña (INIBIC). CIBERCV.
- 4011-7. IMPACTO DE LA DOSIS VACUNAL DE REFUERZO FRENTE SARS-COV-2 EN EVENTOS CLÍNICOS EN PACIENTES CON TRASPLANTE CARDIACO EN GALICIA. ESTUDIO INMU_TC
- Daniel Enríquez Vázquez1, Eduardo Barge Caballero1, Paula Blanco Canosa1, Zulaika Grille Cancela1, Germán Bou Arévalo2, Pastora Rodríguez Vázquez2, Carmen Naya Leira1, Cristina Riveiro Rodríguez1, David Couto Mallón1, Gonzalo Barge Caballero1, María Jesús Paniagua Martín1, Javier Muñiz García2, José Manuel Vázquez Rodríguez2 y María G. Crespo Leiro3
1Unidad de Insuficiencia Cardiaca Avanzada y Trasplante Cardiaco, Complexo Hospitalario Universitario A Coruña, 2Complexo Hospitalario Universitario A Coruña y 3Unidad de Insuficiencia Cardiaca Avanzada y Trasplante Cardiaco, Complexo Hospitalario Universitario A Coruña, CIBERCV, Universidade de A Coruña.
Más comunicaciones de los autores
-
Barge Caballero, Eduardo
- 4005-6 - CARACTERÍSTICAS BASALES DE LOS PACIENTES DE MÁS DE 85 AÑOS CON INSUFICIENCIA CARDIACA AMBULATORIA SEGUIDOS POR CARDIOLOGÍA EN ESPAÑA
- 4011-7 - IMPACTO DE LA DOSIS VACUNAL DE REFUERZO FRENTE SARS-COV-2 EN EVENTOS CLÍNICOS EN PACIENTES CON TRASPLANTE CARDIACO EN GALICIA. ESTUDIO INMU_TC
- 6006-9 - ESTUDIO DE LA RESPUESTA INMUNE CELULAR TRAS LA VACUNACIÓN CONTRA SARS-COV-2 EN PACIENTES CON TRASPLANTE CARDIACO EN GALICIA. ESTUDIO INMU_TC
- 4011-2 - EVOLUCIÓN Y COMPLICACIONES DE LA DISFUNCIÓN GRAVE DEL INJERTO EN TRASPLANTE CARDIACO: REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 4005-3 - VARIABLES CLÍNICAS, ANALÍTICAS Y ECOCARDIOGRÁFICAS RELACIONADOS CON LA MORTALIDAD EN PACIENTES MAYORES AMBULATORIOS CON INSUFICIENCIA CARDIACA EN FUNCIÓN DEL SEXO
- 6030-4 - AMILOIDOSIS CARDIACA CON COMPONENTE MIXTO
- 5016-6 - ANÁLISIS DE LA EXPRESIÓN DE LA PROTEÍNA MITOCONDRIAL TRANSPORTADORA DE PIRUVATO EN TEJIDO CARDIACO, DE ORIGEN ISQUÉMICO O NO ISQUÉMICO, DE PACIENTES CON INSUFICIENCIA CARDIACA
- 5015-5 - PREVALENCIA E IMPACTO PRONÓSTICO DE LA FRAGILIDAD Y OTROS SÍNDROMES GERIÁTRICOS EN PACIENTES MAYORES CON INSUFICIENCIA CARDIACA. ¿DIFERENCIAS ENTRE SEXOS?
- 5025-4 - EL IMPLANTE PRECOZ DE ASISTENCIA VENTRICULAR EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO NO MEJORA EL PRONÓSTICO
- 5025-3 - RESPUESTA SEROLÓGICA EN PACIENTES CON TRASPLANTE CARDIACO, TRAS LA DOSIS DE RECUERDO EN VACUNACIÓN CONTRA COVID-19. ESTUDIO PROSPECTIVO EN GALICIA INMU-TC
- 6006-13 - EL ECMO VA NO ES SUPERIOR A OTRAS ASISTENCIAS MECÁNICAS CIRCULATORIAS EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 6006-6 - DIFERENCIAS EN LA COMPOSICIÓN CORPORAL ENTRE LOS PACIENTES TRASPLANTADOS CARDIACOS EN SITUACIÓN URGENTE Y LOS PACIENTES CON TRASPLANTE CARDIACO ELECTIVO
- 4011-5 - LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 4005-7 - DIFERENCIAS SEGÚN EDAD EN LA PREVALENCIA DE LOS SÍNDROMES GERIÁTRICOS EN UNA POBLACIÓN MAYOR CON INSUFICIENCIA CARDIACA AMBULATORIA
-
Blasco Peiro, María Teresa
- 4011-2 - EVOLUCIÓN Y COMPLICACIONES DE LA DISFUNCIÓN GRAVE DEL INJERTO EN TRASPLANTE CARDIACO: REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 6004-2 - FACTORES ASOCIADOS CON EL EMPEORAMIENTO DE LA INSUFICIENCIA CARDIACA EN PACIENTES CON INSUFICIENCIA CARDIACA Y FIBRILACIÓN AURICULAR ANTICOAGULADOS CON RIVAROXABÁN. ESTUDIO FARAONIC
- 5025-4 - EL IMPLANTE PRECOZ DE ASISTENCIA VENTRICULAR EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO NO MEJORA EL PRONÓSTICO
- 6004-7 - MORTALIDAD Y VARIABLES ASOCIADAS EN PACIENTES CON INSUFICIENCIA CARDIACA Y FIBRILACIÓN AURICULAR ANTICOAGULADOS CON RIVAROXABÁN. ESTUDIO FARAONIC
- 6006-3 - PREDICTORES DE MORTALIDAD GLOBAL Y PRECOZ TRAS TRASPLANTE CARDIACO: ¿ES RELEVANTE EL PAPEL DE LA CARDIOPATÍA DE BASE? UN ANÁLISIS DEL REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 4011-5 - LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 6006-13 - EL ECMO VA NO ES SUPERIOR A OTRAS ASISTENCIAS MECÁNICAS CIRCULATORIAS EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
-
Blázquez Bermejo, Zorba
- 6006-13 - EL ECMO VA NO ES SUPERIOR A OTRAS ASISTENCIAS MECÁNICAS CIRCULATORIAS EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 6033-12 - FACTIBILIDAD Y SEGURIDAD DEL ALTA PRECOZ TRAS IMPLANTE MINIMALISTA DE TAVI (FASE-APRETAVI)
- 4011-5 - LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 4011-2 - EVOLUCIÓN Y COMPLICACIONES DE LA DISFUNCIÓN GRAVE DEL INJERTO EN TRASPLANTE CARDIACO: REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 6006-3 - PREDICTORES DE MORTALIDAD GLOBAL Y PRECOZ TRAS TRASPLANTE CARDIACO: ¿ES RELEVANTE EL PAPEL DE LA CARDIOPATÍA DE BASE? UN ANÁLISIS DEL REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 6004-15 - OPTIMIZACIÓN DEL TRATAMIENTO FARMACOLÓGICO EN EL PERIODO PRECOZ TRAS EL ALTA DE UNA HOSPITALIZACIÓN POR INSUFICIENCIA CARDIACA: CAMBIOS EN FÁRMACOS, DOSIS Y AGENTES RESPONSABLES EN LA "VIDA REAL"
- 5025-4 - EL IMPLANTE PRECOZ DE ASISTENCIA VENTRICULAR EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO NO MEJORA EL PRONÓSTICO
- 6031-7 - ADHERENCIA DEL CARDIÓLOGO PRESCRIPTOR A LAS RECOMENDACIONES DE LAS GUÍAS SOBRE TRATAMIENTO FARMACOLÓGICO DE LA INSUFICIENCIA CARDIACA CON FEVI REDUCIDA AL ALTA TRAS UNA HOSPITALIZACIÓN POR DESCOMPENSACIÓN: EXPERIENCIA DE UN CENTRO TERCIARIO
-
Díaz Molina, Beatriz
- 4011-5 - LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 6006-13 - EL ECMO VA NO ES SUPERIOR A OTRAS ASISTENCIAS MECÁNICAS CIRCULATORIAS EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 5025-4 - EL IMPLANTE PRECOZ DE ASISTENCIA VENTRICULAR EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO NO MEJORA EL PRONÓSTICO
- 6006-3 - PREDICTORES DE MORTALIDAD GLOBAL Y PRECOZ TRAS TRASPLANTE CARDIACO: ¿ES RELEVANTE EL PAPEL DE LA CARDIOPATÍA DE BASE? UN ANÁLISIS DEL REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 4011-2 - EVOLUCIÓN Y COMPLICACIONES DE LA DISFUNCIÓN GRAVE DEL INJERTO EN TRASPLANTE CARDIACO: REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 6006-10 - ESTRATEGIA DE INMUNOSUPRESIÓN EN TRASPLANTE CARDIACO: PROTECCIÓN FRENTE A CITOMEGALOVIRUS EN ESTRATEGIAS QUE INCLUYEN EVEROLIMUS. DATOS DE DOS CENTROS ESPAÑOLES
- 6054-5 - CREACIÓN DE UNA UNIDAD MULTIDISCIPLINAR DE CARDIOGERIATRÍA PARA EL MANEJO DE LA INSUFICIENCIA CARDIACA DEL PACIENTE MAYOR
-
Díez López, Carles
- 6006-14 - IMPACTO DE LA HIPOTENSIÓN EN EL TRATAMIENTO CON SOPORTE INOTRÓPICO INTERMITENTE CON LEVOSIMENDÁN EN LA INSUFICIENCIA CARDIACA AVANZADA COMO TERAPIA DE DESTINO: ANÁLISIS DEL REGISTRO LEVO-D
- 4011-5 - LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 6006-13 - EL ECMO VA NO ES SUPERIOR A OTRAS ASISTENCIAS MECÁNICAS CIRCULATORIAS EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 5025-2 - ENFERMEDAD ARTERIAL CORONARIA TRANSMITIDA POR EL DONANTE EN EL TRASPLANTE CARDIACO: PREVALENCIA Y CARACTERÍSTICAS DE LOS DONANTES. RESULTADOS DEL ESTUDIO MULTICÉNTRICO DONOR-CAD
- 4003-5 - PREDICCIÓN DE RESPUESTA AL SOPORTE INOTRÓPICO INTERMITENTE CON LEVOSIMENDÁN EN LA INSUFICIENCIA CARDIACA AVANZADA COMO TERAPIA DE DESTINO: EL LEVO-D SCORE
- 6006-3 - PREDICTORES DE MORTALIDAD GLOBAL Y PRECOZ TRAS TRASPLANTE CARDIACO: ¿ES RELEVANTE EL PAPEL DE LA CARDIOPATÍA DE BASE? UN ANÁLISIS DEL REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 6035-8 - AMILOIDOSIS CARDIACA POR TRANSTIRRETINA (AC-ATTR) MEDIANTE GAMMAGRAFÍA CARDIACA CON 99MTC-DIFOSFONATOS (GC) Y RESONANCIA MAGNÉTICA CARDIACA (RMC)
- 4011-4 - PROGRESIÓN DE LA ENFERMEDAD CORONARIA TRANSMITIDA POR EL DONANTE EN RECEPTORES DE TRASPLANTE CARDIACO Y FACTORES RELACIONADOS. RESULTADOS DEL ESTUDIO MULTICÉNTRICO DONOR-CAD
- 4011-6 - IMPACTO PRONÓSTICO DE LA ENFERMEDAD ARTERIAL CORONARIA TRANSMITIDA POR EL DONANTE EN PACIENTES TRASPLANTADOS CARDIACOS. RESULTADOS DEL ESTUDIO MULTICÉNTRICO DONOR-CAD
- 5025-4 - EL IMPLANTE PRECOZ DE ASISTENCIA VENTRICULAR EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO NO MEJORA EL PRONÓSTICO
-
Farrero Torres, Marta
- 4003-1 - MODERADORA
- 4011-5 - LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 6006-13 - EL ECMO VA NO ES SUPERIOR A OTRAS ASISTENCIAS MECÁNICAS CIRCULATORIAS EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 6058-10 - PSEUDOANEURISMA VENTRICULAR: ¿ES EL ABORDAJE PERCUTÁNEO UNA ESTRATEGIA SEGURA?
- 6006-3 - PREDICTORES DE MORTALIDAD GLOBAL Y PRECOZ TRAS TRASPLANTE CARDIACO: ¿ES RELEVANTE EL PAPEL DE LA CARDIOPATÍA DE BASE? UN ANÁLISIS DEL REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 4011-2 - EVOLUCIÓN Y COMPLICACIONES DE LA DISFUNCIÓN GRAVE DEL INJERTO EN TRASPLANTE CARDIACO: REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 5025-4 - EL IMPLANTE PRECOZ DE ASISTENCIA VENTRICULAR EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO NO MEJORA EL PRONÓSTICO
-
García Cosío, María Dolores
- 6013-12 - ¿CUÁNDO DERIVAR A UN PACIENTE CON INSUFICIENCIA CARDIACA AVANZADA?: ANÁLISIS DE LAS REFERENCIAS DE PACIENTES AMBULATORIOS A UN CENTRO ESPECIALIZADO EN TERAPIAS AVANZADAS
- 4011-3 - LA FRAGILIDAD DE LOS PACIENTES INCLUIDOS EN LISTA DE TRASPLANTE CARDIACO ES REVERSIBLE CON EL TRASPLANTE Y NO INFLUYE EN EVENTOS ADVERSOS A LARGO PLAZO
- 4004-4 - EXPOSICIÓN A HIPOXIA-HIPEROXIA INTERMITENTE COMO TERAPIA NO FARMACOLÓGICA EN LA REHABILITACIÓN DE LA INSUFICIENCIA CARDIACA
- 4011-2 - EVOLUCIÓN Y COMPLICACIONES DE LA DISFUNCIÓN GRAVE DEL INJERTO EN TRASPLANTE CARDIACO: REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 6006-3 - PREDICTORES DE MORTALIDAD GLOBAL Y PRECOZ TRAS TRASPLANTE CARDIACO: ¿ES RELEVANTE EL PAPEL DE LA CARDIOPATÍA DE BASE? UN ANÁLISIS DEL REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 4011-5 - LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 5025-4 - EL IMPLANTE PRECOZ DE ASISTENCIA VENTRICULAR EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO NO MEJORA EL PRONÓSTICO
- 6006-13 - EL ECMO VA NO ES SUPERIOR A OTRAS ASISTENCIAS MECÁNICAS CIRCULATORIAS EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 6006-11 - QUIÉN, CUÁNDO Y CÓMO: DETERMINACIÓN DE ANTICUERPOS ANTIHLA POR PROTOCOLO EN UNA COHORTE DE PACIENTES CON TRASPLANTE CARDIACO
- 6006-4 - CÁNCER DE PULMÓN Y TRASPLANTE CARDIACO: ¿HAY MARGEN PARA UN CRIBADO EFICAZ?
- 5025-5 - UNA BATALLA PENDIENTE: ANTICUERPOS HLA DE NOVO Y PRONÓSTICO A LARGO PLAZO TRAS EL TRASPLANTE CARDIACO
-
Garrido Bravo, Iris Paula
- 6045-9 - REVISIÓN DE LOS RESULTADOS DEL TRASPLANTE CARDIACO POR DONACIÓN EN ASISTOLIA EN COMPARACIÓN CON LOS RESULTADOS DEL TRASPLANTE CARDIACO ELECTIVO POR DONACIÓN EN MUERTE ENCEFÁLICA EN EL HOSPITAL UNIVERSITARIO VIRGEN DE LA ARRIXACA
- 4011-6 - IMPACTO PRONÓSTICO DE LA ENFERMEDAD ARTERIAL CORONARIA TRANSMITIDA POR EL DONANTE EN PACIENTES TRASPLANTADOS CARDIACOS. RESULTADOS DEL ESTUDIO MULTICÉNTRICO DONOR-CAD
- 4011-4 - PROGRESIÓN DE LA ENFERMEDAD CORONARIA TRANSMITIDA POR EL DONANTE EN RECEPTORES DE TRASPLANTE CARDIACO Y FACTORES RELACIONADOS. RESULTADOS DEL ESTUDIO MULTICÉNTRICO DONOR-CAD
- 4011-2 - EVOLUCIÓN Y COMPLICACIONES DE LA DISFUNCIÓN GRAVE DEL INJERTO EN TRASPLANTE CARDIACO: REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 6006-3 - PREDICTORES DE MORTALIDAD GLOBAL Y PRECOZ TRAS TRASPLANTE CARDIACO: ¿ES RELEVANTE EL PAPEL DE LA CARDIOPATÍA DE BASE? UN ANÁLISIS DEL REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 5025-6 - EXPERIENCIA INICIAL DEL TRASPLANTE CARDIACO CON DONACIÓN EN ASISTOLIA EN UN HOSPITAL DE TERCER NIVEL
- 5025-4 - EL IMPLANTE PRECOZ DE ASISTENCIA VENTRICULAR EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO NO MEJORA EL PRONÓSTICO
- 5025-2 - ENFERMEDAD ARTERIAL CORONARIA TRANSMITIDA POR EL DONANTE EN EL TRASPLANTE CARDIACO: PREVALENCIA Y CARACTERÍSTICAS DE LOS DONANTES. RESULTADOS DEL ESTUDIO MULTICÉNTRICO DONOR-CAD
- 6006-13 - EL ECMO VA NO ES SUPERIOR A OTRAS ASISTENCIAS MECÁNICAS CIRCULATORIAS EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 4011-5 - LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
-
González Costello, José
- 6031-12 - DIFERENCIAS EN EL PERFIL CLÍNICO DE LOS PACIENTES ATENDIDOS EN UNIDADES DE INSUFICIENCIA CARDIACA EN ESPAÑA SEGÚN SU TIPOLOGÍA
- 6030-2 - FENOTIPO Y EVOLUCIÓN CLÍNICA DE AMILOIDOSIS TRANSTIRRETINA HEREDITARIA POR P. GLU109LYS. UNA NUEVA VARIANTE ENDÉMICA EN ESPAÑA
- 4011-5 - LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 6031-14 - CARACTERÍSTICAS CLÍNICAS DE PACIENTES REFERIDOS A UNIDADES DE INSUFICIENCIA CARDIACA DE CARDIOLOGÍA Y MEDICINA INTERNA EN ESPAÑA EN 2021
- 6027-2 - ¿CÓMO TRATAMOS A LOS PACIENTES SON INSUFICIENCIA CARDIACA Y FRACCIÓN DE EYECCIÓN REDUCIDA E INSUFICIENCIA RENAL GRAVE EN LA VIDA REAL?
- 6031-13 - MANEJO Y TRATAMIENTO DE LA INSUFICIENCIA CARDIACA EN UNIDADES ACREDITADAS DE CARDIOLOGÍA Y MEDICINA INTERNA EN ESPAÑA EN 2021
- 6006-14 - IMPACTO DE LA HIPOTENSIÓN EN EL TRATAMIENTO CON SOPORTE INOTRÓPICO INTERMITENTE CON LEVOSIMENDÁN EN LA INSUFICIENCIA CARDIACA AVANZADA COMO TERAPIA DE DESTINO: ANÁLISIS DEL REGISTRO LEVO-D
- 6013-16 - RESULTADOS DE UN PROGRAMA DE ACREDITACIÓN DE UNIDADES DE EXCELENCIA EN INSUFICIENCIA CARDIACA DE LA SOCIEDAD ESPAÑOLA DE CARDIOLOGÍA (2017-2021)
- 6006-10 - ESTRATEGIA DE INMUNOSUPRESIÓN EN TRASPLANTE CARDIACO: PROTECCIÓN FRENTE A CITOMEGALOVIRUS EN ESTRATEGIAS QUE INCLUYEN EVEROLIMUS. DATOS DE DOS CENTROS ESPAÑOLES
- 4003-5 - PREDICCIÓN DE RESPUESTA AL SOPORTE INOTRÓPICO INTERMITENTE CON LEVOSIMENDÁN EN LA INSUFICIENCIA CARDIACA AVANZADA COMO TERAPIA DE DESTINO: EL LEVO-D SCORE
- 6031-4 - MODELOS DE GESTIÓN Y ESTRUCTURA ORGANIZATIVA DE LAS UNIDADES DE INSUFICIENCIA CARDIACA DE CARDIOLOGÍA Y MEDICINA INTERNA EN ESPAÑA EN 2021
- 6004-11 - TRATAMIENTO INICIAL DE LOS PACIENTES CON INSUFICIENCIA CARDIACA DE NOVO Y FRACCIÓN DE EYECCIÓN REDUCIDA. ¿CUÁL ES EL IMPACTO DE LAS NUEVAS GUÍAS DE PRÁCTICA CLÍNICA?
- 4011-2 - EVOLUCIÓN Y COMPLICACIONES DE LA DISFUNCIÓN GRAVE DEL INJERTO EN TRASPLANTE CARDIACO: REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 6021-4 - DIFERENCIAS ENTRE LOS PACIENTES CON INSUFICIENCIA CARDIACA SEGÚN EL TIPO DEFINIDO POR LA FRACCIÓN DE EYECCIÓN DEL VENTRÍCULO IZQUIERDO
- 6006-13 - EL ECMO VA NO ES SUPERIOR A OTRAS ASISTENCIAS MECÁNICAS CIRCULATORIAS EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 5025-4 - EL IMPLANTE PRECOZ DE ASISTENCIA VENTRICULAR EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO NO MEJORA EL PRONÓSTICO
-
González Vílchez, Francisco
- 6006-2 - INCIDENCIA Y DETERMINANTES DE LA SENSIBILIZACIÓN TRAS EL TRASPLANTE CARDIACO
- 6001-8 - PREVALENCIA Y FACTORES PREDICTORES DE ENDOCARDITIS INFECCIOSA EN PACIENTES CON HEMOCULTIVOS POSITIVOS PARA BACTERIAS USUALES
- 6006-8 - IMPACTO PRONÓSTICO DE LA SENSIBILIZACIÓN TRAS EL TRASPLANTE CARDIACO
- 6006-13 - EL ECMO VA NO ES SUPERIOR A OTRAS ASISTENCIAS MECÁNICAS CIRCULATORIAS EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 4011-2 - EVOLUCIÓN Y COMPLICACIONES DE LA DISFUNCIÓN GRAVE DEL INJERTO EN TRASPLANTE CARDIACO: REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 4011-5 - LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 5025-7 - MONITORIZACIÓN DEL RECHAZO AGUDO EN EL TRASPLANTE CARDIACO. ¿BIOPSIA ENDOMIOCÁRDICA RUTINARIA?
- 5025-4 - EL IMPLANTE PRECOZ DE ASISTENCIA VENTRICULAR EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO NO MEJORA EL PRONÓSTICO
- 6006-3 - PREDICTORES DE MORTALIDAD GLOBAL Y PRECOZ TRAS TRASPLANTE CARDIACO: ¿ES RELEVANTE EL PAPEL DE LA CARDIOPATÍA DE BASE? UN ANÁLISIS DEL REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
-
López Vilella, Raquel
- 6006-14 - IMPACTO DE LA HIPOTENSIÓN EN EL TRATAMIENTO CON SOPORTE INOTRÓPICO INTERMITENTE CON LEVOSIMENDÁN EN LA INSUFICIENCIA CARDIACA AVANZADA COMO TERAPIA DE DESTINO: ANÁLISIS DEL REGISTRO LEVO-D
- 4001-7 - TRATAMIENTO DE LA FERROPENIA EN INSUFICIENCIA CARDIACA AGUDA. UN ESTUDIO EN PRÁCTICA CLÍNICA REAL
- 4011-4 - PROGRESIÓN DE LA ENFERMEDAD CORONARIA TRANSMITIDA POR EL DONANTE EN RECEPTORES DE TRASPLANTE CARDIACO Y FACTORES RELACIONADOS. RESULTADOS DEL ESTUDIO MULTICÉNTRICO DONOR-CAD
- 4020-5 - EFICACIA Y SEGURIDAD DEL QUELANTE DE POTASIO PATIROMER EN EL MANEJO DE LA HIPERPOTASEMIA EN PACIENTES CON INSUFICIENCIA CARDIACA: REGISTRO PROSPECTIVO MULTICÉNTRICO
- 6037-7 - LA ULTRAFILTRACIÓN PERIFÉRICA REDUCE LA NECESIDAD DE FÁRMACOS DIURÉTICOS EN LA INSUFICIENCIA CARDIACA AVANZADA
- 6006-7 - INFECCIÓN POR COVID-19 EN TRASPLANTADOS CARDIACOS EN PERÍODOS PRE Y POSVACUNACIÓN
- 6006-3 - PREDICTORES DE MORTALIDAD GLOBAL Y PRECOZ TRAS TRASPLANTE CARDIACO: ¿ES RELEVANTE EL PAPEL DE LA CARDIOPATÍA DE BASE? UN ANÁLISIS DEL REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 5025-4 - EL IMPLANTE PRECOZ DE ASISTENCIA VENTRICULAR EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO NO MEJORA EL PRONÓSTICO
- 5025-2 - ENFERMEDAD ARTERIAL CORONARIA TRANSMITIDA POR EL DONANTE EN EL TRASPLANTE CARDIACO: PREVALENCIA Y CARACTERÍSTICAS DE LOS DONANTES. RESULTADOS DEL ESTUDIO MULTICÉNTRICO DONOR-CAD
- 4028-6 - REDUCCIÓN DE EVENTOS CARDIOVASCULARES A CORTO PLAZO EN LA INSUFICIENCIA CARDIACA AGUDA TRAS LA INHIBICIÓN DEL COTRANSPORTADOR SODIO-GLUCOSA DE TIPO 2
- 4011-5 - LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 4003-5 - PREDICCIÓN DE RESPUESTA AL SOPORTE INOTRÓPICO INTERMITENTE CON LEVOSIMENDÁN EN LA INSUFICIENCIA CARDIACA AVANZADA COMO TERAPIA DE DESTINO: EL LEVO-D SCORE
-
Lozano Jiménez, Sara
- 5025-2 - ENFERMEDAD ARTERIAL CORONARIA TRANSMITIDA POR EL DONANTE EN EL TRASPLANTE CARDIACO: PREVALENCIA Y CARACTERÍSTICAS DE LOS DONANTES. RESULTADOS DEL ESTUDIO MULTICÉNTRICO DONOR-CAD
- 6006-12 - PERFUSIÓN DE MILRINONA EN PACIENTES AMBULATORIOS: UNA OPCIÓN A TENER EN CUENTA
- 4011-2 - EVOLUCIÓN Y COMPLICACIONES DE LA DISFUNCIÓN GRAVE DEL INJERTO EN TRASPLANTE CARDIACO: REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 6035-11 - UTILIDAD DEL PET-TAC EN EL DIAGNÓSTICO DE LA INFLAMACIÓN MIOCÁRDICA
- 5025-13 - PREDICTORES DE NECESIDAD DE TERAPIA RENAL SUSTITUTIVA EN PACIENTES EN SHOCK CARDIOGÉNICO DE CUALQUIER ETIOLOGÍA
- 4028-2 - DETECCIÓN DE LA CONGESTIÓN CLÍNICA Y SUBCLÍNICA EN INSUFICIENCIA CARDIACA
- 4012-6 - UTILIDAD DE LA CLASIFICACIÓN SCAI EN EL TRASLADO DE PACIENTES EN SHOCK CARDIOGÉNICO A UN CENTRO DE REFERENCIA
- 4011-5 - LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 6018-11 - PAPEL DE LA EDAD EN LA ESCALA SCAI DE SHOCK CARDIOGÉNICO
- 6012-4 - COMPLICACIONES INFECCIOSAS DE PACIENTES EN SHOCK CARDIOGÉNICO ATENDIDOS EN UN CENTRO DE REFERENCIA
- 6012-3 - INCIDENCIA, CARACTERIZACIÓN E IMPACTO CLÍNICO DE LOS EVENTOS HEMORRÁGICOS MAYORES EN PACIENTES EN SHOCK CARDIOGÉNICO DE CUALQUIER ETIOLOGÍA
- 6026-5 - SEGUIMIENTO ECOCARDIOGRÁFICO MEDIANTE SPECKLE-TRACKING DE LA FUNCIÓN BIVENTRICULAR A 10 AÑOS TRAS EL TRASPLANTE CARDIACO
- 5025-4 - EL IMPLANTE PRECOZ DE ASISTENCIA VENTRICULAR EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO NO MEJORA EL PRONÓSTICO
- 6006-13 - EL ECMO VA NO ES SUPERIOR A OTRAS ASISTENCIAS MECÁNICAS CIRCULATORIAS EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
-
Olivella San Emeterio, Aleix
- 4011-5 - LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 4011-2 - EVOLUCIÓN Y COMPLICACIONES DE LA DISFUNCIÓN GRAVE DEL INJERTO EN TRASPLANTE CARDIACO: REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 5025-4 - EL IMPLANTE PRECOZ DE ASISTENCIA VENTRICULAR EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO NO MEJORA EL PRONÓSTICO
- 6006-13 - EL ECMO VA NO ES SUPERIOR A OTRAS ASISTENCIAS MECÁNICAS CIRCULATORIAS EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
-
Pomares Varó, Antonia
- 4003-6 - DESACTIVACIÓN DEL DESFIBRILADOR AUTOMÁTICO IMPLANTABLE EN PACIENTES CON INSUFICIENCIA CARDIACA AVANZADA: ANALIZANDO EL PROBLEMA
- 4011-5 - LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 6006-13 - EL ECMO VA NO ES SUPERIOR A OTRAS ASISTENCIAS MECÁNICAS CIRCULATORIAS EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 6014-16 - TROMBOSIS AURICULAR INCIDENTAL EN PACIENTES RECEPTORES DE TRASPLANTE CARDIACO
- 6030-5 - PREVALENCIA DE AMILOIDOSIS HEREDITARIA POR TRANSTIRRETINA EN PACIENTES ANCIANOS CON AMILOIDOSIS CARDIACA POR TRANSTIRRETINA
- 4011-2 - EVOLUCIÓN Y COMPLICACIONES DE LA DISFUNCIÓN GRAVE DEL INJERTO EN TRASPLANTE CARDIACO: REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 5025-4 - EL IMPLANTE PRECOZ DE ASISTENCIA VENTRICULAR EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO NO MEJORA EL PRONÓSTICO
-
Sobrino Márquez, José Manuel
- 4011-5 - LA CANULACIÓN PERIFÉRICA DEL SOPORTE MECÁNICO CIRCULATORIO ES SUPERIOR A LA CENTRAL EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 6006-13 - EL ECMO VA NO ES SUPERIOR A OTRAS ASISTENCIAS MECÁNICAS CIRCULATORIAS EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO
- 4011-2 - EVOLUCIÓN Y COMPLICACIONES DE LA DISFUNCIÓN GRAVE DEL INJERTO EN TRASPLANTE CARDIACO: REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 6006-3 - PREDICTORES DE MORTALIDAD GLOBAL Y PRECOZ TRAS TRASPLANTE CARDIACO: ¿ES RELEVANTE EL PAPEL DE LA CARDIOPATÍA DE BASE? UN ANÁLISIS DEL REGISTRO ESPAÑOL DE TRASPLANTE CARDIACO
- 5025-4 - EL IMPLANTE PRECOZ DE ASISTENCIA VENTRICULAR EN FALLO PRIMARIO DEL INJERTO GRAVE EN TRASPLANTE CARDIACO NO MEJORA EL PRONÓSTICO
